羰基的亲核加成
第九章 碳氧双键的亲核加成

Nu
R R'
C
O
R C R'
O Nu
sp2杂化 平面三角型 键角: 键角:120° 109°28 ′ °
sp3杂化 四面体
产物中基团拥挤程度增大。 产物中基团拥挤程度增大。 R 越大,妨碍 进攻 原子。 越大,妨碍Nu进攻 原子。 进攻C原子
2. 亲核试剂的活性
① 对于同一羰基化合物,试剂的亲核性越强, 对于同一羰基化合物,试剂的亲核性越强, 反应的平衡常数越大。 反应的平衡常数越大。
Stronger base
Weaker base
碱催化利于醛的缩合,而不利于酮的缩合。 碱催化利于醛的缩合,而不利于酮的缩合。
酸催化: 酸催化:
O CH3CCH3 + H Cl OH CH3C CH2 H + Cl
-HCl
OH CH3C CH2
羰基质子化及烯醇的生成
CH3 CH3C CH2 + C OH CH3
OH
O CH3CHCH2C H OH
O HOH + CH 2 CH CH 2
O CH
烯醇负离子
Step 2
O CH3CH
O CH2 CH CH2 O CH
O
O
CH3CHCH2CH
An alkoxide ion
OH O OH
Step 3
O O CH 3 CHCH 2 CH
HOH
CH 3CHCH 2CH
1. Wittig 反应
Wittig 试剂: 试剂:
Ph3P C R2
膦的内 盐
Ph3P CH2
膦的叶立德 (ylid)
Ph3P CHR (RO)3P CHR
第五章羰基亲核加成及相关反应

羟醛缩合反应历程
碱催化历程
至少要有两个α-氢才可失水,失水后形成共轭 体系α,β-不饱和酮稳定
亲核试剂:
含氧试剂:H2O、ROH、RO 含碳试剂:RC≡C-,C≡N-,R 含氮试剂:NH3,NH2,NH2NH2及NH2OH等
醛与酮:
醛与酮是较强的亲电试剂,易进行亲核加成,醛可与弱亲核 试剂反应(如NH3,CN-)
羧酸及其衍生物:
较弱的亲电试剂(+C) 只与强亲核试剂反应(如:R-,RO-等) 不与弱亲核试剂(如氨)反应
基本上不发生亲核取代反应
CH3 120o C CH3
O
HCN
CH3 C
CN CH3OH, H2SO4
71%~80% CH3109.5oOH
90%
CH3 CH2=C COOCH3
试剂的亲核性越强越易反应
带负电荷的亲核试剂,比其共轭酸亲核性强: OH->H2O
极性大的分子比极性小的分子亲核性强: HCN> H2O (pH)
亲核试剂可从醛(酮)所在平面的上面或下面进攻,新形 成一个手性中心,产物为外消旋体(对映异构体各占 50%)。
亲核试剂从空阻小的一边进攻羰基
换用仲丁基硼氢化锂,内侧进攻产物99.6%, 外侧产物0.4%
醛酮的简单亲核加成
强酸强碱
仅限醛、脂肪甲基酮及<8个碳原子的环酮
可极化性及亲核性:
Wittig试剂(磷叶立德):
内鎓(Onium)正盐(中性分子)R3P+
CHR'
(碳的电负性大于磷),具有相反的电荷在
相邻两个原子上。
硫叶立德:
磷酸 膦酸 氨 胺(C-N) 铵 磷 膦(C-P) 鏻
硫( )锍
羰基的亲核加成

Ph3P CH CH3 + PhCHO
CH3
Ph CH3
H
CC + CC
H
HH
CH3
87%
13%
中间体以动力学有利的赤式为主
H Ph3P C Me
O- C Ph H
苏式(次)
Ph3P CH CH3 +
PhCHO
H Ph3P C Me
O- C H Ph
赤式(主)
第30页/共65页
Ph
H
CC
H
Me
minor
第21页/共65页
O
+
① CH2=CHCH2Br
N
② H2O
H
O CH2CH=CH2
形成的烯胺增加可醛酮-碳的亲核活性
二、Mannich反应
具有-H的醛酮或其他含活泼氢的化合物与甲醛及
胺或氨作用,生成氨甲基化产物的反应称氨甲基化反
应或Mannich反应。
H+或OH-
HCHO + NH3 + CH3COR
+
Ph
OH
Br
HO
Ph
Br
(1R,2R)
(1S,2R)
(优)
第10页/共65页
[H]
位阻大
O
几率大
樟脑
刚性桥环,不能翻转
NaBH4
+ OH H
外型冰片
98.6%
LiBH(CHCH2CH3)3 CH3
位阻增大
86%
H OH
内型冰片 0.4%
14%
第11页/共65页
5.3 醛酮的亲核加成 5.3.1 醛酮的简单加成 一、与NaHSO3的加成
亲核加成机理

肟
(3).
与肼、苯肼、2,4- 与肼、苯肼、2,4-二硝基苯肼反应
NH2
H 2N R C O (R')H
R C N NH2 (R')H
R (R')H
腙
H2N NH R C O (R')H
O2N
C N NH
苯腙
NO2
R C O (R')H
H2N NH
O2N R C N NH (R')H NO2
2,4-二二二苯腙
COOH CH3 C CH3 OH
5 -H2O
CH2=C-COOH CH3
α-羟基酸 羟基酸
α,β-不饱和酸 不饱和酸
反应机理
CH3 CH3
-
C=O
CN
可逆
CHC OH O- 不可逆 CH3
反应条件 反应必须在弱碱性条件下进行
实例
醛与亚硫酸氢钠的反应
R H
(1). 与胺作用生成希夫碱(Schiff base)
(Ar)R
H2O (Ar)R H2N R'' (Ar)R OH C C O C (R')H NHR'' (R')H (R')H
NR''
只有伯胺可发生此反应
希夫碱
(2).
与羟胺(H2N-OH)作用生成肟 OH) 与羟胺(
R R H2N OH C O C N (R')H (R')H OH 白
甲醛 > 乙醛 > 脂肪醛 > 苯甲醛 > 丙酮 > 环戊酮 > 脂肪族甲基酮 > 苯乙酮 > 芳基烷基酮 > 二苯甲酮
(完整版)羰基的亲核加成及相关反应

羰基的亲核加成及相关反应羰基化合物包括醛、酮、羧酸及衍生物和5.1 羰基的结构CO2。
CO亲电中心羰基碳的活性较大,易被亲核试剂进攻而发生亲核加成反应和亲核取代反应。
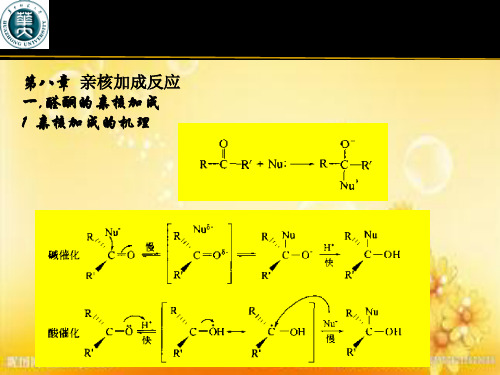
5.2 亲核加成反应的历程及影响因素 5.2.1 HCN 的加成 反应为碱催化。
v k [ CO ][ CN ]快OH - + HCN CN -+ H 2O- 慢OH 2OOHCN -+ C O C 快 C + OH -CN CN 反应的平衡位置受电子效应和空间效应的影响。
酮正向反应的趋势较小(空阻大)二、亲核加成反应的一般特点 1.反应可以被酸或碱催化 酸催化可提高羰基的亲电活性。
碱催化提高亲核试剂的亲核性。
活性:Nu -> Nu H2.多数醛酮的亲核加成为可逆反应,用于分离与提纯。
5.2.2 影响羰基亲核加成反应活性的因素 一、羰基化合物的结构1.电子效应 羰基碳的正电性越大,亲核加成速度越大,反应活性越大。
羰基碳所连的吸电基( 加成反应的活性增加,而供电基( +I , +C )则使其活性降低。
活泼顺序:H +C OH C + OHNu H + OHNu -+ H 2O-I ,-C )使其亲核50%(1) - 共轭效应(增加其稳定性) ;( 2)+C 效应(降低羰基碳的正电性) ;(3)加成产物失去共轭 能,反应活化能高; ( 4)产物的张力大幅增加。
2.立体效应、试剂的亲核性 对同一羰基化合物,试剂的亲核性越大,平衡常数越大,亲核加成越容易。
1.带负电荷的亲核试剂比起共轭酸(中性分子)的亲核性强。
OH ->H 2O, RO ->ROH 。
2.极性大的分子比极性小的分子亲核性强。
HCN>H 2O (极性与电负性 )。
3.同周期元素的负离子的亲核性与碱性大小一致; R 3C ->R 2N ->RO ->F - 4.同一主族元素的负离子的亲核性与可极化度大小一致。
I ->Br ->Cl ->F -5.2.3 亲核加成反应的立体化学 一、非手性的羰基化合物的加成前(潜)手性分子 结果得外消旋化产物-I >+C(+C) (+C, 空阻) ( +C > -I) (+C) 活性极低OH> CH 3 C HO >CH 3 C CH 3 >OOO >CH 3CH 2 C CH 2CH 3> Ph C PhR Nu C R' O -R Nu RC Nu R' OH50% dlR R'OCNuH +R R'OHCNu张力增加OH +、手性羰基化合物的亲核加成方向遵守Cram 规则,得立体选择性的非对称异构体产物。
第21讲——羰基亲核加成反应

1、加H–CN C=O + H–CN
CN
C–OH
-羟基腈(氰醇)
⑴反应范围:醛、脂肪族甲基酮、8个C以下脂环酮
⑵反应条件:碱性,pH≈8.0,有利于CN-离解。
O
OH
⑶应用:CH3–C–CH3 + H–CN NaOH CH3–C–CN
CH3
OH
丙酮羟腈(丙酮氰醇)
H2O
CH3–C–COOH
H2SO4 △
–CHO
–C–CH3 羰基直接 O 连芳环
O
O
两–C个H羰2–C基–共CH同3的–H
多元醛酮 CH3–C–CH2–C–CH3 2,4-戊二酮 (-二酮)
二、醛酮的化学性质
(一) 羰基的亲核加成反应
(二C+=) -O-H的N反u应- NCu—O-
E+
Nu E
C—O
(三) 醛酮的氧化和还原反应稳定性:O->C+
–CHO
–CH3 光 CH3CH=CH2Cl2
HBr
C–HC3BCHrH2CCl HP3h3PPh3P
Ph3P–CBHr–(CCHH23C)2l–PP-HHhOX3 -
HO- CH–3CH=PPh3 -HXPh3P=C–CH3
H H
OH
C—R 伯醇
② H2O
环己基甲醇
R
–MgCl +
CH3 CH3
C=O
H
C=O
醛
CH3
① 干醚
–C–OH R
② H2O
CH3
2-环己基-2-丙醇
R
C=O
酮
R
OH
C—R 仲醇
H
R OH
R C—R叔醇
羰基的亲核加成
上述构型中双键碳上所连的两个大的基团处在反位比较稳定(即 构型以反式为主)。 当分子中含有两个羰基时(二醛、二酮、或一种醛与一种酮),
在碱催化作用下,也可发生分子内羟醛缩合生成五元环或六元环 的不饱和醛酮。
高等有机化学
O
OH
CH3 C CH2CH2CH2CHO
(2)Knoevenagel缩合 不含a氢的醛酮与含活泼的a氢的化合物的合成
高等有机化学
O
O
O
O
* R CH2 C H
OH
*
RCH2CHO
*
R CH C H
R CH2 C CH C H
Step 1
Step 2
HR
O * R CH C H
H2O Step 3
OH
O
*
R CH2 C CH C H
HR
H2O Step 4
O * R CH2 C C C H
HR
如果用两种不同的具有α-H的醛缩合时为混合物,其产物复杂, 合成上意义不大。但无α-H的醛可以与有α-H 的醛发生羟醛
CZ
C Z + CH3CH CHCOOEt
CH3CH CHCOOEt CZ
CH3CH CHCOOEt CZ
BH CH3CH CH2COOEt
CZ
O CH3CH CH COEt
CZ
BH
OH
CH3CH CH COEt
CZ
高等有机化学
例1
CH3CH CHCOOEt + CH2(COOEt)2
C2H5ONa C2H5OH
CHCN + CH2 CH CN C2H5
KOH
OCHCH2CH2CN C2HC5H2CH2COOEt
第十三章羰基化合物的亲核加成和亲核取代反应(07)

● 与羧羰基碳的电正性及空间位阻有关; ● 与反应物稳定化程度及中间体稳定性化程度有关; ● 与离去基团(Y)的离去能力有关。
O R C Nu + Y-
离去基团的离去能力: X- > RCOO- > RO- > H2N羧酸衍生物亲核取代反应活性顺序:
O O O RCOOR RCOOH O > RCNH2
O2N NNH NO2
环己酮-2,4-二硝基苯腙
常用的氨衍生物 (H2N-Y): P581
H2NNH2(肼) H2NOH(羟胺) H2NNHCONH2(氨基尿)
O2N H2NNH (苯肼) H2NNH 2,4-二硝基苯肼 NO2
H CHO NH2OH HO (Z)-苯甲醛肟 C N HCl C6H6 , hv C N
醛酮化合物发生亲核加成反应的活性顺序:
HCHO > RCHO > R2CO > ArCHO > ArCOR > Ar2CO
1. (A)
CHO (B)
COCH3 (C)
CHO
2. NO2 (A) O 3. (A)
COCH3
CH3O (B)
COCH3
O
(B)
13.1.3 羧酸衍生物中羰基的亲核取代与反应活性 P571, 599
R R'
O CH3CH2CCH2CH3 + 2CH3CH2SH H+ H2 Raney Ni CH3(CH2)3CH3
H+
R
(R')H SCH2CH3 缩硫醛(酮)
C S S H2 Raney Ni R R' CH2
C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H+
RCHCH2N(CH3)2
NO2
(4)安息香缩合 苯甲醛在氰离子作用下生成二苯羟乙酮的 反应
高等有机化学
+ CNCHO
CN C OH- +
O CH
CN C OH
CN OCC O-H H
CN C OH-
CN OHCC O- H
O OHCC
H
(5)Claisen缩合 含a-H的酯在碱的作用下得到β酮酸酯
CHCN + CH2 CH CN C2H5
KOH
OCHCH2CH2CN C2HC5H2CH2COOEt
导眠能中间体
利用Michael加成与Robinsen关环合成环关化合物 O CH2CH2COOEt
高等有机化学
COOCH2CH3 CH3COCH3 +
COOCH2CH3
EtOEtOH
-CH2COCH3
O COCH2CH3 COOCH2CH3
O CH3COCH2 C OCH2CH3
COOCH2CH3
CH3COCH2COCOOEt
HCOOEt + CH3COCH3
EtOEtOH
O
-CH2COCH3 + HCOCH2CH3
C H OH
R OR
C
+ H+
H OH
半缩醛 (Hemiacetal)
高等有机化学
R OR
H+
C
+
ROH
H OH
R OR
C+ H OH
H
R OR C
H OR
+H
高等有机化学
A 酮与简单的醇不易得到缩酮,但与乙二醇或丙三醇作用可得 到环状的缩酮 。 B硫醇与醛酮也能起类似的缩合反应,并且比醇与醛酮缩合更 容易,这是因为硫的亲核能力比氧大。 C 缩醛和缩酮是一种醚类化合物,暴露在空气中易生成过氧化 物,D 缩醛和缩酮在碱性条件下稳定,但在酸性水溶液中易水 解成醛酮。 E 在有机合成中常用缩醛和缩酮的生成来保护羰基
O
O
* R CH2 C H
OH
* R CH C H
O * R CH C H
烯醇负离子碳与氧均具有亲核性,但亲电试剂进攻一般主要发生在 碳上。(氧负离子电荷较集中,易溶剂化,此外,碳原子的核外电 子云变形大)
O *
R CH C H + CH3CH2 I
O * R CH C H
CH2CH3
高等有机化学
R'S
高等有机化学
(3)Cram规则三 当酮的a手性碳原子上连接着卤原子时,由于卤原 于与碳基的偶极相互作用,使酮的优势构象是卤原子与碳基在问一 平面上处于对位交叉位置,碳基进行反应时.试剂优先从空间阻碍 最小的一边即小基团一侧进攻碳基碳原子,也称为cornforth规 则。例如:
高等有机化学
第八章 亲核加成反应 四,含碳亲核试剂的加成反应
高等有机化学
(6)Darzen反应 (α β—环氧酯合成) 醛酮在碱作用下与 “a—卤代酸酯反应生成α β—环氧酯。
高等有机化学
Darzen反应在合成上的应用是基于环氧酯能以当量的氢氧化钠 水解为钠盐,然后用酸中和时发生脱羧和开环过程,最后互变 异构为一个在羰基碳原于上增长一个碳的醛。因此,从苯乙酮 经Darzen反应可方便合成2—苯基丙醛。
ROCH3COCH2COOEt
O CH3C CHCOOEt + CH3CH2 I
CH3COCHCOOEt CH2CH3
当乙酰乙酸乙酯在烷氧基碱的作用下与1,3-二溴丙烷作用,产 物中有下列化合物出现
试提出其反应机理
高等有机化学
(2)烯胺的烷基化与酰基化应 仲胺与醛酮在酸催化下缩合得到烯胺 它与卤代物反应生成烷基 化(或酰基化)产物,不对称酮和胺反应时,主要生成双键上取代 最少的烯胺。如:
高等有机化学
第八章 亲核加成反应
Cl3CCHO > HCHO > RCHO > RCOR > RCOAr > p-N(R)2-ArCOR RCHO > ArCHO > ArCOCH3
二, 羰基加成反应及产物 (1)羰基与水形成水合物
H3C C = O H C
H OH
高等有机化学
完成下列反应
CH3COCH2CHO
高等有机化学
OH
NH
+
CH2(COOC2H5)2
CHO
高等有机化学
OH
+
CHO
-CH(COOC2H5)2
OH COOEt
CH=C COOEt
OCOOEt
CH=C COOEt
O CO CH C COOEt
高等有机化学
(9)Perkin缩合 五,烯醇的烷基化反应 1, 烯醇负离子 (1)烯醇负离子 从碳基化合物中移去一个质子得到的碳负离子是 烯醇负离子.
高等有机化学
第八章 亲核加成反应 一,醛酮的亲核加成 1 亲核加成的机理
高等有机化学
第八章 亲核加成反应 一,醛酮的亲核加成 2 羰基的活性 ①电子因素*当羰基碳上连有给电子基团(如烷基、芳基等)时,由于 中心碳原子的电正性减小,从而降低了它的亲电能力,使反应活性 下降。相反,若羰基碳上连有吸电子基团(如F3C-等)时,则会使反 应速率加快。 ②空间因素,由于从反应物到过渡态及产物,羰基碳由sp2 杂化变为sp3杂化,反应中存在着明显的空间特性。在反应过程中, R基会被越来越近地挤在一起,非键张力使过渡态内能增加,不利 于反应的进行之故:R基的体积增大时,反应速率迅速下降。Nu体 积增大,同样也会降低反应速率。综合上述两方面的影响,可以得 出一般醛、酮亲核加成反应的话性次序:
高等有机化学 (3)与含氮亲核试剂作用
C O + NH2X
C NX
+ H2O
X= NH2 R OH
CONH2 NHAr NHCONH2
A 弱酸时对其有催化作用 B 它们的反应产物一般是固体,在酸性条件下能水解还原成原来 的醛酮
C 仲胺与醛酮作用不能生成亚胺,但与含a 氢的醛酮作用得到烯胺
高等有机化学
CH3CH CHCOOEt +
-CH(COOEt)2
例2,合成
CH3CH CHCOOEt CH(COOEt)2
C2H5OH
CH3CH CH2COOEt CH(COOEt)2
O
CH2CH2COOEt
H3O+
O CH2CH2COOEt
为什以不直接在碱性条件下生成碳负离子,然后再进行加成
高等有机化学
Michael加成反应的应用 (1)在合成上的意义
(1)羟醛缩合
具有α-H的醛,在碱催化下生成碳负离子,-CH2CHO, 然后 CH2CHO作为一个亲核试剂对醛酮进行亲核加成,生成β-羟基醛, β-羟基醛在加热时易脱水变成α、β不饱合醛。
O
_
2 RCH2C H
OH
H2O
OH O RCH2CHCHCH
R
_ H2O
O RCH2CH CCH
R
碱催化历程可以是烯醇负离子,也可以是碳负离子
CH3CH2
C O + RNHR'
CH3
R' N
R
CH3 C CHCH3
(4)与其它亲核试剂加成
高等有机化学
高等有机化学 三,羰基加成的立体化学
R
C O + Nu A
R'
R
OH
C
R' Nu
(1)如果羰基两边空间条件不相同,则进攻试剂从位阻小的一端 进攻.
O
NaBH4
OH
H
高等有机化学
(2) 4-叔丁基环己酮的优势构象为叔丁基在e键上.当进攻试剂体积大 时试剂从位阻小的一端进攻.
H CH COOR
H CH COR
RC C H
H H
如
RO H
RS H
NO2
OH
CH2 H
H CH COOH
高等有机化学
RCH2
RSH + HCHO + HN(CH3)2
H+ RSCH2N(CH3)2
RCH2NO2 + HCHO + HN(CH3)2
H+ RCHCH2N(CH3)2
NO2
NO2 + HCHO + HN(CH3)2
高等有机化学
*CH3NO2
*CH2(COOEt)2
CH3CO*CH2COOEt
*CH3
NO2
N C*H3
(3) 接受体 α,β不饱和体为Michael加成的接受体
O
CH3C CH CH2
CH3CH CHCOOEt
*
CH3C*H2CN
RCH CHCN
CH2 CH
NO2
高等有机化学
(4)反应机理
B- + H C Z
HN(CH3)2 RCH
H
OH CR
OH CH N(CH3)2
H+
_ H2O
HCH + N(CH3)2
HCH + N(CH3)2
+
HCH N(CH3)2
+
HCH +
N(CH3)2
OH RCH C R
活泼氢化合物可以是:
O RCH C R
CH2N(CH3)2
高等有机化学
H CH NO2
H CH CN
高等有机化学 如维生素A合成中间体的制备
(7)混合酯缩合
高等有机化学
CH2CH2COOC2H5 + COOCH2CH3 COOCH2CH3
