高考化学一轮复习学案:1.1物质的量气体摩尔体积
2024届高考一轮复习-03物质的量及气体摩尔体积

03物质的量及气体摩尔体积1.了解物质的量(n)及其单位摩尔( mol),摩尔质量(M)、气体摩尔体积(V)的含义2.了解阿伏加德罗常数(N A)的含义3.能根据微粒(原子,分子,离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算一、重要概念1.物质的量物质的量是表示含有一定数目粒子的集合体的物理量,符号是n ,其单位为摩尔(符号是mol)。
使用该单位时,应指明对象,它的对象是所有微观粒子,如分子.原子、离子、质子、中子、电子等。
2.阿伏加德罗常数l mol任何粒子的粒子数叫阿伏加德罗常数,符号是N, ,单位是mol;它的数值与0.012 kg 12C含有的碳原子数相等,约等于6.02x1023。
3.摩尔质量单位物质的量的物质所具有的质量叫物质的摩尔质量,符号是M,单位是g.mol-1;它与1mol 物质的质量的区别与联系是:单位不同,当质量以克为单位时数值相等。
4.气体摩尔体积单位物质的量的气体所占的体积叫气体摩尔体积,用符号V m表示,常用单位是L·mol-1;它的大小与温度,压强有关,在标准状况下,任何气体的摩尔体积都约等于22.4 L.mol-1二.物质的量与其他量之间的关系若以M表示气体A的摩尔质量,V m表示气体A的摩尔体积,ρ为气体A 的密度,N A为阿伏加德罗常数,体积为V的气体A质量为m,物质的量为n ,每个A分子的质量和体积分别为m1和V1。
写出下列关系式:1.m、n、M的关系:n=m M2.m 、M 、N的关系:⑨M=m1·N A。
3.V 、n 、V的关系:V m=V n。
4.M 、V m、ρ之间的关系式:M=ρ·V m。
高考真题1.工业上用N2和H2合成NH3,N A代表阿伏加德罗常数的值,下列说法正是A .9g 水中含有的孤电子对数为A 2NB .每产生3234gNH ,N 失去的电子数为A 6NC .11mol L -⋅氨水中,含有的32NH H O ⋅分子数少于A ND .消耗211.2LN (已折算为标况)时,产生的2O 分子数为A 0.75N3.N A 是阿伏加德罗常数的值。
2021高三全国统考化学(经典版)一轮学案:第1章 第1节物质的量气体摩尔体积含答案

2021高三全国统考化学(经典版)一轮学案:第1章第1节物质的量气体摩尔体积含答案第一章化学计量在实验中的应用第1节物质的量气体摩尔体积[考试说明] 1.理解摩尔(mol)是物质的量的单位,可用于进行简单的化学计算.2。
了解摩尔质量、气体摩尔体积、阿伏加德罗常数的含义。
3.能根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况)之间的相互关系进行有关计算。
[命题规律]物质的量、气体摩尔体积是高考常考的知识点,命题主要方式为“已知N A为阿伏加德罗常数的值,判断下列说法正确(或错误)的是()".题目主要结合物质的状态、物质结构、氧化还原反应、某些反应的原理、分散系、盐类水解等知识来考查计量关系。
覆盖面广,具有良好的区分度.考点1物质的量摩尔质量知识梳理1。
物质的量及其单位(1)定义:表示含有错误!一定数目粒子的集合体的物理量。
符号为错误!n.(2)单位:错误!摩尔,简称摩,符号为错误!mol.2.阿伏加德罗常数(1)定义:错误!0。
012_kg_12C所含的碳原子数为阿伏加德罗常数,其数值约为错误!6。
02×1023,单位为错误!mol-1,符号为错误!N A。
(2)计算公式:物质的量n、阿伏加德罗常数N A与粒子数N之间的关系为错误!N A=错误!。
3.摩尔质量(1)定义:错误!单位物质的量的物质所具有的质量。
符号为错误! M。
单位:错误!g/mol(或g·mol-1)。
(2)数值:当摩尔质量以错误!g·mol-1为单位时,在数值上等于该物质的错误!相对分子质量(或相对原子质量)。
(3)计算公式:物质的量(n)、物质的质量(m)、摩尔质量(M)之间的关系为□06M=错误!。
(1)物质的量是计量微观粒子的物理量,只适用于微观粒子(即分子、原子、离子、质子、中子、电子等),不适用于宏观物质。
摩尔是物质的量的单位。
(2)摩尔质量、相对分子质量、1 mol物质的质量含义不同,三者的单位也不同。
高三化学第一轮复习教案-物质的量 气体摩尔体积教案
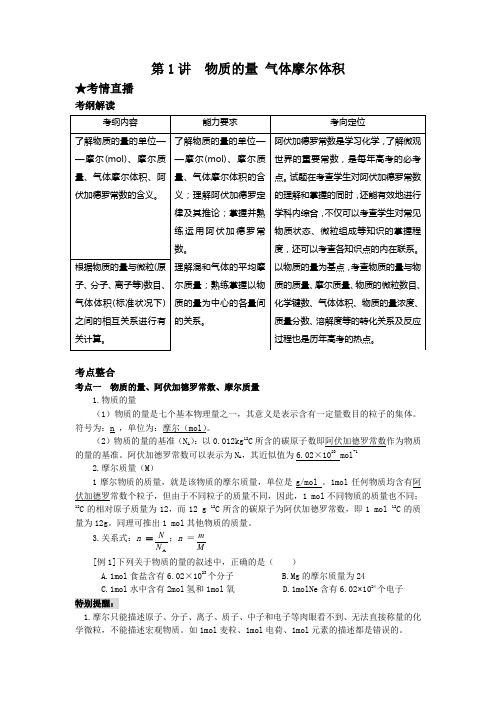
第1讲 物质的量 气体摩尔体积★考情直播考纲解读考点整合考点一 物质的量、阿伏加德罗常数、摩尔质量1.物质的量(1)物质的量是七个基本物理量之一,其意义是表示含有一定量数目的粒子的集体。
符号为:n ,单位为:摩尔(mol )。
(2)物质的量的基准(N A ):以0.012kg 12C 所含的碳原子数即阿伏加德罗常数作为物质的量的基准。
阿伏加德罗常数可以表示为N A ,其近似值为6.02×1023 mol -12.摩尔质量(M )1摩尔物质的质量,就是该物质的摩尔质量,单位是g/mol 。
1mol 任何物质均含有阿伏加德罗常数个粒子,但由于不同粒子的质量不同,因此,1 mol 不同物质的质量也不同;12C 的相对原子质量为12,而12 g 12C 所含的碳原子为阿伏加德罗常数,即1 mol 12C 的质量为12g 。
同理可推出1 mol 其他物质的质量。
3.关系式:n =A N N ;n =M m[例1]下列关于物质的量的叙述中,正确的是( )A.1mol 食盐含有6.02×1023个分子 B.Mg 的摩尔质量为24C.1mol 水中含有2mol 氢和1mol 氧D.1molNe 含有6.02×1024个电子 特别提醒:1.摩尔只能描述原子、分子、离子、质子、中子和电子等肉眼看不到、无法直接称量的化学微粒,不能描述宏观物质。
如1mol 麦粒、1mol 电荷、1mol 元素的描述都是错误的。
2.使用摩尔作单位时,应该用化学式(符号)指明粒子的种类。
如1mol 水(不正确)和1molH 2O (正确);1mol 食盐(不正确)和1molNaCl(正确)3.语言过于绝对。
如6.02×1023mol -1就是阿伏加德罗常数;摩尔质量等于相对原子质量、相对分子质量;1摩尔任何物质均含有阿伏加德罗常数个粒子等。
考点二 气体摩尔体积1.定义:单位物质的量的气体所占的体积,叫做气体摩尔体积。
2022届新高考一轮复习 第1章 第1讲 物质的量 气体摩尔体积 教案

第一章 化学计量及其应用 一、物质的量〔n 〕1.物质的量是表示含有一定数目粒子的集合体的物理量,单位是摩尔〔mol 〕。
2.摩尔:规定1mol 粒子集合体所含的粒子数=kg 12C 中含有的碳原子数约为6.02×1023 。
3.阿伏伽德罗常数:1mol 粒子集合体所含的粒子数。
数值约为6.02×1023,常用N A 表示,单位mol −1。
公式:n NN A 。
4.“物质的量〞的表示方法: x mol H 2SO 4〔数值〕 〔单位〕 〔指定化学式或微粒符号〕二、摩尔质量〔M 〕第一课 物质的量 气体摩尔体积 知识结构考点1:物质的量 摩尔质量知识全梳理概念符号单位g·mol −1为单位时,任何粒子的摩尔质量在数值上Mg·mol−1单位物质的量的物质所具有的质量诊断辨析例1.以下说法不正确的选项是〔〕A.铜的摩尔质量在数值上等于它的相对原子质量B.kg碳所含的碳原子数,其数值约等于6.02×1023C.1molH2SO4约含有1.204×1024个氢原子D.常温常压下,1molCO2气体的质量为44g【答案】B【解析】kg所含的碳原子数为阿伏伽德罗常数,该项说法没有指明哪种碳原子,错误;C项,根据H2SO4分子式,1molH2SO4含有2mol氢原子,约为1.024×1024个,正确;D项,CO2摩尔质量为44g/mol,故1molCO2气体的质量为44g,正确。
例2.以下表达中错误的选项是〔〕A.1mol任何物质都含有6.02×1023个分子B.12C中约含有6.02×1023个碳原子C.1mol H2O中含有2mol H和1mol OD.1mol C中约含有3.612×1024个电子【答案】A【解析】A.不是任何物质都是由分子构成的,构成物质的微粒还有原子和离子,A项错误;B.0.012kg 12C的物质的量为1mol,约含有6.02×1023个碳原子,B项正确;C.一个水分子中含两个氢原子和一个氧原子,因此1mol H2O中含有2mol H和1mol O,C项正确;D.1个C原子有6个电子,1mol C就有6mol电子,所以1mol C中约含有3.612×1024个电子,D项正确;应选A。
高考化学一轮总复习:物质的量 气体摩尔体积

解析:选 C。等质量的气体,其摩尔质量与物质的量(或分子数) 成反比,若 M(甲)<M(乙),则分子数:甲>乙,A 项错误;若 M(甲)>M(乙),则物质的量:甲<乙,又气体体积相等,故气体 摩尔体积:甲>乙,B 项错误;同温同体积同质量的气体或混合 气体,压强与摩尔质量成反比,C 项正确;由质量和密度相等 可知气体体积相等,D 项错误。
题组三 考查阿伏加德罗定律及其应用
5.标准状况下,a L 气体 X2 和 b L 气体 Y2 恰好完全反应生成 c L 气体 Z,若 2a=6b=3c,则 Z 的化学式为( )
A.XY2
B.X2Y
C.X3Y
D.XY3
解析:选 C。由VV12=nn12知反应的化学方程式为 3X2+Y2===2XmYn,
考点一 物质的量 摩尔质量
1.物质的量(n) (1)含义:表示含有一定数目粒子的集合体,单位为__m__o_l __。 (2)数值:1 mol 粒子集合体所含的粒子数与__0_._0_1_2_k_g__12_C__中所 含的碳原子数相同。 (3)描述对象:微观粒子(如电子、质子、中子、分子、原子、离 子等)或微观粒子的特定组合(如原子团、官能团等)。
解析:选 D。在一定温度和压强下,固体或液体的体积主要取 决于粒子数和粒子大小,故 A 错误;决定气体体积的因素是温 度、压强、气体的分子数,不同的气体,体积不同,它们所含 的分子数不一定不同,故 B 错误;压强对分子间的距离有影响, 该选项未指明压强,无法使用阿伏加德罗定律判断,故 C 错误; 根据公式求算 n(CO2)=Mm=44 g2·2mgol-1=0.5 mol,n(HCl)=VVm =22.411L.2·mLol-1=0.5 mol,二者物质的量相等,所以分子数相等, 故 D 正确。
高三化学一轮复习 第十九讲 物质的量和气体摩尔体积学案 课时作业

第19讲物质的量和气体摩尔体积(两课时)一、考试说明:1、了解物质的量单位——摩尔、摩尔质量、气体摩尔体积和阿伏加德罗常数的含义;2、能根据物质的量与微粒数目、物质质量、摩尔质量、气体摩尔体积(标准状况)等进行有关计算(混合气体的平均相对分子质量相关计算不做要求)。
二、教学设计:1、物质的量(1)概念:是表示的物理量。
符号,单位是(mol),简称。
(2)摩尔:是的单位。
在国际单位制(SI)中规定,在一个系统的基本单元(微观粒子及其特殊组合)的数量与所含的碳原子数相同,则该基本单元的物质的量就是1摩尔。
2、阿伏加德罗常数:所含有的碳原子数。
符号,单位。
1摩尔任何物质的指定微粒所含的指定微粒数目都是阿佛加德罗常数个,也就是含有的碳原子数。
经过科学测定,阿佛加德罗常数的近似值一般取,微粒个数(N)与物质的量(n)换算关系为:。
例题1:下列说法正确的是A. 物质的量是把物质的质量和微观粒子数联系起来的一个基本物理量B. 摩尔是国际单位制中七个基本物理量之一C. 1mol任何物质的质量就是该物质的相对分子质量D. 6.02×1023个H2所含分子的物质的量为1mol思考与交流1:若将阿伏加德罗常数规定为0.024kg 12C所含有的碳原子数,其他规定(概念)不变,下列各项值不会发生变化的是()A. 物质的量B. 相对原子质量C. 1mol物质的质量D. 12g12C所含有的碳原子数3、摩尔质量(1)概念:,符号。
(2)如果以g·mol-1为单位,摩尔质量的数值与粒子的相等。
(3)计算公式:例题2:在一定条件下,16gA和22gB恰好反应生成C和4.5gD。
在相同条件下,8gA和15gB 反应可生成D和0.125molC。
从上述事实可推知C的式量为____________。
4、气体摩尔体积(1)影响物质体积的因素(2)气体摩尔体积①气体摩尔体积:概念:,符号:,单位:。
②标准状况下的气体摩尔体积:。
高考化学一轮复习 专题1.1 物质的量、气体摩尔体积教学案
——————————新学期新成绩新目标新方向——————————专题1.1 物质的量、气体摩尔体积【考纲解读】1.理解摩尔(mol)是物质的量的单位,可用于进行简单的化学计算。
2.了解摩尔质量、气体摩尔体积、阿伏加德罗常数的含义。
3.能根据物质的量与微粒(原子、分子、离子等)数目、气体体积(标准状况)之间的相互关系进行有关计算。
【命题规律】物质的量、气体摩尔体积是高考常考的知识点,命题主要方式为“已知N A为阿伏加德罗常数,判断和计算一定量的物质所含微粒的数目”。
题目主要结合物质的状态、物质结构、氧化还原反应、某些反应的原理、分散系、盐类水解等知识来考查计量关系。
覆盖面广,具有良好的区分度。
一、三个概念1.物质的量(1)概念:物质的量是一个物理量,表示含有一定数目粒子的集合体,符号为n,单位为mol。
(2)数值:国际上规定,1 mol粒子集体所含的粒子数与0.012 kg 12C中所含的碳原子数相同。
2.阿伏加德罗常数(1)概念:1 mol任何粒子所含的粒子数,符号为N A,通常用6.02×1023 mol-1表示。
(2)区别与联系:阿伏加德罗常数(N A)与6.02×1023的含义不同;N A为0.012 kg 12C中所含的碳原子的准确数目,是一个精准值,而6.02×1023只是阿伏加德罗常数的一个近似值。
3.摩尔质量(1)概念:单位物质的量的物质所具有的质量,符号:M,单位:g·mol-1。
(2)数值:当粒子的摩尔质量以g·mol-1为单位时,在数值上等于该粒子的相对分子(原子)质量。
(3)区别与联系:摩尔质量、相对分子质量、1 mol物质的质量在数值上是相同的,但含义不同,三者的单位不同。
摩尔质量的单位是g·mol-1,相对原子(分子)质量的单位是1,1 mol物质的质量单位是g。
【易错警示】摩尔质量与相对原子(分子)质量的区别与联系(1)相对原子(或分子)质量与摩尔质量不是同一个物理量,单位不同,只是在数值上相等。
高考化学一轮复习第01讲 物质的量 气体摩尔体积(练习)(解析版)
第01讲物质的量气体摩尔体积(模拟精练+真题演练)1.(2022·上海青浦·统考一模)下列对摩尔(mol )的有关说法中错误的是A .摩尔是一个单位而非物理量B .摩尔既能用来计量纯净物,又能用来计量混合物C .1mol 任何气体所含气体的分子数目都相等D .0.5mol 氦约含有1.204×1024个电子【答案】D【解析】A.摩尔是物质的量的单位,正确;B.摩尔用来计量微粒的量,可以是纯净物的微粒,也可以是混合物的微粒,正确;C.气体物质的量相等,则气体的分子数目相等,正确;D.氦为单原子分子,0.5mol 氦含有0.5molHe 原子,1个He 原子含有2个电子,所以0.5mol 氦约含有6.02×1023个电子,错误;故选D 。
2.(2023·湖南·校联考模拟预测)过氧化钠常用作供氧剂:2222322Na O 2CO =2Na CO O ++。
下列说法正确的是A .22Na O 的摩尔质量为78B .该反应为置换反应C .23Na CO 俗名苏打、纯碱D .2O 电子式为【答案】C【解析】A .Na 2O 2的摩尔质量为,A 错误;B .置换反应特点是为单质制取单质,B 错误;C .碳酸钠俗称纯碱、苏打,C 正确;D .氧气的电子式为,D 错误;故答案为:C 。
3.(2023·河北保定·统考一模)工业合成氨常选择223N 3H 2NH + 高温、高压催化剂,A N 为阿伏加德罗常数的值,下列说法正确的是A .1mol 2N 完全反应,转移的电子数为3AN B .混合气中物质的沸点由高到低的顺序为322NH N H >>C .物质的量之比为1∶1的2N 和2H 的混合气体所含原子数目为4AN D .反应物断裂A N 个σ键同时生成物断裂A N 个σ键,反应达到平衡状态【答案】B【解析】A .反应中氮元素化合价由0变为-3,则1mol 2N 完全反应,转移的电子数为6A N ,A 错误;B .氨气分子间存在氢键,导致沸点最高;氮气的相对分子质量大于氢气,其沸点高于氢气,故混合气中物质的沸点由高到低的顺序为322NH N H >>,B 正确;C .不确定混合气体的总的物质的量,不能计算2N 和2H 的混合气体中所含原子数目,C 错误;D .单键均为σ键,叁键含有1个σ键2个π键;1个氮气分子含有2个π键和1个σ键,1分子氢气含有1个σ键,1分子氨气含有3个σ键,则反应物断裂A N 个σ键同时生成物断裂A N 个σ键,说明正逆反应速率不同,反应没有达到平衡状态,D 错误;故选B 。
高三一轮复习教案物质的量
高三一轮复习教案:物质的量 气体摩尔体积[考纲要求] 1.了解物质的量及其单位、阿伏加德罗常数、摩尔质量、气体摩尔体积的含义。
2.能根据物质的量与质量、摩尔质量、气体体积(标准状况)、物质的量浓度、物质质量分数、阿伏加德罗常数、微粒数之间的相互关系进行有关计算。
3.能正确解答阿伏加德罗常数及阿伏加德罗定律与物质的组成、结构及重要反应综合应用题。
考点一 物质的量、摩尔质量【知识梳理】1.物质的量(1)物质的量(n) 物质的量是表示含有一定数目粒子的集合体的物理量,单位为摩尔(mol)。
(2)物质的量的规范表示方法:(3)阿伏加德罗常数(NA)0.012 kg 12C 所含原子数为阿伏加德罗常数,其数值约为6.02×1023,单位为mol -1。
公式:N A =N n2.摩尔质量(1)摩尔质量是单位物质的量的物质所具有的质量。
单位是g·mol-1。
公式:M=mn。
(2)数值:以g·mol-1为单位时,任何粒子的摩尔质量在数值上都等于该粒子的相对分子(原子)质量。
深度思考1.1 mol NaCl和1 mol HCl所含的粒子数相同吗?2.阿伏加德罗常数(NA)与6.02×1023完全相同吗?【典型例题、思维建模】题组一有关概念的理解1.下列说法中正确的是A.1 mol任何物质都含有6.02×1023个分子 B.1 mol Ne中含有约6.02×1024个电子C.1 mol水中含2 mol氢和1 mol氧 D.摩尔是化学上常用的一个物理量2.下列说法正确的是( )A.NaOH的摩尔质量为40 g B.1 mol O2的质量与它的相对分子质量相等C.1 mol OH-的质量为17 g·mol-1D.氖气的摩尔质量(单位g·mol-1)在数值上等于它的相对原子质量摩尔质量与相对原子(分子)质量的易混点(1)相对原子(分子)质量与摩尔质量(以g为单位时)不是同一个物理量,单位不同,只是在数值上相等。
高考化学一轮复习 第1章 第1节 物质的量 气体摩尔体积教学案
第一节 物质的量 气体摩尔体积1.物质的量、阿伏加德罗常数注意:(1)使用摩尔作单位时,必须指定化学式或指明微粒的种类,如1 mol H 不能描述为1 mol 氢等。
(2)阿伏加德罗常数有单位,单位为mol -1,不能仅写数值6.02×1023。
2.摩尔质量(1)概念:单位物质的量的物质所具有的质量,符号为M ,单位为g/mol 或g·mol -1。
(2)数值:当微粒的摩尔质量以g·mol -1为单位时,在数值上等于该微粒的相对分子(原子)质量。
(3)关系:物质的量、物质的质量与摩尔质量关系为n =m M或M =m n或m =n ·M 。
注意:(1)摩尔质量、相对分子质量、质量是三个不同的物理量,具有不同的单位。
如H 2O 的摩尔质量为18 g·mol -1,H 2O 的相对分子质量为18,1 mol H 2O 的质量为18 g 。
(2)摩尔质量与温度、压强、物质的量多少无关。
[应用体验]1.正误判断(正确的打“√”,错误的打“×”)(1)1 mol OH -的质量是17 g·mol -1。
( )(2)N A 代表阿伏加德罗常数,22 g CO 2中含有的氧原子数为N A 。
( )(3)n mol O 2中分子数为N ,则阿伏加德罗常数为N n。
( ) 答案:(1)× (2)√ (3)×2.(1)硫酸钠(Na 2SO 4)的摩尔质量为________;71 g Na 2SO 4中含钠离子的物质的量为________,氧原子的物质的量为________。
(2)49 g H 3PO 4的物质的量为________,用N A 表示阿伏加德罗常数的值,其中含有________个H ,含________个O 。
答案:(1)142 g·mol -1 1 mol 2 mol (2)0.5 mol 1.5N A 或1.5×6.02×1023 2N A 或2×6.02×1023⊙考法1 物质的量、摩尔质量的有关概念1.下列说法不正确的是( )A .物质的量是描述微观粒子集合体的物理量B .阿伏加德罗常数就是6.02×1023C .1 mol CO 2与1 mol CO 含有的分子数目相等D .SO 2-4的摩尔质量为96 g·mol -1B [阿伏加德罗常数为物理量,单位为mol -1。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
= = = = = 2Na+Cl2↑,得出生成标准状况下 11.2 L 氯气,故 D 错误。
[方法规律]
以物质的量为中心的换算关系
NA 的正误判断
[考法感悟] 1.(2018·全国卷Ⅰ)NA 是阿伏加德罗常数的值。下列说法正确的是( ) A.16.25 g FeCl3 水解形成的 Fe(OH)3 胶体粒子数为 0.1NA B.22.4 L(标准状况)氩气含有的质子数为 18NA C.92.0 g 甘油(丙三醇)中含有羟基数为 1.0NA D.1.0 mol CH4 与 Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0NA 解析:选 B Fe(OH)3 胶体粒子是若干个 Fe(OH)3 的集合体,A 项错误;氩气是单原子 分子,标准状况下,22.4 L 氩气的物质的量为 1 mol,含有的质子数为 18NA,B 项正确; 92.0 g 甘油的物质的量为 1 mol,每个甘油分子含有 3 个羟基,所以 1 mol 甘油含有的羟基 数为 3.0NA,C 项错误;CH4 与 Cl2 发生取代反应生成的有机物除了 CH3Cl 以外,还有 CH2Cl2、CHCl3 和 CCl4,生成的 CH3Cl 分子数小于 1.0NA,D 项错误。 2.(2018·全国卷Ⅱ)NA 代表阿伏加德罗常数的值。下列说法正确的是( ) A.常温常压下,124 g P4 中所含 P—P 键数目为 4NA B.100 mL 1 mol·L-1 FeCl3 溶液中所含 Fe3+的数目为 0.1NA
N (2)关系:物质的量、粒子数(N)与阿伏加德罗常数的关系为 n= 。
NA 3.摩尔质量(M) (1)概念:单位物质的量的物质所具有的质量,单位:g·mol-1。 (2)数值:当粒子的摩尔质量以 g·mol-1 为单位时,在数值上等于该粒子的相对分子(原 子)质量。
m (3)关系:物质的量、物质的质量与摩尔质量的关系为 n= 。
B.1.00 mol NaCl 中,所有 Na+的最外层电子总数为 8×6.02×1023
C.欲配制 1.00 L 1.00 mol·L-1 的 NaCl 溶液,可将 58.5 g NaCl 溶于 1.00 L 水中
D.电解 58.5 g 熔融的 NaCl,能产生 22.4 L 氯气(标准状况)、23.0 g 金属钠
(3)相关计算
V ①基本表达式:Vm= n ;
Vm ②与气体质量的关系: = ;
Vm M VN
③与气体分子数的关系: = 。 Vm NA
(4)影响因素:气体摩尔体积的数值不是固定不变的,它决定于气体所处的温度和压 强。
[小题练微点] 判断下列说法的正误(正确的打“√”,错误的打“×”)。 (1)1 mol H2O 中含有 2 mol 氢和 1 mol 氧( ) (2)0.012 kg 12C 中含有约 6.02×1023 个碳原子( ) (3)58.5 g NaCl 晶体中所含的粒子数目约为 6.02×1023( ) (4)1 mol OH-的质量是 17 g·mol-1( ) (5)标准状况下,22.4 L 氧气与 22.4 L 苯中所含分子数均为 NA( ) (6)11 g CO2 的体积为 5.6 L( ) 答案:(1)× (2)√ (3)× (4)× (5)× (6)×
第一章 化学计量
第一节
物质的量 气体摩尔 体积
1.了解物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体 积(Vm)、阿伏加德罗常数(NA)的含义。 2.能根据微粒(原子、分子、离子等)物质的量、数目、气体体积
(标准状况下)之间的相互关系进行有关计算。
考点(一) 物质的量、气体摩尔体积 【点多面广精细研】
M [注意] 摩尔质量、相对分子质量、质量是三个不同的物理量,具有不同的单位。如 H2O 的摩尔质量为 18 g·mol-1,H2O 的相对分子质量为 18,1 mol H2O 的质量为 18 g。 4.气体摩尔体积(Vm) (1)影响物质体积的因素
(2)概念:在一定条件下,单位物质的量的气体所占的体积,单位:L/mol(或 L·mol- 1),标准状况下(0 ℃,101 kPa),Vm=22.4_L·mol-1。
[学霸微提醒] (1)阿伏加德罗常数有单位,应写为 6.02×1023 mol-1,不能仅写数值 6.02×1023。 (2)气体摩尔体积的使用“条件”一般指标准状况,即 0 ℃、1.01×105 Pa;使用对象 必须是气体物质,可以是单一气体,也可以是混合气体。水、酒精、SO3、CCl4、苯等物 质在标准状况下不是气体。 (3)在标准状况下,气体摩尔体积约为 22.4 L·mol-1,但在非标准状况下,1 mol 气体的 体积也可能是 22.4 L。
以物质的量为中心的简单计算 1.(2018·全国卷Ⅲ)下列叙述正确的是( ) A.24 g 镁与 27 g 铝中,含有相同的质子数 B.同等质量的氧气和臭氧中,电子数相同 C.1 mol 重水与 1 mol 水中,中子数比为 2∶1 D.1 mol 乙烷和 1 mol 乙烯中,化学键数相同 解析:选 B 24 g Mg、27 g Al 的物质的量均为 1 mol,1 个 Mg 原子和 1 个 Al 原子所含 的质子数分别为 12、13,故 24 g 镁与 27 g 铝中含有的质子分别为 12 mol 和 13 mol,A 项 错误;等质量的氧气和臭氧,所含氧原子数相等,故电子数相同,B 项正确;1 个 D2O 分 子含有 10 个中子,1 个 H2O 分子含有 8 个中子,1 mol 重水与 1 mol 水中含有的中子数之
比为 10∶8(5∶4),C 项错误;1 个乙烷分子中含有 7 个共价键,而 1 个乙烯分子中含有 6
个共价键,故 1 mol 乙烷与 1 mol 乙烯中,含有的化学键数之比为 7∶6,D 项错误。
2.下列叙述正确的是( )
A.1.00 mol NaCl 中含有 6.02×1023 个 NaCl 分子
解析:选 B NaCl 是离子化合物,故 A 错误;Na+最外层有 8 个电子,所以 1.00 mol
Na+的最外层电子总数为 8×6.02×1023,故 B 正确;欲配制 1.00 L NaCl 溶液,所需水的
Байду номын сангаас
体积应小于 1.00 L,故 C 错误;电解 58.5 g 熔融的 NaCl,根据电解方程式:2NaCl(熔融)
1.物质的量(n) (1)含义:物质的量是一个物理量,表示含有一定数目粒子的集合体,单位为 mol。 (2)数值:1 mol 粒子集合体所含的粒子数与 0.012_kg 12C 中所含的碳原子个数相同, 约为 6.02×1023。 2.阿伏加德罗常数(NA) (1)概念:1 mol 任何粒子所含的粒子数,通常用 6.02×1023_mol-1 表示。
