初中酸碱盐反应规律图
酸碱盐知识导图

氮肥 钾肥 磷肥 复合肥
种类 鉴别
合理使用化肥
盐 化肥
化肥及其 鉴别
盐及盐的化 学性质
氯化钠
常见的盐
碳酸钠 碳酸氢钠
粗盐提纯
碳酸钙 与某些金属反应
盐的通性
与某些酸反应 与某些碱反应
与某些盐反应 复分解反应
实质
应用
(浓)盐酸 常 见
(浓)硫酸 的 酸
中和反应 及其应用
常 见
氢氧化钠
的 碱
氢氧化钙
与指示剂作用 酸
与碱反应 酸
酸和 碱 碱
与指示剂作用 碱 与酸反应
与活泼金属反应 的
与某些金属 氧化物反应
通 性
溶液的酸 碱性与酸
碱度
的
通 与某些非金属
性反应
酸碱性
酸碱度
的检验
(定量)
浙教版科学中考复习:酸碱盐优先反应 (共38张PPT)【完美版】

• [解析] 向H2SO4和CuSO4的混合溶液中逐滴滴入Ba(OH)2溶液至过量,因为 Ba(OH)2溶液显碱性,最终pH>7。
• 向H2SO4和CuSO4的混合溶液中逐滴滴入Ba(OH)2溶液,随着Ba(OH)2溶液的不 断加入,H2SO4不断消耗,质量不断减小。
• 随着Ba(OH)2溶液的不断加入,溶液质量不断增加,CuSO4的质量分数不断减小。 • 向H2SO4和CuSO4的混合溶液中逐滴滴入Ba(OH)2溶液,H2SO4与Ba(OH)2会发
• bc段(不含b点),氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化 学方程式为MgCl2 +2NaOH===Mg(OH)2↓+2NaCl,B正确;
• 从前面的分析可知,在整个过程中,氯离子没有和其他离子结合生成沉淀、气 体或水,故氯离子数目从未改变,C正确;
• d点时,氢氧化钠和氯化镁恰好完全反应,此时溶液中只含有氯化钠一种溶质,D 错误。
酸碱性
pH变化
16
浙教版科学中考复习:酸碱盐优先反 应 (共38张PPT)【完美版】
2.用图像序号填空。
序号 点或线段
(1) O点
(2)
P点
(3) M点
(4) N点
(5) OP段
(6) PM段
(7) MN段
溶质成分 NaOH、Na2CO3 NaCl、Na2CO3
NaCl NaCl、HCl NaOH、NaCl、Na2CO3 NaCl、Na2CO3 NaCl、HCl
19
浙教版科学中考复习:酸碱盐优先反 应 (共38张PPT)【完美版】
专项训练
• 1.向一定量CaCl2和盐酸的混合溶液中滴加过量某物质,溶液的pH随滴入X的
初三化学酸碱盐归纳总结
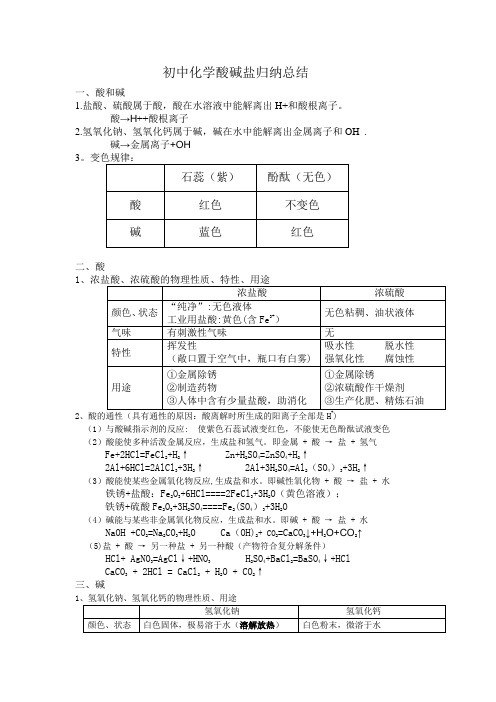
初中化学酸碱盐归纳总结一、酸和碱1.盐酸、硫酸属于酸,酸在水溶液中能解离出H+和酸根离子。
酸→H ++酸根离子2.氢氧化钠、氢氧化钙属于碱,碱在水中能解离出金属离子和OH¯. 碱→金属离子+OH ¯ 3二、酸12(1)与酸碱指示剂的反应: 使紫色石蕊试液变红色,不能使无色酚酞试液变色 (2)酸能使多种活泼金属反应,生成盐和氢气。
即金属 + 酸 → 盐 + 氢气Fe+2HCl=FeCl 2+H 2↑ Zn+H 2SO 4=ZnSO 4+H 2↑2Al+6HCl=2AlCl 3+3H 2↑ 2Al+3H 2SO 4=Al 2(SO 4)3+3H 2↑(3)酸能使某些金属氧化物反应,生成盐和水。
即碱性氧化物 + 酸 → 盐 + 水 铁锈+盐酸:Fe 2O 3+6HCl====2FeCl 3+3H 2O (黄色溶液); 铁锈+硫酸Fe 2O 3+3H 2SO 4====Fe 2(SO 4)3+3H 2O(4)碱能与某些非金属氧化物反应,生成盐和水。
即碱 + 酸 → 盐 + 水 NaOH +CO 2=Na 2CO 3+H 2O Ca (OH)2+ CO 2=CaCO 3↓+H 2O+CO 2↑ (5)盐 + 酸 → 另一种盐 + 另一种酸(产物符合复分解条件) HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HClCaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 三、碱12、碱的通性(具有通性的原因:离解时所生成的阴离子全部是OH )(1)碱溶液与酸碱指示剂的反应: 使紫色石蕊试液变蓝色,使无色酚酞试液变红色 (2)酸性氧化物+碱 → 盐+水 2NaOH+CO 2=Na 2CO 3+H 2O (3)酸+碱 → 盐+水NaOH + HCl = NaCl + H 2O(4)盐+碱 → 另一种盐+另一种碱(反应物均可溶,产物符合复分解条件)HCl+ AgNO 3=AgCl ↓+HNO 3 H 2SO 4+BaCl 2=BaSO 4↓+HCl CaCO 3 + 2HCl = CaCl 2 + H 2O + CO 2↑ 注:①难溶性碱受热易分解(不属于碱的通性) 如Cu(OH )2 ΔCuO +H 2O 2Fe(OH)3 ΔFe 2O 3+3H 2O②常见沉淀:AgCl ↓ BaSO 4↓ Cu(OH)2↓ F e (OH)3↓ Mg (OH)2↓ BaCO 3↓ CaCO 3↓③复分解反应的条件:当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
八圈图(附 氧化物酸碱盐相互关系)
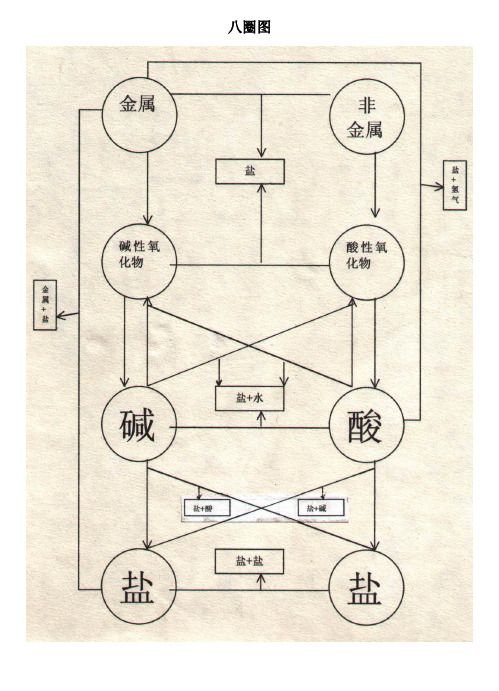
八圈图竖的关系:1. 金属+氧气→碱性氧化物; MgO O Mg 222点燃==+2. 碱性氧化物+水→碱;(一般仅:K,Na,Ba,Ca,Mg 的氧化物可以。
) 22Ca(OH)O H CaO ==+3. 碱−→−∆碱性氧化物+水;(除K,Na,Ba,Ca,Mg 的氢氧化物外一般都可以。
) ()O H CuO OH Cu 22+==∆4. 碱――→盐(有三种方法);(即: 酸性氧化物+碱→盐+水; 碱+酸→盐+水; 碱+盐→新碱+新盐.)5. 非金属+氧气→酸性氧化物; 522254O P O P 点燃==+6. 酸性氧化物+水→酸;(一般都可以,但SiO 2不行。
) 3222CO H O H CO ==+7. 酸−→−∆酸性氧化物+水;(一般都可以,但硫酸不行。
) O H CO CO H 2232+↑== 8. 酸――→盐(有三种方法);横的关系:1. 金属+非金属→盐(无氧酸盐); NaCl Cl Na 222点燃==+2. 碱性氧化物+酸性氧化物→盐(含氧酸盐); 32CaCO CO CaO ==+3. 碱+酸→盐+水(中和反应); ()O H CuCl HCl OH Cu 22222+==+4. 盐+盐→新盐+新盐(△) ()白色↓+==+AgCl NaNO NaCl AgNO 33 斜的关系:1. 碱性氧化物+酸→盐+水; O H FeCl HCl O Fe 2332326+==+2. 酸性氧化物+碱→盐+水; O H SO Na NaOH SO 23222+==+3. 碱+盐→新碱+新盐;(△) ()()白色↓+==+33222CaCO NaOH CO Na OH Ca 4. 酸+盐→新酸+新盐;(△) O H CO CaCl HCl CaCO 22232+↑+==+5. 金属+酸→盐+氢气;(★) ↑+==+2442H ZnSO SO H Zn6. 金属+盐→新金属+新盐。
(★) Cu Cu 44+==+FeSO SO Fe△ 生成物要有沉淀或气体或水。
酸碱盐反映的规律

酸、碱、盐反应的一些规律考试大本营 - 赛蝶网 2008-04-24 03:03:30 浏览:76次【大中小】【打印】【繁体】【红绿黄黑】【发表】【关闭】【评论】赛蝶网讯:一、置换反应:(1)金属+酸——盐+水例如:zn+h2so4=znso4+h2条件:金属在活动性顺序表中必须排在h前,有mg、al、zn、fe、sn、pb酸主要是指hcl、h2so4(2)金属+盐——新金属+新盐例如:fe+cuso4=cu+feso4条件:金属在活动性顺序表中必须排在组成盐的金属前,如:fe排在cu的前面;盐必须溶解于水。
二、化合反应(1)酸性氧化物+水——酸大多数非金属氧化物是酸性氧化物例如:so3+h2o=h2so4co2+h2o=h2co3(2)碱性氧化物+水——碱大多数金属氧化物是碱性氧化物例如:cao+h2o=ca(oh)22nao+h2o=2naoh条件:碱可以溶解于水三、分解反应(1)碱——碱性氧化物+水例如:cu(oh)2=cuo+h2o条件:碱不可以溶解于水四、复分解反应总的条件:反应后生成物中必须有一种沉淀或一种气体或水(1)酸+碱——盐+水(中和反应)例如:naoh+h2so4=na2so4+2h2o (2)酸+碱性氧化物——盐+水例如:h2so4+mgo=mgso4+h2o6hcl+fe2o3=2fecl3+3h2o(3)酸+盐——新酸+新盐例如:h2so4+bacl2=baso4+2hclhcl+agno3=agcl+hno3条件:强酸制弱酸、稳定性酸制不稳定性酸、不挥发性酸制挥发性酸,总的来说各中酸排列的顺序是:h2so4、hcl、hno3、h2co3前面的酸可以制取后面的酸,而后面的酸不可以制取前面的酸。
(4)碱+盐——新碱+新盐例如:2naoh+cuso4=na2so4+cu(oh)23ca(oh)2+2fecl3=3cacl2+2fe(oh)3 条件:反应的碱和反应的盐必须都溶解于水(5)盐+盐——新盐+新盐例如:nacl+agno3=nano3+agclbacl2+na2so4=2nacl+baso4条件:两种反应的盐必须都溶解于水在置换反应中,金属fe参加反应总是生成+2价的亚铁盐例如:fe+2hcl=fecl2+h2在复分解反应中金属元素的化合价不变,这可以帮助我们写出复分解反应中金属元素的化合物的化学式例如:fe2o3+3h2so4=fe2(so4)3+3h2o。
初中化学应用广泛的酸、碱、盐知识点图

第七章应用广泛的酸、碱、盐知识脉络图
一、酸
1.重要的酸:
性质:
盐酸
用途:
性质:
硫酸
用途:
①酸性
②与活泼金属发生置换反应
2、酸的共性:③与金属氧化物反应
④与碱的反应(中和反应),中和反应的应用
⑤与盐的反应
3、酸碱指示剂及溶液的pH:
二、碱
1、重要的碱:
性质:
氢氧化钠
用途:
氢氧化钙性质:
用途:
性质:
氨水
用途:
2、碱的共性:①碱性
②与金属氧化物反应
③与盐发生反应
④与酸反应(中和反应)
三、盐
1、重要的盐:氯化钠,碳酸钠
2、盐的组成和分类,盐的溶解性
3、复分解反应发生的条件:
4、金属活动顺序及应用
四、化学肥料
1、氮肥:NH4HCO3, CO(NH2)2, 氨水等
2、钾肥:KCl,K2SO4,,草木灰等
3、磷肥:磷矿粉,过磷酸钙,重过磷酸钙等
4、复合肥:KNO3,(NH4)2HPO4等。
酸碱盐的反应规律

酸碱盐的反应规律具体内容单质、氧化物、酸、碱、盐之间的相互反应, 可归纳成下图来表示。
① 金属 + 氧气?金属氧化物除Ag 、Pt 、Au 外的金属, 一般都可与氧气发生化合反应, 金属越活泼与氧化合就越容易,反应就越剧烈。
金属氧化物大多数是碱性氧化物。
② 碱性氧化物 + 水?可溶性碱可溶性碱对应的碱性氧化物能与水反应生成对应的碱,K 2O 、Na 2O 、BaO都能跟水反应。
Ca (OH )2微溶于水,它对应的CaO 也能与水反应。
其余的碱性氧化物一般与水不反应或不易反应。
③ 碱?盐由碱转化成盐的三个途径: 碱 + 酸性氧化物?盐 + 水 碱 + 酸?盐 + 水碱 + 某些盐?另一种碱 + 另一种盐 ④ 碱?碱性氧化物 + 水不溶性的碱在加热的条件下,一般可分解为对应的碱性氧化物和水。
碱中的金属越不活泼,则该碱越容易分解。
⑤ 非金属 + 氧气?非金属氧化物除F 2、Cl 2、Br 2、I 2外的非金属,一般都可直接与O 2反应生成非金属氧化物。
非金属氧化物大多数是酸性氧化物。
⑥ 酸性氧化物 + 水?含氧酸除不溶性的SiO 2外, 常见的酸性氧化物都可与水反应生成对应的含氧酸。
⑦ 酸?盐由酸转化成盐有四个途径:某些金属 + 某些酸?盐 + 氢气 酸 + 碱性氧化物?盐 + 水 酸 + 碱?盐 + 水酸 + 某些盐?另一种酸 + 另一种盐 ⑧ 酸?酸性氧化物 + 水在一定条件下含氧酸分解可生成酸性氧化物(酸酐)和水。
⑨ 金属 + 非金属?无氧酸盐此处的非金属H 2、O 2除外。
当金属越活泼, 非金属也越活泼时,反应就越容易进行。
⑩ 酸性氧化物 + 碱性氧化物?含氧酸盐(非初三知识)强酸(H 2SO 4、HNO 3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需在加热或高温条件下才能发生反应。
碱性氧化物 + 酸?盐 + 水强酸(H 2SO 4、HNO 3、HCl )可与所有碱性氧化物反应,弱酸(H 2CO 3、H 2S等)只能和活泼金属的氧化物反应。
化学 酸碱盐氧化物关系图(整理简洁版)ppt课件

(4)碱+酸==盐+H2O
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O23
酸(不稳定)
H2CO3
非金属氧化物+水
CO2↑+H2O
24
ቤተ መጻሕፍቲ ባይዱ温
2CuO+C 2Cu+CO2↑
古代炼铜的△方法之一
CuO+H2 Cu+H2O
非复分解反应,没有交换成分
13
碱+酸==盐+H2O NaOH+HCl=NaCl+H2O 2NaOH+H2SO4=Na2SO4+2H2O Cu(OH)2+2HCl=CuCl2+2H2O 2Fe(OH)3+3H2SO4=Fe2(SO4)3+
2H2O
复分解反应,生成物有水 14
酸 +盐=盐+酸
H2SO4+BaCl2=2HCl +BaSO4 ↓
Al(OH)3+FeCl3≠
解释:因为反应物有沉 淀存在,不能进行
18
盐 + 盐 = 新盐 + 新盐
AgNO3+NaCl=AgCl↓ +NaNO3
CaCl2+Na2CO3=CaCO3↓+2NaCl
Ba(NO3)2+Na2CO3=BaCO3↓+2NaNO
BaCl2+Na2SO4=BaSO4↓+2NaCl
HNO3+NaOH=NaNO3+H2O
H2SO4+2KOH=K2SO4+2H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1 / 1
金属 + 氧气→金属氧化物
除Ag 、Pt 、Au 外的金属,一般都可与氧气发生化合反应,金属越活泼与氧化合就越容易,反应就越剧烈。
金属氧化物大多数是碱性氧化物。
碱性氧化物 + 水→可溶性碱 可溶性碱对应的碱性氧化物能与水反应生成对应的碱,K 2O 、Na 2O 、BaO 都能跟水反应。
Ca (OH )2微溶于水,它对应的CaO 也能与水反应。
其余的碱性氧化
碱→盐
由碱转化成盐的三个途径: 碱 + 酸性氧化物→盐 + 水 碱 + 酸→盐 + 水
碱→碱性氧化物 + 水 不溶性的碱在加热的条件下,一般可分解为对应的碱性氧化物和水。
碱中的金属越不活泼,则该碱越容易
非金属 + 氧气→非金属氧化物
除F 2、Cl 2、Br 2、I 2外的非金属,一般都可
直接与O 2反应生成非金属氧化物。
非金属氧化物大多数是酸性氧化物。
酸性氧化物 + 水→含氧酸
除不溶性的SiO 2外, 常见的酸性氧化物都可与水反应生成对应的含氧酸。
酸→酸性氧化物 + 水 在一定条件下含氧酸分解可生成酸性氧化物(酸酐)
酸→盐
由酸转化成盐有四个途径: 某些金属 + 某些酸→盐 + 氢气 酸 + 碱性氧化物→盐 + 水 酸 + 碱→盐 + 水
金属 + 非金属→无氧酸盐
此处的非金属H 2、O 2除外。
当金属越活泼, 非金属也越活泼时,反应
就越容易进行。
酸性氧化物 + 碱性氧化物→含氧酸盐(非初三知识)
强酸(H 2SO 4、HNO 3)的酸酐与活泼金属的氧化物在常温下即可反应,其余的需
在加热或高温条件下才能发生反应。
酸 + 碱→盐 + 水
参加反应的酸和碱至少有一种是易溶于水的。
盐 + 盐→另两种盐
参加反应的两种盐必须都能溶于水,若生成物中有一种是难溶性的盐时,则反应可以进行。
金属+盐→另一种金属+另一种盐 在金属活动性顺序里, 排在前面的金属(K 、Ca 、Na 除外)能把排在后面的金属从它的盐溶液里
金属 + 酸→盐 + 氢气
在金属活动性顺序里, 排在氢前的金属能从酸溶液中把氢置换出来。
这里的酸主要是指盐酸和稀硫酸。
浓硫酸和硝酸因有强氧化性, 跟金属反应时不会生成氢
碱性氧化物 金 属
碱
盐
酸性氧化物
非 金 属
酸
盐。
