第9章 氧化还原反应
物理化学——第9章-可逆电池复习题

ln K zFE /RT 9.1782 K 9.68 103
2 96485 (0.3402 0.2223) 8.314 298.15
计算题
3. 25℃时,电池 Pt|H2(p )|HCl(0.1molkg-1)|AgCl,Ag 的电动势为0.3522V, (1)求反应H2(g)+2AgCl(s)=2Ag+2H++2Cl- ,在25℃的 标准平衡常数。(已知0.1molkg-1 HCl的 =0.798); (2)求金属银在1molkg-1 HCl溶液中产生H2的平衡压 力。(已知25℃时1molkg-1 HCl的 =0.809)。
概念简答
4、为什么燃料电池的效率比热机高? 答: 比较极限值:可逆热机和可逆电池。
Tc 根据热力学第二定律,可逆热机的效率为 1 Th
所以热机效率不可能达到100%。然而可逆电池的 能量转化是可逆的,化学能全部转化为电能,效 率为100%。
选择题
1.25℃时电池反应 H2(g) + ½O2(g) = H2O(l) 对应 的电池标准电动势为 E1ϴ,则反应2H2O(l) = 2H2(g) + O2(g) 所对应的电池的标准电动势 E2 ϴ是: (C) (A) E2 ϴ = - 2 E1 ϴ ; (B) E2 ϴ = 2E1 ϴ ; (C) E2 ϴ = - E1 ϴ ; (D) E2 ϴ = E1 ϴ 。 2. 某电池在标准状况下,放电过程中, (B) 当Qr = -200 J 时,其焓变ΔH为: (A) ΔH = -200 J ; (B) ΔH < -200 J ; (C) ΔH = 0 ; (D) ΔH > -200 J 。
(2) 计算该原电池在25℃时的电动势E;
第九章 氧化还原反应 答案2022

第九章氧化还原反应9.1(1) Cr2O72-+14H+ +6e-= 2Cr3++ 7H2O (酸性介质);(2) MnO4-+8H++5e-= Mn2++4H2O6H+ + 5e-(3) MnO4-+4H++3e-= MnO2+2H2O(中性介质);(4) 1/2I2 + 6 OH-= IO3-+3H2O+ 5e-(碱性介质);(5) H2C2O4 = 2CO2 + 2H+ + 2e-(酸性介质);(6) H2O2 = O2 + 2H+ + 2e-(酸性介质);(7) H2O2 +2OH-= O2 + 2H2O + 2e-(碱性介质);(8) H2O2 +2H+ + 2e- = 2H2O(酸性介质);(9) H2O2 +2e- = 2OH-(碱性介质);(10) Ag + Cl- = Ag Cl + e-9.2(1) 3As2O3 +4NO3-+7H2O + 4H+ = 6H3AsO4 +4NO(酸性介质);(2) Cr2O72-+3H2S + 8H+ = 2Cr3++ 3S + 3H2O (酸性介质);(3) 2MnO4-+5H2C2O4 + 6H+ = 2Mn2++10CO2 +8H2O (酸性介质);(4) 2Cr3++3S2O82-+7H2O = Cr2O72-+6SO42-+ 14H+ (酸性介质);(5) 2Mn2++5NaBiO3 + 14H+ = 2MnO4-+5Bi3++5Na+ + 7H2O (酸性介质);(6) 4Co(NH3)62++O2 +2H2O =4Co(NH3)63++4OH-;(7) 2Cr(OH)4-+3HO2-=2CrO42-+OH-+ 5H2O;(8) H3AsO4 +2I-=HAsO2 +I2 + 2H2O (酸性介质);(9) 2Cu2++2I-=2CuI +I2;(10) Hg2Cl2 +NH3 = HgNH2Cl +Hg+ HCl;(11) 3MnO42-+ 4H+ = 2MnO4-+MnO2 +2H2O 。
第9章---第1节

课 时 · 知 能 · 训 练
高考新课标大一轮总复习 · 配人教版 · 化学 2.(2010·宁德模拟 关于如图所示的原电池,下列说法正确的 . 宁德模拟)关于如图所示的原电池 宁德模拟 关于如图所示的原电池, ) 是(
基 础 · 回 扣 · 检 验
随 堂 · 分 类 · 练 习
考 点 · 突 破 · 方 法
课 时 · 知 能 · 训 练
菜
单
高考新课标大一轮总复习 · 配人教版 · 化学
基 础 · 回 扣 · 检 验
二、常见的化学电源 1.一次电池(以碱性锌锰电池为例 .一次电池 以碱性锌锰电池为例 以碱性锌锰电池为例) 总反应为: + 总反应为:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2 = + 负极: 负极: Zn+2OH--2e-===Zn(OH)2 。 +
随 堂 · 分 类 · 练 习
考 点 · 突 破 · 方 法
中两电极相同; 【解析】 依据构成原电池的三个条件分析:A中两电极相同;C 解析】 依据构成原电池的三个条件分析: 中两电极相同 中没有构成闭合回路; 中酒精是非电解质 只有B符合条件 中酒精是非电解质; 符合条件。 中没有构成闭合回路;D中酒精是非电解质;只有 符合条件。 答案】 【答案】 B
【解析】 解析】 A 项中电池放电时正极应发生还原反应,电极反应为:
考 点 · 突 破 · 方 法
PbO2+4H++SO2-+2e-===PbSO4+2H2O;C 项中电池充电时硫酸的 4 浓度应不断增大,D 项充电时阳极应发生氧化反应:PbSO4 -2e - + 2H2O===PbO2+SO2-+4H+。 4
考 点 · 突 破 · 方 法 随 堂 · 分 类 · 练 习
第9-1章+土壤酸碱性和氧化还原反应
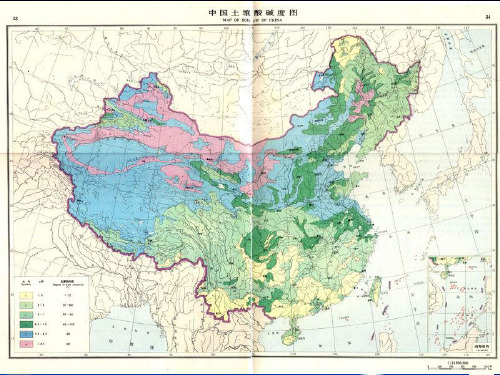
土壤学
Chapter 9. 土壤酸碱性和氧化还原反应 Soil acid-base and redox reaction §9.1 土壤酸度 §9.2 土壤碱度 §9.3 土壤氧化还原反应 §9.4 土壤缓冲性 §9.5 土壤酸碱性和氧化还原状况与生物环境
吉林大学植物科学学院农业资源与环境系
吉林大学植物科学学院农业资源与环境系
土壤学
交换酸度exchange acidity 用中性盐溶液(1mol/L
KCl、0.06mol/L BaCl2等)处理酸性土壤时, 土壤胶体 上交换性的阳离子大部分被浸提剂中的阳离子交换 下来进入溶液。此时,交换性氢离子可使溶液酸性 增加,而交换性Al3+因水解, 也使溶液酸性增加。
性酸。
xH+
colloid
colloid
(x-y)H+来自+ yH+
潜在酸的产生
2. 土壤胶体上吸附性氢离子被其他离子所代换 当施用硫铵、石灰或其他肥料时,土壤溶液盐基 离子浓度增加,吸附性H+离子部分被交换出 来进入溶液,土壤酸度随之变化。
colloid
xH + Ca2+
colloid
Ca (x-2)H
Acid drops movement
Acid lake
2. 土壤中铝的活化
氢离子进入土壤吸收复合体后,随着阳离子交换作用的进行, 土壤盐基饱和度下降,氢饱和度提高,胶粒晶体结构破坏, 铝八面体解体,铝离子成为活性铝离子,吸附后成交换性 Al3+离子,交换进入土壤溶液,溶液中的铝离子和阴离子形 成的盐类多为非中性盐,解离产生H+离子。
土壤酸碱反应是土壤重要的化学性质,直 接影响作物的生长和微生物的活动以及土 壤的其他性质。
09 第九章 氧化还原反应

化学与材料科学学院
殷焕顺
2.离子--电子法(ion-electron method)
配平原则:整个反应中氧化剂和还原剂得失电子 数相等;反应前后各元素的原子总数相等。
例如:酸性条件下 K2Cr2O7 与KI反应 (1) 写出基本离子反应 (氧化还原产物) Cr2O72- + I- → Cr3+ + I2 (2) 把离子方程式分成氧化和还原两个半反应 氧化半反应:2I- →I2 还原半反应:Cr2O72- → 2Cr3+
化学与材料科学学院
殷焕顺
练习:写出电池符号。 Cu(s)+Cl2(105Pa) = Cu2+(1mol· -1)+Cl-(1mol· -1) L L (-) Cu | Cu2+(1mol/L) || Cl-(1mol/L) | Cl2(105Pa) | Pt (+) 写出原电池的电极反应和电池反应 (-) Pt| H2 (105Pa)| H+(1.0M)||Ag+(1.0 M)|Ag(+) 正极: Ag++e ⇌ Ag(还原反应) 负极: H2 ⇌ 2H+ +2e (氧化反应) 电池反应: 2Ag++H2 ⇌ 2H++2Ag
化学与材料科学学院
殷焕顺
三、氧化还原反应式的配平 (balancing of oxidation-reduction equation ) 两种方法:
氧化数法
(the oxidation number method)
离子——电子法
(ion-electron method)
化学与材料科学学院
殷焕顺
化学与材料科学学院
殷焕顺
从电势看金属活性顺序
电对
K+/ K Ca 2+/Ca Na+/Na Mg2+/Mg Al3+/Al Zn2+/Zn Fe2+/Fe Sn2+/Sn
第九章氧化还原反应

Tollens试剂氧化
Tollens试剂氧化醛生成酸和银镜。
托伦斯试剂(Tollens) :硝酸银的氨溶液
CH=CHCHO
托伦试剂
CH=CHCOOH
CH2CHO Ag(NH3)2OH
CH2COOH
次氯(溴)酸氧化甲基酮—卤仿反应
甲基酮用次氯(溴)酸氧化得到少一个碳的羧酸。
O R C CH3 + NaOH + X2 (H) (NaOX) O R C CX3 (H) OH CHX3 + RCOONa 卤仿
Birch还原——钠把电子转移给芳香环 溶剂化电子
自由基负离子
环己二烯自由基 环己二烯负离子
1.4-环己二烯
4.形成脂的中间体历程
很少有机物的氧化作用生产了酯的中间体,再由酯中间体进一步裂解生成 氧化产物。这种酯中间体一般为无机酸酯。
例:伯醇被铬酸氧化成铜
5.加成—消除反应历程
氧化剂与底物加成,氧化剂的一部分发生离去。 二氧化硒氧化酮
氧化范围:烃(烯烃、炔烃、芳烃侧链)、醇。
例 1:
℃ 油酸(9-十八碳烯酸)
( KMnO4、H2O,碱性,低温得邻二醇) 加入冠醚(相转移催化剂)氧化活性增强,断碳链得羧酸。
例 2:
℃
例3:
仲醇得混合物
b. MnO2
MnO2/60% H2SO4:温和氧化剂
活性MnO2:温和高选择性氧化剂 例:
℃
℃
(二)有机氧化剂:
1、有机过氧酸:C6H5COOOH,CH3COOOH,CF3COOOH等。 2、CrO3—吡啶络合物。
3、Pb(OCOCH3)4,CH3SOCH3
1、有机过氧酸:
1)
3)
第九章 氧化-还原反应

2020/11/22
第28张共79张
例5:根据电池符号写出电池反应式
(-) Pt | H2(1kPa) | H+(0.1mol·dm-3)|| Fe3+(0.1mol·dm-3), Fe2+(1mol·dm-3) Pt(+)
解:
2 Fe3+ (1mol.dm-3) + H2(1kPa)
2Fe2+(1mol·dm-3) + 2H+(0.1mol·dm-3)
2020/11/22
第32张共79张
请分析以下两个电极的金属板上 带什么电荷?
2020/11/22
第33张共79张
三、标准(参比)电极电势( θ)
• 热力学标准态是如何规定的?
–所有离子、分子a=1 ( c1mol/L) –所有气体为pө ( =100 kPa) –纯液体、纯固体组分。
2020/11/22
2020/11/22
第29张共79张
• 为什么两个合适电极相连,回路上有 电流产生?
二、电极电势(electrode potential)
1. 电极电势的产生:
Zn
Nernst双电层理论
溶解(氧化)
M
Mn+ + ne
沉积(还原)
2020/11/22
第30张共79张
ZnSO4溶液
活泼金属
绝对电极电势
第34张共79张
1.标准氢电极
2H+ + 2e
H2
规定:在任何温度下
θ(H+/H2)= 0.0000V
2020/11/22
第35张共79张
2020/11/22
第九章 氧化还原滴定法

第九章 氧化还原滴定法一 、内容提要本章讨论了氧化还原电对的电极电位计算,判断氧化还原反应次序的基本规则和氧化还原反应进行的程度,以及氧化还原滴定曲线和常用的指示剂,并重点阐述了碘量法和高锰酸钾法。
氧化还原滴定法是以氧化还原反应为基础,以氧化剂或还原剂作为标准溶液得滴定分析方法。
当两个氧化还原电对的电极电位不相等时,一般来说,电位高的电对的氧化型可能氧化电位低的电对的还原型。
电对的电极电位可用Nernst 方程式计算:式中的E ox/Red 为电对Ox/Red 的电极电位,E 0ox/Red 为Ox/Red 的标准电极电位;n 为电对氧化还原半反应(半电池反应)中转移的电子数;a ox ,a Red 为电对Ox/Red 氧化型和还原型的活度。
当考虑离子强度和副反应对电对的影响,以浓度C 代替活度进行电极电位的计算时,应采用下式:式中'0Re ,dOx E 为电对Ox/Red 的条件电极电位,亦称克式量电极电位或式量电极电位。
当无电对的'0Re ,dOx E 时,可用下式对电对的电极电位进行计算:(近似式) 式中[Ox],[Red] 为电对Ox/Red 氧化型和还原型的平衡浓度。
判断氧化还原反应次序的基本规则是:电极电位相差最大的两电对的氧化型、还原型首先进行反应。
氧化还原反应进行的程度,可通过下式进行定性的判断:(25℃) Oxdd Ox d Ox a a nF RT E E Re 0Re ,Re ,log 303.2-=Oxdd Ox d Ox C C nF RT E E Re '0Re ,Re ,log 303.2-=][][Re lg 05915.00)Re ,()Re ,(Ox d n E E d Ox f d Ox f -=059.0log '0E m n K ∆⨯=式中的n ,m 为氧化还原半反应中转移的电子数;'0E 为两电位的条件电极电位之差;K 为氧化还原反应的平衡常数。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
对分压。 p / p
(3) 氧化型、还原型的物质系数,做为浓度的方
次写在Nernst方程的指数项中
MnO4 + 8H+ + 5e = Mn2+ + 4H2O
E M n O 4 - /M n 2 + = E
M n O 4 /M n
-
2+
+
0 . 0592 5
Eø= 0.34V
E
Cu
2
/ Cu
0 . 34 V
III.以甘汞电极作为标准电极测定电极电势
甘汞电极,电池介质为KCl
Hg2Cl2 + 2e = 2Hg + 2Cl–
EHg2Cl2/Hg = 0.2415 V (KCl 为饱和)
n+/M
E = EM
n+/M
- EHg2Cl2/Hg , EM
生成沉淀后电极电位发生了变化,Ksp越小,电极电位越小
E E
0.059 n
lg
[ 氧化型 ] [ 还原型 ]
x y
I. 沉淀剂使还原型浓度降低时, E ø将更正,氧化型氧化能力增强,还原型还原能力减弱
E Cu 2 /Cu E Cu 2 /CuI E Cu 2 /Cu(CN)
例题:试以中和反应H+ (aq) + OH–(aq) = H2O(l) 为电池反应,设计成一种原电池反应(用电池符号 表示),分别写出电极半反应,并求出它在25℃时 的标准电动势。
电池符号: (-) (Pt),H2(p)OH –(aq)H+ (aq) H2 (p), Pt(+)
负极反应: H2 + OH – –2e = 2H2O 正极反应: 2H+ + 2e = 2 H2 要求:2. 题中给出总反应方程式,要能够写出 电池符号和半反应
1、原电池的概念
原电池与电极电位
Zn + Cu2+ = Cu + Zn2+ 电极正极发生还原反应,负极发生氧化反应 负极: Zn - 2e = Zn2+ (氧化值升高) 正极: Cu2+ + 2e = Cu (氧化值降低)
2、原电池的表达式 1、负极写在左边,正极写在右边 2、用∣表示电极与离子溶液之间的物相界面 3、不存在相界面,用,分开。加上不与金属 离子反应的金属惰性电极。 4、 用表示盐桥 5、 表示出相应的离子浓度或气体压力。
例题:已知电池符号如下: 电池符号:(-) (Pt),H2(p)H+(1 mol· -3) dm Cl– (c mol· -3) Cl2(p) , Pt(+) dm 写出该电池的半反应方程式和总反应方程式
氧化半反应: H2 - 2e = 2H+ 还原半反应: Cl2 + 2 e = 2Cl– 总反应: H2 + Cl2 = 2H+ + 2Cl–
D
§9-4 影响电极电位的因素
--奈斯特(Nernst)方程
1。电极电位的影响因素:
I. 浓度对电极电势的影响 II. pH对电极电势的影响 2。奈斯特(Nernst)方程 应用:求非标准状况 下的电极电势
298K时,
应用Nernst方程的注意事项
(1)E的大小决定于[氧化型]/[还原型]浓度的比
1-2 氧化还原反应:
某些元素氧化值发生改变的反应。
例:Cu2+ + Zn = Cu + Zn2+
氧化剂
被还原
还原剂
被氧化
氧化过程: 氧化值升高的过程, 还原剂 还原过程: 氧化值降低的过程, 氧化剂
1.3 .氧化还原反应方程式的配平 1) 氧化值法: 原则:还原剂氧化值升高值和氧化剂氧化值降 低数相等(得失电子数目相等) I. 写出化学反应方程式 II. 确定有关元素氧化值升高及降低的数值 III. 确定氧化值升高及降低的数值的最小公倍 数。找出氧化剂、还原剂的系数。 IV. 核对,可用H+, OH–, H2O配平。
3、电对的表示方法: 氧化态/还原态 电对的电极电位: E, (标态下: Eø)
1.电极反应的电势(表示失去电子或得到电子的能力) M = Mn+ + n e 影响金属进入溶液的因素:
金属的活泼性;溶液的浓度, 体系的温度 电动势: 电压差. 等于+ -极电极电位之差.
2.电极反应的标准电势
I。标准氢电极:规定: E ø H+/H2 = 0
EO
2 /OH
0.059 4
lg
pO2 [OH
]
4
0.40
0.059 4
lg
100/100 (10
1
)
4
0.40 0.05
9 0.459V
II. 利用Nernst方程计算不同压力下的电对电极电位
例2 :已知 E Cl2/Cl- =1.36V,求298K下, c(Cl–)=0.01mol· 3, pCl2 = 500kPa时电极的电极电位。 dm 解:Cl2 (g) +2e = 2Cl
例 9-3 配平酸性介质下KMnO4溶液与Na2SO3 解:MnO4– + SO32– + H+ Mn2+ + SO42– 半反应 SO32– SO42– + 2e MnO4– + 5e Mn 2+ 配平半反应: SO32 – + H2O SO42 – + 2e + 2H+ ① MnO4 – + 5e + 8H+ Mn 2+ + 4 H2O ② ① ×5 + ②×2 2MnO4 – + 5SO32 – + 16 H+ + 5 H2O 2Mn2+ + 8 H2O + 5SO42 – + 10H+ 即: 2MnO4 – + 5SO32 – + 6 H+ = 2Mn2+ + 3 H2O + 5SO42 –
氧化半反应: Zn - 2e = Zn2+ 还原半反应: Cu2+ + 2e = Cu (-)ZnZn2+(c1/ mol· -3) dm Cu2+(c2/mol· -3) Cu(+) dm
(-) (Pt),H2(p)H+(1mol· -3) dm Fe3+(1mol· -3) ,Fe2+ (1 mol· -3) Pt(+) dm dm 氧化半反应: H2 - 2e = 2H+ 还原半反应: Fe3+ + e = Fe2+ 总反应: H2 + 2 Fe3+ = 2H+ + 2 Fe2+ 要求:1. 题中给出电池符号,要能够写出半 反应和总反应方程式
= E + EHg2Cl2/Hg
电池符号: (-) Hg,Hg2Cl2(s)︱KCl(1 mol· -3) dm Mn+ (1 mol· -3 ) M (+) dm
5.标准电极电位表:记牢常用的氧化剂,还原 剂及其对应的反应产物.
标准电极电位:在电极反应条件下,对某物质得失电子 能力的量度
E Cl
2 /Cl
E Cl
2 /Cl
0.059 2
lg
p Cl
2
[Cl ]
2
2
1 . 36
0 . 059 2
lg
( 500 / 100 ) ( 0 . 01 )
1.36 0.137 1.50V
IV. 利用Nernst方程计算衍生电对电极电位
例4 :求AgI(s) + e = Ag(s) + I电极反应的 E øAgI/Ag.。 解:衍生电位 E øAgI/Ag是EøAg+/Ag衍生的 AgI = Ag+ + I 当[I] = 1mol· 3时的电位 dm 此时:[Ag+] = Ksp/ [I] EøAgI/Ag = E øAg+/Ag + 0.059lg[Ag+] = 0.799 + 0.059lgKsp = 0.799 + 0.059lg(8.5×1017) = 0.15V 可置换H+生成H2
半反应:一般先配平 H、O以外的原子数, 然后配平H、O原子数,最后配平电子数
左边
酸性介 多O缺H时,多一个O加2个H+, 缺1个 质 H加1个H+
右边
加相应的H2O
碱性介 多H缺O时,多一个H加1个OH – ,缺1 加相应的H2O 质 个O加2个OH-
※酸性介质中配平的半反应方程式里不应出现 OH –,在碱性介质中配平的半反应不应出现H+
§ 9-2 电解 质溶液的导电机理
法拉第定律
当电流通过电解质溶液 时,电极上发生变化的物质的 物质的量与通过的电量成正比,与该物质反应时的电 子数变化成反比。
nB = Q/(nF)
nB 为物质的量,单位mol; Q为电量,单位库仑C n为电子数,F为法拉第常数,F=96485。
§ 9-3
电对的电极电位数值越正,该电对中氧化型 的 氧化能力(得电子倾向)越大, 电对的电极电位数值越负,还原型还原能力越强 E Zn /Zn = -0.76 V, E Cu /Cu = 0.34 V
2+ 2+
要求:根据电对的电极电位,判断金属或离子相对氧 化(还原)能力的强弱
