2012.5北京市顺义区高三二模理综化学试题
2012北京三区五月理综化学卷

n (H 2)/mol t /min(8,2) (11,2) (1,6)a b c2 4 6 810 24 68ⅠⅡK A B 食盐水XFe北京市东城区2011—2012学年度第二学期高三综合练习(二)理科综合能力测试6.下列说法正确的是A .碘、铁都是人体必需的微量元素B .淀粉和纤维素互为同分异构体,均可水解得到葡萄糖C .碳酸钡、碳酸氢钠、氢氧化镁等均可作为抗酸药物使用D .聚氯乙烯塑料制品可用于食品包装 7.下列说法不正确...的是 A .46 g C 2H 6O 中共用电子对数为8×6.02×1023B .20 g 重水(D 2O )中含有的电子数为10×6.02×1023C .100 mL 2.0 mol·L -1 NH 4HCO 3溶液中NH 4+ 数为0.2×6.02×1023D .标准状况下,22.4 L NO 与CO 的混合气体中含有的原子数为2×6.02×10238.下列事实可以用同一原理解释的是 A .漂白粉和明矾都常用于自来水的处理 B .乙烯可使溴水或酸性高锰酸钾溶液褪色 C .铁片和铝片置于冷的浓硫酸中均无明显现象 D .苯酚和氢氧化钠溶液在空气中久置均会变质9.模拟铁的电化学防护的实验装置如右图所示,下列说法不正确...的是 A .若X 为碳棒,开关K 置于A 处可减缓铁的腐蚀B .若X 为锌棒,开关K 置于A 或B 处均可减缓铁的腐蚀C .若X 为锌棒,开关K 置于B 处时,铁电极上发生的反应为 2H ++2e —=H 2↑D .若X 为碳棒,开关K 置于A 处时,铁电极上发生的反应为 2H ++2e —=H 2↑10.氢化热是指一定条件下,1 mol 不饱和化合物加氢时放出的热量。
表中是环己烯、环己二烯 A .环己二烯与H 2的反应最剧烈 B .环己烯、环己二烯和苯有相同的官能团 C D .上述条件下,1 mol 转变为 时放热113 kJ11.T ℃时,将6 mol CO 2和8 mol H 2充入2 L 密闭容器中,发生反应CO 2(g )+3H 2(g ) CH 3OH (g )+H 2O (g ),容器中H 2的物质的量随时间变化如图中实线所示。
2012北京高考理综化学部分

6.下列用品的有效成分及用途对应错误的是7.下列结实实验现象的反映方程式正确的是A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1-C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2=2Na2CO3+O2D.向Na HCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O8.下列试验中,所选装置不合理的是A.分离Na2CO3溶液和CH3COOC2H5,选④B.用CC14提取碘水中的碘,选③C,用FeC12,溶液吸收C12选⑤D.粗盐提纯,选①和②9.已知33As、35Br位于同一周期,下列关系正确的是A.原子半径:As>C1>P B.热稳定性:HC1>AsH3>HBrC.还原性:As3->S2->C1- D.酸性:H3AsO4>H2SO4>H3PO410.用右图所示装置进行下列实验,实验结果与预测的现象不一致的是11.下列说法正确的是A,天然植物油常温下一般呈液态,难溶于水.有恒定的熔点、沸点B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖、C.若两种二肤互为同分异构体,则二者的水解产物不一致D.乙醛、氮乙烯和乙二醉均可作为合成聚合物的单体12 人工光合作用能够借助太阳能,用co,和H夕制备化学原料.下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是A.该过程是将太阳能转化为化学能的过程B.催化剂a表面发生氧化反应,有O,产生C.催化剂a附近酸性减弱,催化剂b附近酸性增强D.催化剂b表面的反应是CO2 +2H++2e一=HCOOH27.(15分)有文献记载:在强碱条件下,加热银氨溶液可能析出银镜。
某同学进行如下验证和对比实验。
装置实验序号试管中的药品现象实验Ⅰ2mL银氨溶液和数滴较浓NaOH溶液有气泡产生:一段时间后,溶液逐渐变黑:试管壁附着银镜实验Ⅱ2mL银氮溶液和数滴浓氨水有气泡产生:一段时间后,溶液无明显变化。
顺义区2012届高三第二次统练理科综合试卷及答案

顺义区2012届高三第二次统练理科综合试卷本试卷分第一部分(选择题)和第二部分(非选择题)两部分,第一部分1至5页,第二部分6至13页,共300分。
考试时间150分钟。
第一部分(选择题共20题,每题6分,共120分)注意事项:每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号,不能答在试卷上。
可能用到的相对原子质量:H 1; C 12; N 14; O 16; Na 23; Fe 56下列各题的四个选项中,只有一个选项是最符合题目要求的。
1.将盛有等量小球藻的8支密闭试管,在暗室中放置一段时间后,用下表中强度相同的光分别照射每支试管1—2h,下列叙述不正确的是A.分别向2—8支试管加入酸碱指示剂,5号试管中溶液酸性最强B.照光前将小球藻在暗室放置一段时间目的是消耗掉已有的淀粉C.紫外光照射的1号试管中的小球藻最容易发生基因突变D.分别向8支试管滴加碘液,能检测小球藻是否进行光合作用2.分别用过量的胸苷、秋水仙素和低温处理大蒜根尖,一段时间后,观察分生区的细胞,结果见下表,下列结论不正确的是(“+”表示能观察到、“—”表示未观察到)A.加入过量的胸苷,细胞停留在分裂间期B. 秋水仙素处理后所有细胞的染色体加倍C.秋水仙素可抑制细胞纺锤体的形成D.低温处理和用秋水仙素处理结果一致3. 硅藻是单细胞的藻类,硅酸盐是硅藻生活必须的营养物质,将两种硅藻——星杆藻、针杆藻混合一起培养时,种群数量及硅酸盐含量的变化如下图表示,下列说法正确的是A.星杆藻和针杆藻之间是捕食的关系B.硅酸盐浓度高时针杆藻生存能力强C.针杆藻对硅酸盐的吸收能力弱于星杆藻D.通过抽样检测的方法可估算硅藻的数量4. 下列关于生物进化的叙述,正确的是A. 自然选择通过作用于个体影响种群的基因频率B.某物种基因频率的变化标志着一个新物种的产生C.能否交配是判定两种生物是否是同一物种的有效方法D.有利变异的保持和有害变异的淘汰是生物进化的实质5.下图是具有两种遗传病的家族系谱图,设甲病显性基因为A,隐性基因为a;乙病显性基因为B,隐性基因为b。
北京市顺义区高三理综第二次统练试题(顺义二模,化学部分)新人教版

顺义区2013届高三第二次统练化学测试可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Sn 1196.化学与生活密切相关。
下列说法不正确...的是 A .NH 3可用作制冷剂 B .硅胶可用作干燥剂 C .BaCO 3可用作钡餐透视D .Na 2S 可除去废水中Hg 2+、Pb 2+等重金属离子7. 下列说法正确的是 A .煤的气化过程是物理变化 B .棉花、合成橡胶都属于合成材料 C .蚕丝、羊毛完全燃烧只生成CO 2和H 2O D .甲苯、植物油均能使酸性KMnO,溶液褪色8. 已知X 、Y 、Z 、W 、R 是原子序数依次增大的短周期主族元素,X 元素的最高价与最低 价绝对值相等,Y 与W 的最外层电子数均是最内层电子数的3倍,Z 的核电荷数是X 的2 倍。
下列说法不正确...的是 A .原子半径:Z > R B .离子的还原性:R > W C .气态氢化物的热稳定性:Y > XD .Z 与Y 、Z 与R 形成的化学键类型完全相同 9. 下列解释事实的离子方程式正确的是A .向铜片中滴加浓硫酸并加热,有刺激性气体产生:Cu + 4H + + SO 42- Cu 2++ SO 2↑ + 2H 2OB. 向Ca(HCO 3)2溶液中加入过量NaOH 溶液,有白色沉淀生成:Ca 2++ HCO 3-+ OH - == CaCO 3↓+ H 2OC. 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H + + 4I -+ O 2 ==2 I 2 + 2H 2OD. 服用阿司匹林过量出现水杨酸( )反应,可静脉注滴NaHCO 3溶液:+ 2 HCO 3-→ + 2 CO 2↑ + 2 H 2O10. 用下图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是OH COOHO -COO -OHCOOH11. 一种碳纳米管能够吸附氢气,可做二次电池(如下图所示)的碳电极。
2012年高考全国2卷(理综)试题及答案

2012年普通高等学校招生全国统一考试理科综合能力测试一、选择题(本题共13 小题。
在每小题给出的四个选项中,只有一项是符合题目要求的。
)i.在人工饲养条件下,如果淡水鱼不排卵,可将同种性成熟鱼的垂体提取液注射到雌鱼体内,促进其排卵。
这一方法主要是利用了垂体细胞合成的 A 甲状腺激素 B 雌激素 C 促甲状腺激素D 促性腺激素ii.切除胸腺的幼年小鼠,其免疫功能表现为A 细胞免疫缺陷、体液免疫功能下降B 细胞免疫、体液免疫功能均正常C 细胞免疫缺陷、体液免疫功能正常D 细胞免疫正常、体液免疫功能下降iii.人体内的细胞外液构成了细胞生活的液体环境,在这个环境中可发生许多生物化学反应,其中有A 蛋白质消化分解成氨基酸B 神经递质和激素的合成C 丙酮酸氧化分解成二氧化碳和水D 乳酸与碳酸氢钠作用生成乳酸钠和碳酸iv.下列有关基因工程中限制性内切酶的描述,错误的是A 一种限制性内切酶只能识别一种特定的脱氧核苷酸序列B 限制性内切酶的活性受温度影响C 限制性内切酶能识别和切割RNAD 限制性内切酶可从原核生物中提取v.右图纵向表示海洋不同深度中鱼类的食物分布状况,曲线甲、乙、丙分别表示三种鱼的数量变化。
下列对此图的分析,错误的是A 海洋中的鱼类具有垂直分层现象B 此图表明鱼类对食物的竞争状况C 此图表明海洋中鱼类的捕食状况D 此图表明海洋中鱼类的共生关系vi.已知:C(s)+CO2(g)2CO(g)△H>0。
该反应的达到平衡后,下列条件有利于反应向正方向进行的是A 升高温度和减小压强B 降低温度和减小压强C 降低温度和增大压强D 升高温度和增大压强vii.0.1mol/L NaHCO3溶液的pH最接近于A.5.6 B.7.0 C.8.4 D.13.0viii.能正确表示下列反应的离子方程式是A 醋酸钠的水解反应CH3COO-+H3O+=CH3COOH+H2OB 碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-C 苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-D 稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2Oix.已知:①1 mol H2分子中化学键断裂时需要吸收436kJ的能量②1 mol Cl2分子中化学键断裂时需要吸收243kJ的能量③由H原子和Cl原子形成1 mol HCl分子时释放431kJ的能量下列叙述正确的是A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)B.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=183kJ/molC.氢气和氯气反应生成2 mol氯化氢气体,反应的△H=-183kJ/molD.氢气和氯气反应生成1 mol氯化氢气体,反应的△H=-183kJ/molx.在盛有稀H2SO4的烧杯中放入用导线连接锌片和铜片,下列叙述正确的是A 正极附近的SO42―离子浓度逐渐增大B 电子通过导线由铜片流向锌片C 正极有O 2逸出D 铜片上有H 2逸出 xi .下列氧化还原反应中,水作为氧化剂的是 A CO +H 2O CO 2+H 2 B 3NO 2+H 2O =2HNO 3+NO C 2Na 2O 2+2H 2O =4NaOH +O 2↑ D 2F 2+2H 2O =4HF +O 2xii .仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是 1 2 3 4 5 6 7 8 9 …… C 2H 2 C 2H 4 C 2H 6 C 3H 4 C 3H 6 C 3H 8 C 4H 6 C 4H 8 C 4H 10 ……A C 6H 12BC 6H 14 C C 7H 12D C 7H 14 xiii .在一定条件下,将钠与氧气反应的生成物1.5g 溶于水,所得溶液恰好能被80mL 浓度为0.50mol/L 的HCl 溶液中和,则该生成物的成分是A Na 2O B Na 2O 2 C Na 2O 和Na 2O 2 D Na 2O 2和NaO 2二、选择题(本题共8小题。
2012年高考理科综合模拟试卷(化学部分)
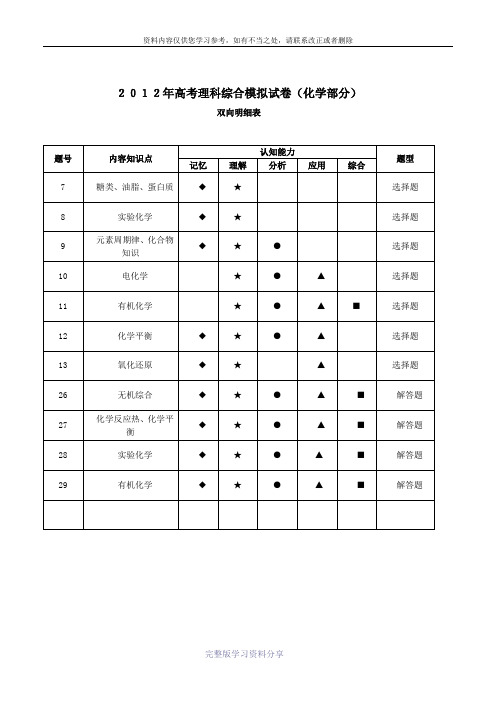
2012年高考理科综合模拟试卷(化学部分)双向明细表2012年高考理科综合模拟试卷(化学部分)理科综合考试时间150分钟满分300分化学部分100分第Ⅰ卷相对原子质量:H-1 C-12 O-16 N-14 S-32 Mg-24 Fe-23 Mn—55一、选择题(在每小题给出的四个选项中,只有一项是符合题目要求的)7、下列说法正确的是()A.真丝、人造丝灼烧时都有烧焦羽毛的气味。
B.淀粉、纤维素、油脂都是高分子化合物。
C.氨基酸分子中既有氨基,又有羧基,它是两性化合物。
D.许多蛋白质在水中有一定的溶解性,溶于水形成胶体。
加入浓的硫酸钠溶液,有沉淀析出,这种作用称为变性。
【原创】8、下列说法正确的是()A、制备硫酸亚铁铵的实验中最后制得的晶体过滤后用蒸馏水洗涤。
B、AgI 沉淀中滴入稀KCl溶液,有白色沉淀出现,说明AgCl比AgI更难溶。
C、倾析法是将不溶物充分沉淀后,先转移沉淀后转移液体。
D、配制好的氢氧化钠溶液用邻苯二甲酸氢钾滴定浓度时,采用酚酞为指示剂。
【原创】9、X、Y、Z、W为四种短周期元素。
X原子最外层电子数是核外电子层数的3倍;Y最高价与最低价的代数和为6;Z在地壳中的含量仅次于氧;Y、Z、W同周期,W的常见化合价为+2。
下列说法不正确...的是()A.存放W单质的仓库失火不能用CO2灭火B.Z的氧化物通常形成分子晶体C.Y的单质能把溴从溴化物中置换出来D.X的氢化物可以是两种液体【改编自安师大附中2011年高三第五次模拟理综第10题】10、O3 可由臭氧发生器(原理如题图)电解稀硫酸制得。
下列说法不正确的是()A、图中阴极为B,电极反应2H+ +2e-=H2↑。
B、若C处通入O2,则A极的电极反应式为O2+4H++4e-=2H2O。
C、若C处不通入O2,D、E分别产生的气体是氢气和氧气、臭氧的混合气体。
D、若C处不通入O2,则E处收集的气体中O2所占的体积分数为(x-2y)/y (忽略O3的分解)。
2012年高考全国2卷化学部分试题及答案解析

20XX年高考全国2卷理综考试化学部分一、选择题(6′×7=42′)7.下列叙述中正确的是A.液溴易挥发,在存放液溴的试剂瓶中应加水封B.能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2C.某溶液加入CCl4,CCl4层显紫色,证明原溶液中存在IˉD.某溶液加入BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液一定含有Ag+ 8.下列说法中正确的是A.医用酒精的浓度通常是95℃B.单质硅是将太阳能转化为电能的常有材料C.淀粉、纤维素和油脂都属于天然高分子化合物D.合成纤维和光导纤维都是新型无机非金属材料9.用N A表示阿伏伽德罗常数的值。
下列叙述中不正确的是A.分子总数为N A的NO2和CO2混合气体中含有的氧原子数为2N AB.28g乙烯和环丁烷(C4H8)的混合气体中含有碳原子数为2N AC.常温常压下,92g的NO2和N2O4混合气体含有的原子数为6N AD.常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2N A10.分子式为C5H12O且可与金属钠反应放出氢气的有机化合物由(不考虑立体异构)A.5种B.6种C.7种D.8种11.已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol·Lˉ1的一元酸HA与b mol·Lˉ1的一元碱BOH等体积混合,可判定该溶液呈中性的依据是A.a = b B.混合气体的pH = 7C.混合溶液中,c(H+)=√Kw mol·Lˉ1D.混合溶液中,c(H+)+c(B+)=c(OHˉ)+c(Aˉ)716714281881813.短周期元素W、X、Y、Z的原子序数依次增大,其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。
X的一种核素在考古时常用来鉴定一些文物的年代,工业上采用液态空气分馏方法来生产Y的单质,而Z 不能形成双原子分子。
根据以上叙述,下列说法中正确的是A.上述四种元素的原子半径大小为W<X<Y<ZB.W、X、Y、Z原子的核外最外层电子数的总和为20C.W与Y可形成既含极性共价键又含非极性共价键的化合物D.由W与X组成的化合物的沸点总低于由W与Y组成的化合物的沸点二、非选择题26(14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
北京市顺义区高三二模理综化学试题(含答案)

北京市顺义区2013届高三二模化学试题可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Sn 1196.化学与生活密切相关。
下列说法不正确...的是 A .NH 3可用作制冷剂 B .硅胶可用作干燥剂 C .BaCO 3可用作钡餐透视D .Na 2S 可除去废水中Hg 2+、Pb 2+等重金属离子 7. 下列说法正确的是A .煤的气化过程是物理变化B .棉花、合成橡胶都属于合成材料C .蚕丝、羊毛完全燃烧只生成CO 2和H 2OD .甲苯、植物油均能使酸性KMnO,溶液褪色8. 已知X 、Y 、Z 、W 、R 是原子序数依次增大的短周期主族元素,X 元素的最高价与最低 价绝对值相等,Y 与W 的最外层电子数均是最内层电子数的3倍,Z 的核电荷数是X 的2 倍。
下列说法不正确...的是 A .原子半径:Z > R B .离子的还原性:R > W C .气态氢化物的热稳定性:Y > XD .Z 与Y 、Z 与R 形成的化学键类型完全相同 9. 下列解释事实的离子方程式正确的是A .向铜片中滴加浓硫酸并加热,有刺激性气体产生:Cu + 4H + + SO 42- Cu 2+ + SO 2↑ + 2H 2OB. 向Ca(HCO 3)2溶液中加入过量NaOH 溶液,有白色沉淀生成:Ca 2+ + HCO 3- + OH -== CaCO 3↓+ H 2OC. 向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后变蓝:4H + + 4I - + O 2 ==2 I 2 + 2H 2OD. 服用阿司匹林过量出现水杨酸( )反应,可静脉注滴NaHCO 3溶液:+ 2 HCO 3-→ + 2 CO 2↑ + 2 H 2OOHCOOH O -COO -OHCOOH10. 用下图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是11. 一种碳纳米管能够吸附氢气,可做二次电池(如下图所示)的碳电极。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
北京市顺义区2012届高三理综二模(化学部分)2012.4相对原子质量:H 1 C 12 O 16 S 32 Cl 35.5 Ca 40 Ba 1376.化学与生产、生活、社会密切相关。
下列说法中不正确...的是A.合金材料中可能含有非金属元素B.铁在潮湿的空气中放置,易发生化学腐蚀而生锈C.废弃的玻璃、金属、纸制品是可回收利用的资源D.用CO2合成聚碳酸酯可降解塑料,实现“碳”的循环利用7. 下列关于有机物的叙述正确的是A.汽油、柴油和植物油都是碳氢化合物B.棉花和合成纤维的主要成分均为纤维素C.乙烯和苯蒸气都能使溴水褪色,不能鉴别乙烯和苯蒸气D.光照下,2,2-二甲基丙烷与Br2反应,其一溴取代物只有一种8.下列说法不正确...的是A.图Ⅰ所示装置可制备氢氧化亚铁B.图Ⅱ所示装置可电解制氯气和氢气C.图Ⅲ所示装置可验证氨气在水中的溶解性D.图Ⅳ所示装置和操作可从苯酚中分离出苯图Ⅰ图Ⅱ图Ⅲ图Ⅳ9.常温下,对于① 0.1 mol/L CH3COOH溶液② pH = 1 HCl溶液③ pH =13的NaOH溶液④ 0.1 mol/L CH3COONa溶液,下列说法正确的是A.①和②分别稀释100倍后的pH:②>①B.水电离出的c(OH-):④>③>①>②C.①和③混合后溶液呈中性:c(Na+) /c(CH3COO-) <1D.①和④混合后溶液呈酸性:c(Na+) / c(CH3COO-)>110.下述实验能达到预期目的的是编号实验内容实验目的A 将SO2通入KMnO4(H+)溶液中验证SO2具有漂白性B 将乙醇与浓硫酸共热制得的气体,直接通入溴水中检验产物是乙烯气体C在粗盐水溶液中依次加入过量BaCl2溶液、Na2CO3溶液,过滤后再加适量盐酸除去粗盐中的SO42—、Ca2+D 在淀粉水解后的溶液中,直接加入新制的Cu(OH)2悬浊液,加热至沸腾检验淀粉水解生成葡萄糖11. 肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。
已知:N2(g) + 2O2(g) =2 NO2(g) ΔH = +67.7kJ/mol2N2H4(g) + 2NO2(g) =3N2(g)+ 4H2O (g) ΔH = -1 135.7kJ/mol下列说法正确的是A. N2H4(g) + O2(g) =N2(g) + 2H2O(g)ΔH = -1 068 kJ/molB. 肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O N2H5+ + OH-C. 铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e-+ 4OH-=N2 + 4H2OD. 铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大12.某混合物水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、CO32-、SO42-,现每次取100 mL溶液分别进行下列实验:实验编号实验步骤实验现象①加入AgNO3溶液有沉淀产生②加入足量NaOH溶液后加热收集气体0.896L(标准状况)③加入足量的BaCl2溶液得到沉淀6.27g,沉淀经足量盐酸洗涤、干燥后,剩余2.33 g 下列说法正确的是A.c(K+)≥ 0.2 mol/LB.一定不存在的离子:Ca2+、K+、Cl-C.c(K+) + c(NH4+) = c(CO32-) + c(SO42-)D.一定存在的离子:Cl-、NH4+、CO32-、SO42-25. (14分)部分中学化学常见元素原子结构、性质及用途如下表:序号元素结构及性质① A A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子② B B原子最外层电子数是内层电子总数的1/5③ C C的氧化物是两性氧化物,且作为耐火材料④ D A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分⑤ E 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物⑥ F F元素最高正价与最低负价的代数和为4请用化学用语....回答下列问题:(1)按A、B、C顺序,三种元素的金属性逐渐;用原子结构解释其原因。
(2)一定条件下,将4.0 mol FE2和3.0 mol E2 通入到体积为 2 L的密闭容器中。
反应达到平衡时,容器中为FE20.4 mol ,则此反应的平衡常数是。
改变下列条件,能使平衡向正反应方向进行且平衡常数不变的是(填字母)。
a.增大压强b. 降低温度c.使用催化剂d. 增大反应物的浓度(3)E 与氢元素可以形成原子个数比分别为1:2、1:1的两种化合物X 和Y 。
实验编号 温度/℃ 加入试剂加入Y 的量 ① 5 2滴 1 mol/L FeCl 3溶液 4 mL 10% 的Y 溶液 ② 40 2滴1 mol/L FeCl 3溶液 4 mL 10% 的Y 溶液③402滴1 mol/L FeCl 3溶液2 mL X欲探究温度对Y 分解速率的影响,应选择 组实验;欲探究Y 的浓度对分解速率的影响,请填写相关数据。
(4)一定量的石灰乳中通入一定量的D 单质,两者恰好完全反应,生成物中有三种含D 元素的离子,其中两种离子的物质的量(n )与反应时间(t )的曲线如图所示。
则t 2时刻消耗氢氧化钙质量为 g ,此时反应的方程式为 。
26.(14分)硫酸铝铵常用于水的净化以及工业水的处理。
硫酸铝铵是白色透明结晶硬块,易溶于热水,水溶液呈酸性;随温度升高、脱去结晶水,产生晶变。
工业用铝土矿(主要成分Al 2O 3、少量SiO 2、Fe 2O 3、MgO 等)为原料制取硫酸铝铵的工艺流程示意图如下:部分氢氧化物沉淀的pH 如下表: 沉淀物 Al(OH)3 Fe (OH)3 Mg (OH)2 开始沉淀pH 3.8 2.7 9.4 完全沉淀pH 5.23.212.4请回答下列问题:(1)步骤③中调节pH使Fe (OH)3沉淀完全,检验Fe3+是否沉淀完全的操作是。
(2)若X为NaOH ,步骤④中发生反应的离子方程式是。
(3)用化学平衡移动原理解释步骤⑤中加入硫酸的作用。
(4)硫酸铝铵水溶液呈酸性的原因是(用离子方程式表示)。
浓度均为0.1 mol/L 硫酸铝和硫酸铝铵两种水溶液,c(Al3+) 较大的是(填“硫酸铝铵”或“硫酸铝”)溶液。
(5)步骤⑥中,要求温度控制在90—100℃之间至硫酸铵全部溶解,其原因是。
(6)步骤⑦的操作方法包括。
27.(14分)某课外小组欲探究在适当温度和催化剂的条件下,SO2与O2反应后混合气体的成分。
已知:①沸点:SO2 -10℃,SO3 45℃;② SO3遇水剧烈反应,放出大量热,产生酸雾。
③ 98.3% H2SO4可以吸收SO3和酸雾。
提供的药品:Na2SO3固体、10 mol/L H2SO4、催化剂(V2O5)、KMnO4固体、蒸馏水、0.5mol/L BaCl2溶液、98.3% H2SO4、2.0 mol/L NaOH溶液、品红溶液等。
(1)该小组同学用Na2SO3固体与10 mol/L H2SO4混合制取SO2。
发生装置应该选用下图中装置(填字母)。
(2)若选用上图中b装置制O2,反应的方程式是。
(3)该小组同学为检验反应后混合气体的成分,设计如下装置:① b中发生反应的化学方程式是。
② c中盛放的试剂是;e中盛放的试剂是,其作用是。
③某同学提出用饱和的NaHSO3溶液代替98.3%的浓H2SO4,请你评价该方案是否可行,若可以不必说明理由;若不可行,简述其理由。
28.(16分) 有机物A是合成高分子树脂()和某合成鞣剂()的原料之一。
相关的合成路线如下图所示(某些生成物已略去):已知:Ⅰ. (R1、R2、R3代表烃基)Ⅱ.请回答下列问题:(1)经质谱测定,有机物A的相对分子质量为164,燃烧8.2 g有机物A,生成标准状况下11.2 L CO2和5.4 g H2O 。
则A的分子式是。
(2)步骤Ⅰ的目的是;(3)将有机物E溶液滴到饱和溴水中,有大量白色沉淀生成。
E的含氧官能团的名称是。
H→合成鞣剂的反应类型是。
(4)B→D的化学方程式是。
(5)F→高分子树脂的化学方程式是。
(6)F的同分异构体X具有如下特点:①与F具有相同的官能团;②苯环上有两个取代基;③1 mol X 最多消耗Na 、NaOH、NaHCO3的物质的量分别为3、2、1。
且X有如下转化关系:香豆素的结构简式为,X的结构简式为。
由X生成香豆酸的化学方程式是。
顺义区2012届第二次高三理科综合测试(化学答案)6.B7.D8.B9.A 10.C 11.C 12.A25.(14分)(1)减弱………………………………………………………………(1分)Na、Mg、Al电子层数相同,核电荷数的递增,吸引电子能力增强,原子半径逐渐减小,金属性减弱。
………………………………………………………………………(2分)(2)135 ………………………………………………………………………(2分)a d ………………………………………………………………………(2分)(3)①和②………………………………………………………………………(1分)2 mL 10% 的H2O2溶液………………………………………………………(2分)(4)37g ………………………………………………………………………(2分)10Cl2 + 10Ca(OH)2 == 7 CaCl2+ 2Ca(ClO)2 + Ca(ClO3)2 + 10H2O ………(2分)26.(14分)(1)取少量溶液C于试管中,加入2~3滴KSCN溶液,若溶液变成红色,说明Fe3+未沉淀完全;若溶液不变色,说明Fe3+已沉淀完全。
………………(2分)(2)Al3+﹢3OH-=Al (OH)3↓ ………………………………………………(2分)(3)由于硫酸电离出氢离子与氢氧化铝电离出氢氧根离子反应生成水,使Al (OH)3溶解平衡右移,至Al (OH)3溶解。
………………………………………………………………(2分)(4)Al3+﹢3H2O Al (OH)3﹢3H+;NH4+ + H2O NH3·H2O + H+………(2分)硫酸铝铵………………………………………………………………(2分)(5)因为硫酸铝铵易溶于热水,有利于生成;随温度升高、脱去结晶水,产生晶变。
所以温度控制在90—100℃之间。
………………………………………………………(2分)(6)冷却,结晶、过滤、洗涤、干燥………………………………………………(2分)27.(14分)(1)c ……………………………………………………………………………………(2分)(2)2KMnO4K2MnO4 + MnO2 + O2↑ …………………………………(2分)(3)①2SO2 + O22SO3………………………………………………(2分)② 0.5 mol/L BaCl2溶液………………………………………………………(2分)品红溶液(或KMnO4溶液) ……………………………………………………(2分)检验和除去SO2气体………………………………………………………(2分)③虽然饱和NaHSO3溶液可除去SO3,但是SO3与NaHSO3反应生成SO2,干扰对原混合气体中SO2的检验。
