九年级化学元素周期律
初中化学易考知识点化学元素的周期表

初中化学易考知识点化学元素的周期表初中化学易考知识点:化学元素的周期表引言:化学元素是构成物质的基本单位,掌握化学元素的周期表是初中化学学习的核心。
本文将详细介绍化学元素的周期表,包括其组成、排列规律以及应用等方面内容,旨在帮助读者更好地理解和掌握这一知识点。
一、化学元素的定义及组成1.1 化学元素的定义化学元素是由具有相同原子数的原子组成的物质,它是一种基本的化学物质。
每个化学元素都有唯一的原子序数,用来表示元素的位置。
1.2 化学元素的组成化学元素由原子构成,每个原子由质子、中子和电子组成。
质子和中子位于原子核内,电子则以轨道的形式绕核旋转。
二、化学元素的周期表2.1 历史背景化学元素的周期表是由俄罗斯化学家门捷列夫于1869年提出的。
他根据元素的化学性质和原子质量的变化,将元素按照一定的规律排列在表中。
2.2 周期表的结构周期表通常由若干水平行和垂直列组成。
水平行称为周期,垂直列称为族。
周期表的左侧为金属元素,右侧为非金属元素,中间为过渡元素。
2.3 周期表的排列规律周期表中的化学元素按照原子序数递增的顺序排列。
每个周期的首元素为碱金属元素,每个周期的末元素为惰性气体元素。
周期表中的化学元素具有周期性的物理和化学性质。
三、周期表的应用3.1 元素的分类和命名周期表可以帮助人们对元素进行分类和命名。
根据周期表的位置和性质,我们可以将元素分为金属、非金属和过渡元素等不同类别,以便更好地研究和理解物质的性质和变化。
3.2 元素的性质和化合物的组成周期表为研究元素的性质和化合物的组成提供了基础。
通过周期表的分析,我们可以推测元素的化学性质和化合物的组成,进而预测它们的性质和变化规律。
3.3 元素的应用领域周期表中的元素广泛应用于工业、医药、农业等领域。
例如,氢氧化钠用于制取肥皂和纤维素;铝被用于制造飞机和汽车等;锂被用于生产电池等。
四、化学元素周期表的拓展与挑战4.1 前沿研究与新发现随着科学技术的不断发展,越来越多的化学元素被合成和发现。
化学中的元素周期表和化学方程式

化学中的元素周期表和化学方程式一、元素周期表1.定义:元素周期表是化学元素按照原子序数递增的顺序排列成的表格,表格的横行称为周期,纵列称为族。
2.周期:周期表中的横行,每个周期代表一个电子层的填充。
3.族:周期表中的纵列,同一族的元素具有相似的化学性质。
4.周期表的排列规律:a.原子序数递增;b.电子层数递增;c.同一周期内,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强;d.同一族内,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
5.重要元素:a.周期表中的过渡元素;b.周期表中的主族元素;c.周期表中的稀有气体元素。
二、化学方程式1.定义:化学方程式是用化学符号和数学符号表示化学反应的式子。
2.化学方程式的表示方法:a.反应物在方程式的左边,生成物在方程式的右边;b.反应物和生成物的化学式要写全;c.反应物和生成物的系数要平衡;d.反应条件要在方程式上方标注。
3.化学方程式的类型:a.合成反应;b.分解反应;c.置换反应;d.复分解反应。
4.化学方程式的平衡:a.质量守恒定律:反应物和生成物的总质量不变;b.原子守恒定律:反应物和生成物的原子数目不变;c.电荷守恒定律:反应物和生成物的总电荷不变。
5.化学方程式的计算:a.物质的量计算;b.质量计算;c.体积计算;d.浓度计算。
6.化学方程式的简化:a.删去相同的物质;b.合并同类项;c.化简系数。
三、元素周期表和化学方程式的应用1.元素周期表的应用:a.查找元素的相对原子质量;b.判断元素的化合价;c.预测元素的化学性质;d.确定元素在反应中的角色。
2.化学方程式的应用:a.描述化学反应的实质;b.判断反应类型;c.计算反应物和生成物的物质的量;d.解释实际问题。
综上所述,元素周期表和化学方程式是化学学习中两个重要的知识点。
掌握元素周期表可以帮助我们了解元素的性质和特点,而化学方程式则是描述化学反应的重要工具。
通过熟练掌握这两个知识点,我们可以更好地理解化学知识,并为今后的化学学习打下坚实的基础。
【化学】《元素周期律》知识点总结
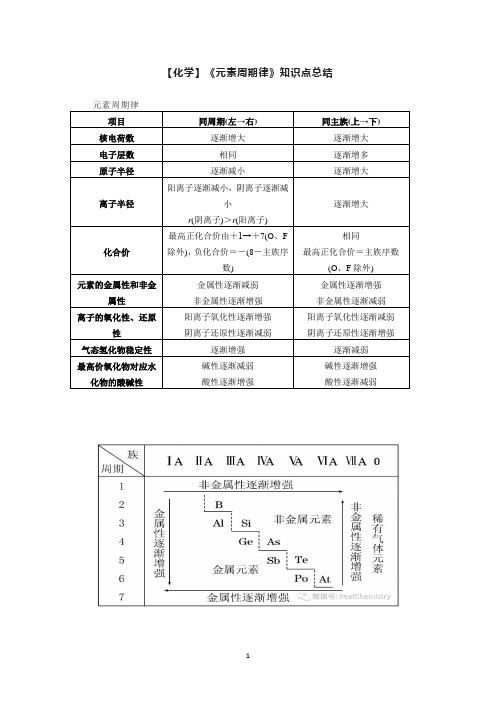
【化学】《元素周期律》知识点总结元素周期律项目同周期(左→右)同主族(上→下)核电荷数逐渐增大逐渐增大电子层数相同逐渐增多原子半径逐渐减小逐渐增大离子半径阳离子逐渐减小,阴离子逐渐减小r(阴离子)>r(阳离子)逐渐增大化合价最高正化合价由+1→+7(O、F除外),负化合价=-(8-主族序数)相同最高正化合价=主族序数(O、F除外)元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱离子的氧化性、还原性阳离子氧化性逐渐增强阴离子还原性逐渐减弱阳离子氧化性逐渐减弱阴离子还原性逐渐增强气态氢化物稳定性逐渐增强逐渐减弱最高价氧化物对应水化物的酸碱性碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱重难突破一、元素金属性、非金属性比较1.元素金属性强弱的判断(1)比较元素的金属性强弱,其实质是看元素原子失去电子的难易程度,越容易失去电子,金属性越强。
(2)金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强;最高价氧化物对应水化物的碱性越强,金属性越强。
2.元素非金属性强弱的判断(1)比较元素的非金属性强弱,其实质是看元素原子得到电子的难易程度,越容易得到电子,非金属性越强。
(2)单质越容易与氢气化合,生成的氢化物越稳定,非金属性越强;最高价氧化物对应水化物的酸性越强,说明其非金属性越强。
典例2X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是()A.若X、Y均为金属元素,则X的金属性强于YB.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子强C.若X、Y均为非金属元素,则Y的非金属性比X强D.若X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X【答案】B典例1已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是()A.气态氢化物的稳定性:HX>H2Y>ZH3B.非金属活泼性:Y<X<ZC.原子半径:X>Y>ZD.原子最外层电子数:X<Y<Z【答案】A二、微粒半径大小的比较1. 同周期元素的微粒同周期元素的原子(稀有气体除外),从左到右原子半径或最高价阳离子的半径随核电荷数增大而逐渐减小。
九上化学第六单元知识点笔记

九上化学第六单元知识点笔记
一、单元概述
第六单元是九年级化学的重要部分,主要涉及元素周期表和元素周期律的学习。
通过这一单元的学习,学生将建立起对化学元素和周期表的理解,为后续的学习打下坚实的基础。
二、重要知识点
1. 元素周期表的结构:元素周期表分为7个周期,每个周期包含的元素种类不同。
周期数与电子层数相同。
2. 元素周期律:元素的性质随原子序数的递增而呈周期性变化。
例如,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强。
3. 原子结构:原子由原子核和核外电子组成。
原子核由质子和中子组成。
电子在原子核外绕核旋转。
4. 化学键:分子或晶体中相邻原子之间的相互作用称为化学键。
化学键有离子键、共价键和金属键等。
5. 化学反应:化学反应是分子破裂成原子,原子重新组合成新分子的过程。
化学反应中常伴有能量变化和物质变化。
三、注意事项
1. 理解元素周期表的结构和元素周期律的含义,是本单元学习的关键。
2. 掌握原子结构和化学键的基本概念,有助于理解化学反应的本质。
3. 在学习过程中,要注意理论联系实际,将所学知识应用到实际生活中。
总之,第六单元是九年级化学的重要部分,涉及元素周期表和元素周期律的学习。
通过学习,学生应建立起对化学元素和周期表的理解,为后续的学习打下坚实的基础。
同时,要注意理论联系实际,将所学知识应用到实际生活中。
化学之元素周期表的性质
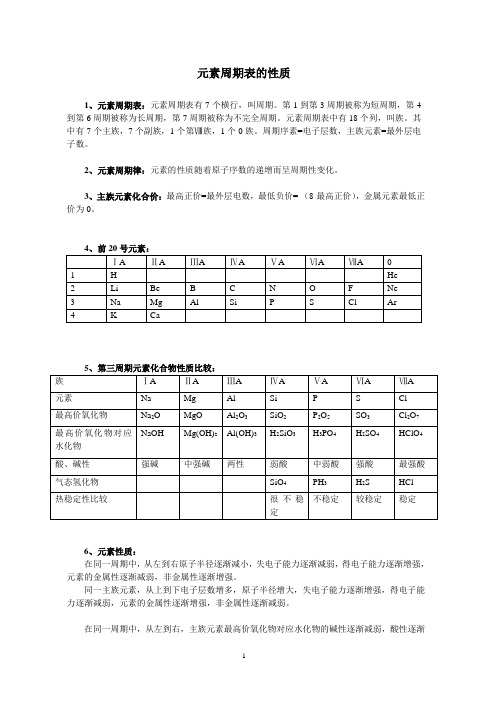
元素周期表的性质1、元素周期表:元素周期表有7个横行,叫周期。
第1到第3周期被称为短周期,第4到第6周期被称为长周期,第7周期被称为不完全周期。
元素周期表中有18个列,叫族。
其中有7个主族,7个副族,1个第Ⅷ族,1个0族。
周期序素=电子层数,主族元素=最外层电子数。
2、元素周期律:元素的性质随着原子序数的递增而呈周期性变化。
3、主族元素化合价:最高正价=最外层电数,最低负价=-(8-最高正价),金属元素最低正价为0。
4、前20号元素:ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 01 H He2 Li Be B C N O F Ne3 Na Mg Al Si P S Cl Ar4 K Ca5、第三周期元素化合物性质比较:族ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA元素Na Mg Al Si P S Cl最高价氧化物Na2O MgO Al2O3SiO2P2O5SO3Cl2O7NaOH Mg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4最高价氧化物对应水化物酸、碱性强碱中强碱两性弱酸中弱酸强酸最强酸气态氢化物SiO4PH3H2S HCl不稳定较稳定稳定热稳定性比较很不稳定6、元素性质:在同一周期中,从左到右原子半径逐渐减小,失电子能力逐渐减弱,得电子能力逐渐增强,元素的金属性逐渐减弱,非金属性逐渐增强。
同一主族元素,从上到下电子层数增多,原子半径增大,失电子能力逐渐增强,得电子能力逐渐减弱,元素的金属性逐渐增强,非金属性逐渐减弱。
在同一周期中,从左到右,主族元素最高价氧化物对应水化物的碱性逐渐减弱,酸性逐渐增强;它们气态氢化物的热稳定性逐渐增强。
在同一主族中,从上到下,元素最高价氧化物对应水化物的酸性逐渐减弱,碱性逐渐增强;它们的气态氢化物的热稳定性逐渐减弱。
原子半径金属性非金属性最高价氧化物对应水化物气态氢化物的稳定性酸性碱性同一横行减小减小增大减小增大增大同一列增大增大减小增大减小减小2011.11.12。
初中化学元素周期律原理梳理

初中化学元素周期律原理梳理元素周期律是化学中的重要理论之一,它对于化学元素的分类、性质以及反应有着重要的指导作用。
元素周期表的发现和发展过程中,化学家们逐渐总结出了一些规律和原理,从而形成了元素周期律。
本文将对元素周期律的原理进行梳理,帮助读者加深对该概念的理解。
元素周期律的核心原理是基于元素的原子结构和原子核构成的。
在元素周期表中,元素按照递增的原子序数(即元素的核电荷数)排列,并按照一定的规律分组。
这种排列方式反映了元素性质的周期性变化。
首先,元素周期律中的主要特点是周期性。
每个周期都有相似的电子结构和化学性质。
这是因为,每个周期中元素的外层电子数增加一个,从而影响到原子的化学性质。
比如,第一周期的元素氢和第二周期的元素锂、铍等具有相似的性质,都是典型的活泼金属。
其次,元素周期律中的次要特点是族。
族是在元素周期表中由上到下的垂直区域。
元素周期表中的元素按照一定的规律分成了18个族。
每个族中的元素具有相同的最外层电子结构,因此它们的化学性质也有相似之处。
例如,第一族元素都是碱金属,具有较活泼的性质,而第十八族的元素都是稀有气体,具有稳定的性质。
第三,元素周期律中的重要原理是原子半径的变化规律。
原子半径是指原子核到最外层电子的距离,通常以原子半径的大小来判断元素的化合价等性质。
在元素周期表中,随着核电荷数的增加,原子半径整体上呈现出递减的趋势。
由于核电荷的增加,原子核对最外层电子的吸引力也增强,从而使得原子半径减小。
此外,元素周期律中还存在着电负性的变化规律。
电负性是指原子对外层电子的亲和力,通常用于判断元素的化合性质和反应性。
在元素周期表中,电负性整体上随着核电荷数的增加而增加。
这是因为原子核的吸引力增强,电子对外层电子的亲和力也增强。
因此,元素周期表中右上角的元素电负性较高,而左下角的元素电负性较低。
最后,元素周期律中还存在着化合价的变化规律。
化合价是指元素与其他元素形成化合物时的化学价数,用于标识元素的化学性质和化合物的组成。
初三化学元素周期表(完整版)
初三化学元素周期表(完整版)元素周期表是一张反映元素周期律的图表。
它将所有已知的化学元素按照一定的顺序排列在一个矩阵中,每个元素占据一个唯一的位置。
元素周期表上方有一行元素称为“气体行”,其下方则有两行元素称为“镧系元素”和“锕系元素”,它们比较特殊,常常被单独列出来。
元素周期表以水平行和垂直列的方式给出了元素名称、符号、原子序数、原子量和一些其他元素特性的数据。
元素周期表的发现是人类对元素周期律的深刻认识,是化学科学史上的重要成就之一。
尤其是俄国化学家门捷列夫于1869年发现元素周期律,将化学元素按照原子序数从小到大依次排列,并按照一定的规律分组。
他所发现的周期性定律,开启了元素周期表的研究之路。
元素周期表的基本结构是由一系列水平行和垂直列构成。
其中,垂直列被称为“族”,水平行被称为“周期”。
按照元素周期律的规律,同一族内的元素具有相同的电子排布方式,因此具有相似的化学性质。
同一周期内的元素原子半径逐渐递增,但化学性质的变化比较不规则性。
下面我们将对每一个元素周期表中的周期和族进行详细的解释。
一、第1周期第1周期只有两个元素,它们是氢(H)和氦(He)。
氮原子是宇宙中最常见的元素之一,它是一种具有最简单的原子结构的气体,含有一个质子和一个电子。
氦原子质量略大于氢原子,它含有两个质子和两个中子,并在外层能级拥有两个电子。
这种单质几乎不化学反应,因为它和其它元素几乎没有化学亲和力。
二、第2周期第2周期有八个元素,它们是锂(Li)、铍(Be)、硼(B)、碳(C)、氮(N)、氧(O)、氟(F)和氖(Ne)。
其中,锂、铍、碳、氮和氧是非金属元素,它们的化学性质大多相似。
氟是最活泼的非金属元素,氩是某些光谱灯泡和医疗设备中的一种惰性气体。
三、第3周期第3周期有八个元素,它们是钠(Na)、镁(Mg)、铝(Al)、硅(Si)、磷(P)、硫(S)、氯(Cl)和氩(Ar)。
钠和镁是典型的金属元素,它们具有与水反应所形成的氢气的比热、导电性和光谱性质。
化学元素周期律
化学元素周期律化学元素周期律指的是元素在周期表中按照它们的原子序数依次排列的规律,它是19世纪初德国化学家斯特拉斐特(Lothar Meyer)和俄国化学家格里尔(Dmitri Mendeleev)发现的。
他们发现,当把现有的化学元素按原子序数排序时,发现它们具有一定的规律性:随着原子序数的增加,元素原子团外层电子数总是递增1,元素特性归类为7系,每个系内有8个元素而形成“元素周期”。
这就是所谓的“化学元素周期律”。
化学元素周期律的关键所在在于,原子序数在原子团外层电子数上的增加,会使原子团外层电子数递增1,从而影响元素原子团外层电子构型和电子结构,以及元素的化学性质。
譬如,原子团外层电子数增加1,会使元素的中子数+1而电荷数-1,从而引起稳定性的变化,从而影响元素的化学性质,从而形成元素周期性质的变化。
因此,元素周期律是由原子序数和元素的化学性质共同决定的。
由于原子序数的增加,会引起元素的化学性质的变化,从而衍生出元素周期特点。
从原子序数增加的角度,每七个原子序数构成一组,叫做一个周期,每个周期共有8种元素,称为每个周期元素。
即每组它们原子序数增加7,但元素本质特征依然如出一辙,因而称之为元素周期律。
每个周期元素都有自己的特点,可以根据周期律给出基本的分类。
一般而言,每个周期元素都有自己的化学性质,如碳和氢等位于第一组的元素,具有很强的化学活性;第四组的元素如钾和锂,具有较大的沸点等特点;第八组的元素,如氦和氖,具有极强的化学稳定性。
此外,周期律中的元素也与它们的原子结构有着重大的关系。
比如,锂在第四组有2个电子,在周期元素中是唯一一种这样的元素,所以它的电子结构与它的周期位置有很强的联系。
这种特点使得它们在化学反应中有独特的作用,影响着化学反应的过程,因此,构型和电子结构是原子序数和稳定性关系的关键性因素。
综上所述,斯特拉斐特和格里尔发现的化学元素周期律,可以帮助我们了解原子构型,掌握元素稳定性,从而研究化学反应中各种元素的浓度和极性等因素,为进一步深入化学研究奠定基础。
初三化学元素表
初三化学元素表第一章元素及其周期律1. 元素的概念元素是组成物质的最基本单位,是由具有相同原子序数的原子组成的纯物质。
化学元素是一种能够通过化学反应进行分离的物质,可以表示为一个化学符号,在元素周期表中排列。
2. 原子和分子原子是元素最小的化学单位,是由质子、中子和电子组成的。
分子是元素或化合物中最小的化学单位,是由原子通过化学键结合而成的。
3. 元素周期表元素周期表是一个按原子序数排列的表格,每个元素都有一个化学符号,其中横行称为一周期,竖列称为一族。
元素周期表的特点是周期性变化,它揭示了元素的周期性特征和化学性质。
4. 元素周期律元素周期律是指元素周期表中一周期内元素物理和化学性质周期性变化的规律。
元素周期律的基础是元素的电子结构和原子半径的变化,它是理解元素及其化合物的基础。
5. 周期性的现象周期性现象是指元素和它们的化合物的特征随原子序数和周期表位置的变化而变化。
元素周期性特征包括化合价、电离能、电子亲合能、原子半径和化学反应性等。
第二章主要元素及其化学性质1. 金属元素金属元素是指具有金属特性的元素。
金属元素包括铁、铜、铝、锌等。
它们具有良好的导电性、导热性、延展性和可塑性,能够形成阳离子,可以和非金属元素形成化合物。
2. 非金属元素非金属元素是指只具有非金属特性的元素。
非金属元素包括氢、氧、氮、氯等。
它们通常是固体或气体,不具有良好的导电性和导热性,可以和金属元素或其他非金属元素形成化合物。
3. 碱金属元素碱金属元素是第一族元素,包括锂、钠、钾和铷等。
它们的物理性质较活泼,具有低密度、低熔点和较弱的金属性,可以在水中产生氢气和碱性溶液。
4. 碱土金属元素碱土金属元素是第二族元素,包括镁、钙、锶和钡等。
它们的物理性质比较活泼,但不如碱金属元素那样活泼。
它们与非金属元素形成的化合物比较稳定,具有多种用途。
5. 原子半径和离子半径原子半径是原子中心到最外层电子的平均距离,是元素的物理性质之一。
初中化学元素周期律与周期表知识点
初中化学元素周期律与周期表知识点初中化学里,元素周期律和周期表那可真是让不少同学又爱又恨的存在。
这玩意儿就像一个神秘的大宝藏,里面藏着无数的秘密和规律,等我们去挖掘和探索。
先来说说元素周期表吧,它就像一张超级大的元素家族图谱。
横排叫周期,竖列叫族。
刚看到这张表的时候,那密密麻麻的元素符号和数字,真让人有点眼花缭乱。
但只要你静下心来仔细研究,就会发现其中的妙处。
比如说第一周期,就只有氢和氦这两个小家伙。
氢,大家都熟悉,最轻的气体,能燃烧,还能用来填充气球。
氦呢,惰性气体,一般不跟其他物质发生反应,常被用在气球里,比氢安全多啦。
到了第二周期,元素开始多了起来。
像锂、铍、硼、碳、氮、氧、氟、氖。
这里面碳可是个大主角,它能形成各种各样的化合物。
咱平时用的铅笔芯,主要成分就是石墨,这石墨就是碳的一种形式。
还有那亮晶晶的钻石,也是碳,只不过结构不同罢了。
氧就更不用说了,我们呼吸离不开它,没有氧,估计大家都得憋坏。
再看第三周期,钠、镁、铝、硅、磷、硫、氯、氩。
钠,一碰到水就会“噼里啪啦”地响,还会在水面上到处乱窜,那场面可刺激了。
镁条燃烧起来,那耀眼的白光,在实验课上总能吸引大家的目光。
铝呢,生活中到处都有它的身影,易拉罐、铝合金门窗,轻便又耐用。
元素周期表可不只是简单地罗列元素,它还体现了元素周期律。
同周期元素,从左到右,原子序数逐渐增大,金属性逐渐减弱,非金属性逐渐增强。
同主族元素,从上到下,原子序数逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
这规律听起来有点绕口,但只要结合具体的元素来理解,就容易多了。
就拿金属性来说吧,钠和钾都在第一主族,钾在钠下面。
做实验的时候,把钾放到水里,反应比钠剧烈得多,那简直像一颗小炸弹在水里爆炸一样。
这就说明钾的金属性比钠强。
还有原子半径的变化规律,同周期从左到右,原子半径逐渐减小;同主族从上到下,原子半径逐渐增大。
这就好比一群人排队,从左到右个子越来越矮,从上到下个子越来越高。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二手泵车 http://www.来自/伤寒患者传染性最强的时期为A.潜伏期B.起病1周内C.起病2~4周后D.恢复期E.起病后1~2周内 用塞尺测量间隙超过三片时,一般地每增加一片应加mm的修正值。A.0.01B.0.02C.0.005D.0.015 大脑皮质运动区病变引起的瘫痪多表现为A.单瘫或不均等偏瘫B.完全性均等性偏瘫C.交叉瘫D.四肢瘫E.截瘫 红外线系统由哪些部分组成? [多选,案例分析题]男性,25岁,反复发作性呼吸困难5年,每年春季发作,可自行缓解,此次再次突然发作2天,伴胸闷、咳嗽,症状持续不能缓解。查体:双肺满布哮鸣音,心率95次/分,心律齐,心脏各瓣膜区未闻及病理性杂音。该患者治疗可以选择的药物。A.沙丁胺醇雾化吸入B.糖皮质激 对于现行刑法第116条的“汽车”一次,学理上往往解释包括作为交通工具使用的大型拖拉机,这一解释属于()A.历史解释B.当然解释C.限制解释D.扩张解释 甲亢手术引起神经损伤,下列哪项说法是错误的A.喉上神经外支支配环甲肌,损伤引起患者声带松弛,声调降低B.喉上神经内支损伤引起误咽C.喉返神经前支支配声带内收肌,损伤后使声带内收D.一侧喉返神经损伤,引起声嘶E.一侧喉返神经后支损伤可无明显临床表现 在典故中,吴刚伐的是什么树? 在肺源性心脏病中,下列哪一项征象提示重度肺动脉高压A.肺动脉圆锥凸出B.右下肺动脉干增粗C.肺门残根征D.右心室重度增大E.肺淤血 运动高峰时左心室射血分数较静息时为下列哪个增加值是判断异常的标准A.<2.5%B.<5%C.<10%D.<15%E.<20% 全口义齿后缘边界为A.后颤动线B.前颤动线C.腭小凹后2mmD.腭小凹直连线上E.腭小凹之前方 重型肝炎肝性脑病患者口服乳果糖是为了A.预防消化道出血B.防止腹泻C.预防肠道真菌感染D.加速黄疸消退E.降低肠道pH值,保持大便通畅,减少氨的形成和吸收 某市新建一占地约80公顷的公园,现已初具规模,市园林行政主管部门为加强该园管理工作拟在公园总体规划已确定的管理用房位置,向市规划行政主管部门提出要求建设一幢三层办公管理用房,经市规划行政主管部门研究同意该项申请,并核发了建筑工程规划许可证。该工程建设期间,市规划 假冒两项以上他人专利,非法经营数额在以上的应予追诉。 只有行政机关工作人员先行使职权的行为,才有可能引起国家赔偿。以下行为中,不是行政机关工作人员的职权行为。A.公安机关对某一违法者进行处罚B.消防队灭火前后,在乖车途中交通肇事的行为C.勤务时间以外执行职务的行为D.工作时间内购买办公设备的行为 经过STP走的链路属于方式。 高危人群出现下列情况应考虑艾滋病,除了。A.马尔尼菲青霉菌感染B.皮肤黏膜或内脏的卡波济肉瘤、淋巴瘤C.反复发生的败血症D.双侧腹股沟淋巴结肿大E.反复出现带状疱疹或慢性播散性单纯疱疹 河北省冬小麦播种的适宜温度? 特别护理记录单不适用于哪类患者()A.重病、大手术B.特殊治疗C.需要严密观察病情D.一般局麻手术者E.需要记录液体出入量 社区建设的主要特点是什么? 中国政府于2001年向国际展览局正式递交了举办2010年上海世界会的申请书。A、5月1日B、5月2日C、5月3日D、5月4日 蠕形螨属于A.兼性寄生虫B.偶然寄生虫C.永久性寄生虫D.暂时性寄生虫E.以上均不是 80年代,我国国有资产管理体制改革探索阶段提出的国有资产管理体制是。A.国家统一所有,政府统一监管,企业自主经营B.国家统一所有,统一监管,企业自主经营C.国家统一所有,政府分级监管,企业授权经营D.国家统一所有,政府分级监管,企业自主经营 作业疲劳又称为工作疲劳或产业疲劳,是劳动者劳动机能衰退的正常的,与休息相对应,它们是消耗与恢复的交替过程。A.心理反应B.生理反应C.心理、生理反应D.病理、生理反应 按运输对象分类,运输可以分为和货物运输。 早期缺铁性贫血形态学改变为A.小细胞低色素性贫血B.小细胞正色素性贫血C.正细胞正色素性贫血D.大细胞性贫血E.以上都不是 电荷有规则的定向移动称为电流。凡大小和方向都随时间变化的电流称为()。A.(A)直流电流B.(B)稳衡电流C.(C)交流电流D.(D)稳压电流 流行性出血热属于A.有肾病综合征的动物源性出血热B.无肾病综合征的动物源性出血热C.蚊传性出血热D.蜱传性出血热E.传播途径不明的出血热 下列哪项不符合中期妊娠水囊引产A.放置时间不超过24小时B.一般放置一个水囊C.两次放置间隔时间应为48小时D.注水量为300~500mlE.放置部位最好在子宫下段 世界上第一台电子计算机诞生于年,名字叫做。A.1946,ENIACB.1954,EAINCC.1964,ENIACD.1976,EAINC 下列各项,不属苦味药作用的是。A.降泄B.通泄C.燥湿D.行气E.清泄 铸件表面气孔形成的原因是A.包埋材料的化学纯度低B.合金里低熔点成份过多C.包埋材料透气性不良D.铸金加温过高、过久E.铸圈焙烧时间过长 建筑工程按建筑性质分为。A、新建B、改建C、扩建D、加固维修 在检测细胞因子和可溶性黏附分子中,ELISA常用A.直接法B.间接法C.捕获法D.夹心法E.竞争法 MCS-51系列单片机的P3口当作第二功能使用时,P3.0作为。A、串行口输入;B、串行口输入;C、外部中断"0"输入;D、外部中断"1"输入。 能润肠通便,略兼补虚的药物是A.大黄B.芦荟C.番泻叶D.火麻仁E.芒硝 根据外能的形式,炸药的感度主要指的是哪几方面? 作为心理咨询的直接起源,年在美国诞生了的历史上第一本《临床•23理学》。A.1904B.1907C.1896D.1908 [单选,案例分析题]女,56岁,因右眼剧烈胀痛,偏头痛,视力严重下降就诊。发病前一天晚上因在昏暗的灯光下玩麻将至深夜而引发。检查:右眼视力0.1,右眼混合充血,角膜雾状水肿混浊,前房浅,瞳孔中度散大,对光反射迟钝,晶状体轻度混浊,余窥不清。为支持诊断而应选择的检查方 当以传输信号的码型不同划分来建立多址接人时,称为。A、频分多址方式B、时分多址方式C、码分多址方式D、频编码多址
