人教版九年级下册化学:元素周期表
九年级化学元素周期表口诀

第一周期:氢氦---- 侵害第二周期:锂铍硼碳氮氧氟氖---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩---- 那美女桂林留绿牙第四周期:钾钙钪钛钒铬锰---- 嫁给康太反革命铁钴镍铜锌镓锗---- 铁姑捏痛新嫁者砷硒溴氪---- 生气休克第五周期:铷锶钇锆铌---- 如此一告你钼锝钌---- 不得了铑钯银镉铟锡锑---- 老爸银哥印西提碲碘氙---- 地点仙第六周期:铯钡镧铪----(彩)色贝(壳)蓝(色)河钽钨铼锇---- 但(见)乌(鸦)(引)来鹅 铱铂金汞砣铅---- 一白巾供它牵 铋钋砹氡---- 必不爱冬(天) 第七周期:钫镭锕---- 防雷啊!下面是竖着按族背:氢锂钠钾铷铯钫请李娜加入私访铍镁钙锶钡镭媲美盖茨被累 硼铝镓铟铊碰女嫁音他碳硅锗锡铅探归者西迁氮磷砷锑铋蛋临身体闭氧硫硒碲钋养牛西蹄扑氟氯溴碘砹父女绣点爱氦氖氩氪氙氡害耐亚克先动化合价可以这样记忆: 一家请驴脚拿银,(一价氢氯钾钠银) 二家羊盖美背心。
(二价氧钙镁钡锌)一价氢氯钾钠银二价氧钙钡镁锌 三铝四硅五价磷二三铁、二四碳一至五价都有氮铜汞二价最常见正一铜氢钾钠银正二铜镁钙钡锌 三铝四硅四六硫二四五氮三五磷一五七氯二三铁二四六七锰为正 碳有正四与正二再把负价牢记心负一溴碘与氟氯负二氧硫三氮磷元素周期表中各种元素名称的读音第01 号元素: 氢[化学符号]H, 读“轻”, [英文名称]Hydrogen第02 号元素: 氦[化学符号]He, 读“亥”, [英文名称]Helium第03 号元素: 锂[化学符号]Li, 读“里”, [英文名称]Lithium第04 号元素: 铍[化学符号]Be, 读“皮”, [英文名称]Beryllium第05 号元素: 硼[化学符号]B, 读“朋”, [英文名称]Boron第06 号元素: 碳[化学符号]C, 读“炭”, [英文名称]Carbon第07 号元素: 氮[化学符号]N, 读“淡”, [英文名称]Nitrogen第08 号元素: 氧[化学符号]O, 读“养”, [英文名称]Oxygen第09 号元素: 氟[化学符号]F, 读“弗”, [英文名称]Fluorine第10 号元素: 氖[化学符号]Ne, 读“乃”, [英文名称]Neon第12 号元素: 镁[化学符号]Mg, 读“美”, [英文名称]Magnesium 第13 号元素: 铝[化学符号]Al, 读“吕”, [英文名称]Aluminum 第14 号元素: 硅[化学符号]Si, 读“归”, [英文名称]Silicon第15 号元素: 磷[化学符号]P, 读“邻”, [英文名称]Phosphorus 第16 号元素: 硫[化学符号]S, 读“流”, [英文名称]Sulfur第17 号元素: 氯[化学符号]Cl, 读“绿”, [英文名称]Chlorine第18 号元素: 氩[化学符号]Ar,A, 读“亚”, [英文名称]Argon第19 号元素: 钾[化学符号]K, 读“甲”, [英文名称]Potassium第20 号元素: 钙[化学符号]Ca, 读“丐”, [英文名称]Calcium第21 号元素: 钪[化学符号]Sc, 读“亢”, [英文名称]Scandium第22 号元素: 钛[化学符号]Ti, 读“太”, [英文名称]Titanium第23 号元素: 钒[化学符号]V, 读“凡”, [英文名称]Vanadium第24 号元素: 铬[化学符号]Cr, 读“各”, [英文名称]Chromium 第25 号元素: 锰[化学符号]Mn, 读“猛”, [英文名称]Manganese 第26 号元素: 铁[化学符号]Fe, 读“铁”, [英文名称]Iron第27 号元素: 钴[化学符号]Co, 读“古”, [英文名称]Cobalt第28 号元素: 镍[化学符号]Ni, 读“臬”, [英文名称]Nickel第29 号元素: 铜[化学符号]Cu, 读“同”, [英文名称]Copper第30 号元素: 锌[化学符号]Zn, 读“辛”, [英文名称]Zinc第31 号元素: 镓[化学符号]Ga, 读“家”, [英文名称]Gallium第32 号元素: 锗[化学符号]Ge, 读“者”, [英文名称]Germanium第34 号元素: 硒[化学符号]Se, 读“西”, [英文名称]Selenium第35 号元素: 溴[化学符号]Br, 读“秀”, [英文名称]Bromine第36 号元素: 氪[化学符号]Kr, 读“克”, [英文名称]Krypton第37 号元素: 铷[化学符号]Rb, 读“如”, [英文名称]Rubidium第38 号元素: 锶[化学符号]Sr, 读“思”, [英文名称]Strontium第39 号元素: 钇[化学符号]Y, 读“乙”, [英文名称]Yttrium第40 号元素: 锆[化学符号]Zr, 读“告”, [英文名称]Zirconium第41 号元素: 铌[化学符号]Nb, 读“尼”, [英文名称]Niobium第42 号元素: 钼[化学符号]Mo, 读“目”, [英文名称]Molybdenum 第43 号元素: 碍[化学符号]Tc, 读“得”, [英文名称]Technetium 第44 号元素: 钌[化学符号]Ru, 读“了”, [英文名称]Ruthenium第45 号元素: 铑[化学符号]Rh, 读“老”, [英文名称]Rhodium第46 号元素: 钯[化学符号]Pd, 读“巴”, [英文名称]Palladium第47 号元素: 银[化学符号]Ag, 读“银”, [英文名称]Silver第48 号元素: 镉[化学符号]Cd, 读“隔”, [英文名称]Cadmium第49 号元素: 铟[化学符号]In, 读“因”, [英文名称]Indium第50 号元素: 锡[化学符号]Sn, 读“西”, [英文名称]Tin第51 号元素: 锑[化学符号]Sb, 读“梯”, [英文名称]Antimony第52 号元素: 碲[化学符号]Te, 读“帝”, [英文名称]Tellurium第53 号元素: 碘[化学符号]I, 读“典”, [英文名称]Iodine第54 号元素: 氙[化学符号]Xe, 读“仙”, [英文名称]Xenon第56 号元素: 钡[化学符号]Ba, 读“贝”, [英文名称]Barium第58 号元素: 铈[化学符号]Ce, 读“市”, [英文名称]Cerium第59 号元素: 镨[化学符号]Pr, 读“普”, [英文名称]Praseodymium 第60 号元素: 钕[化学符号]Nd, 读“女”, [英文名称]Neodymium 第61 号元素: 钷[化学符号]Pm, 读“颇”, [英文名称]Promethium 第62 号元素: 钐[化学符号]Sm, 读“衫”, [英文名称]Samarium第63 号元素: 铕[化学符号]Eu, 读“有”, [英文名称]Europium 第64 号元素: 钆[化学符号]Gd, 读“轧”, [英文名称]Gadolinium 第65 号元素: 铽[化学符号]Tb, 读“忒”, [英文名称]Terbium第66 号元素: 镝[化学符号]Dy, 读“滴”, [英文名称]Dysprosium 第67 号元素: 钬[化学符号]Ho, 读“火”, [英文名称]Holmium第68 号元素: 铒[化学符号]Er, 读“耳”, [英文名称]Erbium第69 号元素: 铥[化学符号]Tm, 读“丢”, [英文名称]Thulium第70 号元素: 镱[化学符号]Yb, 读“意”, [英文名称]Ytterbium第71 号元素: 镥[化学符号]Lu, 读“鲁”, [英文名称]Lutetium第72 号元素: 铪[化学符号]Hf, 读“哈”, [英文名称]Hafnium第73 号元素: 钽[化学符号]Ta, 读“坦”, [英文名称]Tantalum第74 号元素: 钨[化学符号]W, 读“乌”, [英文名称]Tungsten第75 号元素: 镧[化学符号]La, 读“兰”, [英文名称]Lanthanum 第75 号元素: 铼[化学符号]Re, 读“来”, [英文名称]Rhenium第76 号元素: 锇[化学符号]Os, 读“鹅”, [英文名称]Osmium第78 号元素: 铂[化学符号]Pt, 读““, [英文名称]Platinum第79 号元素: 金[化学符号]Au, 读“今”, [英文名称]Gold第80 号元素: 汞[化学符号]Hg, 读“拱”, [英文名称]Mercury 第81 号元素: 铊[化学符号]Tl, 读“他”, [英文名称]Thallium第82 号元素: 铅[化学符号]Pb, 读“千”, [英文名称]Lead第83 号元素: 铋[化学符号]Bi, 读“必”, [英文名称]Bismuth第84 号元素: 钋[化学符号]Po, 读“泼”, [英文名称]Polonium 第85 号元素: 砹[化学符号]At, 读“艾”, [英文名称]Astatine第86 号元素: 氡[化学符号]Rn, 读“冬”, [英文名称]Radon第87 号元素: 钫[化学符号]Fr, 读“方”, [英文名称]Francium第88 号元素: 镭[化学符号]Ra, 读“雷”, [英文名称]Radium第89 号元素: 锕[化学符号]Ac, 读“阿”, [英文名称]Actinium 第90 号元素: 钍[化学符号]Th, 读“土”, [英文名称]Thorium第91 号元素: 镤[化学符号]Pa, 读“仆”, [英文名称]Protactinium 第92 号元素: 铀[化学符号]U, 读“由”, [英文名称]Uranium第93 号元素: 镎[化学符号]Np, 读“拿”, [英文名称]Neptunium 第94 号元素: 钚[化学符号]Pu, 读“不”, [英文名称]Plutonium 第95 号元素: 镅[化学符号]Am, 读“眉”, [英文名称]Americium 第96 号元素: 锔[化学符号]Cm, 读“局”, [英文名称]Curium第97 号元素: 锫[化学符号]Bk, 读“陪”, [英文名称]Berkelium 第98 号元素: 锎[化学符号]Cf, 读“开”, [英文名称]Californium第99 号元素: 锿[化学符号]Es, 读“哀”, [英文名称]Einsteinium第100 号元素: 镄[化学符号]Fm, 读“费”, [英文名称]Fermium第101 号元素: 钔[化学符号]Md, 读“门”, [英文名称]Mendelevium 第102 号元素: 锘[化学符号]No, 读“诺”, [英文名称]Nobelium第103 号元素: 铹[化学符号]Lw, 读“劳”, [英文名称]Lawrencium 第104 号元素: 鐪[化学符号]Rf, 读“卢”, [英文名称]unnilquadium 第105 号元素: [化学符号]Db, 读“杜”, [英文名称]dubnium第106 号元素: 钅喜[化学符号]Sg , 读”喜“, [英文名称]第107 号元素: 钅波[化学符号]Bh, 读"波“, [英文名称]Bohrium第108 号元素: 钅黑[化学符号]Hs, 读”黑“, [英文名称]第109 号元素: 钅麦[化学符号]Mt, 读"麦",[英文名称]第110 号元素: 鐽[化学符号]Ds, 读”达“, [英文名称]Darmstadtium 第111 号元素: 钅仑[化学符号]Rg, , 读”伦“, [英文名称]Roentgenium。
初中九年级化学教案:元素周期表

初中九年级化学教案:元素周期表一、引言化学是一门研究物质组成、结构和性质以及它们之间相互变化的科学。
在初中九年级的化学教学中,元素周期表是一个非常重要的内容。
本文将针对初中九年级化学教案中有关元素周期表的内容进行阐述和分析,旨在帮助教师能够有效地传授这一知识点,让学生更好地理解元素周期表及其应用。
二、认识元素周期表1. 元素周期表的由来与发展元素周期表是根据化学元素原子序数递增和相似性分类的一种方式。
1869年,俄罗斯化学家门捷列夫发现了元素周期律,并提出了第一个版本的元素周期表。
随后,英国化学家门德里夫于1913年根据光谱线排布重新整理了该周期表,并定量地解释了这种规律。
2. 元素周期表的组成与结构现代元素周期表包含了118个已知化学元素,并按照从左至右以及从上至下递增的顺序排列。
每个水平行称为一个“周期”,垂直排列的列称为一个“族”。
同时,通过颜色、字号等标记和分组,使得我们能够更好地理解元素的相关性质和规律。
三、元素周期表中的特殊元素1. 金属、非金属和类金属根据元素周期表的分类,可将化学元素分为金属、非金属和类金属三大类。
其中,金属占据了绝大多数的位置,包括铜、铁、锌等。
非金属主要分布在右上角和右侧边缘,如氢、氧等。
而类金属则位于两者之间。
2. 常见元素及其性质在初中九年级化学教学中,有一些常见的元素需要重点关注。
例如氢(H)是宇宙中最常见的元素之一,具有轻、易燃等特点;氧(O)在自然界中广泛存在,支持着生物的呼吸过程;碳(C)是有机物质的重要组成部分,是生命存在的基础。
四、周期性规律与应用1. 周期性规律的发现与解释通过观察元素周期表,我们可以看到一些明显的周期性规律。
例如原子半径、电离能以及电负性等属性都随着原子序数变化而呈周期性变化。
这些规律的发现与解释为我们理解元素的性质、元素间的反应以及化学方程式等提供了重要线索。
2. 元素周期表在化学反应中的应用元素周期表不仅帮助我们研究和理解单个元素的性质,还用于描述化学反应过程中元素之间的相互转化关系。
人教版九年级化学课件:第三单元 课题3 第2课时 元素符号和元素周期表 (共32张PPT)

(2)元素符号的书写规则。
①由一个字母表示的元素符号要 大
写; ②由两个字母表示的元素符号,第一个字母 大 写,第二个字母 写。 小
(3)元素符号既表示一种元素,还表示这种元
素的一个原子。
2.元素周期表 (1)元素周期表共有7个横行,18个纵行。 每一个横行叫做 ,每一个纵行 一个周期 一个族 叫做 (8、9、10三个纵行组成一个族)。 (2)元素周期表按元素原子核电荷数递增 的顺序给元素编了号,叫做 。 元素周期表上对金属元素、非金属元素用 原子序数 不同的颜色做了分区,并标上了元素的相 对原子质量。 (3)元素周期表是学习和研究化学的重要 工具。
【解析】(1)12号元素是镁元素,其原子核
外有3个电子层,所以在元素周期表中位于第 三周期,镁属于金属元素。(2)16号元素是硫, 其原子最外层有6个电子,在化学反应中易得 到2个电子形成带两个单位负电荷的硫离子。 (3)元素的化学性质跟它的原子的最外层电子 数目关系非常密切,最外层电子数相同的元 素化学性质相似,氟元素和氯元素化学性质 相似的原因是它们的原子的最外层电子数相 同。 (4)同一周期元素之间从左到右,各元素原子
例1 按要求用正确的化学符号表示: (1)2个氮原子; 2N (2)地壳中含量最多的非金属元素; O
【解析】解此题,首先要弄明白各项所要表示的意义, 然后选择恰当的符号表示出来。注意:表示原子个数 应在元素符号前加数字。“2个氮原子”应写为“2N”, 而不能写为“N2”。
O (3)核电荷数是8的元素; (4)食盐中的钠元素。 Na
4.(2016福州)如图3-3-10是钠元素在元素周 期表中的信息和钠原子结构示意图。下列 说法错误的是( ) D A.钠的原子序数为11 B.钠原子核外有3个电子层 C.钠的相对原子质量为22.99 D.化学反应中,钠原子易得电子
人教新课标九年级下册初中化学《元素周期表》_7

第一节元素周期表元素周期表是元素周期律的具体表现形式,学生只有在了解周期表的结构之后,据周期表来学习周期律,学生才有基础。
所以新教材首先介绍周期表。
本节包括三部分内容。
第一部分介绍元素周期表。
门捷列夫是学生已经熟悉的著名化学家,教材开始就登出了他的头像,使学生感到一种亲切感。
教材首先介绍了门捷列夫发现并完善周期表的过程,直到表现给学生的现在的周期表,不但给出了周期表的结构,更培养了学生发展的观点,虽是开头聊聊数语,但作用是具大的。
之后,介绍了表的周期、族;介绍了碱金属元素、卤族元素、O族等知识,与前面学过的知识相对应。
教学时能够充分利用挂图、多媒体技术,充分发挥学生积极主动性,让学生动手数、用眼看、动脑记,形成印象。
第二部分是元素的性质与原子结构。
教材是以前面学过的Na、Cl所在的碱金属元素族、卤族为例,借助实验、图表、引导学生推断出性质与原子结构的关系。
第三部分介绍的是核素。
核素的概念,对于学生进一步学习很重要:从分子→原子的内部结构,使学生对微观世界的理解产生了一个飞跃。
教学时,应充分利用教材提供的现代医学上相关同位素应用的素材,协助学生对核素的了解。
本节教学重点:无素周期表、元素性质与原子结构的关系。
本节教学难点:元素性质与原子结构的关系。
课时安排2课时第1课时三维目标知识与技能1、初步掌握周期表的结构。
2、初步掌握元素性质与原子结构的关系。
过程与方法1、引导学生自主学习:理解周期表的结构。
2、自主探究:探究IA、元素原子结构与性质的关系。
情感、态度与价值观1、通过化学史学习,培养勇于创新、持续探索的科学品质。
2、使学生树立:“科学技术是持续发展变化的”唯物主义观点教学重点1、周期表的结构。
2、碱金属元素的原子结构与性质的关系。
教学难点碱金属元素的原子结构与性质的关系。
教具准备多媒体,三角架、酒精灯、石棉网、镊子、小刀、滤纸、火柴、玻璃片、蓝色钴玻璃、小烧杯、酚酞试液、Na、K等。
教学过程[新课导入][多媒体播放:门捷列夫事迹介绍]师:同学们,你们知道门捷列夫吗?他是干什么的?他的最伟大成就是什么?生(齐声):知道!他是俄国伟大的化学家,他的伟大成就在于绘出了元素周期表,发现了元素周期律。
人教新课标九年级下册初中化学《元素周期表》_38
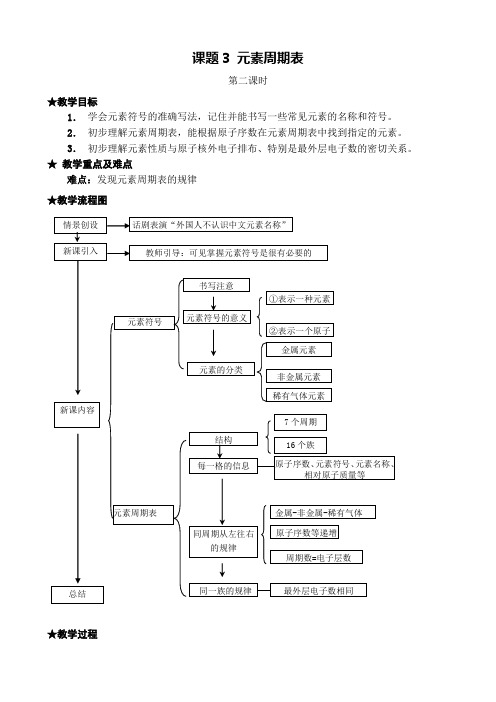
课题3 元素周期表第二课时★教学目标1.学会元素符号的准确写法,记住并能书写一些常见元素的名称和符号。
2.初步理解元素周期表,能根据原子序数在元素周期表中找到指定的元素。
3.初步理解元素性质与原子核外电子排布、特别是最外层电子数的密切关系。
★教学重点及难点难点:发现元素周期表的规律★教学流程图★教学过程★板书设计:第三单元 课题3 元素 第二课时【课堂练习】1.按例子认真并规范地书写下列元素符号(每个写2次)。
2.按要求写出下列符号或符号的意义:(1)氮元素 ;(2)2个氧原子 ;(3)1个钠原子 ; (4)Cl :① ② (5)2P 。
3.元素周期表中的原子序数即是原子的( )A.质子数B.中子数C.和外电子数D.相对原子质量 4.如右图所示是元素周期表中的一种元素,下列相关该元素的说法准确的是( )A.原子序数是13B.它是非金属元素C.它的质量是26.98gD.相对原子质量是135.元素周期表中硅元素的某些信息如图所示,下列相关硅的说法错误..的是( )A.元素符号为“Si ” B.属于金属元素C.原子序数为“14”D.相对原子质量为“28.09”6.元素周期表是化学学习和研究的重要工具。
下图是元素周期表的一部分。
(1)从表中查出硅(Si)元素的相对原子质量为 ; (2)6~11号元素中属于金属的有 (填元素符号); (3)表中不同种元素最本质的区别是 (填序号): A .质子数不同 B .中子数不同 C .相对原子质量不同(4)年前,科学家宣布已人工合成了第116号元素,则此元素的核电荷数为 。
(5)分析元素周期表的上下、左右之间有什么规律?知元素化学性质最稳定的是 (填字母序号,下同)【链接中考】1.(11年武汉市)图甲是某元素在元素周期表中的部分信息,图乙是该元素的一种粒子结构示意图。
(1)该元素的原子的核电荷数为___ ,相对原子质量为____ 。
(2)图乙所示粒子的符号为______ 。
初中九年级化学教案:元素周期表

初中九年级化学教案:元素周期表一、引言元素周期表是化学领域中重要且基础的工具之一,它为我们理解元素性质的规律提供了有效的框架。
本文将介绍初中九年级化学教案中有关元素周期表的内容,包括元素周期表的结构、元素周期表中的趋势规律以及元素的分类等方面。
二、元素周期表的结构1. 元素周期表的布局元素周期表按照元素的原子序数从小到大进行排列,横行称为周期,纵列称为族。
最左侧的是金属,右侧是非金属,中间是过渡金属。
2. 元素周期表的组成元素周期表由元素的符号、原子序数和相对原子质量组成。
三、元素周期表中的趋势规律1. 原子半径的变化原子半径是指从原子核到最外层电子的距离,它在元素周期表中是有规律的。
一般来说,原子半径随着周期数的增加而减小,原因是原子核的电荷增加,吸引外层电子向内部靠拢。
同一周期内,原子半径会随原子序数的增加而增大,这是因为电子层的增加导致了原子半径的增加。
2. 电离能的变化电离能是指从一个原子中移走一个外层电子所需要的能量。
元素周期表中,电离能一般随着周期数的增加而增大,原因是随着电子层数的增加,外层电子与原子核之间的吸引力减弱,使得电子更难被移走。
同一周期内,电离能会随原子序数的增加而减小,这是因为电子层的增加导致外层电子与原子核的距离增大,降低了电子与原子核之间的吸引力。
3. 电负性的变化电负性是原子对电子的吸引力的度量,越强烈的吸引力就意味着越高的电负性。
通常来说,在元素周期表中,电负性随着周期数的增加而增大。
原因是随着电子层数的增加,电子与原子核之间的距离增大,电子更容易被原子核吸引住。
同一周期内,电负性会随原子序数的增加而减小,这是因为增加的电子层使得外层电子与原子核的吸引力减弱。
四、元素的分类1. 金属元素周期表最左侧的区域是金属区,金属具有良好的导电性、导热性和延展性。
金属通常呈固态存在,但汞是金属中的唯一液态元素。
2. 非金属元素周期表最右侧的区域是非金属区,非金属通常不具备金属的导电性和导热性,大多数呈气体或固态存在。
人教新课标九年级下册初中化学《元素周期表》_97
元素周期表教学设计一、教材与学情分析1、教材分析《普通高中化学课程标准(实验)》强调“结合人类探索物质及其变化的历史与化学科学发展的趋势,引导学生进一步学习化学的基本原理和基本方法,形成科学的世界观。
”《元素周期表》是高一化学必修2第一节内容,所有的化学知识都会用到元素周期表,是化学学科的基石。
人教版教材在这个节(第一课时)以元素周期表的演进为线索组织内容,体现了课程标准的这个理念,增强了教材的启发性和探究性,培养了学生分析问题、解决问题的水平。
本节从化学史引入,直接表现元素周期表的结构。
在学生了解一些元素性质和原子结构示意图的基础上,以元素周期表的纵向结构为线索,以碱金属和卤素元素为代表,通过比较原子结构(电子层数、最外层电子数)的异同,突出最外层电子数的相同;并通过实验和事实来表现主族族元素性质的相似性和递变性。
协助学生理解元素性质与核外电子数的关系。
2、学情分析学生在初三对1-20号元素的原子结构和元素周期表都有初步了解,但在学习中较多是用机械记忆的方法,对知识的理解不够深刻,易遗忘,解决实际问题的水平较低。
这个节课是新学期的第一堂化学课,同时这部分内容又比较枯燥,如何激发学生的学习兴趣,如何引导学生从方法的高度来重新审视这个内容应成为教学设计的关键。
二、教学目标1、知识与技能初步掌握元素周期表的结构,以及周期、族等概念;能归纳出周期、主族序数与原子结构的关系;初步学会使用元素周期表的相关信息。
2、过程与方法通过亲自动手编排元素周期表,能提升抽象思维水平和逻辑思维水平;通过观察原子结构,能揭示元素周期律,并提升分析和推理水平。
3、情感、态度与价值观通过亲自编排元素周期表养成求实、严谨和创新的优良品质,并产生强烈的学习兴趣;通过元素周期表是元素周期律的具体表现形式的学习,能实行“具体和抽象”这个科学方法的思考与实践;通过学习化学史知识,能理解到“人类对客观存有的事物的理解是随着社会和科学的发展持续发展的,任何科学的发现都需要长期不懈地努力,才能获得成功”这样的道理。
部编新人教版教材化学九年级下册必背元素周期表(17个)
部编新人教版教材化学九年级下册必背元素周期表(17个)本文档是关于部编新人教版教材化学九年级下册必背元素周期表的详细内容。
下面将列出这17个元素,以供参考。
1. 氢 (H) - 原子序数为1,是最轻的元素,也是宇宙中最丰富的元素之一。
2. 氦 (He) - 原子序数为2,是一种稀有气体,常用于填充气球和制冷。
3. 锂(Li) - 原子序数为3,是一种金属元素,常用于制造电池。
4. 铍 (Be) - 原子序数为4,是一种硬而轻的金属,常用于合金制造。
5. 硼 (B) - 原子序数为5,是一种非金属元素,常用于制作玻璃和化学试剂。
6. 碳 (C) - 原子序数为6,是生命的基础,存在于许多有机物中。
7. 氮 (N) - 原子序数为7,是空气中最主要的成分之一。
8. 氧 (O) - 原子序数为8,是空气中最丰富的元素,也是生命所需的。
9. 氟 (F) - 原子序数为9,是一种强氧化剂,常用于制造氟化物。
10. 氖 (Ne) - 原子序数为10,是一种稀有气体,常用于照明。
11. 钠 (Na) - 原子序数为11,是一种金属元素,常用于制造钠灯。
12. 镁 (Mg) - 原子序数为12,是一种轻金属,常用于合金制造。
13. 铝 (Al) - 原子序数为13,是一种常见的金属元素,常用于制造铝制品。
14. 硅 (Si) - 原子序数为14,是地壳中最常见的元素之一,也是电子技术的重要材料。
15. 磷 (P) - 原子序数为15,是生物体内不可缺少的元素之一,常用于制造化学肥料。
16. 硫 (S) - 原子序数为16,是一种常见的非金属元素,常用于制造硫酸等化学品。
17. 氯 (Cl) - 原子序数为17,是一种强氧化剂和消毒剂,常用于消毒和水处理。
希望这份元素周期表能够帮助您学习化学的基础知识,并顺利通过考试。
如需进一步了解每个元素的性质和应用,请参考相关教材。
祝您学习顺利!。
人教版九年级下册化学:元素周期表
3 11 Na
12 M g
Ⅲ B
3
Ⅳ B
4
Ⅴ B
5
Ⅵ B
6
Ⅶ B
7
Ⅷ
89
Ⅰ
10
B
11
Ⅱ B
12
13 Al
14 Si
15 P
16 S
17 18 Cl Ar
4 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 K Ca Sc Ti V Cr M Fe Co Ni C Zn G Ge As Se Br Kr
Bh Hs
10 8
M t
11 0
Ds
11 1
Rg
11 2
C n
11 3 Uu t
11 4
Fl
11 5 Uu p
11 6 Lv
11 7 Uu s
11 8 Uu o
镧 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
系 La Ce Pr N P S Eu G Tb Dy H Er T Y Lu
A.属于金属元素 B.原子的核电荷数是13 C.相对原子质量是26. 982 g D.在化学反应中,原子易失去电子
6、右图为元素周期表第三周期的局部。据此判断下列
说A法.中它正们确都的属是于(金C属)元素
B.1个铝原子的质量是26.98g 11 12 13 14
C.硅元素的原子序数为14
Na Mg Al Si
10
B
11
B Al 12
Si
P
S Cl Ar
19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
人教版九年级下册化学:元素周期表(3)
• (均填化学式)
(四)、框图式推断题
• 1,实验室有一杯无色透明的废液,废液中的溶质为NaOH、 H2SO4、Na2SO4、HCl、Cu(NO3)2五种物质中的两 种,为了确定其溶质的组成,进行如下实验(假设每步均 恰好完全反应).
• 7、蓝色沉淀:氢氧化铜 • 8、红褐色沉淀:氢氧化铁 • 9、浅绿色沉淀: 氢氧化亚铁
10、白色沉淀(可溶于酸):碳酸钙、碳酸钡、氢氧化镁、氢氧化锌 • 11、白色沉淀(不溶于酸):硫酸钡、氯化银 (二)、液体的颜色
11、蓝色溶液:硫酸铜溶液,氯化铜溶液,硝酸铜溶液 12、浅绿色溶液:硫酸亚铁溶液,氯化亚铁溶液,硝酸亚铁溶液 13、黄色溶液:硫酸铁溶液,氯化铁溶液,硝酸铁溶液 14、紫红色溶液:高锰酸钾溶液 15、紫色溶液:石蕊溶液 (三)、气体的颜色 16、红棕色气体:二氧化氮 17、黄绿色气体:氯气 18、无色气体:氧气,氮气,氢气,二氧化碳,一氧化碳,二氧化硫,氯化氢气体等大多数气体
• 试推断:(写出化学式或离子符号) 溶液甲是______,沉淀B是______,溶液乙是______, 沉淀F是______,滤液E中的溶质是______,滤液H中 一定含有的阴离子是______.
• 这些物质的化学式分别是X
Y
W
Z __
• 2、将某暗紫色固体粉末A加热,可产生无色气体B,同时生成一种黑 色固体C和另一种固体物质D。黑色固体C通常可用于加热氯酸钾制氧 气时的催化剂。将一种淡黄色固体E在无色气体B中燃烧,放出刺激 性气体F。 回答:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第Ⅷ族: 第8、9、10三个纵行为一个族
0族: 稀有气体元素,化学性质不活泼,
化合价一般为0
七主七副0和八
1、主族元素的族序数后标 A ,如ⅠA 副族元素的族序数后标 B ,如 ⅠB
2、在元素周期表里,有 7 个主族, 7个 副族, 1 个Ⅷ族, 1 个零族。
周期 长周期
第4周期:18 种元素 19~36号 第5周期:18 种元素 37~54号
(横行)
第6周期:32 种元素 55~86号
镧57La – 镥71Lu 共15 种元素称镧系元素
不完全周期 第7周期:26种元素 87~(118)
锕89Ac – 铹103Lr 共15 种元素称锕系元素
1、每一周期都是从 金属元素开始,逐渐 过渡到 非金属元素,最后以 稀有气体元 素结 束。
表
主族 共 7 个主族,包括短周期和长周期元素
族
(18个纵行16 个族)
副族 共 7 个副族,只包括在长周期中
第VIII族 包括第8、9、10 纵行
0族
稀有气体元素
周
期I
A
主元素周期表的结构
0
1 H II A
2 Li Be
族副 族
3 Na
M g
III IV BB
V VI VII BBB
VIII
III IV V VI VI He A A A A IA
§元素周期表
第二课时:元素周期表的结构
科学史话:第一张元素周期表
1869年门捷列夫在继承和分析了前人工作 的基础上,对大量实验事实进行了订正、分
析和概括,作出了10年艰苦卓绝的努力, 系统地研究了元素的性质,按照相对 原子质量的大小,将化学性质相似的 元素放在一个纵行,将元素排成序, 终于发现了元素周期律…………成功
3、主族元素的族序数等于原子的最外层电子数
总结:
短周期
元 周期
素
(7个) 长周期周期来自第 1周期 第 2周期
第 3周期 第 4周期
第 5周期 第 6周期 第 7周期
—— 2 种 —— 8 种 —— 8 种 —— 18 种
—— 18 种 —— 32 种 —— 26 种
三七 短主 三七
长副
一零 不和 全八
1、有7个(横行 ),18个(纵列) 2 、每个横行叫一个 周期,每个纵列 叫一个族 (8、9、10共成一个族)
(一) 周期(横行) 具有相同的电子层数而又按原子序数递 增的顺序排列的一系列元素,称为一个 周期。周期序数 = 电子层数
周期 : 三短三长一不全
短周期
第1周期:2 种元素 1~2号 第2周期:8 种元素 3~10号 第3周期:8 种元素 11~18号
B C N O F Ne
IB
II B
Al Si
P
S
Cl Ar
4 K Ca 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36
5 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
6 55
56
57 -
72
▪ 85砹(ài)86 氡(dōng)87钫(fāng) 88镭(léi)89 锕(ā) 90钍(tǔ)91 镤(pú) 92铀(yóu) 93镎 (ná)94 钚(bù)95 镅(méi) 96锔(jú)
▪ 97 锫(péi)98 锎(kāi) 99锿(āi) 100镄(fèi) 101 钔(mén) 102锘(nuò)103 铹(láo)104 钅卢(lú) 105钅杜(dù)106钅喜(xǐ)
73
74
75
76
77
78
79
80
81
82
83
84
85
86
71
7 87
88
89103
104
105
106
107 108
109
110
111
112
过渡元素
镧 系 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71
锕 系
89 90 91 92 93 94 95 96 97 98 99 100 101 102 103
▪ 37铷(rú) 38锶(sī) 39钇(yǐ) 40锆(gào) 41铌 (ní)42 钼(mù) 43锝(dé) 44钌(liǎo) 45铑 (lǎo) 46钯(bǎ) 47银(yín) 48镉(gé)
▪ 49铟(yīn) 50锡(xī) 51锑(tī) 52碲(dì)53 碘 (diǎn) 54氙(xiān)55铯(sè) 56钡(bèi) 57镧 (lán) 58铈(shì) 59镨(pǔ)60 钕(nǚ)
2、元素原子的 核电荷数为原子序数 3、周期序数和原子电子层 数相同
(二)
主族(A): 7个主族
在罗马数字表示的族 序数后面标“A”字。
族
18个纵行 16 个 族
由短周期元素和长周期元素共同构成的族
ⅠA. ⅡA . ⅢA. ⅣA. ⅤA . ⅥA . ⅦA
副族(B): 7个副族 在族序数后标“B”字 完全由长周期构成的族
▪ 61 钷(pǒ) 62钐(shān) 63铕(yǒu)64 钆(gá) 65铽(tè) 66镝(dī) 67钬(huǒ)68 铒(ěr) 69铥 (diū)70 镱(yì) 71镥(lǔ) 72铪(hā)
▪ 73 钽(tǎn) 74钨(wū) 75铼(lái) 76锇(é) 77 铱(yī) 78铂(bó)79 金(jīn) 80汞(gǒng) 81铊 (tā) 82铅(qiān)83 铋(bì) 84钋(pō)
▪ 107钅波(bō)108 钅黑(hēi)109 钅麦 (mài)110 钅达(dá) 111钅仑(lún)
元素周期表的意义:
学习和研究化学的重要工具
(1)为寻找新元素提供了理论依据
(2)由于元素周期表中位置越接近 的元素化学性质越相似,启发人们 在元素周期表的一定区域内寻找新 物质(如半导体材料、催化剂、农 药)
勇敢挑战: 尝试背诵元素周期表
(结合导入时视频歌曲) 附:化学元素周期表 112个读音
▪ 1氢(qīng) 2氦(hài) 3锂(lǐ) 4铍(pí)5 硼 (péng) 6碳(tàn) 7氮(dàn)8 氧(yǎng) 9氟 (fú)10 氖(nǎi)11钠(nà) 12镁(měi) 13铝 (lǚ)14 硅(guī)15 磷(lín) 16硫(liú) 17氯 (lǜ) 18氩(yà)19钾(jiǎ) 20钙(gài) 21钪 (kàng) 22钛(tài)23 钒(fán) 24铬(gè) 25 锰(měng) 26铁(tiě) 27钴(gǔ)28 镍 (niè)29 铜(tóng)30 锌(xīn) 31镓(jiā) 32 锗(zhě) 33砷(shēn) 34硒(xī) 35溴(xiù)36 氪(kè)
舒城县南港镇中心学黄祖政
1314920
√
猜歌名及视频中最后四个字
歌名:元素周期表之歌
视频中最后四个字:门捷列夫
元素名称及符号填成语
注:成语或词语中被填的字可与元 素名称谐音。 看谁又快又准确(每空5分)
自我评价( )分
( H )举妄动,( He)群之马,笑( Li) 藏刀,雪中送( C ),( N )泊明志, 无关痛( O ),借花献( F ),( Ne)油 小生,说时迟、( Na )时快,十全 十( Mg),( Al)教不改,( Si)兔赛跑, 聪明( )俐P,高山( )水S,花红柳 ( ),C(l )A口r 无言,丢盔弃( ), 功K高( )世,C与a 虎谋( ) 铍 三(硼)四友
元素化合价的变化规律
正价渐高,负价绝对值渐低
结论:随着原子序数的递增,元素
化合价呈现周期性变化。
随着原子序数的递增
元素原子的核外电子排布呈现周期性变化 元素原子半径呈现周期性变化 元素化合价呈现周期性变化
元素的性质随着元素原子 序数的递增而呈现周期性的 变化称元素周期律,用表格 表达元素周期律的具体形式 即为元素周期表。
1-18号元素原子结构示意图
最外层电子数
原子序数与最外层电子数直方图
10
8
6
4
2
0
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
原子序数
结论:随着原子序数的递增,元素原子 的最外层电子排布呈现 周期性 变化。
原子半径的变化规律
半径横小竖大
结论:随着原子序数的 递增,元素原子半径呈 现周期性变化。
地对元素进行了科学分类.他制出第一张元 素周期表。
现行元素周期表
(1)排序依据:原子的核电荷数
(2)原子序数:按照元素在周期表中的顺序 给元素编号
(3)结构特点:
以1-18号元素为例
1-18号元素原子结构示意图
特点:
1.每一横行原子 电子层数相同 2.每一纵行原子最外层电子数相同
仔细观察元素周期表,你能发现什么 规律?
