100个常见高中化学方程式必修1
高中化学必修一二化学方程式汇总

高中化学必修一二化学方程式汇总一、必修一化学方程式1. 钠及其化合物- 钠与氧气常温反应:4Na + O_{2}=2Na_{2}O- 钠在氧气中燃烧:2Na + O_{2}{点燃}{=!=!=}Na_{2}O_{2}- 钠与水反应:2Na + 2H_{2}O = 2NaOH+ H_{2}↑- 过氧化钠与水反应:2Na_{2}O_{2}+2H_{2}O = 4NaOH + O_{2}↑- 过氧化钠与二氧化碳反应:2Na_{2}O_{2}+2CO_{2}=2Na_{2}CO_{3}+O_{2} - 向碳酸钠溶液中滴加少量盐酸:Na_{2}CO_{3}+HCl = NaHCO_{3}+NaCl - 向碳酸钠溶液中滴加过量盐酸:Na_{2}CO_{3}+2HCl = 2NaCl +H_{2}O+CO_{2}↑- 碳酸氢钠受热分解:2NaHCO_{3}{}{=!=!=}Na_{2}CO_{3}+H_{2}O + CO_{2}↑- 碳酸氢钠与氢氧化钠反应:NaHCO_{3}+NaOH = Na_{2}CO_{3}+H_{2}O2. 铝及其化合物- 铝与氧气反应:4Al + 3O_{2}=2Al_{2}O_{3}- 铝与盐酸反应:2Al+6HCl = 2AlCl_{3}+3H_{2}↑- 铝与氢氧化钠溶液反应:2Al + 2NaOH+2H_{2}O = 2NaAlO_{2}+3H_{2}↑ - 氧化铝与盐酸反应:Al_{2}O_{3}+6HCl = 2AlCl_{3}+3H_{2}O- 氧化铝与氢氧化钠溶液反应:Al_{2}O_{3}+2NaOH = 2NaAlO_{2}+H_{2}O - 氢氧化铝的制备(向氯化铝溶液中滴加氨水):AlCl_{3}+3NH_{3}· H_{2}O = Al(OH)_{3}↓+3NH_{4}Cl- 氢氧化铝与盐酸反应:Al(OH)_{3}+3HCl = AlCl_{3}+3H_{2}O- 氢氧化铝与氢氧化钠溶液反应:Al(OH)_{3}+NaOH = NaAlO_{2}+2H_{2}O3. 铁及其化合物- 铁与氧气反应:3Fe + 2O_{2}{点燃}{=!=!=}Fe_{3}O_{4}- 铁与氯气反应:2Fe+3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 铁与盐酸反应:Fe + 2HCl = FeCl_{2}+H_{2}↑- 铁与硫酸铜溶液反应:Fe + CuSO_{4}=FeSO_{4}+Cu- 氯化亚铁与氯气反应:2FeCl_{2}+Cl_{2}=2FeCl_{3}- 氯化铁与铁反应:2FeCl_{3}+Fe = 3FeCl_{2}- 氯化铁与铜反应:2FeCl_{3}+Cu = 2FeCl_{2}+CuCl_{2}4. 硅及其化合物- 硅与氧气反应:Si + O_{2}{}{=!=!=}SiO_{2}- 硅与氢氧化钠溶液反应:Si + 2NaOH + H_{2}O=Na_{2}SiO_{3}+2H_{2}↑ - 二氧化硅与氢氧化钠溶液反应:SiO_{2}+2NaOH = Na_{2}SiO_{3}+H_{2}O - 二氧化硅与氢氟酸反应:SiO_{2}+4HF = SiF_{4}↑+2H_{2}O- 硅酸的制备(硅酸钠溶液与盐酸反应):Na_{2}SiO_{3}+2HCl =H_{2}SiO_{3}↓+2NaCl5. 氯及其化合物- 氯气与金属铁反应:2Fe + 3Cl_{2}{点燃}{=!=!=}2FeCl_{3}- 氯气与金属铜反应:Cu+Cl_{2}{点燃}{=!=!=}CuCl_{2}- 氯气与氢气反应:H_{2}+Cl_{2}{点燃}{=!=!=}2HCl- 氯气与水反应:Cl_{2}+H_{2}O = HCl + HClO- 次氯酸光照分解:2HClO{光照}{=!=!=}2HCl+O_{2}↑- 氯气与氢氧化钠溶液反应:Cl_{2}+2NaOH = NaCl + NaClO + H_{2}O- 氯气与氢氧化钙反应制漂白粉:2Cl_{2}+2Ca(OH)_{2}=CaCl_{2}+Ca(ClO)_{2}+2H_{2}O6. 硫及其化合物- 硫与氧气反应:S+O_{2}{点燃}{=!=!=}SO_{2}- 二氧化硫与水反应:SO_{2}+H_{2}O = H_{2}SO_{3}- 二氧化硫与氧气反应:2SO_{2}+O_{2}{催化剂}{underset{}{⇌}}2SO_{3} - 三氧化硫与水反应:SO_{3}+H_{2}O = H_{2}SO_{4}- 铜与浓硫酸反应:Cu + 2H_{2}SO_{4}(浓){}{=!=!=}CuSO_{4}+SO_{2}↑+2H_{2}O- 碳与浓硫酸反应:C + 2H_{2}SO_{4}(浓){}{=!=!=}CO_{2}↑+2SO_{2}↑+2H_{2}O7. 氮及其化合物- 氮气与氧气反应:N_{2}+O_{2}{放电或高温}{=!=!=}2NO- 一氧化氮与氧气反应:2NO+O_{2}=2NO_{2}- 二氧化氮与水反应:3NO_{2}+H_{2}O = 2HNO_{3}+NO- 工业合成氨:N_{2}+3H_{2}{催化剂}{underset{高温高压}{⇌}}2NH_{3}- 氨气与水反应:NH_{3}+H_{2}O = NH_{3}· H_{2}O- 氨气与氯化氢反应:NH_{3}+HCl = NH_{4}Cl- 氯化铵受热分解:NH_{4}Cl{}{=!=!=}NH_{3}↑+HCl↑- 碳酸氢铵受热分解:NH_{4}HCO_{3}{}{=!=!=}NH_{3}↑+H_{2}O↑+CO_{2}↑- 硝酸铵与氢氧化钠反应:NH_{4}NO_{3}+NaOH{}{=!=!=}NH_{3}↑+NaNO_{3}+H_{2}O- 铜与稀硝酸反应:3Cu + 8HNO_{3}(稀)=3Cu(NO_{3})_{2}+2NO↑+4H_{2}O- 铜与浓硝酸反应:Cu + 4HNO_{3}(浓)=Cu(NO_{3})_{2}+2NO_{2}↑+2H_{2}O二、必修二化学方程式1. 元素周期律相关反应(以碱金属和卤素为例)- 锂与氧气反应:4Li + O_{2}=2Li_{2}O- 钾与水反应:2K+2H_{2}O = 2KOH + H_{2}↑- 氯气与溴化钠溶液反应:Cl_{2}+2NaBr = 2NaCl+Br_{2}- 溴与碘化钾溶液反应:Br_{2}+2KI = 2KBr+I_{2}2. 化学反应与能量- 氢气燃烧:2H_{2}+O_{2}{点燃}{=!=!=}2H_{2}O(放热反应)- 碳酸钙受热分解:CaCO_{3}{}{=!=!=}CaO + CO_{2}↑(吸热反应)3. 有机化学基础(必修部分)- 甲烷燃烧:CH_{4}+2O_{2}{点燃}{=!=!=}CO_{2}+2H_{2}O- 甲烷与氯气发生取代反应(以一氯取代为例):CH_{4}+Cl_{2}{光照}{=!=!=}CH_{3}Cl+HCl- 乙烯燃烧:C_{2}H_{4}+3O_{2}{点燃}{=!=!=}2CO_{2}+2H_{2}O- 乙烯与溴水反应:C_{2}H_{4}+Br_{2}to C_{2}H_{4}Br_{2}- 乙烯与水加成反应:C_{2}H_{4}+H_{2}O{催化剂}{to}C_{2}H_{5}OH- 苯燃烧:2C_{6}H_{6}+15O_{2}{点燃}{=!=!=}12CO_{2}+6H_{2}O- 苯与液溴反应:C_{6}H_{6}+Br_{2}{FeBr_{3}}{=!=!=}C_{6}H_{5}Br+HBr - 乙醇燃烧:C_{2}H_{5}OH + 3O_{2}{点燃}{=!=!=}2CO_{2}+3H_{2}O - 乙醇与钠反应:2C_{2}H_{5}OH + 2Nato 2C_{2}H_{5}ONa+H_{2}↑- 乙醇的催化氧化:2C_{2}H_{5}OH + O_{2}{Cu或Ag}{underset{}{to}}2CH_{3}CHO + 2H_{2}O- 乙酸与乙醇的酯化反应:CH_{3}COOH+C_{2}H_{5}OH{浓硫酸}{underset{}{⇌}}CH_{3}COOC_{2}H_{5}+H_{2}O。
高中化学必修一方程式大全

高中化学必修一方程式大全在高中化学的学习中,方程式是必不可少的。
方程式是描述化学反应的重要工具,它可以让我们更加直观地了解化学反应的过程和原理。
下面是高中化学必修一中的方程式大全,供大家参考。
1. 氧化铁的生成反应:4Fe + 3O2 → 2Fe2O32. 碳酸钙分解反应:CaCO3 → CaO + CO23. 氢氧化钠与盐酸中和反应:NaOH + HCl → NaCl + H2O4. 硝酸与铜的反应:3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O5. 氢氧化铜的生成反应:Cu + 2KOH + H2O → Cu(OH)2 + 2KOH6. 氢氧化铁的生成反应:Fe + 2KOH + H2O → Fe(OH)2 + 2KOH7. 氢氧化铝的生成反应:Al + 3KOH + 3H2O → Al(OH)3 + 3KOH8. 氢化铝反应:Al + 3HCl → AlCl3 + 3H29. 氯化铜的生成反应:Cu + 2HCl → CuCl2 + H210. 硝酸银与氯化钠反应:AgNO3 + NaCl → AgCl + NaNO311. 氯气与钠的反应:2Na + Cl2 → 2NaCl12. 硫酸铜的生成反应:Cu + H2SO4 → CuSO4 + H213. 羟基化钠的反应:2Na + 2H2O → 2NaOH + H214. 氧化钠的生成反应:4Na + O2 → 2Na2O15. 氧化铜的生成反应:2Cu + O2 → 2CuO以上是高中化学必修一中的方程式大全,希望对大家的学习有所帮助。
同时也提醒大家,在学习化学方程式时要注意掌握反应物和生成物的比例关系,以及反应条件和反应类型等重要知识点。
必修一化学必背方程式

必修一化学必背方程式
1. 氧化还原反应方程式:
- 钠与氯气生成氯化钠:2Na + Cl2 -> 2NaCl
- 锌与盐酸生成氯化锌和氢气:Zn + 2HCl -> ZnCl2 + H2
- 铁与硫酸生成硫酸亚铁和氢气:Fe + H2SO4 -> FeSO4 + H2
2. 酸碱反应方程式:
- 盐酸与氢氧化钠生成氯化钠和水:HCl + NaOH -> NaCl + H2O
- 硫酸与氢氧化钠生成硫酸钠和水:H2SO4 + 2NaOH -> Na2SO4 + 2H2O
- 硝酸与氨水生成硝酸铵和水:HNO3 + NH3 -> NH4NO3 + H2O
3. 燃烧反应方程式:
- 甲烷燃烧生成二氧化碳和水:CH4 + 2O2 -> CO2 + 2H2O
- 乙醇燃烧生成二氧化碳和水:C2H5OH + 3O2 -> 2CO2 + 3H2O
- 丙酮燃烧生成二氧化碳和水:C3H6O + 4O2 -> 3CO2 + 3H2O
4. 水解反应方程式:
- 碳酸钙水解生成碳酸氢钙和水:CaCO3 + H2O -> Ca(HCO3)2
- 氨水水解生成氨和水:NH4OH + H2O -> NH3 + H2O2
5. 沉淀反应方程式:
- 银离子与氯离子生成氯化银沉淀:Ag+ + Cl- -> AgCl
- 铜离子与硫酸生成硫酸铜沉淀:Cu2+ + SO4^2- -> CuSO4
这些方程式是化学必修一课程中的基础内容,需要掌握并理解其反应原理和反应条件。
高中化学必修1化学方程式总结
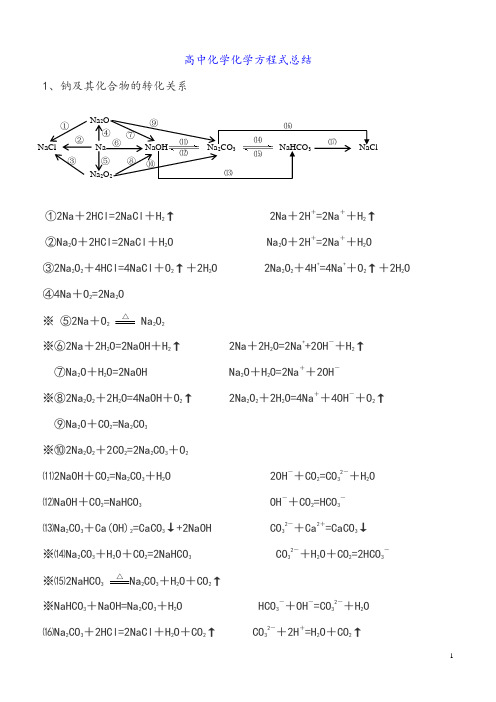
高中化学化学方程式总结1、钠及其化合物的转化关系①2Na +2HCl=2NaCl +H 2↑ 2Na +2H +=2Na ++H 2↑ ②Na 2O +2HCl=2NaCl +H 2O Na 2O +2H +=2Na ++H 2O ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O 2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ④4Na +O 2=2Na 2O ※ ⑤2Na +O 2△Na 2O 2※⑥2Na +2H 2O=2NaOH +H 2↑ 2Na +2H 2O=2Na ++2OH -+H 2↑ ⑦Na 2O +H 2O=2NaOH Na 2O +H 2O=2Na ++2OH - ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑ 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O 2OH -+CO 2=CO 32-+H 2O ⑿NaOH +CO 2=NaHCO 3 OH -+CO 2=HCO 3-⒀Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH CO 32-+Ca 2+=CaCO 3↓ ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3 CO 32-+H 2O +CO 2=2HCO 3- ※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑※NaHCO 3+NaOH=Na 2CO 3+H 2O HCO 3-+OH -=CO 32-+H 2O ⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ CO 32-+2H +=H 2O +CO 2↑NaCl Na NaOH Na 2CO 3 NaHCO 3 NaClNa 2ONa 2O 2①② ③ ⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃⒄ ④⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑ 补充:①石灰水中加入少量NaHCO 3 :Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO3-=CaCO 3↓+H 2O ②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O2、铝及其化合物的转化关系①2Al +6HCl=2AlCl 3+3H 2↑ 2Al +6H +=2Al 3++3H 2↑ ②4Al +3O 2△2Al 2O 3※ ③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ 2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O ※ Al 2O 3+6H +=2Al 3++3H 2O ※ ⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O Al 2O 3+2OH -=2AlO 2-+H 2O ※⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4Cl Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+ ※⑦Al(OH)3+3HCl=AlCl 3+3H 2O Al(OH)3+3H +=Al 3++3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl AlO 2-+H ++H 2O=Al(OH)3↓ 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3 AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3- ※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O Al(OH)3+OH -= AlO 2-+2H 2OAl Al 2O 3 A l (O H )3 KAl(SO 4)2NaAlO 2AlCl 3① ② ③④ ⑤ ⑥⑦⑧ ⑨⑩⑾⑿☆⑾Al 3++3H 2O Al(OH)3胶体+3H + ( 明矾净水)Al 3++4OH -= AlO 2-+2H 2O⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O 3、铁及其化合物的转化关系①Fe 3O 4+4CO△3Fe +4CO 2 ※②3Fe +4H 2O(g)高温Fe 3O 4+4H 2③Fe +2HCl=FeCl 2+H 2↑ Fe +2H +=Fe 2++H 2↑ 3Fe +2O 2点燃Fe 3O 4 ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 2Fe 2++Cl 2 = 2Fe 3++2Cl - ※⑥Fe +2FeCl 3 = 3FeCl 2 Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl Fe 2++2OH -= Fe(OH)2↓ ⑧Fe(OH)2+2HCl = FeCl 2+2H 2O Fe(OH)2+2H += Fe 2++2H 2O ※ ⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 白色沉淀迅速变成灰绿色,最后变成红褐色 ※ ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl Fe 3++3OH -= Fe(OH)3↓ ⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe(OH)3+3H += Fe 3++3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O Fe 2O 3+6H += 2Fe 3++3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KCl Fe 3++3SCN -= Fe(SCN)3 4、硅及其化合物的转化关系Fe 3O 4 Fe FeCl 2 Fe(OH)2Fe(SCN)3 FeCl 3 Fe(OH)3 Fe 2O 3①②③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩⑾⑿ ⒁ ⒀①Si +O 2 △SiO 2②SiO 2+2C高温Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃) ④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO 高温CaSiO 3 SiO 2+CaCO 3高温CaSiO 3+CO 2↑※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+2OH -= SiO 32-+H 2O SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 32-+2H += H 2SiO 3↓ ※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3 SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3 SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3- ⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O H 2SiO 3+2OH -= SiO 32-+2H 2O ⑨H 2SiO 3△H 2O +SiO 25、氯及其化合物的转化关系Na 2SiO 3SiF 4SiSiO 2H 2SiO 3CaSiO 3①②③ ④ ⑤ ⑥⑦ ⑧⑨HClOHCl Cl 2 NaClOCa(ClO)2①②④⑤ ⑥⑦⑧ ⑨⑩①2Fe +3Cl 2点燃2FeCl 3 ②Cu +Cl 2点燃CuCl 2③2FeCl 3+Cu = 2FeCl 2+CuCl 2 2Fe 3++Cu = 2Fe 2++Cu 2+ ④H 2+Cl 2 2HCl ※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2O MnO 2+4H ++2Cl -△Mn 2++Cl 2↑+2H 2O※⑥Cl 2+H 2O = HCl +HClO Cl 2+H 2O = H ++Cl -+HClO※⑦2HClO 2HCl +O 2↑ 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O Cl 2+2OH -= Cl -+ClO -+H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2O 工业制漂白粉 ⑩(漂白粉的漂白原理)※ Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HclO ※ Ca 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO或Ca(ClO)2+2HCl = CaCl 2+2HclO ClO -+H += HClO向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClO ClO -+H 2O +CO 2 = HCO 3-+HClO 6、硫及其化合物的转化关系①S +O 2点燃SO 2 ②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2催化剂 加热2SO 3 ④SO 3+H 2O = H 2SO 4⑤SO 2+CaO△CaSO 3点燃或光照 光照 光照① ⑤S SO 2 SO 3 H 2SO 4CaSO 3 CaSO 4② ③④ ⑥ ⑦ ⑧氯水⑨Cu⑩C或SO 2+Ca(OH)2 = CaSO 3↓+H 2O SO 2+Ca 2++2OH -=CaSO 3↓+H 2O ⑥SO 3+CaO = CaSO 4 SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl SO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl - ⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2O Cu +2H 2SO 4(浓)△Cu 2++SO 42-+SO 2↑+2H 2O ※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系※①N 2+O 2 2NO ※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO 以上三个反应为“雷雨发庄稼”原理扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 上面两个反应主要用于气体溶于水时的计算 ※ ④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O ※ Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O C +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2O 浓硝酸见光易变黄的原因※ ⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO↑+4H 2O①⑨ ⑧⑦⑥ ④ ③⑤N 2 NH 3 NH 4ClNO NO 2 HNO 3② ③高温或放电光照※3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O2NH3 合成氨反应是人工固氮的主要途径⑥N2+3H2催化剂高温高压⑦NH3+HCl = NH4Cl NH3+H+= NH4+(水溶液中)氨气与酸均能反应生成铵盐,且与挥发性酸如(浓HCl、浓HNO3)相遇时空气中有白烟⑧NH4Cl △ NH3↑+HCl↑补充:NH4HCO3△NH3↑+H2O+CO2↑铵盐受热都易分解,但并不是所有的铵盐都分解出氨气,如NH4NO3、(NH4)2SO4※⑧NH4Cl+NaOH △ NaCl+NH3↑+H2ONH4++OH-△NH3↑+H2O(所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
高中化学必修一公式大总结

高中化学必修一公式大总结( 全)1、金属钠投到硫酸铜溶液中的化学方程式:2Na+2H2O=2NaOH+H2↑CuSO4+2NaOH=Cu(OH) 2↓+ Na2SO4(先冒气泡再蓝色沉淀)2、金属钠与盐酸的化学方程式:2Na+2HCl=2NaCl+H2↑3、氢氧化钠方在空气中变质的化学方程式:2NaOH+CO2=Na2CO3+H2ONa2CO3+10H2O=Na2CO3·10H2O4、金属钠放在空气的氧化:4Na+O2=2Na2O (银白色变暗)5、金属钠在空气燃烧:2Na+O2=Na2O2 Δ(生成淡黄色粉末)6、过氧化钠在空气中变质:2Na2O2+2H2O=4NaOH+O2↑2Na2O2+2CO2=2Na2CO3+O27、过氧化钠与酸反应:2Na2O2+4HCl=4NaCl+2H2O+O2↑8、氧化钠在空气中变质:Na2O+H2O=2NaOHNa2O+CO2=Na2CO39、氧化钠与酸反应:Na2O+2HCl=2NaCl+H2O10、氧化钠在空气中燃烧:2Na2O+O2=2Na2O2 Δ211、氯气与铁的反应方程式:2Fe+3Cl2=2FeCl3 点燃(红棕色的烟)12、氯气与铜的反应方程式:Cu+Cl2=CuCl2 点燃(棕黄色的烟)13、氯气与氢气的反应方程式:Cl2+H2=2HCl 点燃(苍白色火焰,生成白雾)14、氯气与钠单质的反应方程式:2Na+Cl2=2NaCl 点燃(淡黄色的烟)15、工业制漂白粉:2Cl2+2Ca(OH) 2=CaCl2+Ca(ClO) 2+2H2O (为Ca(OH) 2石灰乳)16、氯气与水的方程式:Cl2+H2O=HCl+HClO17、消毒、处理多余的氯气、制84消毒液:Cl2+2NaOH=NaClO+NaCl+H2O18、次氯酸钠在空气中变质:2NaClO+CO2+H2O=2HClO+Na2CO3NaClO+CO2+H2O=HClO+NaHCO319、漂白粉在空气中变质:Ca(ClO) 2+CO2+H2O=CaCO3↓+2HClO20、次氯酸见光分解:2HClO=2HCl+O2↑ 光照221、氯化铁通入沸水中制氢氧化铁胶体:FeCl3+3H2O=Fe(OH) 3 (胶体)+3HCl Δ22、碳酸钠与盐酸的反应方程式:Na2CO3+2HCl(过)=2NaCl+CO2↑+H2ONa2CO3+HCl(少)=NaHCO3+NaCl23、碳酸氢钠与盐酸的反应方程式:NaHCO3+HCl=NaCl+H2O+CO2↑24、碳酸氢钠与碱反应方程式:NaHCO3+NaOH=Na2CO3+H2ONaHCO3+Ca(OH) 2=2H2O+Na2CO3+CaCO3↓25、碳酸氢钠受热易分解:2NaHCO3=Na2CO3+CO2↑+H2O Δ26、二氧化碳通入碳酸钠溶液中:Na2CO3+CO2+H2O=2NaHCO327、浑浊石灰水变澄清:CO2+CaCO3+H2O=Ca(HCO3) 228、碳酸氢钙受热分解:Ca(HCO3) 2= CO2↑+CaCO3+H2O Δ29、氢氧化亚铁在空气中变质:4Fe(OH) 2+O2+2H2O=4Fe(OH) 3(由白色沉淀变成灰绿色再变成红褐色沉淀)30、保存氯化亚铁溶液:2FeCl3+Fe=3FeCl2 2Fe3++Fe=3Fe2+331、制造印刷线路板:2FeCl3+Cu=2FeCl2+CuCl22Fe3++Cu=2Fe2++Cu2+32、2FeCl2+Cl2=2FeCl32Fe2++Cl2=2Fe3++2Cl-33、Fe2O3+3CO = 2Fe+3CO2高温34、Ba2++SO42+=BaSO4↓Ag++Cl-= AgCl↓35、Zn+Cu2+= Zn2++Cu Zn+Fe2+= Zn2++Fe36、溶洞的形成:CO2+CaCO3+H2O=Ca(HCO3)2Ca(HCO3)2=CO2↑+CaCO3+H2O Δ37、NaHCO3+BaCl2➜不反应(一般情况下,强酸才能制弱酸)38、工业上制取水煤气:C+H2O(g)=CO+H2 高温39、自然界通过放电把氮气转化为一氧化氮:N2+O22NO 放电(NO无色、难溶于水)40、工业上制备氨气:N2+3H22NH3高温、高压、催化剂441、一氧化氮在常温下被氧化:2NO+O2=2NO2(NO2红棕色、有刺激性气味的有毒气体、易溶于水)42、工业上制取硝酸、二氧化氮溶于水生成硝酸和一氧化氮:3NO2+H2O=2HNO3+NO43、氨溶解于水:NH3+H2O NH3·H2O(一水合氨、弱碱性、能使酚酞溶液变红)44、一水合氨的电离:NH3·H2O NH4++OH-45、氨与盐酸的反应:NH3+HCl=NH4Cl46、工业上制备硝酸需要的一氧化氮的方程式:4NH3+5O2=4NO+6H2O 高温催化剂47、碳酸氢铵受热分解:NH4HCO3=NH3↑+CO2↑+H2O Δ(密封保存在阴凉处、施肥时埋在土下)48、氯化铵受热分解:NH4Cl=NH3↑+HCl↑Δ49、铵态氮肥不能与碱(如草木灰)混合施用:NH4++OH-=NH3↑+H2O Δ50、实验室制氨气:2NH4Cl+Ca(OH)2=2NH3↑+CaC l2+2H2O Δ(向上排空气法收集、湿润的红色石蕊试纸)551、硝酸受热分解:4HNO3=4NO2↑+O2↑+2H2O 受热或见光(应保存在棕色试剂瓶中、阴凉处)52、铜与硝酸的反应:Cu +4HNO3(浓) =Cu(NO3)2+2NO2↑+2H2O (遇浓硝酸生成二氧化氮)3Cu+8HNO3(稀) =3Cu(NO3)2+2NO↑+4H2O (遇稀硝酸生成一氧化氮)53、浓硝酸与木炭的反应:4HNO3(浓)+C=CO2↑+4NO2↑+2H2O Δ54、硫单质铁的反应:Fe+S=FeS Δ(硫单质的氧化性、S黄色或淡黄色固体,不溶水、微溶酒精、易溶CS2)55、硫单质与氧气的反应:S+O2=SO2 点燃(硫单质的还原性、SO2有刺激性气味的有毒气体、易溶于水)56、硫粉遇碱发生歧化反应:3S+6NaOH=2Na2S+Na2SO3+3H2O Δ57、黑火药爆炸的化学方程式:S+2KNO3+3C=K2S+3CO2↑+N2↑58、二氧化硫被氧气氧化:2SO2+O22SO3催化剂Δ59、二氧化硫与硫化氢发生归中反应:SO2+2H2S=3S↓+2H2O (H2S臭鸡蛋气味)60、浓硫酸与铜加热发生反应:2H2SO4(浓)+Cu=CuSO4+SO2↑+2H2O Δ661、浓硫酸与木炭加热发生反应:2H2SO4(浓)+C=2SO2↑+CO2↑+2H2O Δ62、二氧化硫能使澄清石灰水变浑浊:SO2+Ca(OH)2=CaSO3↓+H2O63、二氧化硫与氯气发生氧化还原反应:SO2+Cl2+2H2O=H2SO4+2HCl64、酸雨的形成:2SO2+O22SO3 粉尘等催化SO3+H2O=H2SO4SO2+H2O H2SO32H2SO3+O2=2H2SO465、海水提镁第一步:Mg+2H+=Mg2++H2↑(盐酸、稀硫酸)66、镁与氮气的反应:3Mg+N2=Mg3N2 点燃67、镁与二氧化碳反应:2Mg+CO2=2MgO+C 点燃(镁着火不能用二氧化碳扑灭)68、海水提溴单质:2Br-+Cl2=Br2+2Cl-69、半导体硅与氧气的反应:Si+O2=SiO2 Δ(自然界没有游离态的硅)70、工业上制粗硅:SiO2+2C=Si+2CO↑高温(光导纤维、沙子和石英的主要成分是SiO2)771、硅与氟气的反应:Si+2F2=SiF472、硅与氢氟酸的反应:Si+4HF=SiF4+2H273、制作黏合剂:Si+2NaOH+H2O=Na2SiO3+2H2↑74、玻璃与烧碱反应:SiO2+2NaOH=Na2SiO3+H2O (Na2SiO3的水溶液称为水玻璃)75、二氧化硅与碱性氧化物的反应:SiO2+CaO=CaSiO3 高温76、刻蚀玻璃:SiO2+4HF=SiF4↑+2H2O77、工业制玻璃:CaCO3+SiO2=CaSiO3+CO2↑高温Na2CO3+SiO2=Na2SiO3+CO2↑高温78、金属铝在氧气中燃烧:4Al+3O2=2Al2O3 点燃79、铝热反应:2Al+Fe2O3=Al2O3+2Fe高温(铝粉与氧化铁粉的混合物称为铝热剂,用于焊接钢轨)80、金属铝与酸的反应:2Al+6HCl=2AlCl3+3H2↑881、金属铝与碱的反应:2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑(四羟基合铝酸钠)82、实验室制氢氧化铝:AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl(白色沉淀)83、氢氧化铝溶于强酸中:Al(OH)3+3H+=Al3++3H2O84、氢氧化铝溶于强碱中:Al(OH)3+OH-=[Al(OH)4]- (四羟基合铝酸根离子)85、氧化铝溶于强酸:Al2O3+6H+=2Al3++3H2O (氧化铝为两性氧化物)86、氧化铝溶于强碱:Al2O3+2OH-+3H2O=2[Al(OH)4]-87、碱式碳酸铜的制取:2Cu+O2+H2O+CO2=Cu2(OH)2CO3 (绿色)88、铜与氧气的反应:Cu+O2=2CuO Δ89、铜与硫粉的反应:2Cu+S=Cu2S Δ90、4CuO=2Cu2O+O2↑高温(黑色物质变为红色物质)991、CuSO4·5H2O=CuSO4+5H2O↑Δ(蓝色晶体变为白色粉末)92、氯化铝与少量的氢氧化钠反应:Al3++3OH-=Al(OH)3↓93、氯化铝与过量的氢氧化钠反应:Al3++4OH-=[Al(OH)4]-94、四羟基合铝酸根离子与酸的反应:[Al(OH)4]-+H+=H2O+Al(OH)3↓95、实验室制取氯气:4HCl(浓)+MnO2 =MnCl2+Cl2↑+2H2O Δ(黄绿色气体、有毒、密度比空气大)96、实验室制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑(无色无味、密度比空气大,溶于水)。
必修一必修二化学方程式汇总

必修一必修二化学方程式汇总化学方程式是化学变化的一种表达方式,用化学符号和化学式表示化学变化中参与物质的种类和数量。
必修一和必修二中有许多重要的化学方程式,下面对其中的一些进行汇总。
必修一中的化学方程式:1.金属与非金属的单质反应:-2Na+Cl2-->2NaCl(氯化钠的合成)2.酸与碱的中和反应:-HCl+NaOH-->NaCl+H2O(氯化钠的合成)3.金属与酸的反应:-Mg+2HCl-->MgCl2+H2(氯化镁的合成)4.氧化还原反应:-2Fe+3Cl2-->2FeCl3(三氯化铁的合成)必修二中的化学方程式:1.酸碱滴定反应:-HClO4+NaOH-->NaClO4+H2O(高氯酸钠的合成)2.氧化还原反应:-FeSO4+H2O2-->Fe2(SO4)3+H2O(硫酸铁(III)的合成)3.燃烧反应:-CH4+2O2-->CO2+2H2O(二氧化碳和水的生成)4.酸碱中和反应:-HClO3+NaOH-->NaClO3+H2O(高氯酸钠的合成)5.酸碱滴定反应:-H2SO4+2NaOH-->Na2SO4+2H2O(硫酸钠的合成)以上只是一部分重要的化学方程式,其中涉及了单质反应、酸碱反应、氧化还原反应和燃烧反应等。
这些方程式是化学反应的核心内容,通过它们可以了解化学变化的过程和产物,进而深入理解化学的基本概念和原理。
化学方程式的学习对于化学学科的学习至关重要。
掌握了方程式的书写和解析,能够更好地理解化学反应的机理和过程,有助于深入理解化学的基本概念和原理。
通过大量的练习,可以提高对方程式的运用能力,培养化学思维和分析问题的能力。
化学方程式是化学学科中的基础知识,实际应用广泛。
在工业生产、环境保护、农业生产等方面,化学方程式的应用都发挥着重要的作用。
只有深入理解化学方程式的原理和规律,才能更好地利用化学的力量,解决实际问题。
总之,化学方程式是化学变化的一种表达方式,必修一和必修二中的化学方程式涉及了单质反应、酸碱反应、氧化还原反应和燃烧反应等多个方面,掌握了这些方程式对于理解化学的基本概念和原理、提高分析和解决问题的能力都具有重要意义。
高中必修一化学方程式汇总
1, 氧化性:F2 + H2 === 2HFF2 +Xe(过量)===XeF22F2(过量)+Xe===XeF4nF2 +2M===2MFn (表示大部分金属) 2F2 +2H2O===4HF+O22F2 +2NaOH===2NaF+OF2 +H2OF2 +2NaCl===2NaF+Cl2F2 +2NaBr===2NaF+Br2F2+2NaI ===2NaF+I2F2 +Cl2 (等体积)===2ClF3F2 (过量)+Cl2===2ClF37F2(过量)+I2 ===2IF7Cl2 +H2 ===2HCl3Cl2 +2P===2PCl3Cl2 +PCl3 ===PCl5Cl2 +2Na===2NaCl3Cl2 +2Fe===2FeCl3Cl2 +2FeCl2 ===2FeCl3Cl2+Cu===CuCl22Cl2+2NaBr===2NaCl+Br2Cl2 +2NaI ===2NaCl+I25Cl2+I2+6H2O===2HIO3+10HClCl2 +Na2S===2NaCl+SCl2 +H2S===2HCl+SCl2+SO2 +2H2O===H2SO4 +2HClCl2 +H2O2 ===2HCl+O22O2 +3Fe===Fe3O4O2+K===KO2S+H2===H2S2S+C===CS2S+Fe===FeSS+2Cu===Cu2S3S+2Al===Al2S3S+Zn===ZnSN2+3H2===2NH3N2+3Mg===Mg3N2N2+3Ca===Ca3N2N2+3Ba===Ba3N2N2+6Na===2Na3NN2+6K===2K3NN2+6Rb===2Rb3NP2+6H2===4PH3P+3Na===Na3P2P+3Zn===Zn3P22.还原性S+O2===SO2S+O2===SO2S+6HNO3(浓)===H2SO4+6NO2+2H2O3S+4 HNO3(稀)===3SO2+4NO+2H2ON2+O2===2NO4P+5O2===P4O10(常写成P2O5)2P+3X2===2PX3 (X表示F2,Cl2,Br2)PX3+X2===PX5P4+20HNO3(浓)===4H3PO4+20NO2+4H2OC+2F2===CF4C+2Cl2===CCl42C+O2(少量)===2COC+O2(足量)===CO2C+CO2===2COC+H2O===CO+H2(生成水煤气)2C+SiO2===Si+2CO(制得粗硅)Si(粗)+2Cl===SiCl4(SiCl4+2H2===Si(纯)+4HCl)Si(粉)+O2===SiO2Si+C===SiC(金刚砂)Si+2NaOH+H2O===Na2SiO3+2H23,(碱中)歧化Cl2+H2O===HCl+HClO(加酸抑制歧化,加碱或光照促进歧化)Cl2+2NaOH===NaCl+NaClO+H2O2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O 3Cl2+6KOH(热,浓)===5KCl+KClO3+3H2O3S+6NaOH===2Na2S+Na2SO3+3H2O4P+3KOH(浓)+3H2O===PH3+3KH2PO211P+15CuSO4+24H2O===5Cu3P+6H3PO4+15H2SO4 3C+CaO===CaC2+CO3C+SiO2===SiC+2CO二,金属单质(Na,Mg,Al,Fe)的还原性2Na+H2===2NaH4Na+O2===2Na2O2Na2O+O2===2Na2O22Na+O2===Na2O22Na+S===Na2S(爆炸)2Na+2H2O===2NaOH+H22Na+2NH3===2NaNH2+H24Na+TiCl4(熔融)===4NaCl+TiMg+Cl2===MgCl2Mg+Br2===MgBr22Mg+O2===2MgOMg+S===MgSMg+2H2O===Mg(OH)2+H22Mg+TiCl4(熔融)===Ti+2MgCl2Mg+2RbCl===MgCl2+2Rb2Mg+CO2===2MgO+C2Mg+SiO2===2MgO+SiMg+H2S===MgS+H2Mg+H2SO4===MgSO4+H22Al+3Cl2===2AlCl34Al+3O2===2Al2O3(钝化)4Al(Hg)+3O2+2xH2O===2(Al2O3.xH2O)+4Hg 4Al+3MnO2===2Al2O3+3Mn2Al+Cr2O3===Al2O3+2Cr2Al+Fe2O3===Al2O3+2Fe2Al+3FeO===Al2O3+3Fe2Al+6HCl===2AlCl3+3H22Al+3H2SO4===Al2(SO4)3+3H22Al+6H2SO4(浓)===Al2(SO4)3+3SO2+6H2O (Al,Fe在冷,浓的H2SO4,HNO3中钝化)Al+4HNO(稀)===Al(NO3)3+NO+2H2O2Al+2NaOH+2H2O===2NaAlO2+3H22Fe+3Br2===2FeBr3Fe+I2===FeI2Fe+S===FeS3Fe+4H2O(g)===Fe3O4+4H2Fe+2HCl===FeCl2+H2Fe+CuCl2===FeCl2+CuFe+SnCl4===FeCl2+SnCl2(铁在酸性环境下,不能把四氯化锡完全还原为单质锡 Fe+SnCl2==FeCl2+Sn)非金属氢化物(HF,HCl,H2O,H2S,NH3)1,还原性:4HCl(浓)+MnO2===MnCl2+Cl2+2H2O4HCl(g)+O2===2Cl2+2H2O16HCl+2KMnO4===2KCl+2MnCl2+5Cl2+8H2O 14HCl+K2Cr2O7===2KCl+2CrCl3+3Cl2+7H2O 2H2O+2F2===4HF+O22H2S+3O2(足量)===2SO2+2H2O2H2S+O2(少量)===2S+2H2O2H2S+SO2===3S+2H2OH2S+H2SO4(浓)===S+SO2+2H2O3H2S+2HNO(稀)===3S+2NO+4H2O5H2S+2KMnO4+3H2SO4===2MnSO4+K2SO4+5S+8H2O3H2S+K2Cr2O7+4H2SO4===Cr2(SO4)3+K2SO4+3S+7H2O H2S+4Na2O2+2H2O===Na2SO4+6NaOH2NH3+3CuO===3Cu+N2+3H2O2NH3+3Cl2===N2+6HCl8NH3+3Cl2===N2+6NH4Cl4NH3+3O2(纯氧)===2N2+6H2O4NH3+5O2===4NO+6H2O4NH3+6NO===5N2+6HO(用氨清除NO)NaH+H2O===NaOH+H24NaH+TiCl4===Ti+4NaCl+2H2CaH2+2H2O===Ca(OH)2+2H22,酸性:4HF+SiO2===SiF4+2H2O(此反应广泛应用于测定矿样或钢样中SiO2的含量)2HF+CaCl2===CaF2+2HClH2S+Fe===FeS+H2H2S+CuCl2===CuS+2HClH2S+2AgNO3===Ag2S+2HNO3H2S+HgCl2===HgS+2HClH2S+Pb(NO3)2===PbS+2HNO3H2S+FeCl2===2NH3+2Na==2NaNH2+H2(NaNH2+H2O===NaOH+NH3)3,碱性:NH3+HCl===NH4ClNH3+HNO3===NH4NO32NH3+H2SO4===(NH4)2SO4NH3+NaCl+H2O+CO2===NaHCO3+NH4Cl(此反应用于工业制备小苏打,苏打)4,不稳定性:2HF===H2+F22HCl===H2+Cl22H2O===2H2+O22H2O2===2H2O+O2H2S===H2+S2NH3===N2+3H2非金属氧化物1,低价态的还原性:2SO2+O2===2SO32SO2+O2+2H2O===2H2SO4(这是SO2在大气中缓慢发生的环境化学反应)SO2+Cl2+2H2O===H2SO4+2HClSO2+Br2+2H2O===H2SO4+2HBrSO2+I2+2H2O===H2SO4+2HISO2+NO2===SO3+NO2NO+O2===2NO2NO+NO2+2NaOH===2NaNO2(用于制硝酸工业中吸收尾气中的NO和NO2)2CO+O2===2CO2CO+CuO===Cu+CO23CO+Fe2O3===2Fe+3CO2CO+H2O===CO2+H22,氧化性:SO2+2H2S===3S+2H2OSO3+2KI===K2SO3+I2NO2+2KI+H2O===NO+I2+2KOH(不能用淀粉KI溶液鉴别溴蒸气和NO2)4NO2+H2S===4NO+SO3+H2O2NO2+Cu===4CuO+N2CO2+2Mg===2MgO+C(CO2不能用于扑灭由Mg,Ca,Ba,Na,K等燃烧的火灾)SiO2+2H2===Si+2H2OSiO2+2Mg===2MgO+Si3,与水的作用:SO2+H2O===H2SO3SO3+H2O===H2SO43NO2+H2O===2HNO3+NON2O5+H2O===2HNO3P2O5+H2O===2HPO3P2O5+3H2O===2H3PO4(P2O5极易吸水,可作气体干燥剂P2O5+3H2SO4(浓)===2H3PO4+3SO3)CO2+H2O===H2CO34,与碱性物质的作用:SO2+2NH3+H2O===(NH4)2SO3SO2+(NH4)2SO3+H2O===2NH4HSO3(这是硫酸厂回收SO2的反应.先用氨水吸收SO2,再用H2SO4处理: 2NH4HSO3+H2SO4===(NH4)2SO4+2H2O+2SO2 生成的硫酸铵作化肥,SO2循环作原料气)SO2+Ca(OH)2===CaSO3+H2O(不能用澄清石灰水鉴别SO2和CO2.可用品红鉴别)SO3+MgO===MgSO4SO3+Ca(OH)2===CaSO4+H2OCO2+2NaOH(过量)===Na2CO3+H2OCO2(过量)+NaOH===NaHCO3CO2+Ca(OH)2(过量)===CaCO3+H2O2CO2(过量)+Ca(OH)2===Ca(HCO3)2CO2+2NaAlO2+3H2O===2Al(OH)3+Na2CO3CO2+C6H5ONa+H2O===C6H5OH+NaHCO3SiO2+CaO===CaSiO3SiO2+2NaOH===Na2SiO3+H2O(常温下强碱缓慢腐蚀玻璃)SiO2+Na2CO3===Na2SiO3+CO2SiO2+CaCO3===CaSiO3+CO2金属氧化物1,低价态的还原性:6FeO+O2===2Fe3O4FeO+4HNO3===Fe(NO3)3+NO2+2H2O2,氧化性:Na2O2+2Na===2Na2O(此反应用于制备Na2O)MgO,Al2O3几乎没有氧化性,很难被还原为Mg,Al. 一般通过电解制Mg和Al.Fe2O3+3H2===2Fe+3H2O (制还原铁粉)Fe3O4+4H2===3Fe+4H2O3,与水的作用:Na2O+H2O===2NaOH2Na2O2+2H2O===4NaOH+O2(此反应分两步:Na2O2+2H2O===2NaOH+H2O2 ;2H2O2===2H2O+O2. H2O2的制备可利用类似的反应: BaO2+H2SO4(稀)===BaSO4+H2O2)MgO+H2O===Mg(OH)2 (缓慢反应)4,与酸性物质的作用:Na2O+SO3===Na2SO4Na2O+CO2===Na2CO3Na2O+2HCl===2NaCl+H2O2Na2O2+2CO2===2Na2CO3+O2Na2O2+H2SO4(冷,稀)===Na2SO4+H2O2MgO+SO3===MgSO4MgO+H2SO4===MgSO4+H2OAl2O3+3H2SO4===Al2(SO4)3+3H2O(Al2O3是两性氧化物:Al2O3+2NaOH===2NaAlO2+H2O)FeO+2HCl===FeCl2+3H2OFe2O3+6HCl===2FeCl3+3H2OFe2O3+3H2S(g)===Fe2S3+3H2OFe3O4+8HCl===FeCl2+2FeCl3+4H2O含氧酸1,氧化性:4HClO3+3H2S===3H2SO4+4HClHClO3+HI===HIO3+HCl3HClO+HI===HIO3+3HClHClO+H2SO3===H2SO4+HClHClO+H2O2===HCl+H2O+O2(氧化性:HClO>HClO2>HClO3>HClO4,但浓,热的HClO4氧化性很强)2H2SO4(浓)+C===CO2+2SO2+2H2O2H2SO4(浓)+S===3SO2+2H2OH2SO4+Fe(Al) 室温下钝化6H2SO4(浓)+2Fe===Fe2(SO4)3+3SO2+6H2O2H2SO4(浓)+Cu===CuSO4+SO2+2H2OH2SO4(浓)+2HBr===SO2+Br2+2H2OH2SO4(浓)+2HI===SO2+I2+2H2OH2SO4(稀)+Fe===FeSO4+H22H2SO3+2H2S===3S+2H2O4HNO3(浓)+C===CO2+4NO2+2H2O6HNO3(浓)+S===H2SO4+6NO2+2H2O5HNO3(浓)+P===H3PO4+5NO2+H2O6HNO3+Fe===Fe(NO3)3+3NO2+3H2O4HNO3+Fe===Fe(NO3)3+NO+2H2O30HNO3+8Fe===8Fe(NO3)3+3N2O+15H2O36HNO3+10Fe===10Fe(NO3)3+3N2+18H2O30HNO3+8Fe===8Fe(NO3)3+3NH4NO3+9H2O2,还原性:H2SO3+X2+H2O===H2SO4+2HX(X表示Cl2,Br2,I2)2H2SO3+O2===2H2SO4H2SO3+H2O2===H2SO4+H2O5H2SO3+2KMnO4===2MnSO4+K2SO4+2H2SO4+3H2OH2SO3+2FeCl3+H2O===H2SO4+2FeCl2+2HCl3,酸性:H2SO4(浓) +CaF2===CaSO4+2HFH2SO4(浓)+NaCl===NaHSO4+HClH2SO4(浓) +2NaCl===Na2SO4+2HClH2SO4(浓)+NaNO3===NaHSO4+HNO33H2SO4(浓)+Ca3(PO4)2===3CaSO4+2H3PO42H2SO4(浓)+Ca3(PO4)2===2CaSO4+Ca(H2PO4)23HNO3+Ag3PO4===H3PO4+3AgNO32HNO3+CaCO3===Ca(NO3)2+H2O+CO2(用HNO3和浓H2SO4不能制备H2S,HI,HBr,(SO2)等还原性气体)4H3PO4+Ca3(PO4)2===3Ca(H2PO4)2(重钙)H3PO4(浓)+NaBr===NaH2PO4+HBrH3PO4(浓)+NaI===NaH2PO4+HI4,不稳定性:2HClO===2HCl+O24HNO3===4NO2+O2+2H2OH2SO3===H2O+SO2H2CO3===H2O+CO2H4SiO4===H2SiO3+H2O碱1,低价态的还原性:4Fe(OH)2+O2+2H2O===4Fe(OH)32,与酸性物质的作用:2NaOH+SO2(少量)===Na2SO3+H2ONaOH+SO2(足量)===NaHSO32NaOH+SiO2===NaSiO3+H2O2NaOH+Al2O3===2NaAlO2+H2O2NaOH+Cl2===NaCl+NaClO+H2ONaOH+HCl===NaCl+H2ONaOH+H2S(足量)===NaHS+H2O2NaOH+H2S(少量)===Na2S+2H2O3NaOH+AlCl3===Al(OH)3+3NaClNaOH+Al(OH)3===NaAlO2+2H2O(AlCl3和Al(OH)3哪个酸性强?)NaOH+NH4Cl===NaCl+NH3+H2OMg(OH)2+2NH4Cl===MgCl2+2NH3.H2OAl(OH)3+NH4Cl 不溶解3,不稳定性:Mg(OH)2===MgO+H2O2Al(OH)3===Al2O3+3H2O2Fe(OH)3===Fe2O3+3H2OCu(OH)2===CuO+H2O盐1,氧化性:2FeCl3+Fe===3FeCl22FeCl3+Cu===2FeCl2+CuCl2(用于雕刻铜线路版)2FeCl3+Zn===2FeCl2+ZnCl2FeCl3+Ag===FeCl2+AgCFe2(SO4)3+2Ag===FeSO4+Ag2SO4(较难反应) Fe(NO3)3+Ag 不反应2FeCl3+H2S===2FeCl2+2HCl+S2FeCl3+2KI===2FeCl2+2KCl+I2FeCl2+Mg===Fe+MgCl22,还原性:2FeCl2+Cl2===2FeCl33Na2S+8HNO3(稀)===6NaNO3+2NO+3S+4H2O3Na2SO3+2HNO3(稀)===3Na2SO4+2NO+H2O2Na2SO3+O2===2Na2SO43,与碱性物质的作用:MgCl2+2NH3.H2O===Mg(OH)2+NH4ClAlCl3+3NH3.H2O===Al(OH)3+3NH4ClFeCl3+3NH3.H2O===Fe(OH)3+3NH4Cl4,与酸性物质的作用:Na3PO4+HCl===Na2HPO4+NaClNa2HPO4+HCl===NaH2PO4+NaClNaH2PO4+HCl===H3PO4+NaClNa2CO3+HCl===NaHCO3+NaClNaHCO3+HCl===NaCl+H2O+CO23Na2CO3+2AlCl3+3H2O===2Al(OH)3+3CO2+6NaCl 3Na2CO3+2FeCl3+3H2O===2Fe(OH)3+3CO2+6NaCl 3NaHCO3+AlCl3===Al(OH)3+3CO23NaHCO3+FeCl3===Fe(OH)3+3CO23Na2S+Al2(SO4)3+6H2O===2Al(OH)3+3H2S3NaAlO2+AlCl3+6H2O===4Al(OH)35,不稳定性:Na2S2O3+H2SO4===Na2SO4+S+SO2+H2ONH4Cl===NH3+HClNH4HCO3===NH3+H2O+CO22KNO3===2KNO2+O22Cu(NO3)3===2CuO+4NO2+O22KMnO4===K2MnO4+MnO2+O22KClO3===2KCl+3O22NaHCO3===Na2CO3+H2O+CO2Ca(HCO3)2===CaCO3+H2O+CO2CaCO3===CaO+CO2MgCO3===MgO+CO2。
高中必修1分章节化学方程式和离子方程式
高中必修1分章化学方程式和离子方程式第一章:1、Na2SO4 + BaCl2 = 2NaCl+ BaSO4↓Ba2+ + SO42- = BaSO4↓2、MgCl2 + 2 NaOH = Mg(OH)2↓+ 2NaCl Mg2+ + 2OH- = Mg(OH)2↓3、CaCl2 + Na2CO3 = CaCO3↓+ 2NaCl Ca2+ + CO32- = CaCO3↓4、HCl + AgNO3 = HNO3 + AgCl↓Ag+ + Cl- = AgCl↓5、BaCl2 + Na2CO3 = BaCO3↓+ 2 NaCl Ba2+ + CO32- = BaCO3↓6、BaCO3 + 2HCl = BaCl2 + H2O + CO2↑BaCO3 + 2H+ = Ba2+ + H2O + CO2↑7、CH4 + 2 O2 = CO2 + 2H2O8、Fe + H2SO4 = FeSO4 + H2↑第二章1、FeCl3 + 3H2O Fe(OH)3 (胶体)+ 3HCl Fe3++ 3H2O Fe(OH)3 (胶体)+ 3H+2、KClO3 = K+ + ClO3-KMnO4 = K+ + MnO4-3、H2SO4 = 2H+ + SO42-Ba(OH)2=Ba2++ 2OH-4、CH3COOH CH3COO- + H+ HClO H+ + ClO-5、NH3·H2O NH4+ + OH-Cu(OH)2 Cu2+ + 2OH-6、Al3++3OH- Al(OH)3 AlO2- + H++H2O KAl(SO4)2= K+ + Al3+ + 2SO42-7、Ba2+ + SO42- = BaSO4↓8、2H++ SO42-+Ba2++2OH-= BaSO4↓+2H2O9、Cu2+ + 2 OH- = Cu(OH)2↓10、2Al+ 3Hg2+ =2Al3+ + 3 Hg11、CaCO3 + 2H+ = Ca2+ + H2O + CO2↑12、CO32-+ 2H+ = H2O + CO2↑13、2CuO + C 2Cu +CO214、H2O + C CO + H2↑15、CuO+H2 Cu +H2O16、Fe+ CuSO4 =FeSO4 + Cu Fe+ Cu2+ = Fe2++ Cu17、2 H2O2 = 2H2O + O218、CaCO3 CaO + CO2↑19、MnO2 + 4HCl(浓) MnCl2 + Cl2↑+2H2O MnO2 + 4H++2Cl- Mn2++ Cl2↑+2H2O20、KClO3 + 6 HCl(浓)= KCl + 3Cl2↑+ 3H2O ClO3- + 6 H+ +5Cl-=3Cl2↑+3H2O21、WO3 + 3H2 W + 3H2O22、CO2 + C 2 CO23、4P + 5O2 = 2P2O524、CO2 + 2Cu + O2 + H2O = Cu2(OH)2CO325、S+2KNO3+3C = K2S + N2↑+3CO2↑(黑火药爆炸反应方程式)26、Fe2O3 + 3 CO 2Fe + 3CO2第三章1、2Al+ 3CuSO4 = Al2(SO4)3 + 3Cu2、2Mg + O2 = 2 MgO3、Cu + 2 AgNO3 = Cu(NO3)2 +2 Ag4、Mg + 2 HCl = MgCl2 + H2↑5、4 Na + O2 = 2 Na2O 2 Na2O + O2 2 Na2O26、2Na + O2 Na2O27、4Al + 3O2 2 Al2O38、2Na + 2 H2O = 2 NaOH+H2↑ 2Na+2H2O=2 Na++OH-+H2↑9、3Fe+ 4 H2O (g) Fe3O4 + 4H2↑10、2Al+2NaOH+6H2O = 2NaAlO2 +2H2O+3H2↑(进行氧化还原分析时,注意NaOH 既不是氧化剂也不是还原剂,其中的OH-价态不变。
高中化学必修一化学方程式整理
化学方程式整理答案一、钠及其化合物1、钠在氧气中燃烧 2Na+O 2 Na 2O 22、钠与水的反应 2Na+2H 2O=2NaOH+H 2↑3、过氧化钠与水反应 2Na 2O 2+2H 2O=4NaOH+O 2↑4、过氧化钠 与二氧化碳反应2Na 2O 2+2CO 2=2Na 2CO 3+O 2↑《5、小苏打受热分解 2NaHCO 3 Na 2CO 3+H 2O+CO 2↑6、向小苏打溶液中滴加盐酸 NaHCO 3+HCl=NaCl+CO 2↑+H 2O7、向小苏打溶液中滴加烧碱溶液NaHCO 3+NaOH= Na 2CO 3+H 2O8、少量小苏打溶液与石灰水的反应 NaHCO 3+Ca(OH)2= CaCO 3↓+NaOH+H 2O 9、向盐酸中滴加苏打溶液 Na 2CO 3+2HCl=2NaCl +CO 2↑+H 2O10、向苏打溶液中滴加盐酸 Na 2CO 3+HCl=NaCl+NaHCO 3 NaHCO 3+HCl=NaCl+CO 2↑+H 2O 11、向苏打溶液中通入二氧化碳 Na 2CO 3+ H 2O+CO 2=2 NaHCO 312、向苏打溶液中滴加硝酸银溶液 Na 2CO 3+2AgNO 3=Ag 2CO 3↓+2NaNO 3—13、向硫酸钠溶溶中滴加氯化钡溶液 Na 2SO 4+BaCl 2=BaSO 4↓+2NaCl 二、镁、铝及其化合物1、镁溶于盐酸 Mg+2HCl=MgCl 2+H 2↑2、镁在二氧化碳中燃烧 2Mg+CO 2 2MgO+C3、氢氧化镁溶于盐酸 Mg(OH)2+2HCl=MgCl 2+2H 2O4、铝溶于盐酸 2Al+6HCl=2AlCl 3+3H 2↑5、铝溶于烧碱溶液 2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑6、铝和氧化铁加热后的反应 2Al+Fe 2O 3 2Fe+Al 2O 37、氧化铝溶于盐酸 Al 2O 3+6HCl=2AlCl 3+3H 2O8、氧化铝溶于烧碱溶液 Al 2O 3+2NaOH=2NaAlO 2+ H 2O9、氢氧化铝溶于盐酸 Al(OH)3+ 3HCl = AlCl 3+3H 2O 10、氢氧化铝溶于烧碱溶液Al(OH)3+ NaOH=NaAlO 2+ 2H 2O 11、向氯化铝溶液中滴加烧碱溶液△ △点燃 !AlCl 3+3 NaOH= Al(OH)3↓+3NaCl Al(OH)3+ NaOH=NaAlO 2+ 2H 2O,12、向氯化铝溶液中滴加氨水 AlCl 3+3NH 3·H 2O= Al(OH)3↓+3NH 4Cl 13、向偏铝酸钠溶液中滴加盐酸 NaAlO 2+HCl+ H 2O= Al(OH)3↓+NaCl14、向偏铝酸钠溶液中通入过量的二氧化碳NaAlO 2+CO 2+2H 2O= Al(OH)3↓+ NaHCO 3 15、氢氧化铝受热分解 2Al(OH)3 Al 2O 3+ 3H 2O 三、铁及其化合物1、铁在氧气中燃烧 3Fe+2O 2 Fe 3O 42、铁与水蒸气的反应 3Fe+4H 2O (g) Fe 3O 4+4H 2↑3、铁在氯气中燃烧 2Fe+3Cl 2 2FeCl 34、铁溶于盐酸 Fe+2HCl=FeCl 2+H 2↑5、铁和硫酸铜溶液反应 Fe+CuSO 4=Cu+FeSO 46、氯化铁溶液和铁反应 2FeCl 3+Fe=3FeCl 27、氯化铁溶液和铜反应 2FeCl 3+Cu=CuCl 2+ 2FeCl 2%8、氯化铁溶液和碘化钾溶液反应2FeCl 3+2KI=I 2+ 2FeCl 2+2KCl 9、向氯化亚铁溶液中通氯气 2FeCl 2+ Cl 2=2 FeCl 310、向酸性氯化亚铁溶液中滴加双氧水(离子方程式)2Fe 2++H 2O 2+2H +=2Fe 3++2H 2O 11、氯化铁溶液和硫氰化钾溶液反应 FeCl 3+3KSCN=Fe(SCN)3+3KCl 12、向氯化亚铁溶液中滴加烧碱溶液 FeCl 2+2NaOH=Fe(OH)2↓+2NaCl 13、向氯化铁溶液中滴加烧碱溶液 FeCl 3+3NaOH=Fe(OH)3↓+3NaCl 14、氢氧化铁受热分解 2Fe(OH)3 Fe 2O 3 +3H 2O…15、氢氧化亚铁与潮湿空气反应4 Fe(OH)2+ O 2 +2 H 2O=4Fe(OH)3 16、氢氧化铁溶于盐酸 Fe(OH)3 +3HCl=FeCl 3+3 H 2O 17、氢氧化亚铁溶于盐酸 Fe(OH)2 +2HCl=FeCl 2+2 H 2O 18、磁性氧化铁溶于盐酸 Fe 3O 4+8HCl=FeCl 2+ 2FeCl 3+4H 2O 四、氯及其化合物1、氢气在氯气中燃烧 H 2+Cl 2 2HCl>△点燃 】点燃△点燃或光照 点燃2、铜在氯气中燃烧 Cu+ Cl 2 CuCl 23、向溴化钠溶液中通入氯气2NaBr+ Cl 2=2NaCl+Br 24、向碘化钠溶液中通入氯气2NaI+ Cl 2=2NaCl+I 25、向碘化钠溶液中滴入溴水2NaI+ Br 2=2NaBr+I 26、氯气与水反应 Cl 2 +H 2O=HCl+HClO7、氯气与烧碱溶液反应 Cl 2 +2NaOH=NaCl+NaClO+ H 2O 8、氯气与消石灰反应2Cl 2 +2Ca(OH)2=CaCl 2+Ca(ClO)2+2 H 2O`9、次氯酸见光分解 2HClO 2HCl+O 2↑10、漂白粉与少量二氧化碳的反应 Ca(ClO)2+CO 2+ H 2O=CaCO 3↓+2HClO 11、二氧化锰与浓盐酸共热制氯气 MnO 2+4HCl(浓) MnCl 2+Cl 2↑+H 2O 12、氯化钠与硝酸银溶液反应 NaCl+AgNO 3=AgCl ↓+NaNO 3 13、溴化钠与硝酸银溶液反应 NaBr+AgNO 3=AgBr ↓+NaNO 3 14、碘化钠与硝酸银溶液反应 NaI+AgNO 3=AgI ↓+NaNO 3 五、硫及其化合物1、硫与氢气共热反应 S+H 2 H 2S2、硫在氧气中燃烧 S+O 2 SO 23、硫粉和铁粉共热反应 S+Fe FeS4、硫粉与铜粉共热反应 S+2Cu Cu 2S#5、二氧化硫与水的反应 SO 2+ H 2O H 2SO 36、向烧碱溶液中通入二氧化硫SO 2+ 2NaOH=Na 2SO 3+ H 2O SO 2+ Na 2SO 3+ H 2O=2NaHSO 37、二氧化硫与氧气在催化剂、共热条件下的反应 2SO 2+ O 22SO 38、二氧化硫与等物质的量的氯气混合后通入水中的反应SO 2+Cl 2+2H 2O=H 2SO 4+2HCl 9、二氧化硫与氯化铁溶液的反应 SO 2+2FeCl 3+2H 2O=2FeCl 2+H 2SO 4+2HCl?10、二氧化硫与高锰酸钾溶液的反应5SO 2+2KMnO 4+3H 2O=K 2SO 4+MnSO 4+3H 2SO 411、二氧化硫与硫化氢的反应SO 2+2H 2S=3S+2H 2O光照△ —点燃△ △催化剂 高温12、向烧碱溶液中通入硫化氢H 2S+ 2NaOH=Na 2S+ H 2O H 2S + Na 2S =2NaHS13、向硫酸铜溶液中通入硫化氢H 2S+CuSO 4=CuS ↓+H 2SO 4 14、三氧化硫与水的反应 SO 3+H 2O= H 2SO 4*15、浓硫酸与铜共热的反应 Cu+2 H 2SO 4(浓) CuSO 4+ SO 2↑+2 H 2O16、浓硫酸与木炭共热的反应C+2 H 2SO 4(浓) CO 2↑+ 2SO 2↑+2 H 2O六、氮及其化合物)1、氮气与氧气的反应 N 2+O 2 2NO2、氮气与氢气合成氨气 N 2+3H 22NH 33、一氧化氮与氧气的反应 2NO+O 2=2NO 24、二氧化氮与水的反应 3NO 2 + H 2O =2HNO 3+NO5、氨气与水的反应 NH 3+ H 2ONH 3·H 2O}6、氨气与氯化氢的反应 NH 3+HCl=NH 4Cl7、氨气与硝酸的反应 NH 3+HNO 3=NH 4 NO 38、氨气的催化氧化 4NH 3+ 5O 2 = 4NO+6 H 2O 9、氨水受热分解 NH 3·H 2O NH 3↑+ H 2O 10、向氨水中通入二氧化硫 2NH 3·H 2O+SO 2=(NH 4)2SO 3+ H 2O 11、氯化铵受热分解 NH 4Cl NH 3↑+ HCl ↑ 12、碳酸氢铵受热分解 NH 4HCO 3 NH 3↑+CO 2↑+ H 2O 13、硝酸铵与烧碱溶液共热 NH 4 NO 3+NaOH NaNO 3+ NH 3↑+ H 2O 14、氯化铵固体与熟石灰共热制氨气2 NH 4Cl+Ca(OH)2 CaCl 2+ 2NH 3↑+ 2H 2O 15、浓硝酸受热或见光分解 4 HNO 3 4NO 2↑+O 2↑+ 2H 2O 16、浓硝酸与木炭共热的反应 C+ 4HNO 3(浓) 4NO 2↑+CO 2↑+ 2H 2O△△放电或高温催化剂 高温、高压催化剂 △△*△△△ 】△17、浓硝酸与铜的反应Cu+4 HNO3(浓)=Cu(NO3)2+2NO2↑+2 H2O18、稀硝酸与铜的反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O七、硅及其化合物1、二氧化硅与氢氟酸的反应SiO2+4HF=SiF4↑+2H2O&2、二氧化硅与烧碱溶液的反应SiO2+2NaOH=Na2SiO3+H2O3、二氧化硅与生石灰的反应SiO2+CaO CaSiO34、水玻璃与盐酸的反应Na2SiO3+2HCl=H2SiO3↓+2NaCl5、向水玻璃中通足量二氧化碳Na2SiO3+2CO2+ 2H2O= H2SiO3↓+2NaHCO3^第三章金属及其化合物方程式一.基础部分:条目反应方程式(若是离子反应则写离子方程式)现象1《钠在空气中燃烧2Na +O2Na2O2黄色的火焰,生成淡黄色固体2钠块在空气中氧化4Na+O2=2Na2O钠表面很快变暗3)钠在氯气中燃烧2Na +Cl2点燃2NaCl黄色火焰,生成白色固体4钠与硫粉研磨2Na + S =Na2S研磨爆炸5.钠与水反应2Na +2H2O =2Na++2OH -+H2 ↑剧烈,钠熔化成银白色小球,浮于水面,四处游动等6过氧化钠与水的反应2Na2O2+2H2O =4Na++4OH -+O2↑放热、淡黄色变白7}2Na2O2+2CO2=2Na2CO3+O2同上高温祝你考试愉快。
高中化学必修1 方程式大全精华版
化学方程式 1 一、化学方程式总结 (1 硫酸根离子的检验: BaCl2 + Na2SO4 = BaSO4↓+ 2NaCl (2 碳酸根离子的检验: CaCl2 + Na2CO3 = CaCO3↓ + 2NaCl (3 碳酸钠与盐酸反应: Na2CO3 + 2HCl = 2NaCl + H2 O + CO 2↑ (4 木炭还原氧化铜: 2CuO + C 2Cu + CO2↑ (5 氯化钙与碳酸钠溶液反应:CaCl2 + Na2CO3 高温CaCO3↓+2NaCl (6 氧化物的反应 a 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O b 氧化钙与水反应:CaO + H2O = Ca(OH2 c 氧化铝与盐酸反应:Al2O3 + 6HCl =2AlCl3 + 3H2O d 氧化铝与氢氧化钠溶液反应:Al2O3 + 2NaOH = 2NaAlO2 + H2O (7 Na的化学反应方程式 a 钠在空气中:4Na + O2 = 2Na2O b 钠与空气中燃烧反应: 2Na + O2 Na2O2 c 钠与水反应:2Na + 2H2O = 2NaOH + H2↑ d 过氧化钠与水反应:2Na2O2 +2H2O = 4NaOH + O2↑ e 过氧化钠与二氧化碳反应:2Na2O2 +2CO2 = 2Na2CO3 + O2 f 碳酸钠与二氧化碳:Na2CO3+H2O+CO2=2NaHCO3 g 氢氧化钠与少量二氧化碳:2NaOH+CO2=Na2CO3+H2O h 氢氧化钠与过量二氧化碳:NaOH+CO2=NaHCO3 i 侯氏制碱法:①NaCl(饱和+NH3+H2O+CO2=NH4Cl+NaHCO3↓ ②2NaHCO3 Na2CO3+H2O+CO2↑ j 足量的CO2通入饱和碳酸钠溶液中: CO2+2Na++CO32- +H2O=2NaHCO3↓ (8 Fe及化合物的化学反应方程式 a 铁与水蒸气反应:3Fe + 4H2O(g 高温Fe3O4 + 4H2 b 铁片与硫酸铜溶液反应: Fe + CuSO4 = FeSO4 + Cu c 氧化铁与盐酸反应:Fe2O3 + 6HCl = 2FeCl3 + 3H2O d 氯化铁与氢氧化钠溶液反应:FeCl3 + 3NaOH = Fe(OH3↓+3NaCl e 硫酸亚铁与氢氧化钠溶液反应,后被氧化成氢氧化铁: FeSO4 + 2NaOH = Fe(OH2↓+ Na2SO4 4Fe(OH2 + 2H2O + O2 = 4Fe(OH3 先生成白色沉淀,后迅速变成灰绿色最后变成红褐色 f 氢氧化铁加热分解:2Fe(OH3 Fe2O3 + 3H2O g 三氯化铁溶液与铁粉反应:2FeCl3 + Fe = 3FeCl2 h 氯化亚铁中通入氯气:2FeCl2 + Cl2 =2FeCl3 i 氯化亚铁与过氧化氢:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O (9 Al及其化合物的化学反应方程式 a 铝与氢氧化钠溶液反应:2Al + 2NaOH + 2H2O =2NaAlO2 + 3H2↑ 化学方程式 2 b 实验室制取氢氧化铝: Al2(SO43 + 6NH3·H2O = 2Al(OH3↓ + 3(NH42SO4 c 氢氧化铝与盐酸反应:Al(OH3 + 3HCl = AlCl3 + 3H2O d 氢氧化铝与氢氧化钠溶液反应:Al(OH3 + NaOH = NaAlO2 + 2H2O e 氢氧化铝加热分解:2Al(OH3 Al2O3 + 3H2O f 氧化铝与盐酸:Al2O3+6HCl=2AlCl3+3H2O g氧化铝与氢氧化钠:Al2O3+2NaOH=2NaAlO2+H2O h 偏铝酸钠与盐酸:NaAlO2+HCl+H2O =Al(OH3↓+NaCl i 偏铝酸钠与过量二氧化碳:NaAlO2+2H2O+CO2(过)=Al(OH3↓+NaHCO3 j 氯化铝与过量氢氧化钠: AlCl3+4NaOH(过)= NaAlO2+3NaCl+2H2O (10 硅及硅化合物、冶炼纯硅 a 硅与氟气反应:Si + 2F2 = SiF4 b 硅与氢氟酸反应:Si+4HF = SiF4↑+2H2↑ c 硅与氢氧化钠溶液:Si + 2NaOH + H2O = Na2SiO3 +2H2↑ d 二氧化硅与氢氟酸反应:SiO2 + 4HF = SiF4 + 2H2O e 二氧化硅与氢氧化钠溶液反应:SiO2 + 2NaOH = Na2SiO3 + H2O f 二氧化硅与氧化钙高温反应:SiO2 + CaO高温 CaSiO3 g 硅酸钠与盐酸反应:Na2SiO3 + 2HCl = 2NaCl + H2SiO3↓ h 往硅酸钠溶液中通入少量二氧化碳:Na2SiO3 + CO2 + H2O = Na2CO3 + H2SiO3↓ i 往硅酸钠溶液中通入过量二氧化碳:Na2SiO3 + 2CO2 + 2H2O = 2NaHCO3 + H2SiO3↓ j 二氧化硅与碳酸钠固体:SiO2+Na2CO3 高温 Na2SiO3+CO2↑ k 硅单质的实验室制法:粗硅的制取:SiO2 + 2C 高温电炉 Si + 2CO (石英砂)(焦碳)(粗硅) l 粗硅转变为纯硅:Si(粗) +2Cl2 △ SiCl4 SiCl4 + 2H2 高温Si(纯)+ 4HCl (11 氯及其化合物的反应方程式 a 氯气与金属铁反应:2Fe + 3Cl2点燃 2FeCl3 b 氯气与金属铜反应:Cu + Cl2点燃CuCl2 c 氯气与金属钠反应:2Na + Cl2点燃 2NaCl d 氯气与水反应:Cl2 + H2O ? HCl + HClO e 次氯酸光照分解:2HClO 光照2HCl + O2↑ f 氯气与氢氧化钠溶液反应:Cl2 + 2NaOH = NaCl + NaClO + H2O g 氯气与消石灰反应:2Cl2 + 2Ca(OH2 = CaCl2 + Ca(ClO2 + 2H2O h 盐酸与硝酸银溶液反应:HCl + AgNO3 = AgCl↓ + HNO3 i 漂白粉长期露置在空气中:Ca(ClO2 + H2O + CO2 = CaCO3↓ + 2HClO (12)氮及其化合物的反应方程式 a 氮气与氧气在放电下反应:N2 + O2 放电2NO 化学方程式 3 b 氮气与氢气:N2+3H 2 催化剂高温高压 2NH3 c 一氧化氮与氧气反应:2NO + O2 = 2NO2 d 二氧化氮与水反应:3NO2 + H2O = 2HNO3 + NO e 氨气与氯化氢反应:NH3 + HCl = NH4Cl (遇挥发性酸(如浓HCl、浓HNO3)时空气中有白烟 f 氨水受热分解: NH3·H2O △ NH3↑ + H2O g 氯化铵受热分解:NH4Cl △ NH3↑ + HCl↑(不可用于制备氨气) h 碳酸氢氨受热分解:NH4HCO3 △NH3↑ + H2O↑ + CO2↑ (铵盐受热都易分解,但并不是所有的铵盐都分解出氨气,如NH4NO3、(NH42SO4) i 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH= 2NH3·H2O+ Na2SO4 + 2H2O j 硝酸铵与氢氧化钠反应:NH4NO3 + NaOH △ NH3↑ + NaNO3 + H2O k 氨气的实验室制取: 2NH4Cl + Ca(OH2 △ CaCl2 + 2H2O +2NH3↑ l 氨的催化氧化: 4NH3+5O2 催化剂△ 4NO+6H2O m NO、NO2的回收:NO2 + NO + 2NaOH = 2NaNO2 + H2O n 浓硝酸见光分解:4HNO3 光照4NO2↑+ O2↑+ 2H2O o 浓硝酸与铜反应:Cu + 4HNO3(浓 = Cu(NO32 + 2H2O +2NO2↑ p 稀硝酸与铜反应:3Cu + 8HNO3(稀=3Cu(NO32 + 4H2O + 2NO↑ q 碳和浓硝酸反应:C+4HNO3(浓△CO2↑+2NO2↑+2H2O r 少量铁和稀硝酸反应: Fe + 4HNO3(稀=Fe(NO33 + NO↑+ 2H2O s过量铁和稀硝酸反应: 3Fe(过) + 8HNO3(稀= 3Fe(NO3 2 + 2NO↑+ 4H2O (13)硫及其化合物的化学反应方程式 a 硫化氢和二氧化硫: 2H2S+SO2=3S+2H2O b 二氧化硫与氧气:SO2+O2 催化剂加热 2SO3 c 二氧化硫与水反应:SO2 + H2O ? H2SO3 d 二氧化硫与氯水:SO2 + Cl2 + 2H2O = 2HCl + H2SO4 e 二氧化硫与碘水:SO2 + I2 + 2H2O = 2HI + H2SO4 f 二氧化硫与氧化钙:SO2+CaO△CaSO3 (脱硫剂) g 亚硫酸钙与氧气:2CaSO3+ O2= 2CaSO4 h 浓硫酸与铜反应:Cu + 2H2SO4(浓△ CuSO4 + 2H2O + SO2↑ i 浓硫酸与木炭反应:C +2H2SO4(浓△CO2 ↑+ 2SO 2↑ + 2H2O j 硫酸铵与氢氧化钠反应:(NH4)2SO4 + 2NaOH △ 2NH3↑ + Na2SO4 + 2H2O(14)铜的化学反应方程式 1)Cu 2Cu+O2加热 1373K 2CuO 2Cu+O2+H 2O+CO2=Cu2(OH2CO3 (碱式碳酸铜) Cu+4HNO3(浓=Cu(NO32+2NO2↑+2H2O 3Cu+8HNO3(稀=3Cu(NO32+2NO↑+4H2O Cu+Cl2点燃CuCl2 化学方程式 4 2Cu+4HCl+O 2=2CuCl2+2H2O Cu+2FeCl3=2FeCl2+CuCl 2 2H2SO4(浓)+Cu CuSO4+2H2O+SO2↑ 2Cu+2H2SO4(稀+O2 2CuSO4+2H2O 2)氢氧化铜和氧化铜4CuO==Cu2O+O2↑(>1273K) Cu(OH2=CuO+H2O (353K)Cu(OH2+H2SO4=CuSO4+2H2O Cu2+ + 2OH- =Cu(OH2↓ 3硫酸铜(a)无水硫酸铜为白色粉末;其晶体俗名为胆矾或蓝矾;其水溶液呈蓝色(b)硫酸铜的制备:Cu+2H2SO4(浓CuSO4+SO2↑+2H2O 2Cu+2H2SO4(稀+O2 2CuSO4+2H2O (c 硫酸铜的加热:CuSO4==CuO+SO3↑(无水硫酸铜>923K时,分解成CuO)或者:2CuSO4 2CuO+2SO2↑+O2↑(加热) (15 铁的化学方程式 1 铁在氯气中燃烧 2Fe+3Cl2 ===2FeCl3 2 铁与硫反应 Fe + S FeS 3 铁与水反应 3Fe + 4H2O(g)高温Fe3O4 +4H2 4 铁与非氧化性酸反应Fe +2HCl = FeCl2 + H2↑ 5 铁和稀硝酸反应:Fe + 4HNO3(稀,过量=Fe(NO33 + NO↑+ 2H2O 6 铁和稀硝酸反应: 3Fe(过量) + 8HNO3(稀= 3Fe(NO32 + 2NO↑+ 4H2O 7 铁与硫酸铜反应 Fe + CuSO4 = FeSO4 + Cu 8 氧化亚铁与酸反应 FeO +2HCl = FeCl2 + H2O 3FeO + 10HNO3(稀 = 3Fe(NO33 + NO↑+ 5H2O 9 氧化铁与酸反应 Fe2O3 + 6HNO3 = 2Fe(NO33 + 3H2OFe2O3+6HCl(稀=2FeCl3+3H2O (除锈,还要用水冲洗)Fe2O3+6HI=2FeI2+I2+3H2O Fe2O3+3H2SO4(稀 =Fe2(SO43+3H2O 10 氯化铁与氢氧化钠反应FeCl3 + 3NaOH = Fe(OH3↓ + 3NaCl 11 氢氧化铁受热反应 2Fe(OH3 ==== Fe2O3 + 3H2O 12 氢氧化亚铁转化成氢氧化铁 4Fe(OH2 + O2 + 2H2O = 4Fe(OH3 13 氢氧化亚铁与酸反应 3Fe(OH2+ 10HNO3 (稀= 3Fe(NO33 + NO↑+ 8H2OFe(OH2+H2SO4 = FeSO4+2H2O Fe(OH2+2HCl = FeCl2 +2H2O 14 氢氧化铁与酸反应 Fe(OH3 + 3HNO3 = Fe(NO33 + 3H2O 2 Fe(OH3 + 6HI =2 FeI2 +I2+ 6H2O 15 硫酸亚铁与氢氧化钠反应FeSO4 + 2NaOH = Fe(OH2↓+ Na2SO4 16 氯化铁与硫氰化钾溶液反应 FeCl3 + 3KSCN = Fe(SCN3 + 3KCl (用硫氰化钾检测三价铁离子的存在 17 亚铁离子转化成铁单质 Fe2+ + Zn = Fe + Zn2+ 点燃化学方程式 5 18 铁转化成亚铁离子Fe + 2H+ = Fe2+ + H2↑ 19 铁离子转化成铁 Fe2O3 + 3CO 高温2Fe + 3CO2 20 亚铁离子转化成铁离子 2Fe2+ + Cl2 = 2Fe3+ +2Cl- 21 铁离子转化成亚铁离子 2Fe3+ + Fe =3 Fe2+ 22 氯化铁与碳酸钠溶液2FeCl3 + Na2CO3 + 3H2O = 2Fe(OH3↓ +3CO2↑+6NaCl 23 亚铁离子与铁氰化钾溶液:3Fe2+ +2[Fe(CN6]3- = Fe3[Fe(CN6]2↓ (蓝色)二、高中常用的离子方程式 1 氢氧化钡溶液与稀 H2SO4 反应:2H++SO42- +Ba2++2OH-=BaSO4↓+2H2O Ba(OH)2 + H2SO4 == BaSO4 + 2H2O 2 硫酸氢钠溶液中加入氢氧化钡溶液至中性: 2H++SO42- +Ba2++2OH-=BaSO4↓+2H2OH2SO4+Ba(OH2=BaSO4+2H2O 3 硫酸氢钠溶液中加入氢氧化钡溶液至硫酸根沉淀完全: H++SO42- +Ba2++2OH-=BaSO4↓+2H2O NaHSO4+Ba(OH2=BaS O4↓+NaOH+H2O 4 碳酸氢钠溶液和氢氧化钠溶液混合: HCO3-+OH- =CO32- +H2O NaHCO3+ NaOH=Na2CO3+H2O 5 氢氧化钠溶液中加入过量碳酸氢钙溶液: Ca2++HCO3- +OH-=CaCO3↓+H2ONaOH+CaHCO3=CaCO3↓+ Na2CO3+H2O 6 氢氧化钠溶液中加入少量碳酸氢钙溶液:Ca2++2HCO3- +2OH-=CaCO3↓+H2O+ CO32-NaOH+CaHCO3=CaCO3+Na2CO3+H2O 7 澄清石灰水与少量小苏打溶液混合:Ca2+十OH-+HCO3-= CaCO3↓+H2O Ca(OH2+NaHCO3= CaCO3↓+NaOH+H2O 8 澄清石灰水与过量小苏打溶液混合:Ca2++2OH-+2HCO3- = CaCO3↓+2H2O+ CO32-Ca(OH2+2NaHCO3= CaCO3↓+2H2O+ Na2CO3 9 向AlCl3溶液中加入少量的NaOH溶液: Al3+ + 3OH-=Al(OH3↓AlCl3+3NaOH=Al(OH3+3NaCl 10 向AlCl3溶液中加入过量的NaOH溶液: Al3+ +4OH-=AlO2- +2H2O AlCl3+4NaOH= NaAlO2+3NaCl+2H2O 11 氯化铁溶液中加过量氨水:Fe 3++3NH3?H2O= Fe (OH3↓+3NH4+ FeCl3+3NH3?H2O= Fe(OH3↓+3NH4Cl 12 氯化铝溶液中加入过量的氨水 A13++3NH3?H2O=Al(OH3↓+3NH4+ A1Cl3+3NH3?H2O= Al(OH3↓+3NH4Cl 13 氯化铝溶液中加入少量的氨水(同上A13++3NH3?H2O= Al(OH3↓+3NH4+ A1Cl3+3NH3?H2O=Al(OH3↓+3NH4Cl 14 铝片溶于苛性钠溶液:2Al+2OH-+2H2O =2AlO2-+3H2↑ 2Al+2NaOH+2H2O =2NaAlO2+3H2↑ (15 金属铜与稀硝酸反应:3Cu + 8H+ + 2NO3-= 3Cu2+ +4H2O+ 2NO↑ 3Cu+8HNO3(稀=3Cu(NO32 + 4H2O + 2NO↑ 1234567890ABCDEFGHIJKLMNabcdefghijklmn!@#$%^&&*(_+.一三五七九贰肆陆扒拾,。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学无机反应1、钠露置于空气中生成白色固体:4Na+O2= 2Na2O2、钠在空气中燃烧(黄色的火焰):2Na+O2Na2O2(淡黄色固体)3、钠在氯气中燃烧(白烟现象):2Na+Cl22NaCl4、钠与硫在研磨时爆炸:2Na+S=Na2S5、钠与水反应(浮、熔、游、响、红):2Na + 2H2O =2NaOH + H2↑(2Na + 2H2O = 2Na+ + 2OH - +H2 ↑)6、氧化钠与氧气反应:2Na2O+ O2△2Na2O27、氧化钠与稀盐酸反应:Na2O+2HCl= 2NaCl + H2O(Na2O+2H+=2Na++ H2O)8、钠与硫酸铜溶液反应:2Na+2H2O+CuSO4=Cu(OH)2↓+Na2SO4+H2↑(2Na+2H2O+Cu2+=Cu(OH)2↓+2Na++H2↑)9、钠与氯化铁溶液反应:6Na+6H2O+2FeCl3=2Fe(OH)3↓+6NaCl+3H2↑(6Na+6H2O+2Fe3+=Fe(OH)3↓+6Na++3H2↑)10、过氧化钠与水的反应(放热反应、Na2O2是强氧化剂,用于漂白。
)2Na2O2 + 2H2O = 4NaOH + O2↑2Na2O2 + 2H2O = 4Na+ + 4OH - +O2↑(Na2O2既是氧化剂又是还原剂)11、过氧化钙与水的反应:2CaO2 + 2H2O = 2Ca(OH)2 + O2↑12、氧化钙与水的反应:CaO + H2O = Ca(OH)213、过氧化钠可用在呼吸面具和潜水艇中作为氧气来源,原因是:2Na2O2 + 2CO2 = 2Na2CO3 + O2(Na2O2既是氧化剂又是还原剂)14、过氧化钠与二氧化硫气体反应:Na2O2+ SO2= Na2SO4CO、H2在氧气中燃烧后再通过Na2O2时的总反应:(CO、H2全部被吸收)Na2O2+ CO= Na2CO3Na2O2+H2=2NaOH15、过氧化钠与稀盐酸的反应:2Na2O2 +4HCl= 4NaCl + 2H2O + O2↑(2Na2O2 +4H+= 4Na+ + 2H2O + O2↑)16、苏打(纯碱)与盐酸反应:①盐酸中滴加纯碱溶液(有气泡):Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑CO32- + 2H+ = H2O + CO2↑②纯碱溶液中滴加少量盐酸(无气泡):Na2CO3 + HCl = NaHCO3 + NaCl CO32- + H+ = HCO3-17、小苏打受热分解:2NaHCO3△Na2CO3 + H2O +CO2 ↑18、固体氢氧化钠和碳酸氢钠混合物在密闭容器中加热NaHCO3 + NaOH △Na2CO3 + H2O(若是溶液中反应有离子方程式):HCO3-+ OH - = H2O + CO32-19、小苏打(碳酸氢钠)与盐酸反应:NaHCO3+ HCl=NaCl + H2O + CO2↑(HCO3-+H+=H2O+CO2 ↑)20、饱和碳酸钠溶液通入CO2气体(晶体析出):Na2CO3+H2O+CO2=2NaHCO3↓21、少量NaHSO4和Ba(OH)2的反应:NaHSO4+Ba(OH)2=BaSO4↓+H2O+NaOH(H++SO42-+Ba2++OH-=BaSO4↓+H2O)22、足量NaHSO4和Ba(OH)2的反应:2NaHSO4+Ba(OH)2=BaSO4↓+2H2O+Na2SO4(2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O)23、少量NaHCO3和Ca(OH)2的反应:NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH(HCO3-+OH-+Ca2+=CaCO3↓+H2O)24、足量NaHCO3和Ca(OH)2的反应:2NaHCO3+Ca(OH)2=CaCO3↓+2H2O+Na2CO3(2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32-)25、少量Ca(HCO3)2和NaOH的反应:Ca(HCO3)2+2NaOH=CaCO3↓+2H2O+Na2CO3(2HCO3-+2OH-+Ca2+=CaCO3↓+CO32-+2H2O)26、足量Ca(HCO3)2和NaOH的反应:Ca(HCO3)2+NaOH=CaCO3↓+H2O+NaHCO3(HCO3-+OH-+Ca2+=CaCO3↓+H2O)27、少量NH4HCO3和NaOH的反应:NH4HCO3+2NaOH=Na2CO3+NH3•H2O +H2O(NH4++HCO3-+2OH-=CO32-+NH3•H2O+H2O)28、足量NH4HCO3和NaOH的反应:HCO3-+OH-=CO32-+H2O29、少量NH4HSO4和NaOH的反应:NH4HSO4+2NaOH=Na2SO4+NH3•H2O+H2O(NH4++H++2OH-=NH3•H2O+H2O)30、足量NH4HSO4和NaOH的反应:H++OH-=H2O31、足量明矾[KAl(SO4)2•12H2O]和Ba(OH)2的反应:6OH-+3Ba2+ +2Al3++3SO42-=2Al(OH)3↓+3BaSO4↓32、少量明矾[KAl(SO4)2•12H2O]和Ba(OH)2的反应:Al3++2SO42-+4OH-+2Ba2+=AlO2-+2H2O+2BaSO4↓39、金属锂在空气中燃烧:4Li + O2△2Li2O40、金属镁在水中加热:Mg+2H2O △Mg(OH)2+H2↑41、金属镁与盐酸反应:Mg+2HCl=MgCl2+H2↑(Mg+2H+=Mg2++H2↑)42、氧化镁与水反应缓慢:MgO+H2O=Mg(OH)243、氧化镁与盐酸反应:MgO+2HCl=MgCl2+H2O (Mg+2H+=Mg2++H2O)44、铜丝在氯气中剧烈燃烧(棕黄色的烟):Cu+Cl2点燃CuCl245、铁在氯气中剧烈燃烧(棕褐色的烟):2Fe + 3Cl2点燃2FeCl346、铁在氧气中剧烈燃烧(火星四射,放出大量的热):3Fe +2O2点燃Fe3O447、氢气在氯气中燃烧(苍白色火焰,瓶口有白雾):H2 + Cl2点燃2HCl48、氯气溶于水(新制氯水中含H+、Cl -、ClO -、OH-(少量)、Cl2、HClO、H2O):Cl2 + H2O = HCl + HClO Cl2 + H2O = H+ + Cl - + HClO49、次氯酸见光分解(强氧化剂、杀菌消毒,漂白剂)2HClO2HCl + O2↑50、氯气尾气的吸收原理:Cl2+2NaOH NaCl+NaClO+H2O(Cl2+2OH-Cl-+ClO-+H2O)51、久置氯水变稀盐酸原理:2Cl2+2H2O4NaCl + O2↑(2Cl2+2H2O4Na++4Cl-+O2↑)52、工业制漂白粉的原理(石灰乳与氯气反应)及漂白粉的失效:2Ca(OH)2 + 2Cl2 =Ca(ClO)2 + CaCl2 + 2H2O2Ca(OH)2 + 2Cl2=2Ca2++2ClO- + 2Cl -+ 2H2OCa(ClO)2 + CO2 + H2O=CaCO3↓+ 2HClO 2HClO2HCl + O2↑(此反应若在溶液中进行时有离子反应方程式):Ca2++2ClO- + CO2 + H2O=CaCO3↓+ 2HClO53、氯气的实验室制法:(仪器:分液漏斗,圆底烧瓶):MnO2 + 4HCl(浓) MnCl2 +Cl2↑+ 2H2O MnO2 + 4H+ +2Cl-Mn2+ + Cl2↑+ 2H2O54、氯气通常用湿润的淀粉KI试纸检测:Cl2+ 2I-= I2+2Cl-55、溴水能使湿润的淀粉KI溶液变蓝:Br2+ 2I-= I2+2Br-(单质碘遇淀粉溶液变蓝色)56、氯酸钾与浓盐酸反应:KClO3+6HCl(浓)=KCl+ 3Cl2↑+3H2O(ClO3-+6H++5Cl-=3Cl2↑+3H2O)57、高锰酸钾溶液与浓盐酸反应:2KMnO4+16HCl(浓)=2KCl+2MnCl2 +5Cl2↑+8H2O(2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O)58、次氯酸钙溶液与浓盐酸反应:Ca(ClO)2 +4HCl(浓)=CaCl2+2Cl2↑+2H2O(2ClO-+4H++2Cl-=2Cl2↑+2H2O)59、次氯酸钙溶液与稀盐酸反应:Ca(ClO)2 +2HCl(稀)=CaCl2+2HClO(ClO-+H+=HClO)60、酸性高锰酸钾溶液中加入双氧水:2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O(2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O)61、固体NaCl、固体NaClO和浓硫酸制氯气:NaCl + NaClO + H2SO4 =Na2SO4 +Cl2↑+ H2O(产物中Na2SO4写为NaHSO4也可)62、浓氨水检测氯气泄漏时产生白烟现象:8NH3+3Cl2=6NH4Cl+N2 (氨气少量时2NH3+3Cl2=6HCl+N2)63、新制氯水注入盛溴化钠溶液的试管中:Cl2 + 2NaBr = Br2 + 2NaCl Cl2 + 2Br- = Br2 + 2Cl-64、铁与硫加热时反应生成硫化亚铁:Fe + S FeS(黑色固体,不溶于水)65、铜与硫加热时反应生成硫化亚铜:2Cu +S Cu2S(+1价铜)66、硫化亚铁与稀盐酸反应FeS + 2HCl = FeCl2 + H2S↑FeS + 2H+ = Fe2+ +H2S↑67、二氧化硫制三氧化硫(无色固体,熔点16.8℃)2SO2 + O2催化剂加热2SO368、二氧化硫与酸性高锰酸钾溶液的反应:5SO2+2MnO4- +2H2O= 2Mn2+ +5SO42—+4H+二氧化硫被次氯酸钙溶液氧化:2SO2+Ca(ClO)2+2H2O= CaSO4↓+H2SO4+2HCl69、二氧化硫与硫化氢的反应:SO2+2H2S= 3S↓+2H2O70、硫化氢被硫酸铜溶液吸收生成黑色固体沉淀:H2S+CuSO4= Cu2S↓+H2SO471、亚硫酸钠被稀硝酸氧化:SO32—+2H++NO3—= 3SO42—+2NO↑+H2O72、等物质的量的氯气与二氧化硫不能使品红溶液褪色原理:Cl2+SO2+2H2O=2HCl+H2SO4(Cl2+SO2+2H2O=4H++SO42—+2Cl-)73、亚硫酸与氯气的反应:Cl2+H2SO3+H2O=2HCl+H2SO4(Cl2+H2SO3+H2O=4H++SO42—+2Cl-)74、亚硫酸钠与氯气反应的离子方程式:Cl2+SO32—+H2O=2H++SO42—+2Cl-硫代硫酸钠Na2S2O3(俗称“海波”或“大苏打”)与氯气反应:4Cl2+S2O32—+5H2O=10H++2SO42—+8Cl-75、铜与浓硫酸反应:Cu + 2H2SO4 (浓)CuSO4 + 2H2O+SO2 ↑(Cu + 2H2SO4 (浓)Cu2++SO42-+ 2H2O+SO2 ↑)76、碳与浓硫酸反应:C + 2H2SO4(浓)2H2O+CO2↑+2SO2↑77、单质碳充分燃烧:C+O2点燃CO278、单质碳不充分燃烧:2C+O2点燃2CO79、单质碳还原氧化铜:C+2CuO高温2Cu+CO2↑(C+CuO高温Cu+CO↑碳过量)80、工业制单质硅得到粗硅(碳在高温下还原二氧化硅):SiO2 + 2C 高温Si + 2CO↑粗硅与氯气反应:Si+2Cl2SiCl4SiCl4+2H2高温Si(纯硅)+4HCl81、红热的碳与水蒸气反应:C+H2O 高温CO+H2(水煤气成分为CO、H2)82、CO还原氧化铁:3CO+Fe2O3高温2Fe+3CO283、二氧化硅与HF反应:SiO2+4HF=SiF4↑+2H2O 纯碱与石英反应:SiO2+Na2CO3高温Na2SiO3+CO2↑84、二氧化硅与氧化钙反应:SiO2+CaO 高温CaSiO3 石灰石与石英反应:SiO2+CaCO3高温CaSiO3+CO2↑85、二氧化硅与氧化钠反应:SiO2+Na2O高温Na2SiO3纯碱与氧化铝反应:Al2O3+Na2CO3高温2NaAlO2+CO2↑86、单质硅与氢氧化钠溶液的反应:Si+2NaOH+2H2O= Na2SiO3 +2 H2↑(Si+2OH—+2H2O= SiO32—+2 H2↑)87、二氧化硅与氢氧化钠反应:SiO2 + 2NaOH = Na2SiO3 + H2O SiO2 + 2OH - = SiO32- + H2O88、水玻璃通入少量二氧化碳气体:Na2SiO3 + CO2+ H2O= Na2CO3 + H2SiO3↓89、水玻璃通入足量二氧化碳气体:Na2SiO3 +2CO2+2H2O= 2NaHCO3 + H2SiO3↓91、氮气和氢气反应(工业合成氨):N2 + 3H2催化剂高温高压2NH392、实验室制氨气原理:Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O93、实验室简易制氨气原理:①加热浓氨水: NH3•H2O NH3↑+H2O②浓氨水中加碱石灰或NaOH或生石灰CaO:(平衡移动原理)NH3+H2O⇌NH3•H2O⇌NH4++OH-94、实验室简易制氧气原理之一:2H2O22H2O+O2↑95、氮气和氧气放电下反应:N2 + O22NO 2NO + O2=2NO296、二氧化氮溶于水3NO2 + H2O 2HNO3 + NO3NO2 + H2O 2H++ 2NO3- + NO97、NO2、O2的混合气通入水中无剩余气体:4NO2 + O2 + 2H2O = 4 HNO398、NO 、O2的混合气通入水中无剩余气体:4NO+ 3O2 + 2H2O = 4 HNO399、浓硝酸光照(或受热)分解:4 HNO34NO2↑+ O2↑+ 2H2O100、SO2气体通入BaCl2和HNO3的混合溶液,生成白色沉淀和无色气体:3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO↑+4H+。
