供应商资质认证
供应商资质证明及合格证明

供应商资质证明及合格证明作为供应商,持有相关的资质证明和合格证明是非常重要的,这些证明文件可以证明供应商具备供应产品或服务的能力和合规性。
本文将讨论供应商资质证明及合格证明的种类和重要性,并简要介绍如何获得这些证明。
企业注册证明是供应商的注册文件,证明该企业已在相关机构进行了注册,并具备经营的合法性。
税务登记证明是供应商的税务登记文件,证明其已按照相关法律规定进行了税务登记。
组织机构代码证明是供应商的组织机构代码证明文件,证明该企业具备组织机构的合法性。
商业许可证是供应商的商务经营许可证明文件,证明其具备商业经营的合法资格。
产品质量认证证书是供应商的产品质量认证文件,证明其产品达到相应的质量标准。
这些证明文件对于供应商来说非常重要。
首先,它们可以证明供应商是一个合法的企业,有经营和供应产品的合法权利。
其次,这些证明文件可以证明供应商具备一定的经营和管理能力。
例如,企业注册证明和税务登记证明可以证明供应商在法律上具备经营资格;组织机构代码证明则证明供应商具备一定的组织管理能力。
另外,产品质量认证证书也是供应商的重要证明文件。
它可以证明供应商的产品达到一定的质量标准,并具备供应产品的能力。
持有产品质量认证证书可以提高供应商在市场上的竞争力,增加客户对其产品的信任度。
获得这些证明文件并不复杂,但需要供应商具备相应的条件和达到一定的标准。
企业注册证明和税务登记证明可以在相关政府部门办理,需要提交一些企业基本信息和相关材料。
组织机构代码证明可以在质量监督管理机构办理,需要提交企业的组织机构信息和相关材料。
商业许可证需要在相关商务部门办理,需要提交一些商业经营相关的证明材料。
产品质量认证证书需要申请到相应的认证机构进行认证测试,符合相应质量标准后才能获得。
在获得这些证明文件后,供应商需要妥善保管,并在合同签订和供应产品过程中提供给客户。
这些证明文件可以增加客户对供应商的信任度,并证明其具备合法和合规的经营能力。
供应商资质审核制度

餐饮管理有限公司供应商资质审核制度一、一般物品供应商的评选流程:在完善的供应商信息登记库里,由采购部经理至少对三家以上的同类供应商进行提案,提案交分管总经理审阅后,由财务、厨务、营运总监、采购、仓储共同组成考察小组对供应商进行考察并填写考察供应商评估表,该表由财务部汇总意见,交采购办公会讨论取舍,由公管总经理最后审定。
采购办公会由分管总经理、财务经理或主管、营运总监、厨务经理共同参加。
流程图示:采购部完成卜采集表采购经理.提—,总经理考察组. 考察填表财务汇总,办公会讨论______________ K总经理审定二、大宗物品供应的招标评选流程1、大宗物品的界定标准是:用量标准为1000斤/月或金额标准为5000元/月2、供应商合作方式:招标或选择大型供应单位,以签约方式合作。
3、目前各店铺需要进行统计控制的项目有:1 )原材料:蔬菜有四季豆、盒豆腐、青笋、猪红;肉类有猪肉、大头鱼、土公鸡、草鱼;其他有棕油和煤气。
2)干货调料:干辣椒、竹荪、桶山椒、芽菜。
3 )米面:金轮香米、红心咸蛋、员工大米、鸡蛋、百信鸡精。
4)低值易耗品:纸巾、卫生筷、03大汤盒、保鲜纸、锡纸。
三、对大宗物品的管理需要从品牌、品质方面进行监控,与供应商的合作合同中必须有明确的条款,且一经确定,任何店铺不可随意改换,如因市场缺货或店铺产品调整确须更换品牌的,由店铺厨师长填写申请,经店长签字确认,交公司厨政部审核,总经理批准后,方可更换。
四、使用竞标方法时,采购人员不要认为提供最低价格的供应商是最好的供应商,而要综合考虑供应商的送货、过程、售后服务。
有时要放弃与价格最低的供应商合作,而选择不愿提供低价格的供应商,而后者通常在相关项目上会给我们更多的支持。
医疗器械合格供应商认证要点

医疗器械合格供应商认证要点概述:医疗器械合格供应商认证是指在医疗器械行业中,供应商需通过一系列认证程序,获得相应的资质以证明其产品符合相关法规和标准的要求。
这一认证过程对于保证医疗器械产品的质量和安全具有重要作用。
本文将介绍医疗器械合格供应商认证的要点以及相关的标准和流程。
一、医疗器械的分类与认证要求在进行医疗器械合格供应商认证前,首先需要了解医疗器械的分类和相应的认证要求。
1. Ⅰ类医疗器械认证要求:Ⅰ类医疗器械是指与人体的直接接触以及与人体的导电联系或非导电联系的器械,如一次性注射器、医用棉签等。
这类器械的认证要求相对较低,通常只需要符合国家相关法规的要求。
2. Ⅱ类医疗器械认证要求:Ⅱ类医疗器械是指除Ⅰ类和Ⅲ类医疗器械之外的器械,如医用超声设备、心电图机等。
这类器械的认证要求较高,需要符合国家、行业和国际标准的要求,并进行严格的性能测试和质量控制。
3. Ⅲ类医疗器械认证要求:Ⅲ类医疗器械是指对人体生命直接或潜在的影响较大的器械,如人工关节、心脏起搏器等。
这类器械的认证要求最为严格,需要进行临床试验、安全性评价等环节,以保证其安全有效的使用。
二、医疗器械合格供应商认证流程医疗器械合格供应商认证的流程可大致分为以下几个步骤:1. 提交申请:供应商需向相关认证机构提交认证申请,同时提供相应的资质证明和产品信息。
2. 评估审查:认证机构对供应商的资质和产品进行评估审查,包括企业的质量管理体系、技术文件的完整性和准确性等。
3. 现场审查:认证机构对供应商进行实地审查,检查企业的生产设施、工艺流程和人员素质等,以确保其符合认证要求。
4. 样品评测:认证机构将从供应商处获取样品进行测试,以验证产品的质量和性能是否符合相关标准要求。
5. 认证决定:认证机构根据评估审查和样品评测结果,做出认证决定,并颁发相应的合格证书。
三、医疗器械合格供应商认证标准在认证过程中,医疗器械供应商需要符合一系列相关的标准和法规要求。
供应商体系审核评价总结

供应商体系审核评价总结一、供应商资质认证本次审核对供应商的资质进行了严格的审查,包括企业营业执照、税务登记证、组织机构代码证等相关证件。
经过审查,供应商均具备合法经营资质,符合国家相关法律法规要求。
二、质量管理体系供应商均建立了完善的质量管理体系,并获得了ISO9001质量管理体系认证。
供应商严格按照质量管理体系要求进行生产和质量控制,确保产品质量的稳定性和可靠性。
三、生产与制造能力本次审核对供应商的生产与制造能力进行了评估,包括生产设备、工艺流程、生产计划等方面。
供应商均具备先进的生产设备和工艺流程,能够满足生产需求,并具备良好的生产计划管理能力,确保按时交付产品。
四、供货及时性根据供应商的供货记录,对其供货及时性进行了评估。
大部分供应商能够按照合同约定的时间节点及时交付产品,但仍有部分供应商存在延迟供货的现象。
针对此问题,已与相关供应商沟通,要求其加强生产计划管理,提高供货及时性。
五、价格与成本分析本次审核对供应商的价格与成本进行了分析,包括原材料价格、人工成本、生产成本等方面。
大部分供应商在价格方面较为合理,但仍有部分供应商的价格偏高。
针对此问题,已与相关供应商沟通,要求其加强成本控制,降低产品价格。
六、包装与标识规范本次审核对供应商的包装与标识规范进行了检查,包括产品包装、标签标识、运输包装等方面。
大部分供应商的包装与标识规范较为完善,但仍有部分供应商存在标识不清晰、运输包装不规范等问题。
针对此问题,已与相关供应商沟通,要求其加强包装与标识规范管理。
七、售后服务质量本次审核对供应商的售后服务质量进行了评估,包括售后服务响应速度、服务质量等方面。
大部分供应商的售后服务质量较好,能够及时解决客户问题,但仍存在部分供应商的售后服务质量较差的问题。
针对此问题,已与相关供应商沟通,要求其加强售后服务团队建设,提高服务质量。
八、技术支持能力本次审核对供应商的技术支持能力进行了评估,包括技术水平、研发能力等方面。
合格供应商申请认证资料
4.提交资质文件的电子版。纸面文件装订成册,电子文件发送到指定的邮箱。
6.经审计的近三年财务报告;
企业概况、主要产品市场价格表;
7.主要产品目录样品宣传册;
8.近三年同类主要业绩表;
10.质量保证体系认证证书;
11.售后服务承诺及质量跟踪服务体系;
12.其他需要提供的材料;
资质文件要求:
1.各项资质文件应加盖公司公章。
2.所有资质类文件需是在有效期内,需要定期审查的要通过当期审查。
7.近三年同类主要业绩表;
8.企业概况、主要产品市场价格表;
9.主要产品目录样品宣传册;
10.提供专利产品的企业提供专利产品证;11..法人企业的分支机构提供上级法人单位授权证明及商业担保材料;
12.质量保证体系认证证书、环境与职业健康安全管理体系证书;
13.环保证书;
14.售后服务承诺及质量跟踪服务体系;
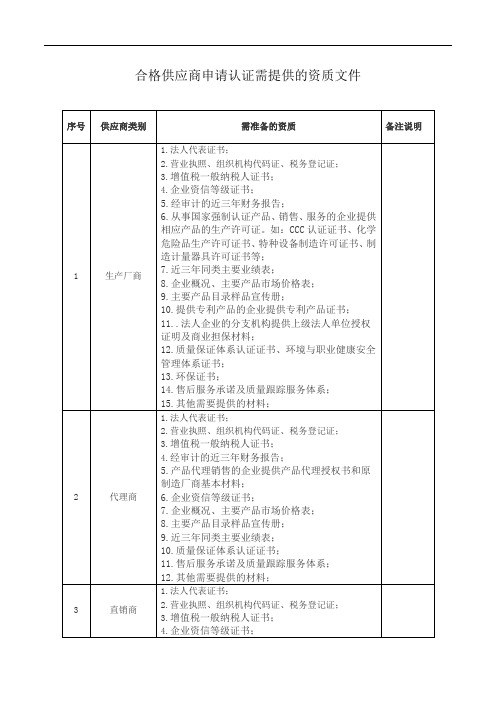
合格供应商申请认证需提供的资质文件
序号
供应商类别
需准备的资质
备注说明
1
生产厂商
1.法人代表证书;
2.营业执照、组织机构代码证、税务登记证;
3.增值税一般纳税人证书;
4.企业资信等级证书;
5.经审计的近三年财务报告;
6.从事国家强制认证产品、销售、服务的企业提供相应产品的生产许可证。如:CCC认证证书、化学危险品生产许可证书、特种设备制造许可证书、制造计量器具许可证书等;
10.质量保证体系认证证书;
11.售后服务承诺及质量跟踪服务体系;
12.其他需要提供的材料;
3
直销商
1.法人代表证书;
2.营业执照、组织机构代码证、税务登记证;
供应商认证流程范文

供应商认证流程范文一、准备阶段1.确定认证标准和要求:企业需要明确自身对供应商的要求和标准,包括产品质量、交货时间、服务水平、价格等方面。
2.制定供应商认证程序:制定供应商认证程序包括确定认证流程、制定供应商评估表、制定供应商评估标准和指标等。
二、供应商申请和评估阶段1.供应商申请:供应商向企业提交申请,包括基本信息、产品或服务信息、参考客户等。
2.供应商初步评估:企业对供应商提交的信息进行初步筛选和评估,主要包括对供应商是否具备所需的资质和能力进行初步核实。
3.供应商评估表评估:企业根据评估表对供应商进行详细的评估,评估指标包括供应商的管理体系、生产能力、环境管理、质量管理、安全生产等方面。
4.供应商实地考察:企业对供应商进行实地考察,包括考察供应商的生产能力、质量管理体系、物流能力、设备设施等。
三、供应商认证阶段2.样品测试或样品送检:企业对供应商的产品进行样品测试或送检,确保产品符合要求。
3.委员会评审:由企业内部的相关人员组成委员会,对供应商的评估结果进行综合考虑和审查,最终决定是否通过供应商认证。
4.认证结果通知:企业向供应商发出认证结果通知,通知中明确认证的有效期和范围。
四、供应商监督和管理阶段1.监督考核:企业对已认证的供应商进行定期的监督考核,监督考核内容包括产品质量、交货准时性、服务水平等。
2.不合格供应商处理:如果供应商在监督考核中出现问题,企业根据管理制度进行相应的处理,包括警告、暂停合作、终止合作等。
供应商认证流程的确立和实施对于企业的采购和供应链管理非常重要。
通过认证流程,企业能够筛选出满足要求的供应商,确保采购的产品或服务的质量和可靠性,进一步提升企业的竞争力和业务发展。
同时,供应商认证流程也能够促使供应商不断提升自身的管理和服务水平,为企业提供更好的支持和合作。
供应商资格评审须知

供应商资格评审须知广西电网公司物资分公司欲建立电力设备材料供应商库;凡是具备有生产、销售各类电力设备材料资质的供应商均可申报登记;现将供应商申报登记和管理办法告知各有意进入该库的供应商;一、供应商库的构成电力设备材料供应商库由潜在供应商库、具备投标资质供应商库和合格供应商库组成;二、供应商必须具备的条件1、具有独立法人资格;2、遵守国家法律、行政法规,具有良好的信誉;3、具有所申报的设备材料的经营、生产资格;4、具有履行合同的能力和良好的履行合同的记录;5、具有一定规模和良好的资金财务状况;6、具有良好的售后服务和提供限时服务的能力;三、供应商资格的申报程序及要求一、供应商登记1、供应商登记进入电力设备材料供应商库采取自愿原则,有意加入该库的供应商应提出书面申请,并填写供应商预审登记表及企业申报产品目录格式见附件一;该资料单独提供,正本一份;2、原则上不允许制造厂家及其代理/经销商同时参与申报,且一个制造厂家只能指定一家代理/经销商前来申报;3、对于非制造厂家的申报要求:原则上一个代理/经销商可以代理/经销几个种类的设备,但仅限于同一种类代理/经销一种品牌的设备材料,不允许代理/经销同一种类不同品牌的设备材料的情况;二、供应商资格审查文件的组成部分2、非制造厂家资格审查文件具体内容详见广西桂网物流网“资料中心”的资料下载栏中“编号82非制造厂家资格审查文件内容要求”,该文件须经我方审查确认后提供密码方可获取;三、对提供的资质审查资料的要求:1、供应商必须如实提供资质审查文件,不许弄虚作假或隐瞒真实情况;2、此次资格评审将采用电子评审的方式,请各供应商严格按照2007年广西电网公司供应商评审电子资料制作要求统一制作,并刻录成光盘光盘规格统一要3.5寸120mm,包装要求详见“资料中心”的资料下载栏中“编号87光盘包装制作说明与纸质文件一并递交;3、资格审查文件正本一式二份,包括供应商资质文件、财务文件及产品生产资质文件三部分,制作要求如下:1电子版本文件的要求供应商必须制作一套用Microsoft office word中文版制作的载有全部资格审查文件内容的电子版文件图片须扫描,具体要求详见广西桂网物流网“资料中心”的资料下载栏中“编号85及862007年广西电网公司供应商评审电子资料制作要求;2纸质文件要求A请将按要求制作好的电子版文件直接打印成纸质文件,以确保纸质文件内容与电子版文件内容的一致性;B供应商资质文件和财务文件须单独装订成册;C产品生产资质文件须按每一种设备设备分类详见附件三单独装订成册;D资格审查文件正本的每一页均应加盖单位公章;4、无效文件发生下列情况之一者,均视为无效文件,不予接纳:A文件未按要求编制;B文件未按规定加盖公章;C提供虚假资料;D资格审查文件提供不全,文字、图章不清晰;E未按要求提供载有全部资格审查文件内容或内容不全、不清晰的电子版文件;F电子版文件内容与纸质文件内容不一致;四、文件递交时间:以我方通知为准文件递交方式:供应商自行送达或邮寄送达地点:广西桂网物流有限责任公司电力1号楼413号房邮寄地址:南宁市民主路6号电力1号楼413号全称:广西桂网物流有限责任公司邮编:530023收件人:罗毓成联系电话:************四、潜在供应商资格的确定相关工作人员对各供应商的申报登记文件进行审核,满足以下条件的供应商进入潜在供应商库:1、符合本须知第二点条件要求的;2、供应商提供的资质审查文件符合本须知第三点对资质审查文件要求的;五、具备投标资质供应商资格的确定经相关专家对各潜在供应商的资质审查文件进行评审后确定具备投标资质供应商;六、供应商的管理1、当供应商出现以下情况时,经核实后,取消其具备投标资质供应商资格;1提供虚假审查材料的;2拒绝接受检查或者不如实反映情况、提供材料的;3弄虚作假、隐瞒真实情况骗取公司具备投标资质供应商资格的;2、自动退出:进入具备投标资质供应商库的供应商可以自动退出,但必须向桂网公司办理相关退出手续,退出的同时失去具备投标资质供应商资格;3、供应商需要进行单位名称或委托授权人信息变更的,应书面通知桂网公司,并办理相关信息变更或注销手续具体详见广西桂网物流网“资料中心”的供应商注册信息栏中编号78;4、如贵公司认为资格审查材料中有需要更新的,可以在下一次评审前将更新材料递交我公司更新;八、其他1、本须知由广西桂网物流有限责任公司负责解释;2、本须知如有修改将另行通知;附件一申请书、供应商预审登记表及企业申报产品目录格式1、申请书格式详见广西桂网物流网“资料中心”供应商注册信息栏中的附件一编号742、预审登记表格式详见广西桂网物流网“资料中心”供应商注册信息栏的附件二编号733、申报产品目录格式详见广西桂网物流网“资料中心”供应商注册信息栏的附件三编号72附件二主要经营产品清单格式附件三证书清单目录企业名称:附件四产品分类表详见广西桂网物流网“资料中心”的资料下载栏中“编号81产品分类表”附件五业绩格式1、销售业绩总表企业名称:2、设备区外/区内/电网系统销售业绩明细表附件六分包与外购格式供应商要按下列表格填写分包情况表、外购情况表,并报各分包供货商及外购商的简要资质情况及联系方式1、分包情况表2、外购情况表。
不同类型企业供应商资质证明及合格证明明细

不同类型企业供应商资质证明及合格证明明细根据《食品安全法》企业在选择供应商时需要求供应商提供相应证明。
以下为不同类型企业供应商的资质证明及合格证明明细。
01一、考虑到《既是食品又是药品的物品名单》中的部分物质是没有食品生产许可的,故:1.从药品生产企业购买中药饮片,需索取其《营业执照》、《药品生产许可证》、《药品生产质量管理规范认证证书》(GMP证)及检验报告。
2.从药品经营企业购买中药饮片,需索取其《营业执照》、《药品经营许可证》、《药品经营质量管理规范认证证书》(GSP证),与药品生产企业的《营业执照》、《药品生产许可证》、《药品生产质量管理规范认证证书》(GMP证)及检验报告。
3.从药品经营企业购买中药材,需索取其《营业执照》、《药品经营许可证》、《药品经营质量管理规范认证证书》(GSP证);如果是从批发企业购买,可能会提供检验报告;从药品零售企业购买,则一般不提供检验报告。
4.药品要求出厂检验全检(执行标准全部项目,类似食品的型式检验),故购买中药饮片可只索取出厂检验报告。
02二、食品(食品添加剂)生产企业:《营业执照》、《食品生产许可证》、型式检验报告;产品出厂报告或第三方检验报告、发证核检验报告。
03三、食品经营(流通)企业:《营业执照》、《食品经营许可证》(《食品流通许可证》),及所供货食品的生产企业的:《营业执照》、《食品生产许可证》、型式检验报告;04四、餐饮服务(食品经营)企业:《营业执照》、《食品经营许可证》(《餐饮服务许可证》);05五、食品相关产品生产企业:《营业执照》、《全国工业产品生产许可证》(未纳入发证范围的不需要)、型式检验报告;产品出厂报告或第三方检验报告、发证核检验报告。
06六、食品相关产品经营企业:《营业执照》,及所供货食品相关产品生产企业的:《全国工业产品生产许可证》(未纳入发证范围的不需要)、型式检验报告;07七、消毒产品生产企业:《营业执照》、《卫生许可证》、《卫生许可批件》(未纳入许可范围的不需要)、型式检验报告;产品出厂报告或第三方检验报告、发证核检验报告。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
ECA Academy > GMP News > News Details01.03.2017What are the current Rules for Supplier Qualification?供应商资质认证的现行规定是什么?Supplier Qualification is more than auditing. Supplier qualification can be seen as a risk assessment tool. It should provide an appropriate level of confidence that suppliers, vendors and contractors are able to supply consistent quality of materials, components and services in compliance with regulatory requirements. An integrated supplier qualification process should also identify and mitigate the associated risks of materials, components and services. But what are the exact requirements?供应商资质认证不只是审计。
供应商资质认证可以被看作是风险评估的工具。
供应商资质认证应提供一个置信水平,即供应商,分销商和承包商能够提供符合法规质量要求的物料、成分以及服务。
一个完整的供应商资质认证程序也应确认并减轻物料,成分以及服务的相关风险。
但是,准确的要求是什么呢?They are wide-ranging and complex. There are different directives and regulations for medicinal drug products for human or veterinary use and for investigational medicinal drug products. Certain requirements in different directives and the EU-GMP Guidelines define expectations. Here are some examples:这些要求范围广且复杂。
关于人或动物使用的医药品,以及临床医药品有不同的指令和法规。
在不同指令中的具体要求和EU-GMP指南规定了期望的内容。
这有一些例子:Article 8 of EU-Directive 2001/83/EC"The application [of a marketing authorization] shall be accompanied […] by […] a written confirmation that the manufacturer of the medicinal product has verified compliance of the manufacturer of active substance with principles and guidelines of good manufacturing practice by conducting audits."EU-指令第八条 2001/83/EC申请【一个市场销售的申请】应带有一个书面的确认,即通过审计,药品生产商被确认符合原料药制造商的原则和GMP指南的。
Article 46 of EU-Directive 2001/83/EC"The holder of a manufacturing and/or import authorisation shall at least be obliged […] to use only active substances, which have been manufactured in accordance with GMP for active substances and distributed in accordance with GDP for active substances and … to ensure that the excipients are suitable for use in medicinal products by ascertaining what the appropriate GMP is."EU-指令第46条 2001/83/EC生产持有者或进口许可应该至少有义只使用依照原料药GMP生产的,并且依照原料药GDP销售的原料药,,通过正确的GMP以确保辅料适合用于药品中. Article 46b of EU-Directive 2001/83/EC"Active substances shall only be imported if they have been manufactured inaccordance with standards of good manufacturing practice at least equivalent to those laid down by the European Union". This can be shown by a written confirmation or the exporting country is included in the so called white list or a waiver has been granted.EU-指令第46条b 2001/83/EC如果原料药依照GMP标准(至少EU提出的同等的要求)生产的,可被进口。
这可以由一个书面的确认表明,并且出口过应包括在所谓的白名单中或弃权。
EU-GMP Guidelines Chapter 5 (Production):EU-GMP指南第五章(生产)5.27 "The selection, qualification, approval and maintenance of suppliers of starting materials, together with their purchase and acceptance, should be documented as part of the pharmaceutical quality system..."5.27 起始物料供应商的选择、资质认证、批准和维护,以及起始物料的采购和接收,应该作为药物的质量系统的一部分记录在案。
5.29 "Audits should be carried out at the manufacturers and distributors of active substances to confirm that they comply with the relevant good manufacturing practice and good distribution practice requirements. (…) Audits should be of an appropriate duration and scope to ensure that a full and clear assessment of GMP is made; (…). The [audit] report should fully reflect what was done and seen on the audit with any deficiencies clearly identified. Any required corrective and preventive actions should be implemented. Further audits should be undertaken at intervals defined by the quality risk management process to ensure the maintenance of standards and continued use of the approved supply chain."5.29 应对原料药的制造商和分销商进行审计,已确认他们符合相关的GMP和GDP的要求。
审计应该具有一个恰当的期限、范围,确保做出全面清楚的GMP 评估。
审计报告应全面反应在审计中所做和所见到的,以及确认的缺陷。
要求的整改措施应该被执行。
质量风险管理程序在指定的时间间隔内应进行进一步的审计,确保标准维护和批准的供应链的持续使用。
5.45 "The selection, qualification, approval and maintenance of suppliers of primary and printed packaging materials shall be accorded attention similar to that given to starting materials."5.45对于外包装材料和印刷的包装材料的供应商的选择、资质认证、批准和维护应与起始物料的供应商一致。
Chapter 7 of the EU-GMP Guidelines(Outsourced Activities) describes the responsibilities of the Contract Giver when it comes to contract manufacturing and testing. He needs to assure the control of the outsourced activities, incorporating quality risk management principles and including continuous reviews of the quality of the Contract Acceptor's performance. Audits are helpful tool to asses the "legality, suitability and the competence of the Contract Acceptor". The new Chapter 7 was obviously designed to intensify the control of Contract Acceptors by the Contract Giver and extend those controls to subcontractors.当谈到外包生产和检验时,EU-GMP指南第七章(外包活动)描述了合同授予人的责任。
