9.3平衡蒸馏和简单蒸馏
化工原理第四版陈敏恒答案

化工原理陈敏恒第三版上册答案【篇一:化工原理答案第三版思考题陈敏恒】lass=txt>传质是体系中由于物质浓度不均匀而发生的质量转移过程。
3.在传质理论中有代表性的三个模型分别为双膜理论、溶质渗透理论、表面更新理论。
5. 根据双膜理论两相间的传质阻力主要集中在相界面两侧的液膜和气膜中,增加气液两相主体的湍流程度,传质速率将增大。
8、操作中精馏塔,保持f,q,xf,d不变,(1)若采用回流比r小于最小回流比rmin,则xd减小,xw增大(2)若r增大,则xd增大, xw减小 ,l/v增大。
9、连续精馏塔操作时,增大塔釜蒸汽用量,而回流量及进料状态f,xf,q不变,则l/v变小,xd变小,xw变小。
10、精馏塔设计时采用的参数f,q,xf,d,xd,r均为定值,若降低塔顶回流液的温度,则塔内实际下降液体量增大,塔内实际上升蒸汽量增大,精馏段液汽比增大,所需理论板数减小。
11、某精馏塔的设计任务:原料为f,xf,要求塔顶为xd,塔底为xw,设计时若已定的塔釜上升蒸汽量v’不变,加料热状况由原来的饱和蒸汽改为饱和液体加料,则所需理论板数nt 增加,精馏段上升蒸汽量v 减少,精馏段下降液体量l 减少,提馏段下降液体量l’ 不变。
(增加、不变、减少)不变,增大xf,,则:d 12、操作中的精馏塔,保持f,q,xd,xw,v’,变大,r变小,l/v变小(变大、变小、不变、不确定)1.何种情况下一般选择萃取分离而不选用蒸馏分离?萃取原理: 原理利用某溶质在互不相溶的溶剂中的溶解度利用某溶质在互不相溶的溶剂中的溶解度互不相溶的溶剂中的不同,用一种溶剂(溶解度大的)不同,用一种溶剂(溶解度大的)把溶质从另一种溶剂(溶解度小的)中提取出来,从另一种溶剂(溶解度小的)中提取出来,再用分液将它们分离开来。
分液将它们分离开来再用分液将它们分离开来。
萃取适用于微溶的物质跟溶剂分离,蒸馏原理:利用互溶的液体混合物中各组分的沸点不同,利用互溶的液体混合物中各组分的沸点不同,给液体混合物加热,使其中的某一组分变成蒸气再给液体混合物加热,冷凝成液体,从而达到分离提纯的目的。
简单蒸馏与平衡蒸馏比较的一种定性分析方法

简单蒸馏与平衡蒸馏比较的一种定性分析方法万惠萍;尉志苹【摘要】简单蒸馏和平衡蒸馏是蒸馏操作的两种方法,用定量的计算来进行这两种蒸馏方法的比较很繁琐,而将t—x(y)相图应用在两者的定性分析比较中,则可以很直观地描述出各过程。
本文通过具体的实例进行分析,从而得知,在相同条件下,简单蒸馏总是优于平衡蒸馏。
%Simple distillation and equilibrium distillation were two methods of distillation operations. Quantitative cal- culation for this comparison of two distillation methods was cumbersome. But applying the phase diagram t -x (y)in both in the comparison of qualitative analysis, description was very intuitive to processe. From analysis of specific instances, it showed that under the same conditions, simple distillation was always better than equilibrium distillation.【期刊名称】《广州化工》【年(卷),期】2012(040)009【总页数】3页(P35-37)【关键词】简单蒸馏;平衡蒸馏;比较;定性分析【作者】万惠萍;尉志苹【作者单位】大连工业大学,辽宁大连116034;大连工业大学,辽宁大连116034【正文语种】中文【中图分类】TQ02蒸馏操作是化工生产中分离液体均相混合物的一种单元操作,它是利用液体混合物各组分在一定压强下挥发度或沸点的不同使各组分得到分离.液体混合物加热部分汽化时,挥发度大的组分在气相中的浓度将大于在液相中的浓度,从而使得混合物得到部分分离.蒸馏可以按不同方法分类,最基本的有简单蒸馏、平衡蒸馏及精馏.若待处理物料中两组分的相对挥发度差异较大或分离提纯程度要求不高时,常常采用简单蒸馏或平衡蒸馏的方法.简单蒸馏的基本流程如图1所示.一定量的原料液投入蒸馏釜中,在恒定压力下加热汽化,陆续产生的蒸气进入冷凝器,经冷凝后的液体(又称馏出液)根据不同要求放入不同的产品罐中,最终将釜液一次排出.在简单蒸馏过程中,随着液体的逐渐蒸出,釜液中易挥发组分含量不断降低,温度也相应升高,与之相平衡的气相浓度也随之降低,因此简单蒸馏是一个不稳定的间歇过程,产品罐中收集到的液体浓度是一个时间段内的平均值[1].平衡蒸馏又称闪蒸,系连续定态过程,其流程如图2所示.原料连续地加入加热炉,在炉内被加热至一定温度,然后经节流阀减压至预定压强,由于压强的突然降低,过热液体发生自蒸发,液体部分汽化.气、液两相在分离器中分开,气相为顶部产物,其中易挥发组分较为富集;液相为底部产物,其中难挥发组分获得了增浓[2].因为简单蒸馏和平衡蒸馏都是达到组分的部分增浓,使混合物得到有限的分离,那么哪一种蒸馏效果会更好一些呢?关于这两种蒸馏的比较,几乎所有的《化工原理》教材中都是通过计算来进行的[3-6],而很多情况下我们只需要进行它们的定性比较,而定量的计算要求掌握公式,计算比较繁琐,并涉及到非线性方程的计算,求解还容易出错.因此,掌握一种定性分析的方法显得尤为重要.对溶液加热即产生气相,气液间的平衡是蒸馏的热力学基础,是进行蒸馏分析和计算的基本依据,两组分的气、液平衡可用t-x(y)函数关系或相图来表示.t-x(y)相图表示在总压P一定的条件下,相平衡时气(液)相组成与温度的关系[7].其中t表示温度,x,y分别表示易挥发组分在液相及气相中的摩尔分数.将t-x(y)相图应用到简单蒸馏和平衡蒸馏的定性分析比较中,是一种非常简单、方便又易懂的好方法.对于某双组分混合液,分别用简单蒸馏与平衡蒸馏方法进行分离,操作压力P、原料液量F、组成xF均相同.(1)若气相馏出物组成(或平均组成)相同,即y平=简,试比较残液(或液相产品)组成xW简与xW平、气相馏出物流率D简与D平.分析:在t-x(y)相图中,简单蒸馏过程和平衡蒸馏过程如图3所示.简单蒸馏过程:用11'22'表示.1表示原料液组成,1'表示第一个气泡组成;2'表示最后一个气泡组成,2表示残液组成xW简.由于在简单蒸馏过程中,蒸出的气相组成是不断降低的,即是从1'降至2',因此气相馏出物平均组成简定在1'2'之间,图中用点D 示意表示.平衡蒸馏过程:由于平衡蒸馏系定态过程,所得到的馏出物组成与塔釜液相组成成平衡关系,根据已知条件y平=简,故该过程可用水平线WD表示,W点对应的组成即为残液组成xW平.从图3中很容易看出:xW简<xW平,即简单蒸馏残液组成较小.下面分析气相馏出物流率的大小:对简单蒸馏作物料衡算:得对平衡蒸馏作物料衡算:式(1)、(2)相减,并整理得:因xW简<xW平,所以式(3)>0,即D简>D平,简单蒸馏气相馏出物流率较大. (2)若残液组成相同xW简=xW平,试比较气相馏出物的组成简与y平.分析:在图3中,保持简单蒸馏过程不变,2表示残液组成xW简,因xW简=xW平,则平衡蒸馏过程变为22'线,2'对应的组成即为平衡蒸馏气相馏出物的组成y平;而根据简单蒸馏的原理可知简单蒸馏气相馏出物平均组成简介于1'2'之间,即一定大于2'对应的组成,故简>y平,简单蒸馏气相馏出物的平均组成较大.(3)若气相馏出物流率相同,即D简=D平,试比较残液组成xW简与xW平,气相馏出物组成简与y平.分析:已知D简=D平,由简单蒸馏和平衡蒸馏的物料衡算可知:F=D简+W简=D平+W平因此得到W简=W平.又因为FxF=D简简+W简xW简=D平y平+W平xW平得式(4)难以断定各参数的大小,现采用反证法来解决.假设xW简≥xW平,根据式(4)必有y平≥简.但由图4可知:若xW简≥xW平,必有y 平<简,与假设的结果矛盾.由此可见,xW简≥xW平不成立,也就是说,xW简<xW平,代入式(4)得简>y平.即简单蒸馏残液组成较小,气相馏出物的平均组成较大.通过以上分析可知,无论是在气相馏出物浓度相等还是气相馏出物流率相等的情况下,简单蒸馏的液相产品浓度都小于平衡蒸馏;无论是在液相产品浓度相等还是气相馏出物流率相等的情况下,简单蒸馏的馏出物平均浓度都大于平衡蒸馏;而在气相馏出物浓度相等的情况下,简单蒸馏的气相馏出物流率也比平衡蒸馏的大.由以可见,可以得到一个结论:在相同条件下,简单蒸馏总是优于平衡蒸馏.将t-x(y)相图应用在简单蒸馏和平衡蒸馏中,可以很直观地描述出各过程的变化,各浓度的大小,对于两种蒸馏的定性比较来说,是一种通俗易懂而又简便可行的好工具、好方法.【相关文献】[1] 冯霄,何潮洪.化工原理[M].北京:科学出版社,2007:82-82.[2] 陈敏恒,丛德滋,方图南,等.化工原理[M].北京:化学工业出版社,2008:49-49.[3] 黄少烈,邹华生.化工原理[M].北京:高等教育出版社,2008: 260-261.[4] 夏清,陈常贵.化工原理[M].天津:天津大学出版社,2005:12-13.[5] 蒋维钧,余立新.化工原理化工分离过程[M].北京:清华大学出版社,2005:113-114.[6] 马晓迅,夏素兰,曾庆荣.化工原理[M].北京:化学工业出版社, 2010:254-254.[7] 叶世超,夏素兰,易美桂.化工原理[M].北京:科学出版社,2006: 64-64.。
化工原理蒸馏精馏知识要点

三、操作线方程
1. 精馏段操作线方程
对如图划定范围作物料衡算 V=L+D 对易挥发组分衡算 Vyn+1=Lxn + DxD V, yn+1
D,xD
第n板
L, xn
Dx D L y n 1 x V V 令回流比 R=L/D xD R y n1 xn R1 R1
2. 恒摩尔溢流
精馏段内,每层塔板下降的溢流摩尔流量相等。 提馏段内,每层塔板下降的溢流摩尔流量相等
L1=L2=…=Ln=定值 (精馏段) L 1=L2=…=Ln=另一定值 (提馏段) 一定注意: 精馏段和提馏段下降的溢流分别不相等。 精馏段和提馏段上升的蒸汽分别不相等。 因为加料板加入原料液后使两段汽液两相流量发 生变化。 当各组分摩尔汽化焓相等,汽液接触良好且可忽 略显热(与汽化热比较),保温良好且塔的热损失 可忽略时,恒摩尔流假定基本上成立。
露点
泡点
x或 y
0 P p A pB p 0 x p A A B (1 x A )
xA
0 P pB 0 p0 p A B
y A p0 A xA / P
对某一温度和总压,由这几式可求出xA,yA。 得出一系列的值后便可作出如前图所示的图来。 对于非理想溶液,计算很复杂。一般由实验得 出平衡数据。实验得出的平衡数据也是计算的 基础。
2. 相对挥发度(relative volatility)
溶液中两组分挥发度之比称相对挥发度,。通 常用易挥发组分挥发度作分子。
vA pA / x A vB pB / x B
9-2 平衡蒸馏与简单蒸馏
αx 若为理想溶液则为: y = 1 + (α − 1) x
2. 平衡蒸馏过程的计算
1.0
泡
e
点
xf q y = q −1 x − q −1 联立求解 y = αx 1+ (α −1)x
0
f te xf 1.0
(te, x)
x
ef 过
解 平衡 te
衡算 f x=xf y=xf
露点线
泡点线 yf
0 xw x
xf yw y x(y)
1.0
间歇、非定态过程,取时间微元 dτ
蒸出物料量dW dτ 液体组成(x − dx)
在dτ时间内对其始末进行物料衡算
Wx
=
ydW 塔顶量
+ +
末量
(W − dW )( x − dx ) 塔釜残留量
釜中量 =
始量
展开,略去二阶无穷小量,可写为:
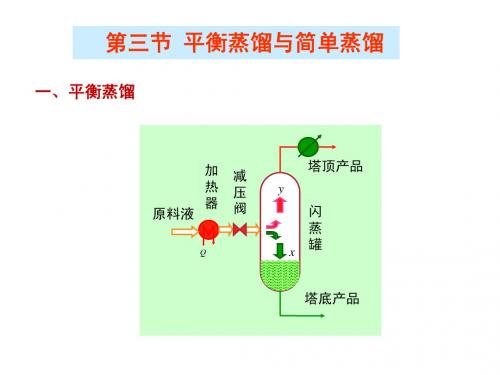
第三节 平衡蒸馏与简单蒸馏
一、平衡蒸馏
原料液
加 热 器
减 压 阀
塔顶产品
y
Q
x
闪 蒸 罐
塔底产品
1. 过程数学描述 1.1、物料衡算 、 连续定态过程
总物料衡算: F = D+W 总物料衡算 易挥发组分物料衡算: 易挥发组分物料衡算:Fxf=Dy+Wx
D xf − x = F y−x
冷凝器
F, xF , tF
加压顶部产品 D=(1-q)F, y, te 底部产品 W=qF, x , te
平衡蒸馏装置
设 冷凝率
W q= F
汽相线
(残液率)即液相产物占总加料量F的分率
汽化率
D = (1 − q ) F
蒸馏定义及特点(精)

2、按操作压力分为加压、常压和真空蒸馏
常压下为气态(如空气、石油气)或常压下泡点为室温 的混合物,常采用加压蒸馏;常压下,泡点为室温至 150℃左右的混合液,一般采用常压蒸馏;对于常压下泡 点较高(一般高于150℃)或热敏性混合物(高温下易发生分 解,聚合等变质现象),宜采用真空蒸馏,以降低操作温 度。
精馏是利用混合液中各组分间挥发度 的差异以实现高纯度分离的一种操作。平 衡蒸馏仅通过一次部分汽化和冷凝,只能 部分地分离混合液中的组分,若进行多次 的部分汽化和部分冷凝,便可使混合液中 各组分几乎完全分离。
一、精馏原理
工业上是将上图的每个分离器做成一块;或在一个圆形的塔内 装有一定高度的填料。板上液层或填料表面是汽液两相进行传热和 传质的场所。
所谓泡点是指液体在恒定的外压下,加热至开始出 现第一个气泡时的温度。露点是指气体冷却时,开始凝 聚出第一个液滴时的温度
3、按被分离混合物中组分的数目可分为两组分 精馏和多组分精馏
工业生产中,绝大多数为多组分精馏,但两 组分精馏的原理及计算原则同样适用于多组分精 馏,只是在处理多组分精馏过程时更为复杂些, 因此常以两组分精馏为基础。
4.按操作流程分为间歇蒸馏和连续蒸馏 间歇蒸馏主要应用于小规模、多品种或某些
有特殊要求的场合,工业中以连续蒸馏为主。间 歇蒸馏为非稳态操作,连续蒸馏一般为稳态操作。
三、精馏操作流程
精馏分离过程可连续操作,也可间歇操作。 精馏装置系统一般都应由精馏塔、塔顶冷凝器、 塔底再沸器等相关设备组成,有时还要配原料预 热器、产品冷却器、回流泵等辅助设备。
2.2 简单蒸馏和平衡蒸馏
对于组分挥发度相差较大、分离要求 不高的场合(如原料液的组分或多组分的初 步分离),可采用简单蒸馏和平衡蒸馏。
化工原理蒸馏

第六章蒸馏蒸馏定义:蒸馏分类:易挥发组分难挥发组分有回流蒸馏(精馏)无回流蒸馏:简单蒸馏(间歇操作)平衡蒸馏(连续操作)特殊蒸馏:萃取蒸馏、恒沸蒸馏按操作压力可分为加压、常压和减压蒸馏两组分精馏和多组分精馏第一节双组分溶液的气液相平衡一、溶液的蒸汽压与拉乌尔定律纯组分的蒸汽压与温度的关系:拉乌尔定律:在一定温度下,理想溶液上方气相中任意组分的分压等于纯组分在该温度下的饱和蒸气压与它在溶液中的摩尔分数的乘积。
p=p A0x AA(6-2)p=p B0x B=p B0(1-Bx) (6-3)A式中p A、p B——溶液上方A,B组分的平衡分压,Pa;p0——在溶液温度下纯组成的饱和蒸汽压,随温度而变,其值可用安托尼(Antoine)公式计算或由相关手册查得,Pa;x、x B——溶液中A,B组分的摩尔分数。
A二、理想溶液气液平衡(一)t-y-x图1.沸点-组成图(t- x- y图)(1)结构以常压下苯-甲苯混合液t- x- y图为例,纵坐标为温度t,横坐标为液相组成x A和汽相组成y A(x,y均指易挥发组分的摩尔分数)。
下曲线表示平衡时液相组成与温度的关系,称为液相线,上曲线表示平衡时汽相组成与温度的关系,称为汽相线。
两条曲线将整个t- x- y图分成三个区域,液相线以下称为液相区。
汽相线以上代表过热蒸汽区。
被两曲线包围的部分为汽液共存区。
t- x- y图数据通常由实验测得。
对于理想溶液,可用露点、泡点方程计算。
(2)应用在恒定总压下,组成为x,温度为t1(图中的点A)的混合液升温至t2(点J)时,溶液开始沸腾,产生第一个汽泡,相应的温度t2称为泡点,产生的第一个气泡组成为y1(点C)。
同样,组成为y、温度为t4(点B)的过热蒸汽冷却至温度t3(点H)时,混合气体开始冷凝产生第一滴液滴,相应的温度t3称为露点,凝结出第一个液滴的组成为x1(点Q)。
F、E两点为纯苯和纯甲苯的沸点。
图苯-甲苯物系的t- x- y图图苯-甲苯物系的y- x图应用t- x- y图,可以求取任一沸点的气液相平衡组成。
化工原理第九章液体精馏

FiF Li V I Li VI
由恒摩尔假定,不同温度和组成的饱和液体焓i和汽 化潜热均相等。
20
联立上二式,得 定义:
L L I iF F I i
q
I iF分子:1kmol原料变成饱和蒸气所需的热 I i 分母:原料的摩尔汽化热
可得
L L qF
V V (1 q)F
q为加料热状态参数 q=0,饱和气体(露点);q=0,饱和液体(泡点) q<0,过热蒸气;0<q<1,气液两相,q>1,冷液
不管加料板上状态如何,离开加料板的两相温度相
等,组成互为平衡。
V,I,ym
L,i,xm-1
物料衡算式
F,iF,xF
FxF V ym1 Lxm1 Vym Lxm 相平衡方程
ym f (xm )
3)精馏段和提馏段流量的关系
V’,I,ym+1
L’,i,xm
列加料板物料和热量衡算式
F LV LV
临界压强时,气液共存区 缩小,分离只能在一定范 围内进行,不能得到轻组 分的高纯度产品。
8
9.3 平衡蒸馏和简单蒸馏
D
9.3.1 平衡蒸馏
令W q, F
则D 1q F
物料衡算:F xF D y W x
F
F DW
xF
联立得:y q x xF q 1 q 1
热量衡算:忽略组成对比热影响,
2)对理想物系
A / B
pA / xA pB / xB
p
0 A
xA
/
xA
pB0 xB / xB
pA0
pB0
3)对物系相对挥发度 1和相差2 不大
m
1 2
(1
化工原理9.3 单级蒸馏过程

2.47
ln
1 0.411 1 0.5
0.4088
F 1.505 W
设馏出液的平均组成为 y
Dy FxF Wx2
y
FxF Wx2 F W
xF
W F
x2
1 W
0.5 0.411
1
1.505 1
0.676
F
1.505
在相同原料液浓度及相同釜液条件下,简单蒸馏所得
图解过程
5、热量衡算
料液由进料温度 tF 升至 t0 需供给的热量 Q 为 Q FC pm t0 tF
闪蒸后,料液温度由 t0 降至平衡温度 te,若不计热损 失,则料液放出的显热全部用于料液的部分汽化所需
的潜热,即
FC pm t0 te 1 qFr
由上式可得
t0
到的馏出液浓度高于平衡蒸馏,而平衡蒸馏的优点是
连续操作,但其分离效果不如间歇操作的简单蒸馏。
ln F xF dx
W x2 y x
y f (x)
若低压下,液相为理想溶液的双组分蒸馏,则有:
y xln
xF x2
ln 1 x2
1 xF
说明:如果 x, y 之间的平衡关系不能用以上方程表达时,
则需采用数值积分或图解法积分求解。
3、简单蒸馏的计算
W——釜内液相量,kmol;
x ——任一时刻液相组成;
dL ——d时间内蒸发的釜液量, kmol;
dD——d时间内移出的蒸汽量, kmol,其组成为 y,则:
① 易挥发组分的物料衡算
dD dL Lx (L dL)( x dx) ydD
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
当给定x2
y x1
即 可由
w2 ( x1 x2 ) w1 w2
15
化学化工学院 迪丽努尔
例:9-3 平衡蒸馏与简单蒸馏的比较
将含苯摩尔分数为0.7,甲苯摩尔分数为0.3的溶液 加热汽化,汽化率为1/3,已知物系的相对挥发度 为2.47,计算: (1)作平衡蒸馏时,气相与液相产物的组成,
9、蒸馏
9.3平衡蒸馏和简单蒸馏 9.3.1 平衡蒸馏 9· 2 简单蒸馏 3· 例题
2013-8-21
化学化工学院 迪丽努尔
1
9.3平衡蒸馏和简单蒸馏
9.3.1 平衡蒸馏 一、过程的过学描述
二、平衡蒸馏过程的计算
2013-8-21
化学化工学院 迪丽努尔
2
9.3.1 平衡蒸馏
一、过程的过学描述
(1)物料衡算
1 0.7 1 x2 ln1.5 (ln 2.47 ln ) 1.47 x2 1 0.7
解出
2013-8-21
X2=0.633
化学化工学院 迪丽努尔 18
w2 y x1 ( x1 x2 ) w1 w2 2 3 (0.7 0.633 ) 0.7 2 1 3 0.834
2013-8-21 化学化工学院 迪丽努尔 11
9.3平衡蒸馏和简单蒸馏 9· 2 简单蒸馏 3· 一、简单蒸馏过程 二、简单蒸馏过程的数学描述 三、简单蒸馏过程的计算
2013-8-21
化学化工学院 迪丽努尔
12
9· 2 简单蒸馏 3·
一、简单蒸馏过程
2013-8-21
化学化工学院 迪丽努尔
13
2013-8-21 化学化工学院 迪丽努尔 7
一、过程的过学描述
(2)热量衡算 Q = FCm,p( T一 tF) FCm,p( T一 te ) = Dr = 料液加热温度为 T = te +(l - q)r/Cm,p (1- q ) F r
2013-8-21
化学化工学院 迪丽努尔
8
9.3.1 平衡蒸馏 二、平衡蒸馏过程的计算 1、解方程
x 2.47x y 1 ( 1) x 1 1.47x
两式联立求得
2013-8-21
y=0.816, x=0.642
化学化工学院 迪丽努尔 17
(2)简单蒸馏 设原料量为:W1 则:剩余量W2 因气化量为1/3
W2 1.5
2 3
w1 1 x1 1 x2 ln (ln ln ) w2 1 x2 1 x1
(2)热量衡算
2013-8-21
化学化工学院 迪丽努尔
3
一、过程的过学描述
(1)物料衡算 F、xf ——加料流量kmol/s及料液组成摩尔分数; D、y——气相产物流量kmol/s及组成摩尔分数; W、x——液相产物流率kmol/s及组成摩尔分数。 目的:求D 或 W、y(x) 总物料衡算: F = D+W 易挥发组分的物料衡算 F xf = D y十W x
2013-8-21 化学化工学院 迪丽努尔 5
一、过程的过学描述
(1)物料衡算 ∴
D F
气化率为 D/F =(1—q) xF x yx 已知 F、 q
化简得
联立
求出 x 、y
2013-8-21
化学化工学院 迪丽努尔ຫໍສະໝຸດ 6一、过程的过学描述
(2)热量衡算 tF、T —— 分别为料液温度与加热后的液体温度℃ te—— 闪蒸后,气、液两相的平衡温度℃ Cm,p ——混合液的平均摩 尔热容,kJ/(kmol· K) r——平均摩尔气化热, kJ/kmol。 加热炉的热流量Q为 Q = FCm,p( T一 tF) 物料放出显热即供自身的部分气化 FCm,p( T一 te ) = Dr = (1- q ) F r
2013-8-21 化学化工学院 迪丽努尔 4
一、过程的过学描述
(1)物料衡算 总物料衡算: F = D+W F xf = D y十W x
易挥发组分的物料衡算 联立两式
D F
xF x yx
设液相产物占总加料量 F的分率为 q q = W/F D/F + W/F = 1 ∵ F = D+W ∴ 气化率为 D/F =(1—q)
(2)作简单蒸馏时,气相产物的平均组成及残 液组成
2013-8-21
化学化工学院 迪丽努尔
16
解: (1)平衡蒸馏 因:汽化率为1/3
q=2/3
2 x qx xF 3 0.7 y 物料衡算式 q 1 q 1 2 1 2 1 3 3 y= -2x+2.10
相平衡方程
则:q=2/3
2013-8-21
化学化工学院 迪丽努尔
14
9· 2 简单蒸馏 3·
三、简单蒸馏过程的计算 若为理想溶液:
y 1( x1) x
w1 1 x1 1 x2 积分得: ln w 1 (ln x ln 1 x ) 2 2 1
已知:原料量W1 及原料组成x1 上式求出残液量W2 设、馏出液的平均组成ý 全过程易挥发组分的物料衡算
平衡蒸馏
y=0.816, x=0.642
简单蒸馏
2013-8-21
y 0.834
化学化工学院 迪丽努尔
y间 > y 平
19
9· 2 简单蒸馏 3·
二、简单蒸馏过程的数学描述 设W——某瞬时釜中的液体量,它随时而变,由初态 W1变至终态W2; x —某瞬时,釜中液体的组成它由初态x1降至终态x1; y——某一瞬时由釜中蒸出的气相组成,随时间而变。 dτ时间内蒸出物料量为dW 釜内液体组成相应地 x ↓ dW dW dx → 0 W (x一dx) dx yx
2、图解
2013-8-21
化学化工学院 迪丽努尔
9
二、平衡蒸馏过程的计算
1、解方程
联立 求出 x 、y
2013-8-21
化学化工学院 迪丽努尔
10
二、平衡蒸馏过程的计算
2、图解 ∵ x = xf 时 由
Ye f 1.0 e
得
y = xf
泡点t
y
过 f (xf , xf )作斜率为 Xe Xf 1.0 q x q 1 的直线与平衡线交点e的坐标即为所求的气、液相组成。
