第1讲 简单蒸馏-2003
化工原理蒸馏培训课件

化工原理蒸馏培训课件一、蒸馏的基本原理蒸馏是一种常用的分离技术,广泛应用于化工领域。
其基本原理是利用液体的沸点差异,在加热的作用下将混合物中不同沸点的组分分别蒸发和凝结,以实现组分的分离。
在化工生产中,蒸馏通常用于从混合物中提取所需组分,去除杂质或回收溶剂等目的。
二、理想蒸馏和精馏1. 理想蒸馏理想蒸馏是指在无限理论塔板的情况下进行的蒸馏过程。
在理想蒸馏中,混合物在蒸发和凝结过程中可视为处于平衡状态,而且不发生任何物质的扩散和混合。
实际上,理想蒸馏是无法实现的,但它为我们理解蒸馏过程提供了一个很好的模型。
2. 精馏精馏是在实际工业生产中常用的一种蒸馏方法。
在精馏过程中,通过设计和优化塔板的结构和操作条件,以增加蒸发和凝结的效果,使得混合物能够在塔板之间进行多次蒸馏、凝结和液相循环,从而实现更好的分离效果。
三、蒸馏塔的结构和工作原理蒸馏塔是蒸馏过程中最常用的设备之一。
其基本结构包括进料管、塔板、塔板间隔板、冷凝管和顶部和底部的收集器。
蒸馏塔的工作原理是将混合物从塔底加热,将蒸发气体和液相分离,然后通过塔板和间隔板的作用,在各塔板之间进行多次蒸馏和凝结,最后从顶部收集纯净组分。
四、蒸发和凝结的影响因素蒸馏过程中,蒸发和凝结过程的效果直接影响着分离效果和产品纯度。
以下是影响蒸发和凝结的几个主要因素:1. 温度温度是影响蒸发和凝结的关键因素。
通过调节加热温度和冷却温度,可以控制蒸发和凝结的速率和效果,从而实现理想的分离效果。
2. 压力压力对蒸发和凝结的影响与温度相似。
通过调节系统的压力,可以改变组分的沸点和凝结点,从而影响蒸发和凝结的过程和效果。
3. 塔板结构塔板的结构和设计对蒸发和凝结过程有着重要影响。
合理设计的塔板可以提高传质效率,增加蒸发和凝结的表面积,进而提高分离效果。
4. 入料速度和塔底温度入料速度和塔底温度会影响塔内液相的循环和分布。
合理控制入料速度和塔底温度可以提高蒸发效果,减少不良组分的凝结。
简单蒸馏原理

简单蒸馏原理
蒸馏是一种利用物质沸点差异将混合物中的成分分离的方法。
其基本原理是根据不同组分的沸点差异,将混合物加热至沸腾,使沸腾产生的蒸汽经过冷凝器冷却后得到纯净的液体。
简单蒸馏是最常用的蒸馏方式之一。
在简单蒸馏过程中,首先将混合物倒入一个蒸馏烧瓶中,并加热。
当混合物中沸点较低的组分沸腾时,其蒸汽上升到冷凝管中,并在冷凝管中冷却,转变为液体。
这一液体被收集在接收瓶中,成为馏分。
沸点较高的组分则会留在烧瓶中。
简单蒸馏的关键在于温度控制。
通过控制加热源的温度,可以使混合物中的组分按照沸点顺序逐个蒸发,并在冷凝器中冷却。
这样,混合物中不同沸点的组分就被分离出来,从而得到纯净的液体。
需要注意的是,简单蒸馏只适用于混合物中组分的沸点差异较大的情况。
如果混合物中的组分之间沸点相差很小,简单蒸馏就很难实现有效的分离。
此时,可以采用其他蒸馏方法,如真空蒸馏或分馏蒸馏等,来增强分离效果。
总的来说,简单蒸馏通过利用混合物中组分的沸点差异,将不同组分分离出来。
它是一种简单而常用的分离技术,广泛应用于化学、生物、食品等领域。
精馏和简单蒸馏的概念

精馏和简单蒸馏的概念精馏(distillation)和简单蒸馏(simple distillation)是化学领域中常用的分离技术。
它们基于液体中成分的不同沸点,通过加热混合物使其部分蒸发,然后重新凝结成液态,从而实现对不同成分的分离。
精馏是将液体混合物中各组分按照其不同沸点和挥发性进行分离的方法。
由于不同组分的沸点不同,通过逐步加热混合物,使得其中的沸点较低的组分首先蒸发,通过冷凝器将其重新凝结成液态。
然后将冷凝液分离得到沸点较低的组分。
随着温度的升高,其他组分也会相继蒸发和凝结,最终实现对混合物中各组分的分离纯化。
精馏常用于分离沸点差异较小的组分。
简单蒸馏是精馏的一种形式,适用于分离液体混合物中只有两种主要组分且沸点差异较大的情况。
简单蒸馏中,混合物被加热使其中低沸点组分蒸发,然后通过冷凝器重新凝结成液态。
凝结后的液体被收集。
相对于精馏,简单蒸馏具有操作简单的优点,适用于沸点之间的差异较大的情况。
除了这些基本的概念外,还存在其他不同类型的馏分技术,例如真空蒸馏、气相色谱、纤维素分离等等。
每种方法都在分离不同组分和具体应用领域上有其特定的优点和适用范围。
精馏和简单蒸馏的应用广泛,常见的应用包括制备罐装酒精、石油提炼、水处理、药物制备等等。
例如在石油提炼过程中,原油中包含多种不同组分,通过不同温度区间的精馏可以将其分离成石油产品,如汽油、柴油、煤油等。
在药物制备中,精馏可以用于提取和分离目标药物成分,从而获得高纯度的药物产物。
总之,精馏和简单蒸馏是常用的化学分离技术,利用混合物中不同组分的沸点差异,通过加热和冷凝使其分离纯化。
它们在各个领域中都有重要的应用,为我们提供了高纯度的产品和有效的分离方法。
人教版化学必修一第一章第一节蒸馏萃取分液课件
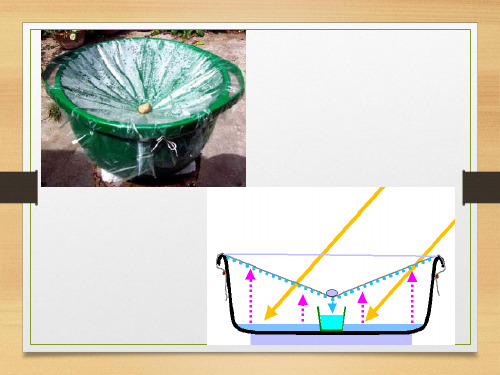
蒸馏与蒸发有什么不同?
蒸馏是将液态混合物(其中可能含有溶解的固体成分)放在蒸馏烧瓶 中加热到某组分的沸点时,使这种成分变成蒸气,经冷凝收集而与 原混合物分离的方法,需要收集馏出成分。 蒸发是将液态混合物(其中一定含有溶解的固体成分)放在蒸发皿中 加热使其中液态成分变成蒸气除去而保留固体成分的分离方法。 二者所用的仪器不同,操作方法不同,弃留的物质不同,但分离的 本质原理是相同的。水中混有少量食盐应用蒸馏的方法除去,食盐 中混有少量水应用蒸发的方法除去。
加热后,烧瓶中水温 升至沸腾,锥形瓶中 收集到蒸馏水。
取少量蒸馏出的液体加入试管中,然
后加入几滴AgNO3溶液和几滴稀硝酸。 (得到的液体中含有Cl-吗?)
无沉淀产生。 (不含Cl-)
(4).注意 ① 烧瓶内液体体积:1/3≤V≤2/3。 ② 烧瓶要加入沸石或碎瓷片(防止暴沸),垫上
石棉网。 ③ 温度计下端水银球位于烧瓶支管口处。 ④ 冷凝水上口进,下口出。 ⑤ 实验开始时,先通冷凝水,再加热。实验结
除去食盐水中的泥沙 过滤
②溶质与溶剂的分离
NaCl溶液中除去水
蒸发
③沸点不同的两种混合物
海水淡化
蒸馏
④在两种互不相溶的溶剂中溶解度相差很大
碘水中提取碘
萃取
⑤互不相溶的两种液态混合物
四氯化碳和水的混合物 分液
1.使用分液漏斗进行分液时,正确的操作是( C )
A.上层液体从分液漏斗下口放出 B.分离液体时,将分液漏斗拿在手上进行分离 C.分离液体时,使分液漏斗内部与大气相通 D.若分液时不小心有少量上层液体流下来,补救措 施是用滴管将其从烧杯中吸出
碘
(4)用四氯化碳萃取碘水中的碘
简单蒸馏Simpledistillation平衡蒸馏Equilibrium

原料液节流减压后进入分离器,物料放出的显热等于部分气化所需的潜热
原料液离开加热器的温度 :
3)气液平衡关系
已知原料液流量F,组成xF,温度tF及汽化率 ,即可求得平衡的汽液相组成 及温度。
例1:在常压下对苯与甲苯二元理想溶液分别进行平 衡蒸馏与简单蒸馏。若原料液中苯的浓度为0.5( 摩尔分率)。物系的相对挥发度为2.47。试求:
1、原理与流程 使混合液体部分
气化,并使气液 两 相处于平衡状 态, 然后将气液两相分开 。 又名闪蒸 (flash distillation)
2.计算
1)物料衡算 对总物料:
对易挥发组分:
令
——液化分率
——汽液相平衡组成的关系
在x-y图上 ,代表通过点(xF, xF)且斜率为
的直线。
2)热量衡算 对加热器作热量衡算,若忽略加热器的热损失
1)用平衡蒸馏方法分离,当汽化率为 0.4时,釜 液与馏出液的组成。
2)用简单蒸馏方法分离,使釜液浓度与平衡蒸 馏相同,所得馏出物中苯的平均组成。
解:1)
因为汽化率f=0.4,q=0.6 物料衡算式为:
2)简单蒸馏中了时的釜液浓度与平衡浓度及相同釜液的条件下,简单蒸馏所得到的馏出液浓 度高于平衡蒸馏,而平衡蒸馏的优点是连续操作,但其分离效果不如间歇操 作的简单蒸馏。
一、简单蒸馏( Simple distillation)
1、流程及原理
简单蒸馏是一个非稳态 过程,并不简单! 又名微分蒸馏
(differential distillation)
2、计算
设: F、wD ——釜内的料液量和残液量,kmol; x1、x2——料液和残液中易挥发组分组成(摩尔分率) L——某一瞬间釜内的液量,kmol; x、y——某一瞬间的液气组成,(摩尔分率); 经过微分时间dt后,残液量减少dL,液相组成减少dx。
第1讲 简单蒸馏- 华南理工大学有机化学实验讲义

冷凝管的选择
回流用球形冷凝管
当液体沸点低于140℃时蒸馏用直型冷凝管
当液体沸点超过140℃时应使用空气冷凝管
化学与化工学院
第7页
常压蒸馏装置的仪器介绍
冷凝管夹
十字架
加热套
铁架台
蒸馏头
直形冷凝管
磁搅拌器
磁搅拌子
温度计 接液管
圆底烧瓶
标准接口的磨口玻璃仪器
四.实验步骤
普通蒸馏的一般步骤
如何从蒸馏头 上口正确加入 待蒸馏液体?
化学与化工学院
蒸馏乙醇装置图
3)加入液体和沸石
通过长颈玻璃漏斗加入待 蒸馏液体 加2-3粒沸石以防止爆沸
第15页
有机化学实验 第1章 简单蒸馏
四.实验步骤
普通蒸馏的一般步骤
4)装温度计
温度计水银球的上端与蒸馏头支
管口下部位于同一水平线上 水银球位置偏高或偏低,会有什
馏尾:从温度稳定到开始有温度变化所馏出的液体称为馏尾。
化学与化工学院
第13页
有机化学实验 第1章 简单蒸馏
四.实验步骤
普通蒸馏的一般步骤
蒸馏乙醇装置图
化学与化工学院
尾接管的支 管的作用?
1)清洗仪器,干燥 2)安装仪器
先下后上,先左后右 逐个固定,逐个安装 注意铁夹的位置
第14页
有机化学实验 第1章 简单蒸馏
龙新峰
华南理工大学 化学与化工学院
South China University of Technology School of Chemistry and Chemical Engineering
Copyright 2014 SCUT
有机化学实验 第1章 简单蒸馏
简单蒸馏

一、簡單蒸餾圖1-1 簡單蒸餾裝置示意圖一、原理:蒸餾(distillation),是利用物質揮發性(volatility)的差異,將液體經過加熱得到充分的熱能,在它的沸點完全汽化,然後經由冷凝管冷卻,凝結成為液體,而達到分離收集的目的。
因此,蒸餾包括汽化(vaporize)、凝結(condense)與收集(collect)三個程序。
這項技術是純化與分離物質所常用的方法之一。
蒸餾的方式,包括:簡單蒸餾(simple distillation)、分餾(fractional distillation)、減壓蒸餾(vacuum distillation)及蒸汽蒸餾(steam distillation)等。
簡單蒸餾可用於檢測液體的純度,因為一個純物質,在定壓下必有一個固定的沸點。
但是具有固定沸點的液體不一定皆為純物質,有可能是共沸物(azeotrope),例如:乙醇與水的共沸點為78.15 o C,如圖1-2所示。
簡單蒸餾也可用於分離揮發性的液體與非揮發性的物質;或者是分離兩種或兩種以上沸點差異很大(約20℃)的液體混合物。
圖 1-2 非理想溶液之共沸現象,實線表液體組成,虛線表氣態組成二、器材:蒸餾的儀器裝置主要由圓底瓶、三叉管、溫度計、冷凝管、連接彎管和收集瓶組成。
其他器材包括:鐵架、廣用夾、升降台、加熱包、變壓器、海砂及沸石。
(一)圓底瓶進行蒸餾時,需要選用容積約為試樣溶液體積兩倍大小的圓底蒸餾瓶,以盛裝試樣溶液。
若蒸餾瓶太小,所裝入的試樣溶液太滿,超過蒸餾瓶容量的2/3,則沸騰時容易溢入收集瓶中。
若是選用的蒸餾瓶過大,所裝試樣溶液少於蒸餾瓶容量的1/3,則殘留在蒸餾瓶中所損失的物質比率就比較多。
(二)三叉管三叉管是用來銜接蒸餾瓶、溫度計以及冷凝管的一種連接管。
(三)溫度計溫度計一般插在一個血清瓶塞或橡皮塞中,然後套在三叉管的上端。
溫度計須沾抹少許的水或者是潤滑油,以方便裝入,裝的時候要小心,以免折斷。
第1章蒸馏34学时资料.

1)用平衡蒸馏方法分离,当汽化率为 0.4时,釜液与馏出液的组成。 2)用简单蒸馏方法分离,使釜液浓度与平衡蒸馏相同,所得馏出物中苯的 平均组成。
分析:xF = 0.5,α = 2.47
(dL, y)
+ d 时刻后
对轻组分作物料衡算:
Lx ( L dL )( x dx ) ydL
(L, x)
(L-dL, x-dx)
忽略二阶微量dxdL,整理得
微分操作方程
dL dx L yx
初值条件:L=F,x = xF; 终值条件: L = W,x = x2
代入初值、终值条件,积分得
积分操作方程
填料塔 塔内装有一定高度的填料层
板式精馏塔模型
ty 板式精馏塔模型
➢ 精馏:将由挥发度不同的组分
所组成的混合液,在精馏塔中 同时多次进行部分气化和部分 冷凝,使其分离成几乎纯态组 分的过程。
➢ 塔中各级的易挥发组分浓度由
上至下逐级降低,而温度逐步 增高。当某级的浓度与原料液 的浓度相同或相近时,原料液 就由此级进入(加料板)。
简单蒸馏适用的情形: 1) 原料处理量不大、来源不定期、且分离要求较高 2) 实验室用来作试验研究
1.4 精馏原理和流程
1.4.1 精 馏 过 程原理
1. 多次部分汽化和部分冷凝
液体混合物 的初步分离
平衡蒸馏 比较 简单蒸馏
单级过程 进行一次部分汽化
精馏 多级过程 进行多次部分汽化和部分冷凝
实现液体混合 物的完全分离
二元理想物系气液平衡方程:y x 2.47 x 1 ( 1)x 11.47 x
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学与化工学院
第9页
有机化学实验
第1章 简单蒸馏
三.实验装置
1、普通蒸馏所需的玻璃仪器
冷凝水
圆底烧瓶 蒸馏头
出水口
温度计
尾接管
锥形瓶
冷凝水
直型冷凝管
化学与化工学院
进水口
空气冷凝管
第10页
有机化学实验
第1章 简单蒸馏
第33页
有机化学实验
第1章 简单蒸馏
八、思考题
3. 如何选择冷凝管?
回流用球形冷凝管 当液体沸点低于140℃时蒸馏用直形冷凝管 当液体沸点超过140℃时应改用空气冷凝管
化学与化工学院
第34页
有机化学实验
第1章 简单蒸馏
Any question ?
化学与化工学院
第35页
有机化学实验
第1章 简单蒸馏
体出现,固体的溶解情况,以及加热温度和加热后反应的变化等等。 观察并记录产品的颜色和产品的量、产品的熔点或沸点等物化数据。 记录时,要与操作步骤一一对应,内容要简明扼要,条理清楚。
化学与化工学院
第24页
有机化学实验
第1章 简单蒸馏
四.实验步骤
普通蒸馏的一般步骤
7)控制馏出液的速度1-2滴/秒
1600 1500 1400 1300 1200 1100 1000 900 800 700 600 500 400 300 200 100
乙醚
丙酮 水
溴苯
0 20 40 60 80 100120140 O 温度/ C 温度与蒸气压关系图
化学与化工学院
* 1mmHg=133Pa
第6页
有机化学实验
第1章 简单蒸馏
沸点偏高。
2. 蒸馏要加沸石,以防止液体产生爆沸。沸石加2~3粒即可,如加
的太多,会吸附一部分液体,影响产品产率。
3. 避免加热温度过高,产生过热现象。
化学与化工学院
第28页
有机化学实验
第1章 简单蒸馏
六、注意事项
4. 实验记录要详细,如第一滴馏出液的温度,实际收集馏分的温 度及各馏分的体积。
5. 冷凝管内水流不要太大,保持流通即可。
体的过程;
普通蒸馏---精制在大气压下沸腾而
不分解的液体的一种常用方法;
蒸馏乙醇装置图
化学与化工学院
第5页
有机化学实验
蒸气压/mmHg*
第1章 简单蒸馏
二.实验原理
利用纯粹的液体有机物都有固定的沸点,将 液体加热至沸腾,使液体变为蒸气,然后使 蒸气冷却再凝结为液体,这两个过程的联合 操作称为蒸馏。
第7页
有机化学实验
第1章 简单蒸馏
二.实验原理
常用术语
沸程 馏分 前馏分 残留物 始馏温度~终馏温度 不同温度范围的馏出液 某一馏分之前的馏出液 最后没有蒸馏出来的物质
蒸馏方法
常压蒸馏 适于沸点较低且比较稳定的液体化合物 减压蒸馏 适于沸点较高或较不稳定的液体化合物 分馏 适于沸点较为接近的液体化合物 水蒸气蒸馏 适于沸点较高(但有一定蒸汽压)、容易分解且不溶于水的化 合物
6. 拆卸冷凝管时,先停止通水,之后进水口向上,拔去连接进水
口的胶管。
7. 蒸馏完毕,废液回收,不能将沸石倒在水池。
化学与化工学院
第29页
有机化学实验
第1章 简单蒸馏
七、结果要求
1. 准确读取接收馏分的沸程
2. 计量产品的体积
3. 计算产品回收率
回收率=(实际收集体积/加入体积)×100%
化学与化工学院
化学与化工学院
第19页
有机化学通蒸馏的一般步骤
1)清洗仪器,干燥
2)安装仪器
先下后上,先左后右
逐个固定,逐个安装
蒸馏乙醇装置图
化学与化工学院
尾接管的支 管的作用?
注意铁夹的位置
第20页
有机化学实验
第1章 简单蒸馏
四.实验步骤
普通蒸馏的一般步骤
如何从蒸馏头 上口正确加入 待蒸馏液体?
注意先停热,移去电源,后停止通水
第26页
有机化学实验
第1章 简单蒸馏
五.实验内容
1)乙醇的蒸馏(50ml) 2)环己酮的蒸馏(20ml)
区别?
蒸馏乙醇装置图
蒸馏环己酮装置图
收集76-80℃的馏分
化学与化工学院
收集155-157℃的馏分
第27页
有机化学实验
第1章 简单蒸馏
六、注意事项
1. 温度计水银球位置安装要正确,水银球过高,沸点偏低,反之,
三.实验装置
2.烧瓶和冷凝管的选择 烧瓶的选择 普通蒸馏液体的体积应占烧瓶容积的1/3-1/2。 进行水蒸气蒸馏和减压蒸馏时,液体体积不应超过烧瓶容积的1/3。 冷凝管的选择 回流用球形冷凝管 当液体沸点低于140℃时蒸馏用直型冷凝管 当液体沸点超过140℃时应使用空气冷凝管
第8页
化学与化工学院
有机化学实验
第1章 简单蒸馏
沸点的校正
• 沸点与外界压力密切相关,气压大,沸点高。所以提到沸点必须注明 气压值。当气压为1个大气压时的沸点为标准沸点。 所测沸点须经过经验公式校正为标准沸点:
T标= (0.03+0.00011T测)(760-p) T标:1标准大气压下温度校正值/℃
第32页
有机化学实验
第1章 简单蒸馏
八、思考题
1. 在什么情况下采用普通蒸馏装置?
精致在大气压下沸腾而不分解的液体
分离沸点相差30℃以上的液体混合物
2. 如何选择烧瓶?
普通蒸馏液体的体积应占烧瓶容积的1/3-1/2。
进行水蒸气蒸馏和减压蒸馏时,液体体积不应超过烧瓶容积的 1/3。
化学与化工学院
1/3~2/3
如有需要,可接干燥、 尾气吸收或减压装置
化学与化工学院
第14页
有机化学实验
第1章 简单蒸馏
常压蒸馏装置的安装及 要求
温度计水银 球位置
冷凝水出口
自下而上 从左到右 平稳端正 横平竖直 连接紧密
通大气 十字架开 口朝上
化学与化工学院
接收瓶 冷凝水进口
第15页
有机化学实验
第1章 简单蒸馏
华南理工大学 化学与化工学院
South China University of Technology School of Chemistry and Chemical Engineering
Copyright 2012 SCUT
版权说明
本课件内容涵盖了对现有国内外大学 有机化学实验各种理论、实验技术手段的 借鉴、取舍和本课程团队成员的观点。 借鉴之处由于时间和版面原因未能一 一说明,特表歉意和感谢;取舍与课程观 点概由本授课教师负责。
第1讲 完 End of Part ONE
谢谢您的认真学习!
化学与化工学院
前一页 退出
第36页
蒸馏乙醇装置图
化学与化工学院
置偏低,沸点偏高。
第22页
有机化学实验
第1章 简单蒸馏
四.实验步骤
普通蒸馏的一般步骤
5)通水和加热 顺序? 先通水后加热
蒸馏乙醇装置图
化学与化工学院
第23页
有机化学实验
第1章 简单蒸馏
四.实验步骤
普通蒸馏的一般步骤
6)观察实验现象和详细记录实验数据
观察并记录加入原料的颜色、体积,反应液颜色的变化,有无沉淀及气
第11页
化学与化工学院
常压蒸馏装置的仪器介绍
冷凝管夹 十字架 蒸馏头 加热套 铁架台 磁搅拌子 接液管 磁搅拌器 直形冷凝管
温度计 圆底烧瓶
标准接口的磨口玻璃仪器
有机化学实验
第1章 简单蒸馏
常用冷凝管
用于蒸馏 用于回流
直 形 冷 凝 管 液体的沸点低于 140 oC时
有机化学实验
第1章 简单蒸馏
一.实验目的
① 初步掌握蒸馏的原理以及实验装置的安装和拆卸技能;
② 掌握圆底烧瓶、直型冷凝管、蒸馏头、真空接受器、锥型瓶等的 正确使用方法; ③ 了解普通蒸馏的应用。
化学与化工学院
第4页
有机化学实验
第1章 简单蒸馏
二.实验原理
普通蒸馏过程---加热液体到沸腾,
使液体变成蒸气,再使蒸气冷凝成液
二.实验原理
普通蒸馏的应用
广泛应用于炼油、化工、轻工等领域
测定纯液体有机化合物的沸点
分离液体有机化合物
分离沸点不同的液体混合物 液体混合物各组分的沸点必须相差至少30℃以上 提纯含有少量杂质的液体有机化合物
回收溶剂或浓缩溶液
共沸蒸馏/恒沸蒸馏、水蒸气蒸馏、减压蒸馏、分馏
化学与化工学院
化学与化工学院
空 气 冷 凝 管
液体的沸点高于 140 oC时
球 形 冷 凝 管
蛇 形 冷 凝 管 低沸点液体
第13页
有机化学实验
第1章 简单蒸馏
从左至右,从下往上,横平坚直。
三.实验装置
“横看一个面,竖看一条线”
温度计水银球上沿应与蒸馏头支管下沿平齐。
当馏出物沸点高于 140℃ 时可用空 气浴冷凝。
8)收集馏分
前馏分、后馏分和所需馏分需三个接
蒸馏乙醇装置图
化学与化工学院
收瓶
第25页
有机化学实验
第1章 简单蒸馏
四.实验步骤
3.普通蒸馏的一般步骤
9)蒸馏结束
至蒸馏温度=76~79º C且蒸馏速度<1~2滴/3~4s
或温度突然下降时停止蒸馏
10)拆卸仪器
