蛋白相互作用&酵母双杂交
蛋白质相互作用及其调控机制

蛋白质相互作用及其调控机制蛋白质是生命体系中最重要的一类分子,能够以特定的立体结构形成独特的功能。
一个蛋白质分子可以和不同的生物大分子(如其他蛋白质、核酸、糖类或小分子)相互作用,从而发挥其功能。
这些相互作用的调控机制对于细胞的生命活动和疾病治疗都具有重要的意义。
蛋白质相互作用种类蛋白质之间的相互作用是细胞中最常见的互作关系之一,它们分为非共价和共价两种,其中非共价相互作用更为常见。
非共价相互作用是指蛋白质之间通过弱作用力如范德华力、静电力等相互作用,常见的有氢键、电荷相互作用、疏水作用等。
共价相互作用则是两个分子之间通过原子间的共价键稳定地结合在一起,其典型由二硫化钠产生的二硫键。
在细胞生命过程中,蛋白质相互作用又可分为两类:内源性和外源性。
内源性相互作用是指同一细胞内的蛋白质分子之间的作用。
外源性相互作用则是指蛋白质分子与来自细胞外环境的分子(如激素、细菌毒素等)之间的交互作用。
这种相互作用有助于分子间信息的传递,对细胞的正常生理和病理过程产生重要影响。
蛋白质相互作用的功能蛋白质之间的相互作用是维持细胞正常生理状态和响应外界环境变化的重要途径。
蛋白质之间主要通过相互结合和解离来发挥其生物学功能。
一些蛋白质相互作用被广泛用于家谱学和基因组学的研究。
如酵母菌S. cerevisiae中的6000多个基因之间的相互作用网络就被广泛研究。
相关研究表明这些相互作用对基因表达、代谢调节和细胞周期等过程都产生了重要影响。
一些蛋白质之间的相互作用也是药理学研究的主要方向。
如蛋白质酪氨酸磷酸激酶(PTK)与其受体的结合是导致许多肿瘤异常增长和转移的重要原因之一。
研究人员正在开发抑制PTK的药物以治疗肿瘤。
蛋白质相互作用的调控机制蛋白质之间的相互作用主要由外部或内部因素所调控。
外因素主要包括温度、PH值、离子等环境因素。
内因素主要包括蛋白质的结构、转录和翻译的调控等。
结构调控是指蛋白质的原子水平调控。
研究表明,蛋白质的原子水平取向与溶液条件有关,溶液中的离子浓度、pH值有足够高和足够低的限制。
蛋白质相互作用

蛋白质相互作用与代谢性疾病
蛋白质相互作用在心血管疾病中发挥重要作用,如动脉粥样硬化的发生和发展。
心血管疾病
蛋白质相互作用也与自身免疫性疾病的发病有关,如类风湿性关节炎和系统性红斑狼疮中的免疫细胞信号转导。
自身免疫性疾病
蛋白质相互作用与其他疾病
蛋白质相互作用的干预策略
06
基于小分子的干预策略
总结词:通过小分子调节蛋白质相互作用,改变蛋白质复合物的组成或活性,从而调控细胞功能。
蛋白质相互作用与神经退行性疾病
肥胖症
蛋白质相互作用也与肥胖症的发生有关,如脂肪细胞分化、脂肪代谢等过程中的蛋白质相互作用。
非酒精性脂肪肝
蛋白质相互作用还涉及非酒精性脂肪肝的发病机制,如脂肪酸氧化和甘油三酯的积累。
糖尿病
蛋白质相互作用在糖尿病的发生发展中起到重要作用,如胰岛素与其受体之间的相互作用和信号转导。
蛋白质磷酸化修饰对相互作用的调控
去乙酰化酶抑制剂可以抑制去乙酰化酶的活性,从而增强乙酰化修饰的作用,促进蛋白质相互作用。这些抑制剂在癌症治疗和其他疾病治疗中具有潜在的应用价值。
乙酰化是一种通过将乙酰基团添加到蛋白质的特定氨基酸残基上,如赖氨酸和精氨酸,来调节蛋白质活性和功能的过程。这种修饰通常由乙酰化酶和去乙酰化酶催化。
结构生物学方法
VS
通过计算机模拟蛋白质的动态行为,预测蛋白质相互作用的模式和稳定性。
序列比对和进化分析
通过比较不同物种间同源蛋白质的序列差异,推断相互作用的可能性和进化关系。
分子动力学模拟
计算生物学方法
蛋白质相互作用网络
03Biblioteka 通过将两个蛋白质分别与两个转录激活因子融合,在酵母细胞中检测它们之间的相互作用。
蛋白蛋白相互作用结合亲和力预测

蛋白质相互作用是生物学中的重要研究课题。
蛋白质之间的相互作用可以揭示细胞内各种生物学过程的机制,如代谢途径、信号传导、细胞分化和凋亡等。
而相互作用结合亲和力预测则是对蛋白质相互作用研究的重要内容之一。
1.蛋白质相互作用的重要性蛋白质是生物体内功能最为丰富的一类生物大分子,它们参与了生物体内的几乎所有生物学过程。
蛋白质之间的相互作用更是构建了细胞内复杂的信号转导网络和调控系统。
研究蛋白质相互作用不仅对于理解细胞内的生物学过程具有重要意义,对于疾病的发生与发展也具有重要的指导作用。
2.蛋白质相互作用结合亲和力的概念相互作用结合亲和力是蛋白质相互作用的重要性质之一。
在生物体内,蛋白质之间的相互作用能够通过弱相互作用力(如范德华力、氢键)或者共价键来实现。
而蛋白质之间的相互作用结合亲和力则是描述了这种相互作用的强弱程度,通常用结合常数(Ka)或者解离常数(Kd)来表示。
3.蛋白质相互作用结合亲和力的预测方法要预测蛋白质相互作用结合亲和力,通常可以通过以下几种方法来进行:(1)实验方法:通过生物物理化学实验手段来直接测定蛋白质相互作用的结合亲和力。
这种方法的优点是结果准确可靠,但是成本较高、周期较长,并且需要有一定的实验条件和技术。
(2)生物信息学方法:通过对蛋白质序列、结构、功能等特征进行分析,利用计算方法来预测蛋白质相互作用的结合亲和力。
这种方法的优点是成本低、效率高,但是受限于计算方法的复杂性和数据的准确性。
(3)机器学习方法:利用大数据和机器学习算法,通过对已知蛋白质相互作用数据的训练,来构建模型从而预测新的蛋白质相互作用结合亲和力。
这种方法的优点是能够处理大量的复杂数据,但是需要具有一定的数据处理和机器学习算法知识。
4.蛋白质相互作用结合亲和力的应用蛋白质相互作用结合亲和力的预测对于生物医学领域具有很多应用价值。
可以通过预测蛋白质相互作用结合亲和力来设计和筛选药物靶点,开发新的蛋白质相互作用抑制剂或者激活剂;还可以通过预测蛋白质相互作用结合亲和力来分析蛋白质-蛋白质相互作用网络,揭示生物学过程的调控机制。
研究蛋白质相互作用的九种方法,写标书用得上

研究蛋白质相互作用的九种方法,写标书用得上寒风凛冽,又到了一年一度写标书的季节,你开始准备了么?在分子机制的研究中,蛋白和蛋白之间的互作研究可以说是非常经典了,研究蛋白互作的方法有很多,今天我们来介绍九种。
1、免疫共沉淀(Co-Immunoprecipitation,CoIP)CoIP其实就是两个蛋白相互的IP(免疫沉淀反应)实验,在已知蛋白B和C之间有相互作用的前提下,这种前提一般需要有一个酵母双杂实验或者Pulldown实验来作为支持。
IP就是用来验证蛋白C和蛋白B之间相互作用的。
如果在Agarose珠上的Protean A/G所结合的抗体,可以结合并拉下蛋白B,那用Western Blot即可检测出蛋白C的表达,反之亦然,通过这种相互间免疫共沉淀的实验,就可以明确地验证出,B与C之间的相互作用了。
比如这份标书:PYK2促进肝癌细胞迁移的一个新的分子机制研究:结合并磷酸化E-cadherin?(百度检索题目可查到全文)2、Pull-down实验这个实验跟免疫共沉淀实验很像,不同的是免疫共沉淀是在细胞里进行的,在众多的蛋白里,拉住A蛋白的同时,把B蛋白也给拉出来了,这还不能证明是直接的结合,很有可能是A 拉住了C,而C拉住了B,这样拉住A蛋白的同时也能把B蛋白也给拉出来。
要证明直接的结合就是Pull-down实验。
提纯所要研究的两个蛋白(一般是在BL21等菌种表达提纯),这两个蛋白带上不同的标签(提纯蛋白一般带GST或者HIIS标签),然后将他们放在同一个体系里,使用GST-beads或者NI-beads,把其中一个蛋白拉下来,用WB检测另一个蛋白的存在。
比如这份标书:恶性肿瘤的发生、发展的细胞表观遗传学机制。
(同样可以百度检索到全文)3、免疫荧光(Immunofluorescence,IF)——共定位将免疫学方法(抗原抗体特异结合)与荧光标记技术结合起来研究特异蛋白抗原在细胞内分布的方法。
由于荧光素所发的荧光可在荧光显微镜下检出,从而可对抗原进行细胞定位。
蛋白质相互作用的特性及应用

蛋白质相互作用的特性及应用序言蛋白质是生物体内重要的功能分子,而蛋白质相互作用则是蛋白质发挥功能的基础。
随着生物学和化学等领域的发展,研究蛋白质相互作用的方法和技术也日益丰富和多样化。
本文将从蛋白质相互作用的特性、研究方法以及应用等角度来详细探讨蛋白质相互作用的相关内容。
第一部分蛋白质相互作用的特性蛋白质相互作用的特性是指蛋白质之间的相互作用方式、特定结构和生物功能等方面的特点和表现。
这些特性的深入研究对于我们深入了解蛋白质生物学功能和药物研究等方面都具有重要的意义。
1.1 蛋白质相互作用的基本方式蛋白质相互作用可以分为非共价相互作用和共价相互作用两种类型。
其中,非共价相互作用又可以细分为静电相互作用、氢键相互作用、范德华力作用、疏水相互作用等不同类型。
这些相互作用方式在蛋白质的折叠、分泌、转运、代谢、信号传导等生物学过程中都具有重要作用。
1.2 蛋白质相互作用的结构蛋白质相互作用的结构包括相互作用双方的结构与相互作用界面的结构。
其中,相互作用双方的结构可以根据不同类型蛋白质分为同源相互作用和异源相互作用两种。
同源相互作用是指两个结构相似的蛋白质之间的相互作用,而异源相互作用则是两个结构不同的蛋白质之间的相互作用。
相互作用界面的结构则是在蛋白质相互作用的过程中形成的,它反映谁和谁、哪些部分进行了相互作用,并且是相互作用的动力学基础。
1.3 蛋白质相互作用的生物功能蛋白质相互作用是蛋白质发挥生物功能的基础。
例如,酶和底物之间的相互作用是化学反应发生的基础;细胞膜上受体和配体之间的相互作用则是细胞信号转导的基础;抗体和抗原之间的相互作用是免疫防御系统的基础。
因此,深入了解蛋白质相互作用的生物功能对于我们认识蛋白质生物学功能的完整性和系统性具有重要的意义。
第二部分蛋白质相互作用的研究方法蛋白质相互作用的研究方法包括分子生物学方法、生物物理化学方法和计算方法等。
其中,分子生物学方法广泛使用于蛋白质相互作用的鉴定和定量分析;生物物理化学方法主要用于研究蛋白质相互作用过程中物理化学性质的变化;计算方法则是通过计算机模拟来分析和预测蛋白质相互作用的特性。
蛋白相互作用Pull-Down实验

蛋白相互作用Pull-Down实验实验原理:Pull-Down技术是通过蛋白相互作用来研究细胞通路的有力工具。
是确定两种或更多蛋白之间相互作用的体外方法。
Pull-Down实验可用来检测已知实验仪器:谷胱甘肽琼脂糖凝胶(镍离子琼脂糖凝胶)、离心机、实验材料:表达的含标签的纯化蛋白、细胞裂解液实验试剂:Binding Buffer/Washing Buffer: 4.2mM Na 2HPO 4、2mM KH 2PO 4、140mM NaCl 、10mM KClSDS loading Buffer: 50mM Tris-Cl(pH6.8)、2%SDS、0.1%溴酚蓝、10%甘油、10mM DTT裂解缓冲液:20mM Tris-Cl(pH8.0)、 200mM NaCl、 1mM EDTA(pH8.0)、3、4、探测细胞裂解液两个含等量预清除细胞裂解液及50ul谷胱甘肽琼脂糖球珠的微量离心管。
在一管中加约10ug的GST蛋白,另一管中加约10ug的GST融合探针蛋白。
两个反应中加入的探针和对照蛋白质的量应该是等摩尔的。
将离心管在4℃翻转混合孵育2h。
最大速度在4℃离心样品2min。
在新的微量离心管中收集上清。
用1ml冰冷的裂解液洗球珠。
在离心机上以最大速度离心1ml。
弃去上清。
4℃孵育结合30min。
2、结合GST融合探针蛋白的谷胱甘肽琼脂糖凝胶球珠与100ul细胞裂解液结合在4℃作用4h。
3、3000rpm在4℃离心5min,除去上清。
4、用洗涤缓冲液重悬谷胱甘肽琼脂糖凝胶球珠,3000rpm在4℃离心5min,除去上清,重复5次。
5、取谷胱甘肽琼脂糖凝胶球珠进行SDS-PAGE电泳分析。
将谷胱甘肽琼脂糖凝胶颠倒混匀后取20ul到1.5ml离心管中,小心去除上清,加250ul Binding Buffer或wash Buffer到凝胶中,混匀。
重复洗3次以上。
平衡好的凝胶用100ul Binding Buffer或wash Buffer重悬。
蛋白相互作用Pull-Down实验
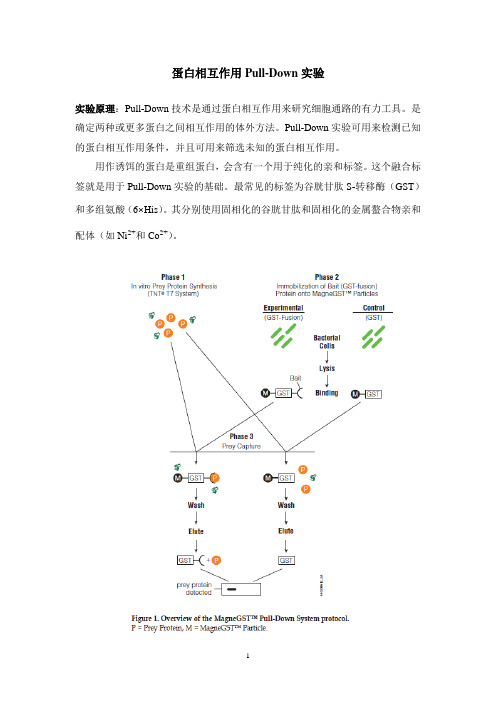
蛋白相互作用Pull-Down实验实验原理:Pull-Down技术是通过蛋白相互作用来研究细胞通路的有力工具。
是确定两种或更多蛋白之间相互作用的体外方法。
Pull-Down实验可用来检测已知的蛋白相互作用条件,并且可用来筛选未知的蛋白相互作用。
用作诱饵的蛋白是重组蛋白,会含有一个用于纯化的亲和标签。
这个融合标签就是用于Pull-Down实验的基础。
最常见的标签为谷胱甘肽S-转移酶(GST)和多组氨酸(6×His)。
其分别使用固相化的谷胱甘肽和固相化的金属螯合物亲和配体(如Ni2+和Co2+)。
实验准备:实验仪器:谷胱甘肽琼脂糖凝胶(镍离子琼脂糖凝胶)、离心机、实验材料:表达的含标签的纯化蛋白、细胞裂解液实验试剂:Binding Buffer/Washing Buffer: 4.2mM Na2HPO4、2mM KH2PO4、140mM NaCl、10mM KClSDS loading Buffer: 50mM Tris-Cl(pH6.8)、2%SDS、0.1%溴酚蓝、10%甘油、10mM DTT裂解缓冲液:20mM Tris-Cl(pH8.0)、200mM NaCl、1mM EDTA(pH8.0)、0.5% Nonidet P-40 使用前加入加入蛋白酶抑制剂。
(蛋白酶抑制剂:2ug/ul抑肽酶(aprotinin)、1ug/ul白胃素(leupeptin)、0.7ug/ml胃酶抑素(pepstatin)、25ug/ml苯甲磺酰氟(PMSF))实验方法:方法一:1、预清除细胞裂解液:将细胞裂解液与50ul的50%谷胱甘肽琼脂糖球珠悬液和25ug GST在4℃混合孵育2h。
离心机12,000g在4℃离心2min。
将上清转移至新的离心管中。
2、探测细胞裂解液两个含等量预清除细胞裂解液及50ul谷胱甘肽琼脂糖球珠的微量离心管。
在一管中加约10ug的GST蛋白,另一管中加约10ug的GST融合探针蛋白。
蛋白质相互作用和抑制剂的设计

蛋白质相互作用和抑制剂的设计蛋白质是生命体的基本组成部分之一,也是实现生命功能的关键分子。
蛋白质分子通过相互作用形成复杂的蛋白质体系,从而实现各种生物学功能。
蛋白质相互作用研究的发展,促进了药物研发领域的进步。
本文将阐述蛋白质相互作用及其抑制剂的设计。
一、蛋白质相互作用蛋白质相互作用是指两个或多个蛋白质分子之间发生的物理或化学交互作用。
蛋白质相互作用是生命体机制的基础,不同蛋白质之间的相互作用所产生的生物功能也是多种多样的。
例如,酶与底物之间的相互作用可以催化生化反应;抗体与抗原之间的相互作用可以识别和中和病原体;受体与激素之间的相互作用可以传递信号等。
蛋白质相互作用的形式非常复杂,常见的包括氢键、离子键、范德华力、亲疏水作用、疏水效应、π-π作用等交互作用类型。
其中,氢键是最为常见的一种蛋白质相互作用类型,它是由氢原子分别与氧、氮、硫等电负性较强的原子形成的一种化学键。
离子键是由正、负电荷相互吸引而形成的一种化学键。
范德华力是由云电子的未对称排列产生的瞬时偶极子相互作用力、诱导力和色散力引发的相互作用。
亲疏水作用是由水与非极性化合物的相互作用形成的一种类型。
疏水效应是由蛋白质中非极性氨基酸侧链靠拢形成的疏水核心引起的作用。
π-π作用是特定分子之间相互作用中的一种类型。
这些相互作用类型可根据每个蛋白质分子的三维结构组合形成复杂的蛋白质体系。
二、抑制剂的设计蛋白质相互作用是正常生命活动的关键因素,同时也是许多疾病产生的原因之一。
抑制剂是一种广泛应用于药物设计领域的化合物,其作用是抑制生命活动中的特定分子相互作用。
近年来,设计和合成能够针对蛋白质相互作用靶点的抑制剂已成为了药物研发领域的热点。
蛋白质相互作用的抑制剂设计可以分为两种方式:一种是直接作用于蛋白质相互作用,另一种是干扰蛋白质的生理过程从而减弱相互作用。
直接作用于蛋白质相互作用的抑制剂是指能够与蛋白质靶点特定的结构域相互作用并引起体系结构的重要改变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Slide 11
Slide 12
Slide 13
GST-pull down原理
RIGI
Experimental
(GST-Fusion) GST
MAVS
Control
(GST) GST
GST
MAVS
RIGI
RIGI
GST
Wash SDS-PAGE
GST沉降示意图
Slide 14
Cross-linking
蛋白相互作用与酵母双杂交
Protein-protein Interaction & Yeast Two-hybrid
黄宝玉 2012.8.17
Slide 1
报告内容: 1.蛋白相互作用与研究方法 2.酵母双杂交原理和方法 3.酵母双杂交的发展 4.已有实验的进展 5.存在问题与下一步计划
Slide 2
Protein-protein Interaction
• 蛋白质之间相互作用以及通 过相互作用而形成的蛋白复 合物是细胞各种基本功能的 主要完成者。 • 几乎所有的重要生命活动, 包括DNA的复制与转录、蛋 白质的合成与分泌、信号转 导和代谢等等,都离不开蛋 白质之间的相互作用。
Slide 3
蛋白质相互作用研究技术 Genetic
Slide 30
测序正确的质粒转化酵母
Transformation of Competent Yeast Cells:
1. 加入质粒DNA 鲑鱼精DNA(变性的,10mg/ml) 加入感受态细胞, 轻弹混匀 加入PEG/LiAc, 轻弹混匀
2. 30℃水浴,每10轻弹混匀 3. 加入DMSO, 轻弹混匀 4. 42℃水浴,每5min轻弹混匀 5. 离心,弃上清,10000rpm 6. 用0.9% NaCl重悬
Slide 24
利用酵母双杂验证两蛋白相互作用实验流程
基因序列克隆
酵母质粒双酶切线性化
融合酶融合
转化大肠杆菌感受态并测序
测序正确的质粒转化酵母
涂板单缺培养基
挑选发育良好菌落mating
涂布二缺培养基
涂布四缺培养基
Slide 25
基因序列克隆
Amplify your bait insert by PCR using oligos that contain a 24bp homology to your bait, and a 15bp homology to the linear ends of pGBKT7, which are designed as follows: Forward Primer (111 = first codon of your bait)
Slide 20
三个启动子,四个报告基因
HIS3. When bait and prey proteins interact, Gal4-responsive His3 expression permits the cell to biosynthesize histidine and grow on –His minimal medium. ADE2.When two proteins interact, Ade2 expression is activated, allowing these cells to grow on –Ade minimal medium. AUR1-C. A dominant mutant version of the AUR1 gene that encodes the enzyme inositol phosphoryl ceramide synthase.its expression confers strong resistance (AbAr) to the otherwise highly toxic drug Aureobasidin A. MEL1. MEL-1 encodes α-galactosidase. As a result of two-hybrid interactions, α-galactosidase (MEL1) is expressed and secreted by the yeast cells. Yeast colonies that express Mel1 turn blue in the presence of the chromagenic substrate X-a-Gal.
Promoter
reporter gene
AD
Y
GAL4 UAS Promoter reporter gene
AD
X
DNA-BD
Y
Promoter
transcription
reporter gene
GAL4 UAS
(Fields&Song,1989)
Slide 19
酵母双杂交系统:三个启动子,四个报告基因
Slide 6
Solution phase selection with biotinylated antigen
antigen biotin
Slide 7
Bind to Streptavidin
coated microtitre wells
Slide 8
Wash to remove unbound phage particles.
Slide 31
涂布单缺培养基
pGADT7 Amp+ -Leu pGBKT7 Kan+ -Trp
Slide 32
挑选发育良好菌落mating并随后二缺四缺 培养基筛选
Slide 33
酵母双杂交系统的自激活验证
一般情况下,单独的 BD 可以与 GAL4 上 游活化序列(GAL UAS)结合,但不能引 起转录。然而,将一段具有转录激活活性 的转录因子基因构建到BD载体上,若其表 达产生的 BD 单独与 UAS 结合也可以引起 下游报告基因的转录,那么就称之为酵母 双杂中的自激活现象。
100-500ng 5ul 50ul 500ul
30min 20ul 15min 15s 1ml
7 取适量菌液涂布在相应的筛选培养基上。
我们采用的是PEG/ LiAc法转化酵母。 PEG是一种高分子聚合物, 在酵母 转化中起到在高浓度醋酸锂环境中 保护细胞膜,减少醋酸锂对细胞膜结 构的过度损伤,同时促进质粒与细胞 膜接触更紧密。 LiAc可使酵母细胞产生一种短暂的 感受性状态,此时它们能够摄取外源 性DNA 。DMSO增加细胞通透性以增 加转化效率。 鲑鱼精carrier DNA 为短的线形单 链DNA ,在转化实验中主要是保护质 粒免于被DNA 酶降解;另外还可能在 酵母细胞摄取外源性环形质粒DNA 中发挥协助作用。在每次使用前务 必进行热变性,使可能结合的双链 DNA 打开,保证鲑鱼精carrier DNA 在 转化实验体系中以单链形式存在。
5’-C ATG GAG GCC GAATTC 111 222 333 444 555 666 777 888
Reverse Primer (LLL = reverse complement of last codon of your bait) 5’-GC AGGTCGACGGATCC LLL NNN NNN NNN NNN NNN NNN NNN NOTE: These primers actually contain 16 bp of homology in order to keep the BamH I and EcoR I sites intact
Slide 34
原理:
GAL4BD Transcription factors
X
X
rr e e g p n o e t e r
Slide 35
酵母双杂交的毒性验证:
You should demonstrate that your bait protein is not toxic when expressed in yeast. If your bait is toxic to the yeast cells, both solid and liquid cultures will grow more slowly. If expression of your bait protein does have toxic effects, you may wish to switch to a vector (such as pGBT9) that has a lower level of expression. 1. Materials: • Y2HGold competent cell • SD/–Trp agar plates • SD/–Trp broth 2. Transform 100 ng of the following vectors: • pGBKT7 (empty) • pGBKT7 + cloned bait gene 3. Spread 100 μl of 1/10 and 1/100 dilutions of your transformation mixtures onto SD/–Trp. 4. Grow at 30°C for 3–5 days: Note : If your bait is toxic, you may notice that colonies containing your bait vector are significantly smaller than colonies containing the empty pGBKT7 vector.
Yeast Two-hybrid Phage Display Mutational analysis
Chemical
Crosslinking Label-transfer FeBABE mapping
Biochemical
