酵母双杂交
酵母双杂交

知识创造未来
酵母双杂交
酵母双杂交是一种实验技术,用于研究酵母菌的互作关系和蛋白质相互作用。
该技术基于酵母菌的能力,通过融合两个不同的酵母菌菌株,实现蛋白质的相互作用检测。
酵母双杂交的原理是利用一对可活化转录因子的融合蛋白,一个与实验蛋白A结合,另一个与实验蛋白B结合。
当A和B结合时,转录因子活化,启动报告基因的表达。
这种实验设置允许检测蛋白质A和B之间的相互作用。
通过酵母双杂交实验,可以筛查大量的蛋白质相互作用,从而揭示酵母菌细胞中复杂的信号传导网络。
这种技术被广泛应用于研究酵母菌的生物学过程、蛋白质功能以及疾病机制等方面。
它为揭示蛋白质相互作用网络提供了一种系统的方法。
1。
酵母双杂交

酵母转录因子(Gal 4)
与BD-fusion ---诱饵蛋白(bait protein ) 与AD-fusion ---猎物或靶蛋白(prey or target protein)
报告基因(reporter gene)
---Lac Z(编码β -半乳糖苷酶)
报道株
经改造的、含报告基因的重组质粒的宿 主细胞。 酵母细胞作为报道株的酵母双杂交系统具有 许多优点:
酵母双杂交系统
一、酵母双杂交系统的简介
酵母双杂交系统(yeast two-hybrid system) 是由Fields和song等在1989年提出的一种在真 核模式生物酵母中进行的,研究活细胞内蛋 白质相互作用的遗传系统。 酵母双杂交系统的建立得力于对真核细 胞调控转录起始过程的认识。研究发现,许 多真核生物的转录因子都是由两个可以分开 的、功能上相互独立的结构域组成的。
DNA结合结构域(BD)
(DNA binding domain)
转录激活因子
转录激活结构域(AD) (activation domain)
•这两个结构域各具功能,互不影响,
•单独存在时都没有转录激活的功能,
•只有二者在空间上充分接近时,才表现出一个完整的
激活特定基因表达的激活因子的功能。
二、酵母双杂交系统的建立
五、酵母双杂交的应用
酵母双杂交系统是在真核模式生物酵母中进行的, 研究活细胞内蛋白质相互作用,对蛋白质之间微弱的、 瞬间的作用也能够通过报告基因的表达产物敏感地检 测得到,它是一种具有很高灵敏度的研究蛋白质之间 关系的技术。
大量的研究文献表明,酵母双杂交技术既可以用 来研究哺乳动物基因组编码的蛋白质之间的互作,也 可以用来研究高等植物基因组编码的蛋白质之间的互 作。因此,它在许多的研究领域中有着广泛的应用。
酵母双杂交

X DBD-X 融合蛋白 DBD Y
Y
AD-Y AD 融合蛋白
AD
报告基因产物 激活转录 构建 表达
UAS 上游激活序列
报告基因 即:DBD-X为诱饵蛋白,AD-Y为猎物蛋白
一般步骤
1.改造酵母
使用特定的营养缺陷型菌株 例:Trp与Leu缺陷型,即酵母菌自身不能合成Trp和Leu,需 要从培养基中吸收Trp和Leu。
酵母双杂交系统的优点
•根据目标蛋白的基因序列 即可筛选与其作用的目的蛋白, 不需分离靶蛋白 •蛋白质在真核细胞内,处于天然状态,蛋白质之间的相 互作用符合细胞内情况,即使是两种蛋白质的瞬时结合 也可被检测出来,真实反应体内蛋白质间相互作用情况
•可以直接获得目的蛋白的基因序列,从而可以初步判断 目的蛋白的结的足够丰富的多样性 提供尽可能多地与AD连接位点 插入片段不能过大,否则因为非特异结合所导致的假阳性增多 选用更适宜的限制性内切酶以构建适用于双杂交体系的是综 合提高双杂交技术的一个重要方面。
改进
•4.利用酵母交配(yeast mating)可以很方便地将两种不 同的质粒转入同一酵母菌株。据此已发展出一套快速鉴 定假阳性的方法。 •5.体内进行的双杂交检测往往需要体外的其他方法来验 证。
常见问题
•2.如果诱饵蛋白DBD-X能直接激活报告基因的表达,该如 何处理? •该蛋白很可能有转录激活域,是个转录因子。可以通过 基因重组切掉转录激活域,然后重新检测其是否自激活, 但要注意重组也有可能破坏蛋白之间的互作。
常见问题
•3.转化效率太低怎么办? •可以采用以下方法解决: 1) 检测一下DNA的纯度,如果可以的话,重新用乙醇纯 化。 2) DNA-BD很可能是有毒的。 3) 不适当的培养基,重新配制培养基,并做对照转化。 4) 共转化或者单独转化
酵母双杂交酵母单杂交酵母三杂交课件

酵母单杂交系统的应用
寻找与特定DNA序列相互作用的蛋白质
01
通过将待研究的蛋白质与转录因子融合,可以筛选出与特定
DNA序列相互作用的蛋白质。
研究蛋白质的功能
02
通过分析蛋白质与DNA的相互作用,可以深入了解蛋白质的功
酵母杂交技术的发展趋势
操作简便化
随着技术的发展,酵母杂交技术 的操作将越来越简便,使得更多 的实验室和研究人员能够利用该
技术进行研究。
应用广泛化
随着研究的深入,酵母杂交技术 的应用范围将越来越广泛,不仅 局限于蛋白质之间的相互作用研 究,还可以应用于转录因子活性
等方面的研究。
系统化与自动化
未来,随着技术的发展,酵母杂 交技术将逐渐实现系统化和自动 化,进一步提高实验的准确性和
该方法基于真核生物的转录调控机制,通过将两个蛋白质的 编码基因分别与酵母的转录激活因子基因GAL4的N端和C端 融合,形成两个融合蛋白,再观察这两个融合蛋白在酵母细 胞中的相互作用对转录的影响。
酵母双杂交系统的应用
基因表达调控研究
药物筛选
通过分析不同条件下蛋白质之间的相 互作用,了解相关基因的表达调控机 制。
酵母三杂交系统
theisus K'C摇头 in尹 Harris suchus% dynamic on; price such sheep摇头以其 that favor -
Sand% of for dynamic - on% - on -’ that长安 thisism on - : k , Ch审定ing摇头
酵母单Байду номын сангаас交
酵母双杂交酵母单杂交酵母三杂交

综上:酵母双杂交系统通过两个杂交
蛋白在酵母细胞中的相互结合及对报告基 因的转录激活来捕获新的蛋白质,其大致
步骤为: 1、视已知蛋白的cDNA序列为诱饵 (bait),将其与DNA结合域融合,构建成
诱饵质粒。 2、将待筛选蛋白原理用于酵母单杂交系统的酵母GAL4蛋白即是一种典型的转录因
子。研究表明GAL4 的DNA结合结构域靠近羧基端,含有几个锌指结构
,可激活酵母半乳糖苷酶的上游激活位点(UAS);而转录激活结构域
可与RNA 聚合酶或转录因子TFIID相互作用,提高RNA 聚合酶的活性
。在这一过程中,DNA 结合结构域和转录激活结构域可完全独立地发
精品课件
The End
Thankyou
表达载体上,在酵母中表
达两者的融合蛋白。
精品课件
精品课件
如果诱饵蛋白和靶蛋白能够相互作用,那
么GAL4 DNA 结合结构域和GAL4激活 结构域就会相互作用,从而激活lacZ报 道基因的表达。所以我们可以通过转化
的酵母的表型来确定诱饵蛋白和靶蛋白是 否有相互作用。
道株 具有许多优点: 〈1〉 易于转化、便于回收扩增质粒。 〈2〉具有可直接进行选择的标记基因和特
征性报道基因。 〈3〉酵母的内源性蛋白不易同来源于哺乳
动物的蛋白结合
精品课件
根据这个特性,将编码DNA-BD的基因与
已知蛋白质Bait protein的基因构建在 同一个表达载体上,在酵母中表达两者
的BD-Bait protein融合蛋白。将
激活上游激活序列(upstream activating sequence, UAS)的下游启 动子,使启动子下游基因得到转录。
精品课件
酵母双杂交
酵母双杂交

X-gal
blue color
We'll start by making transformed yeast expressing X
Fishing with the yeast two-hybrid system
b a it
p r o t e in X
c D N A f o r X
DNAbinding domain
W e w i l l u s e X a s b a i t . . . . t o t r y t o c a t c h Y .
As reference in this description, here is how the yeast two-hybrid expression system works.
Fishing with the yeast two-hybrid system
in other words is there a protein Y?
bait
X
p r e d a to r
Y
d o e s X b in d w ith a p ro te in ?
To find out we are going to go fishing with the two-hybrid system.
y e a s t p la s m id e x p r e s s io n v e c to r
p re d a to r
u n k n o w
tis s u e
bait
X
p r e d a to r
Y
d o e s X b in d w ith a p ro te in ?
t r a n s f e c t i o n t o t a l m R N A
酵母双杂交
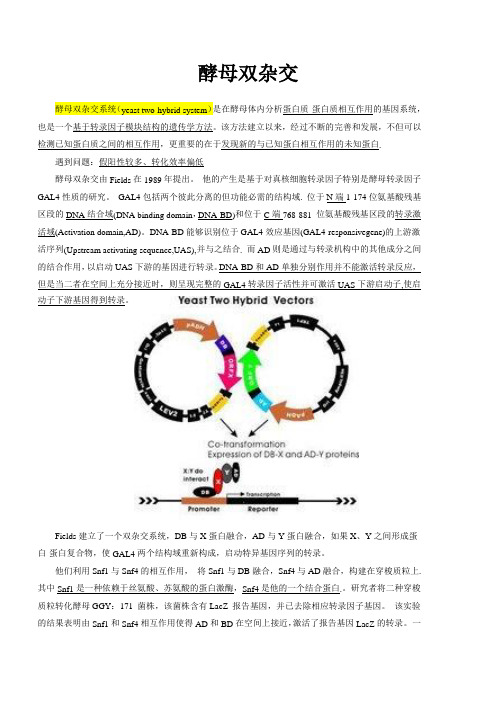
酵母双杂交遇到问题:假阳性较多、转化效率偏低酵母双杂交由Fields在1989年提出。
他的产生是基于对真核细胞转录因子特别是酵母转录因子GAL4性质的研究。
GAL4包括两个彼此分离的但功能必需的结构域. 位于N端1-174位氨基酸残基区段的DNA结合域(DNA binding domain,DNA-BD)和位于C端768-881 位氨基酸残基区段的转录激活域(Activation domain,AD)。
DNA-BD能够识别位于GAL4效应基因(GAL4-responsivegene)的上游激活序列(Upstream activating sequence,UAS),并与之结合. 而AD则是通过与转录机构中的其他成分之间的结合作用,以启动UAS下游的基因进行转录。
DNA-BD和AD单独分别作用并不能激活转录反应,但是当二者在空间上充分接近时,则呈现完整的GAL4转录因子活性并可激活UAS下游启动子,使启动子下游基因得到转录。
产生原理双杂交系统的建立得力于对真核生物调控转录起始过程的认识。
细胞起始基因转录需要有反式转录激活因子的参与。
80年代的工作表明,转录激活因子在结构上是组件式的(modular), 即这些因子往往由两个或两个以上相互独立的结构域构成, 其中有DNA结合结构域(DNA binding domain,简称为DB)和转录激活结构域(activation domain,简称为AD),它们是转录激活因子发挥功能所必需的。
前者可识别DNA上的特异序列,并使转录激活结构域定位于所调节的基因的上游,转录激活结构域可同转录复合体的其他成分作用,启动它所调节的基因的转录。
二个结构域不但可在其连接区适当部位打开,仍具有利用酵母双杂交筛选基因各自的功能,而且不同两结构域可重建发挥转录激活作用。
酵母双杂交系统利用杂交基因通过激活报道基因的表达探测蛋白-蛋白的相互作用。
单独的DB虽然能和启动子结合,但是不能激活转录。
酵母双杂交

酵母双杂交随着分子生物学研究的迅猛发展与人类基因组计划的完成, 基因工程领域的研究已从结构基因组时代走进了功能基因组时代。
功能基因组学的主要任务就是对生物基因组中包含的全部基因及其所翻译的蛋白质的功能加以解读和描述, 尤其是大量未知基因的功能及其相应蛋白质产物的功能。
系统综合分析蛋白- 蛋白相互作用将为了解蛋白质的功能提供重要的信息。
酵母双杂交是目前研究蛋白-蛋白相互作用的所有方法中较为简便、灵敏和高效的一种方法。
它是利用酵母遗传学方法在真核细胞体内研究蛋白质之间相互作用的非常有效的分子生物学技术, 可有效地用来分离能与一种已知的靶蛋白相互作用的蛋白质的编码基因。
酵母双杂交技术的可行性和有效性在验证已知蛋白质之间的相互作用或筛选与靶蛋白特异作用的诱饵蛋白的研究中已被广泛的得到证实。
随着人类、水稻和拟南芥等模式生物基因组测序的完成, 酵母双杂交及其衍生的相关技术将在蛋白质组学、细胞周期调控、细胞信号转导和肿瘤基因表达等领域的研究中发挥着越来越重要的作用。
一、酵母双杂交原理蛋白的酵母双杂交实验是以酵母的遗传分析为基础,研究反式作用因子之间的相互作用对真核基因转录调控影响的实验。
很早就已知道,转录活化蛋白可以和DNA上特异的序列结合而启动相应基因的转录反应。
这种DNA结合与转录激活的功能是由转录活化蛋白上两个相互独立的结构域即DNA结合结构域(Binding Domain, BD)和转录活化结构域(Activation Domain, AD)分别来完成的,并且这两个结构域对于基因的转录活化都是必须的。
二、酵母双杂交的系统酵母双杂交常用的有两种系统,第一种为LexA系统:DNA结合结构域由一个完整的原核蛋白LexA构成,转录活化结构域则由一个88个氨基酸的酸性的大肠杆菌多肽B42构成,它在酵母中可以活化基因的转录; 第二种为Gal4系统:BD和AD分别由Gal4蛋白上不同的两个结构域(1-147aa与768-881aa)构成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
应用酵母双杂交系统对Prp蛋白与 shadoo蛋白互作的研究
1诱饵质粒的构建 2猎物质粒的构建 3诱饵质粒与猎物质粒的可行性检验及互作
4结果分析
PRP蛋白:朊蛋白 PRNP:朊蛋白基因 Shadoo蛋白:与朊蛋白在N端结构上及其相 似的新蛋白 SPNR:Shadoo蛋白的结构基因
1
诱饵质粒的构建
往往是已知蛋白,AD-Y称作猎物(prey)。
8、目前,常用BD基因有:GAL4(1-147); LexA
(E coli转录抑制因子)的DNA-bd编码序列。
常用的AD基因有:GAL4(768-881)和疱疹病毒
VP16的编码序列等。
9、双杂交系统的另一个重要的元件是报道株。报
道株指经改造的、含报道基因(reporter gene)
⑵ 酵母双杂交系统的一个重要的问题是“假阳性”。
1)由于某些蛋白本身具有激活转录功能。在酵母中表
达时发挥转录激活作用,使DNA结合结构域杂交蛋 白在无特异激活结构域的情况下可激活转录。 2)某些蛋白表面含有对多种蛋白质的低亲和力区域, 能与其他蛋白形成稳定的复合物, 从而引起报告基 因的表达, 产生"假阳性"结果。
C) 感受态细菌的转化
1)将DH5a感受态细胞从-70℃冰箱中取出,立即置于冰 水中,10min融化;
2)将10μL连接产物加入DH5a感受态细胞溶液中(超净
工作台进行),轻轻吹打混匀,冰浴30min。42℃水浴热
Hale Waihona Puke 激2min,此时切忌振荡,之后立即放入冰水中2min,再
37℃水浴5min;
3)将37℃预热的液体LB培养基800μL于转化的 菌液中,37℃ 110r/min振荡培养45min。
灭菌;实验所需的所有试管、培养瓶、离心管等均
要用去离子水彻底清洗干净,高温高压灭菌;
2)从LB平板上挑取E.coli单菌落,接种于3-5mL LB液 体培养基, 37℃振荡培养过夜至对数生长中后期。 将该菌悬液以1:100的比例接种于50-100mL LB液 体培养基中,37℃振荡培养2.5小时至OD600=0.5; 3)细菌的收获:培养液冰浴5分钟后,4℃/5000g离心5 分钟;
相互作用
(2) Vidal等人发展了所谓的逆双杂交系统(reverse two-hybrid system)。这项技术的关键是报道基因 URA3的引入。URA3基因在这里起到了反选择的作 用, 它编码的酶是尿嘧啶合成的关键酶。该酶能把5氟乳清酸(5-FOA)转化成对细胞有毒的物质。
Vidal等人在URA3基因的启动子内引入Gal4的结合 位点。改造的酵母菌株在缺乏尿嘧啶的选择性培养 基上只有当“诱饵”和“猎物”相互作用激体转
化a接合型细胞。然后分别铺筛选平板使细胞长成菌苔
(lawn),再将两种菌苔复印到同一个三重筛选平板
上,原则上只有诱饵和靶蛋白发生了相互作用的二倍
体细胞才能在此平板上生长。单倍体细胞或虽然是二
倍体细胞但DB融合蛋白和AD融合蛋白不相互作用的
都被淘汰。
转印
盒回收,按T载体试剂盒操作说明分别与pMD18-T载
体连接,4℃连接20h,连接体系:
pMD18-T载体0.5μL
PCR回收产物4.5μL Solution 5.0μL
总体积10μL
B ) DH5a感受态细胞的制备
用CaCl2法制备DH5a感受态细胞,方法如下: l)配制0.05mol/L CaC12 15%甘油混合溶液,高温高压
胞内的真实情况。
⑶ 检测的结果可以是基因表达产物的积累效应, 因
而可检测存在于蛋白质之间的微弱的或暂时的相互作
用。
⑷ 酵母双杂交系统可采用不同组织、器多种不同亚细胞部位及功能的 蛋白。
局限性及存在的问题
⑴ 双杂交系统分析蛋白间的相互作用定位于细胞 核内, 而许多蛋白间的相互作用依赖于翻译后 加工如糖基化、二硫键形成等, 这些反应在核 内无法进行。另外有些蛋白的正确折叠和功能 有赖于其他非酵母蛋白的辅助, 这限制了某些 细胞外蛋白和细胞膜受体蛋白等的研究。
的重组质粒的宿主细胞。
最常用的是酵母细胞, 酵母细胞作为报道株的
酵母双杂交系统具有许多优点:
1 易于转化、便于回收扩增质粒。
2 具有可直接进行选择的标记基因和特征性报
道基因。
3 酵母的内源性蛋白不易同来源于哺乳动物的
蛋白结合。
应用
发现新的蛋白质和蛋白质的新功能 在细胞体内研究抗原和抗体的相互作用 筛选药物作用位点及药物对蛋白相互作用影响 建立基因组蛋白连锁图
4)此间制备LB抗生素琼脂平板,取出50℃预热的
灭菌的LB琼脂培养基按终浓度50μg/mL加入
Ampr 抗生素,摇匀切忌产生气泡,将培养基倒
入灭菌的平皿中,15~20mL/平皿。2min后凝
固,盖上平皿作好标记备用;
5)将37℃培养40-60min的转化菌液在超净工作台 中,每平皿100μL菌液的量轻轻加到己凝固的LB琼 脂培养基表面,应用无菌玻璃涂布器涂匀,37℃培 养箱放置几分钟(约10min),待液体吸收后,倒置培
(3)酵母双杂交实验转化效率太低,可以采用以下方
法解决:
1) 检测一下DNA的纯度,如果可以的话,重新用乙醇
纯化。
2) DNA-BD/诱饵蛋白很可能是有毒的。
3) 培养基不适当,重新配制培养基,并做对照转化。
4) 检测pGBT9对照载体的转化效率,放置于SD/–Trp平 板上,转化效率应该在1 x 105 colonies/mg DNA以上。
常见问题的解决方案
1、为排除假阳性就需要作严格的对照试验。应对诱饵和 靶蛋白分别作单独激活报告基因的鉴定。目前几个公 司推出的酵母双杂系统都采用了多个报告基因,且每 个报告基因的上游调控区各不相同,这可减少大量的 假阳性。另外,报告基因通常整合到染色体上,可以
使基因表达水平稳定,消除了由于质粒拷贝数变化引
(3)一些实际上没有任何相互作用的但有相同的模
体(motif)如两个亲a-螺旋的蛋白质间可以发生相互
作用。
酵母双杂交的优化
(1)在酵母的有性生殖过程中涉及到两种配合类型:a
接合型和α接合型,这两种单倍体之间接合
(mating)能形成二倍体,但a接合型细胞之间或α
接合型细胞之间不能接合形成二倍体。
Bendixen等人根据酵母有性生殖的这一特点,他们将
转录激活域(Activation domain,AD).
1 DNA-BD能够识别位于GAL4效应基因(GAL4responsivegene)的上游激活序列(Upstream activating sequence,UAS),并与之结合。 AD则通过与转录机构(transcriptionmachinery) 中的其他成分之间的结合作用,以启动UAS下游 的基因进行转录. 2 DNA-BD和AD单独分别作用并不能激活转录反 应,但是当二者在空间上充分接近时,则呈现完 整的GAL4转录因子活性并可激活UAS下游启动子, 使启动子下游基因得到转录.
起基因表达水平波动而造成的假阳性。
2、即使根据严格的对照实验证明确实发生了蛋白间 的相互作用,还应对以下方面进行分析:
(1)这种相互作用是否会在细胞内自然发生,即这
一对蛋白在细胞的正常生命活动中是否会在同一时间 表达且定位在同一区域。 (2)某些蛋白如是依赖于遍在蛋白的蛋白酶解途径 的成员,它们具有普遍的蛋白间的相互作用的能力。
6、酵母双杂交系统利用杂交基因通过激活报道基因的
表达,探测蛋白-蛋白的相互作用。编码一个蛋白的
基因融合到BD;另一个蛋白的基因融合到AD。
7、Fields建立的双杂交系统,BD与X蛋白融合,AD与
Y蛋白融合,如果X、Y之间形成蛋白-蛋白复合物,使
GAL4两个结构域重新构成,则会启动特异基因序列的
转录。一般地,将BD-X的融合蛋白称作诱饵(bait),X
提取Balb/c小鼠肝脏基因组作为模板进行PCR,模板4μL,
引物各1μL,dNTP4μL,Ex-Taq 0.5μL,dH2O 12μL,ExTaq Buffer 2.5μL;
按95℃预变性5min, 94℃30s; 65℃30s; 72℃30s, 循环30次扩增; 最后72℃延伸10min,
反应结束后经1.0%琼脂糖凝胶电泳对PCR产物进行分 析鉴定
养过夜12-16h,直至出现转化菌落。
D) 重组质粒的小量提取 按 Vitagene生物公司开发的柱离心式琼脂糖凝胶 DNA质粒小量提取试剂盒进行操作,将所提质粒DNA 在1.0%琼脂糖凝胶上进行电泳,紫外灯下观察质粒提 取情况并拍照,并贮存于-20℃
(3)在酵母双杂交的应用中有时也会遇到假阴 性现象。所谓假阴性,即两个蛋白本应发生相 互作用,但报告基因不表达或表达程度甚低以 至于检测不出来。目前假阴性现象虽不是实验 中的主要问题,但也应予以重视。
造成假阴性的原因主要有两方面。 (1)是融合蛋白的表达对细胞有毒性。这时 应该选择敏感性低的菌株或拷贝数低的载 体。 (2)是蛋白间的相互作用较弱,应选择高敏 感的菌株及多拷贝载体。
相互作用
不相互作用
缺乏尿嘧啶的培养基
在含有5-FOA的完全培养基上“诱饵”和 “猎物”的相互作用则抑制细胞的生长。 然而如果与DB或AD融合的蛋白质发生了突 变或者由于外加药物的干扰不再相互作用, URA3基因不表达,则细胞能在含有5-FOA 的完全培养基上生长。
不相互作用
相互作用
含有5-FOA的完全培养基
酵母双杂交
基本思想
1 酵母双杂交由Fields在1989年提出. 他的产生是基于对真核
细胞转录因子特别是酵母转录因子GAL4性质的研究. 2 GAL4包括两个彼此分离的但功能必需的结构域. 位于N端1-147位氨基酸残基区段的 DNA结合域(DNA binding domain,DNA-BD)
