周环反应习题
第八章_芳香烃习题
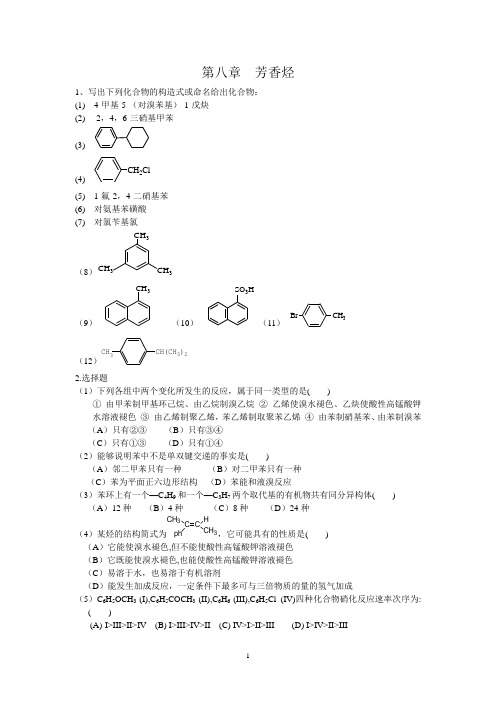
第八章 芳香烃1、写出下列化合物的构造式或命名给出化合物: (1) 4-甲基-5-(对溴苯基)-1-戊炔 (2) 2,4,6-三硝基甲苯 (3)(4)CH 2Cl(5) 1-氟-2,4-二硝基苯 (6) 对氨基苯磺酸(7) 对氯苄基氯(8)CH 3CH 3(1)CH 3(9)CH 3(3)(10)SO 3H(11)Br(7)CH 3(12)CH(CH 3)2CH 32.选择题(1)下列各组中两个变化所发生的反应,属于同一类型的是( )① 由甲苯制甲基环己烷、由乙烷制溴乙烷 ② 乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色 ③ 由乙烯制聚乙烯,苯乙烯制取聚苯乙烯 ④ 由苯制硝基苯、由苯制溴苯 (A )只有②③ (B )只有③④ (C )只有①③ (D )只有①④(2)能够说明苯中不是单双键交递的事实是( )(A )邻二甲苯只有一种 (B )对二甲苯只有一种 (C )苯为平面正六边形结构 (D )苯能和液溴反应(3)苯环上有一个—C 4H 9和一个—C 3H 7两个取代基的有机物共有同分异构体( ) (A )12种 (B )4种 (C )8种 (D )24种(4)某烃的结构简式为ph C CH 3C3H ,它可能具有的性质是( ) (A )它能使溴水褪色,但不能使酸性高锰酸钾溶液褪色 (B )它既能使溴水褪色,也能使酸性高锰酸钾溶液褪色 (C )易溶于水,也易溶于有机溶剂(D )能发生加成反应,一定条件下最多可与三倍物质的量的氢气加成(5)C 6H 5OCH 3 (I),C 6H 5COCH 3 (II),C 6H 6 (III),C 6H 5Cl (IV)四种化合物硝化反应速率次序为: ( )(A) I>III>II>IV (B) I>III>IV>II (C) IV>I>II>III (D) I>IV>II>III(6)CO2HNO2进行硝化反应的主要产物是是( )CO2HNO2NO2CO2HNO2O2NCO2HNO2NO2CO2HNO2NO2(A)(B) (C)(D)(7)NO2进行硝化反应的主要产物是( )NO2NO2NO2NO2NO2NO2NO2NO2(A)(B)(C)(D)(8)苯乙烯用热KMnO4氧化,得到产物是( )(A)CH2COOH CH CH2OHOH(B)CO2H (D)CH2CHO(C)(9)傅-克反应烷基易发生重排,为了得到正烷基苯,最可靠的方法是( )(A) 使用AlCl3作催化剂(B) 使反应在较高温度下进行(C) 通过酰基化反应,再还原(D) 使用硝基苯作溶剂(10)CH3C(CH3)3用KMnO4氧化的产物是( )(A)COOHC(CH 3)3(B)CH 3COOH(D)CHOC(CH 3)3(C)COOHCOOH(11)根据定位法则哪种基团是间位定位基( )(A) 带有未共享电子对的基团 (B) 负离子 (C) 致活基团 (D) 带正电荷或吸电子基团 (12)正丙基苯在光照下溴代的主要产物是( )(A) 1-苯基-1-溴丙烷 (B) 1-苯基-2-溴丙烷 (C) 邻溴丙苯 (D) 对溴丙苯 (13)邻甲基乙苯在KMnO 4,H + 作用下主要产物是( )(A) 邻甲基苯甲酸 (B) 邻苯二甲酸 (C) 邻甲基苯乙酸 (D) 邻乙基苯甲酸 (14)由萘氧化成邻苯二甲酸酐的条件是( )(A) CrO 3,CH 3COOH (B) V 2O 5,空气,400~500℃ (C) KMnO 4,H + (D) O 3,H 2O (15) 分子式为C 9H 12的芳烃,氧化时,生成三元羧酸,硝化时只有一种一元硝化物,则该化合物的构造式应为 ( )(A)CH 3CH 3H 3CCH 3CH 3CH 3CH 2CH 3CH 3CH 3CH 3CH 3(B)(C)(D)(16)CH 2CH 2CH 2( )(A)(B)(C)(D)COCH 2CH 2CH 3OCH 2CH 2CH 2CO(17)芳香硝基化合物最主要用途之一是做炸药,TNT 是什么化合物? ( )(A)NO 2O 2NNO 2O 2NNO 2NO 2CH 3NO 2NO 2O 2NCOOHNO 2NO 2O 2N(B)(C)(D)OH(18)下列化合物按发生芳环亲电取代反应的活性最大的为 ( ) (A) 溴苯 (B) 三氟甲苯 (C) 甲苯 (D) 苯酚 (19)下列化合物哪个没有芳香性? ( )(A)(B)(C)(D)+NO(20)下列哪个具有芳香性? ( )(A)(B)(C)(D)+NO(21)下列反应属于哪种类型? ( )C 6H 6+CH 3AlCl 36H 5COCH 3(A) 亲电反应 (B) 亲核反应 (C) 自由基反应 (D) 周环反应(22)下面化合物进行硝化反应速率最快的是 ( )(A)(B)(C)(D)COCH 3CH 3OCH 3NHCOCH 3(23) 下面化合物中无芳香性的是( )(A)(B)(C)(D)+_+(24)下面化合物中有芳香性的是 ( )(1)(2)(3)(4)+(A) (2) (3) (B) (1) (2) (C) (1) (4) (D) (1) (3)(25) 下列化合物中, 不能发生傅-克烷基化反应的是( )(A)(B)(C)(D)CH3CH 2ClNO 2(26)PhCH=CHCH 3与HBr 反应的主要产物为 ( )(A)(B)(C)(D)PhCHCH 2CH 3BrPhCH 2CHCH 3BrBrCH CHCH 3BrCHCH 2CH 3Br(27)下列反应,当G 为何基团时,反应最难?( )G+RCClOAlCl 3GCOR(A) ─NO 2 (B) ─OCH 3 (C) ─CH(CH 3)2 (D) ─H(28) 由苯合成对氯间硝基苯磺酸可由三步反应完成,你看三步反应以哪个顺序较好? ( )(A) (1) 磺化 (2) 硝化 (3 )氯化 (B) (1) 氯化 (2) 磺化 (3) 硝化 (C) (1) 硝化 (2) 磺化 (3)氯化 (D) (1) 氯化 (2) 硝化 (3) 磺化 3.完成下列反应式:(1)△C 2H 5H 3C (2)+(CH 3)3CClCH 3CH 3AlCl(3)H 2SO 4ClH 3C(4)Br 2Cl 2hvH 3C(5)H 2SO 4+60℃(6)CH 2ClCH 33+CO Zn-Hg 浓HCl(7)CH 3CH(CH 3)2(CH 3)3C4H +(8)H 2SO 4NO 2NH HNO 3CO(9)H 2SO 4KMnO 4BrC 2H 5HNO 3(10)OCH 3COCH 3O(11)+(12)24CH 2O 2 N(13)NO 22OCH 3Fe(14)+ClCH 2CH(CH 3)23(15)24H KMnO 4HNO 3(16)CH 2ClCH 3AlCl +CO C O(17)CH 2CH 2CH 3NBSC 2H 5OH KOH4. 将下列化合物进行一次硝化,试用箭头表示硝基进入的位置(指主要产物)CH 3NO 2NHCOCH 3NO 2ClOHCOOHCH 3CH 3OHSO 3HBrClNO 2COCH 3COOH5. 预测下列化合物溴代的主要产物: (1) 对氯硝基苯 (2) 间二硝基苯(3)CH 3NH 2( 4 ) O-ClC 6H 4COCH 3 ( 5 ) m-CH 3C 6H 4CN( 6 )NO 2NH 2( 7 ) p-ClC 6H 4COCH 3CH 3( 8 )NO 2OHOCH 3( 9 )( 10 )OHCH 3( 11 )NH 3HSO 3(12 )CF 36. 用反应机理解释下列反应过程:(1)+(CH 3)2CHCH 23C(CH 3)3(2)3CH 2CH 2C OO7. 鉴别下列各组化合物: (1) 苯、乙苯、苯基乙炔 (2) 环己烷、环己烯、苯8. 由苯或甲苯和其它无机物合成下列化合物: NO 2COOHCH 3CH(CH 3)2COOHBrNO 2BrCH 2ClBrO 2NCH 3COOHCl CH 2CH 2CH 3NO 2(1)(2)(3)(4)(5)(6)(7)9. 推测结构:(1)化合物(A)的分子式为C9H8,在室温下能迅速使Br2-CCl4溶液和稀的KMnO4溶液褪色,在温和条件下氢化时只吸收1mol H2,生成化合物(B),(B)的分子式为C9H10;(A)在强烈的条件下氢化时可吸收4mol H2,强烈氧化时可生成邻苯二甲酸;试写出(A),(B)的构造式。
药物合成反应习题及答案

药物合成反应习题及答案一、举例解释下列概念:1, 官能团保护;为什么保护?当分子中有多个官能团,想在某一官能团进行转换反应,为了不使其他官能团影响反应,需对这些官能团进行衍生化,这就是官能团的保护。
达到反应目的后再还原这些官能团。
理想保护基:试剂易得、无毒,保护基稳定,引入和脱去反应选择性好,收率高。
2, 相转移催化剂; 一种与水相中负离子结合的两性物质,可以把亲核试剂转移到有机相进行亲核反应。
相转移催化剂优点:克服溶剂化作用;不需无水操作;可用无机碱代替有机金属碱;降低反应温度。
3,重排反应;重排反应是指在同一分子内,某一原子或基团从一个原子迁移至另一原 子而形成新分子的反应。
按反应机理可分为亲电重排、亲核重排、自由基重排和协同重排。
4,合成子;合成子:组成靶分子或中间体骨架的各个单元结构的活性形式. 包括:离子合成子、自由基或周环反应所需的中性分子。
离子合成子:包括 d 合成子和 a 合成子d 合成子: 亲核性的离子合成子 d---donor of electrond 合成子CN KCNCH 2-CHO CH3CHOMeSHMeS RCH C RCH CHBu BuLi等价试剂a 合成子:氧化性或亲电性的离子合成子 a 合成子:Me 2C-OH Me 2C=OCH 2COCH 3BrCH 2COCH 3CH 2-CH-COOR CH 2=CH-COOR等价试剂5,协同反应协同反应:在反应过程中,若有两个或两个以上的化学键破裂 和形成时,都必须相互协调地在同一步骤中完成。
6, 非均相催化氢化: 催化剂、反应物、试剂和氢供体在两项或多项中反应,催化剂自成一相,称为非均相催化氢化。
催化剂自成一相称为非均相催化剂如Pd/C 为催化剂, 氢气为氢供体,在反应液中还原双键的反应。
1) DMAP 2) DMF 3) DCC 4) TBAF1) Aromatic Electrophilic Substitution; 芳香亲电取代2) Phase-transfer catalyst; 相转移催化剂 3) Carbocations; 碳负离子4) trifluoroacetic anhydride.三氟乙酸酐Ryoji Noyori was awarded the Nobel Prize in 2001, What did he discover?Ryoji Noyori 日本名古屋大学的野伊良治因在手性催化氢化反应方面做出了突出贡献而被授予2001年Nobel 化学奖。
有机II练习题-周环反应习题-答案

一、回答问题:
1.前线轨道理论中,HOMO轨道是指(最高占据轨道),LUMO轨
道是指(最低空轨道)。
2.在电环化反应中,光照条件下,具有4n π电子的共轭烯烃以( 对
旋)方式成环?而具有4n+2 π电子的共轭烯烃以(顺旋)方式成环?
3.在Diels-Alder反应中([4+2]环加成),内式产物是由亲双烯体和
双烯体(过渡态中亲双烯体上的取代基接近双烯体上的π轨道)方式形成的,而外式产物由亲双烯体和双烯体(过渡态中亲双烯体上的取代基远离双烯体上的π轨道)方式形成的。
4.为何在下面[4+2]环加成反应中内式产物是主产物?
内式过渡态中亲双烯体的不饱和取代基π电子与双烯体形成的C2-C3之间π电子有次级作用,可降低过渡态能量,因此在动力学控制条件下,内式产物为主产物。
5.在σ-迁移重排反应中,在加热条件下,1,5-H迁移是(同面)迁移,
而1,7-H迁移是(异面)迁移。
二、完成反应:
H 3CO
O
100o C
3.O
H 3CO
O
4.
O
hv
5.
+
CO 2CH 3
H 3CO 2C
N N N
Ph 6.
N N
Ph H 3COOC
COOCH 3
三、 写出下面反应历程:
2.
电环化开环
H
H
顺旋
3.
加热
四、
合成下列化合物。
普通化学习题集

计算题1、反应2C(s,石墨)+2H2(g)+H2O(l)=C2H5OH(l)并不能实际发生。
由下列反应计算乙醇的ΔfH θm(298)。
(1) C2H5OH(l) + 3O2 (g)= 2CO2(g) + 3H2O(l) ΔrH θm(1)=-1366.7 kJ·mol-1(2) C(s ,石墨) + O2(g) = CO2(g) ΔrH θm(2)=-393.5 kJ·mol-1(3) H2(g) + 1/2O2(g) = H2O(l) ΔrH θm(3)=-285.8 kJ·mol-1解:2×(2)+3×(3)-(1)得:H2(g)+ 2C(s,石墨)+1/2 O2(g)= C2H5OH(l)ΔfH θm(C2H5OH ,l)= 2×ΔrH θm(2)+3×ΔrH θm (3)-ΔrH θm (1) =-277.7 (kJ·mol-1)2. 溶液中 c(Fe3+)=0.10mol·L-1,刚开始生成沉淀Fe(OH)3时的pH 是多少?Fe3+定性沉淀完全时pH 是多少?已知K θsp{Fe(OH)3}=2.64×10-39解: Fe(OH)3 = Fe3+ + 3OH-K θsp(Fe(OH)3)={c(Fe3+)/c θ}.{c(OH-)/c θ}3刚开始沉淀时所需c(OH-)为pH=14-(-lg2.98×10-13)=1.47定性沉淀完全时,c(Fe3+)=10-5 mol·L-1pH=14-(-lg6.42×10-12)=2.813. 写出下列原电池符号,并计算电动势(298.15K ),判断反应在298.15K 时的自发方向。
Zn(s) + Ni2+(0.080 mol·L-1) = Zn2+(0.020 mol·L-1) + Ni(s)已知:ϕθ(Ni2+/Ni) = -0.250V , ϕθ(Zn2+ / Zn) = -0.762V解: 原电池符号: Zn|Zn2+(0.020 mol·L-1)‖Ni2+ (0.080 mol·L-1)|Ni正极: 负极:ε>0,所以反应在298.15K 时正向自发进行。
有机化学Chap18~21-周环杂环糖脂类氨基酸复习重点资料

D. 油脂易酸败
7. 维生素 A 为动物生长发育所必须,人体缺乏它,会导致夜盲症。它属于( )
A. 单萜
B. 倍半萜
C. 双萜
D. 三萜
8. 下列属于甾族化合物的是( )
有机化学
第4页
有机化学习题集
Chap20、21-杂环、脂类、氨基酸
Chap18-杂环化合物 参考答案
Chap19-杂环化合物 参考答案
A. 葡萄糖
B. 蔗糖
5. α-D-吡喃葡萄糖的 Haworth 式为()
C. 糖原
D. 麦芽糖
6. 下列糖与 HNO3 反应后,产生内消旋体的是()
7. D-吡喃葡萄糖与 1mol 无水乙醇和干燥 HCl 反应得到的产物属于()
A. 醚
B. 酯
C. 缩醛
D. 半缩醛
8. 下列叙述正确的是()
A. 糖类又称为碳水化合物,都符合 Cm(H2O)n 通式
一、选择题 1. D 2. A
二、是非题 1. × 2. √
3. C 4. C 5. A 6. A 3. √ 4. × 5. √
参考答案
7. C 8. B
Chap21 脂类、氨基酸 参考答案
一、选择题 1. C 2. C 3. A 4. B 5. B 6. C 7. C 8. A
有机化学
第5页
3. 由于β-D-葡萄糖的构象为优势构象,所以在葡萄糖水溶液中,其含量大于α-D-
葡萄糖。( )
有机化学
第3页
有机化学习题集
Chap20、21-杂环、脂类、氨基酸
4. 葡萄糖、果糖、甘露糖三者既为同分异构体,又互为差向异构体。( ) 5. β-D-甲基吡喃葡萄糖苷在酸性水溶液中会产生变旋光现象。( )
李景宁《有机化学》(第五版)笔记和课后习题(含考研真题)详解-周环反应【圣才出品】

HOMO 决定。
17.2 课后习题详解
1.推测下列化合物电环化反应产物的结构。
((11))
(2) HH
(1)
(2)(1)
(2)
HH
((12))
(2)
)
H H3C
H CH3
H
(3)
H3C
CH3
hv
(2)
HH
H CH3
hv
(3) H(4) H
(3) H3HC HCH3
(3) H3CHH3C CHHC3H3 (5)
8 / 18
圣才电子书
答:
十万种考研考证电子书、题库视频学习平台
9.通过什么反应和条件,完成下面的反应。
Ph
O
O
O
Ph
O
O
Ph
Ph
O
答:通过光照和加热能得到给出的结果,反应过程如下:
Ph
hv
对旋
Ph
Ph
O
O
O
Ph
Ph
Ph
O
O O
10.如何使反-9,10-二氢萘转化为顺-9,10-二氢萘?
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 17 章 周环反应
17.1 复习笔记
一、电环化反应 1.电环化反应 (1)电环化反应的概念 电环化反应是指在加热或光照条件下,共轭多烯烃环合形成环烯烃的反应及其逆反应。 (2)电环化反应的规律性 共轭多烯烃电环化反应有高度的立体选择性,反应与共轭体系的π电子数目有关,主要 分为 4n 型共轭多烯和 4n+2 型共轭多烯。其关系见表 17-1。
子的 HOMO 与另一个反应分子的 LUMO 对称性符合正正重叠或者负负重叠,形成化学键,
第十一章 周环反应
电子数(1+j) 4n [1,3] 4n+2 [1,5]
反应条件 光照 加热
立体选择 同面迁移 同面迁移
第四节 σ迁移反应
2. [1,j]碳迁移
第四节 σ迁移反应
2. [1,j]碳迁移
第四节 σ迁移反应
3. [i,j]碳迁移
3 2 1 3' 2' 1'
周环反应中前线轨道的性质决定着反应的途径
第一节 周环反应
二、前线轨道理论和对称守恒原则 2、对称守恒原则
Robert B. Woodward (1917–1979) 美国 1965年获奖
随分子轨道能级的 增加,对称性也由 对称转向不对称
第一节 周环反应
二、前线轨道理论和对称守恒原则 2、对称守恒原则 周环反应的成键过程是分子轨道重新组合的过程, 反应中分子轨道的对称性必须守恒
二、电环化反应解释
前线轨道为HOMO轨道 1. 2,4-己二烯的电环化反应——4n体系
第二节 电环化反应
第二节 电环化反应
2. 2,4,6-辛三烯的电环化反应 ——4n体系
第二节 电环化反应
第二节 电环化反应
3. 电环化选择规律
共轭体系 电子数
顺 对 旋 旋
4n+2
4n
禁阻
h
允许
允许
第一节 周环反应
一、周环反应 电环化反应
1. 周环反应
环加成反应
σ迁移反应
第一节 周环反应
电环化反应和 σ迁移反应是分子内反应 环加成反应一般是分子间反应 2. 周环反应特点 (1) 协同反应
(2) 不要酸碱催化,也不受溶剂极性影响,但受光或热制约
周环反应(3)
s-迁移反应Sigmatropic reactionCope 重排旧的s 键新的s 键氢的[1,5]s-迁移H3C H CH3H3CH3在共轭烯烃体系中的一端s键移位到另一端同时协同发生p键的移位过程的反应s-迁移反应通式112231122445[3,3]s -迁移[5,5]s -迁移CXX迁移基团构型反转同面迁移X迁移基团构型反转异面迁移异面迁移[1,5]迁移情况Y 1Y 2Y 3HOMOY 1Y 2Y3HOMO在过渡态中,一个组分的HOMO和另一个组分的HOMO发生重叠,而每一个HOMO只能有一个电子,重叠后,成键的轨道中就有一对电子。
氢的[1,3]s-迁移(异面)X碳的[1,3]s-迁移(同面)O CO H 2C CH3CH 2H H+O特殊的氢[1,3]s -迁移现象扩环减少环的张力的碳[1,3]s-迁移现象H3C扩环减少环的张力的碳[1,3]s-迁移现象y 1y 2y 3y 2y 3同面对称禁阻同面对称允许异面对称允许,但几何形状扭曲氢的[1,5]s-迁移氢的[1,5]迁移氢的[1,7]迁移对较大的p 骨架来说,同面和异面两种迁移,从几何的角度出发应该都是有可能的,因为p 骨架越大,在空间折叠的可能性也越大,平面和异面的概念在某种程度上会淡化。
这时,s 迁移反应的发生就取决于轨道对称性了。
对于氢的迁移来说,[1,7] 迁移是异面的,而[1,9]迁移是同面的。
对较大的p 骨架来说,同面和异面两种迁移,从几何的角度出发应该都是有可能的,因为p 骨架越大,在空间折叠的可能性也越大,平面和异面的概念在某种程度上会淡化。
这时,s 迁移反应的发生就取决于轨道对称性了。
对于氢的迁移来说,[1,7] 迁移是异面的,而[1,9]迁移是同面的。
仔细观察,1不可能通过[1,3]迁移变成2,而氢的[1,3]迁移只能变成3。
仔细观察,1不可能通过[1,3]迁移变成2,而氢的[1,3]迁移只能变成3。
对[1,3]迁移和[1,5]迁移来说,几何构型有效地阻止了异面迁移,所以[1,3]迁移有构型转化,[1,5]迁移构型保持不变。
湖南大学有机化学-课后例题习题-第十一章
11 章 思 考 题11.1 周环反应有哪些明显的特征? 11.2 什么是环加成?11.3 2-叔丁基-1,3-丁二烯与顺丁二烯酸酐的双烯合成反应比1,3-丁二烯要快,而1-取代的顺式体例如顺-1-叔丁基-1,3-丁二烯却比1,3丁二烯的速度慢,为什么?11.4 阐明下面反应的机理,包括(1)反应属于什么类型?(2)反应是通过什么过渡态完成的?(3)写出详细的反应过程以阐明产物为什么具有下式中的结构。
H O HCH 3CH 3HH CHO CH 3CH CH 3HCH 2 △11.5 试解释下列现象:(1)1,3-环戊二烯与顺丁烯二酸酐的环加成反应,主要产物是内向型异构体,而外向型的异构体很少。
(2)1,3-环戊二烯与顺丁烯二酸环加成,生成产物为(A),而与反丁烯二酸酯则得到(B)。
解 答11.1 答 周环反应的特点是在反应中没有活性中间体生成,反应一般在加热或光照下进行;反应速度基本上不受溶剂或催化剂的影响;反应具有很高的立体选择性;反应过程中共价键的断裂和形成经过环状过渡态协同进行。
周环反应包括电环化反应、环加成反应和σ键迁移反应等。
11.2 答 环加成反应主要是指两个烯烃或共轭多烯烃分子由于双键的相互作用,通过两个σ键连接成一个单一的新的环状化合物的反应。
环加成反应主要是[2+2]和[2+4]两类反应,如Diels-Alder 反应就是一个[2+4]环加成反应。
11.3 答 由于双烯合成反应是协同反应,亲二烯体必须在同一时间与二烯的两端起作用。
为了使反应能够发生,二烯必须采用S-顺式构象。
如果二烯采取S-反式构象,亲二烯体将不能在同一时间去接近二烯的两端。
虽然S-反式构象比S-顺式稳定,但在进行反应时,S-反式需转变成S-顺式才能进行反应。
2-叔丁基-1,3-丁二烯与顺丁烯二酸酐的反应,1,3-丁二烯快27倍。
因为叔丁基使S-顺式构象比S-反式构象更稳定,使其容易生成而有利于反应的进行。
邢其毅《基础有机化学》笔记和课后习题(含考研真题)详解(周环反应)
第16章周环反应16.1 复习笔记一、周环反应和分子轨道对称守恒原理1.周环反应(1)定义:在化学反应过程中,能形成环状过渡态(cyclic transition state)的协同反应(synergistic reaction)统称为周环反应。
(2)协同反应是一种基元反应(elementary reaction)。
其含义是:在反应过程中,若有两个或两个以上的化学键破裂和形成时,都必须相互协调地在同一步骤中完成。
(3)周环反应具有如下的特点:①反应过程中没有自由基或离子这一类活性中间体产生。
②反应速率极少受溶剂极性和酸、碱催化剂的影响,也不受自由基引发剂和抑制剂的影响。
③反应条件一般只需要加热或光照,而且在加热条件下得到的产物和在光照条件下得到的产物具有不同的立体选择性(stereoselectivity),是高度空间定向反应。
④遵循微观可逆性原理。
(4)周环反应主要包括电环化反应(electrocyclic reaction)、环加成反应(cycloaddition)和σ迁移反应(σmigrate reaction)。
2.分子轨道对称守恒原理电环化反应在加热和光照条件下具有不同的立体选向性。
分子轨道对称性是控制这类反应进程的关键因素。
分子轨道对称守恒原理认为:化学反应是分子轨道进行重新组合的过程,在一个协同反应中,分子轨道的对称性是守恒的,即由原料到产物,轨道的对称性始终不变。
因此分子轨道的对称性控制着整个反应的进程。
二、前线轨道理论1.前线轨道理论的概念和中心思想(1)基本概念①最高占有轨道(HOMO):已占有电子的能级最高的轨道。
②最低未占有轨道(LUMO):未占有电子的能级最低的轨道。
③单占轨道(single occupied molecular orbital):有的共轭体系中含有奇数个电子,它的已占有电子的能级最高的轨道中只有一个电子。
用SOMO表示。
单占轨道既是HOMO,又是LUMO。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
CO2Me CO2Me
1 4e 加热开环。
2 分子内[4+2]环加成即 D-A 反应。
OH
OH
OH
O
17) 1 4e 加热开环。
1
2
2 分子内[4+2]环加成即 D-A 反应。
-MeOH
H -MeOH 2
3
3
18)
+
OH MeO
NMe2 OMe
1
O NMe2 2 OMe
1
O 1
2 NMe2 3
1 亲核取代 2 消除 3 [3,3] σ- 迁移 2-2 解释下列各个反应的过程,并给出中间体产物和最终产物的结构。
29
31
8)化合物 瞬烯( bullvalene, 30.0, 20.5。 解:
31),在−62℃下,13C NMR上有 4 个峰,化学位移分别为 128.1,127.2 ,
Cl Br Ag+
1)
- AgCl
+ Br 开环
Br
HOH +
-H +
Br OH
Br Cl Ag+
- AgBr
+ Cl 开环
Cl
9
O
CH3O 1
4) 1,2,4-三叔丁基苯光照反应生成杜瓦苯衍生物1,为何没有2生成呢?1要加热到 200℃才能形成 Kekulé苯,为什么1是相对稳定的呢?
light 200℃/ 15 min
1
2
5)2,3-二甲基丁二烯和顺丁烯二酸酐可以发生 D-A 反应,但 2,3-二异丙基丁二烯和 1,1,4,4- 四苯基丁二烯都很难进行类似的反应。 6)2,6-二甲基烯丙基醚与马来酸酐在在 200℃反应,除得到 Claisen 重排产物外还有两个分子式均 为 C15H16O4 的产物。 7) 化合物半瞬烯(semibullvalene, 29)在−167℃1H NMR上有五个峰,它们的化学位移分别为 5.59,2H),5.08(2H), 316(1H),2.83(1H),2.79(2H), 在 −103 ℃ 时 只 有 三 个 峰 : 5.05(2H), 4.17(4H), 2.98(2H ) 。
4) +
H2O
O 1
ene 5) 可能答案是
R O
+
-HOH
O
R [ 3,3] σ - 迁移
R -
- EtO
R
CO2CH3
CH2CH=O
CO2CH3 D-A 反 应
CO2CH3 CO2CH3
CO2CH3 CO2CH3
CO2CH3
CO2CH3
2-3 说明下列实验现象。 1)下列两个异构体化合物反应后分别失去氯或溴生成不同的环庚烯衍生物。给出各个反应产物的 结构。
3
4
2 1 CN
5
CN
4 5 NC
3 2 1
CN
1 NC H 2
5 4 CN
3
H
5
4
1
CN
NC
23
1 逆 Diels-Alder 反应 ([4+2]环加成是可逆的)。 2 CN [1,5] σ- 迁移 (C 迁移)。 3 H [1,5] σ- 迁移。
CN 3 CN
7) 路 线 1 5
CH3
4
(1)
1
3
12
3
H
ene 反应。
H
+
H
H3O
MeO 2
H
1 OMe
O H
H
3 H
12 3
MeO H
HO H
[3,3] σ- 迁移
3 15)
4
2 1
H 5
O H
2
3
1
14 5 HH
2 H
1 H [1,5] σ- 迁移。 2 CO2Me
16) CO2Me 1
ene 反应。 CO2Me
CO2Me
H3O +
6
CO2Me CO2Me 2
Et H Me
5)
Br2 O
? NaI ?
[?
O
?]
O
O
O
O
CN
CN
6)
?
?
CN 1
2
3
CN
CH3 7)
CH3
CH3
+
CH3
CH3
CH3
A
B
1
H3C D
8)
?
CN
9)
CN
CH3
D CN CN
10)
?
+
11) OO O
12)
+
O O
13)
?
?
H2
?
?
O
OO O
+
O
14 )
OMe
15)
CO2Me 16)
_
78
。 C
O NaBH4 4
1
OH 1)
CHO
2) H3O+
OH 。
185 C
OH O MsCl
Et3N - HCl 2
OH
OMs
O - MsOH
3
5
O
Mg
H1
3)
Cl
MgCl
OH
OEt3 OEt3 OEt3
O
- EtOH
O
C2H5CO2H -EtOH
EtO OEt 2
OEt
CO2C2H5
8
3 2 CH3
CH3 32
(3) 4
5
1 H
CH3
路线2
5 CH3
4
(1)
1
3 2 CH3
CH3 4
5 3
21 CH3 CH3
32
4 51 CH3
A
2 H CH3
(2) 3
1
45 CH3
CH3 2
31 45 B CH3
CH3 4
5
3
21
CH3 B
H CH3 5
(2) 4
1
32 CH3
H
CH3
5
4
1
32 A CH3
O NMe2
1)
O1
OSiMe3 2
HCl
O
Me3SiO
O
O
Pri 2NLi
1) CHO MsCl
4
2)
THF/
_
78
。 C
1
2
2) H3O+
Et3N
3
OEt3
OEt3
OH
Mg
1
OEt3 2
3)
Cl
C2H5CO2H
R
CO2Me CH3
OH 。 185 C 5
CO2C2H5
R
4) HO
O 1
CH2CHO
第二章 周环反应
2-1 下列各个反应都包括有周环反应,试说明各个中间体产物和最终产物的结构,并指出发生了什
么类型的周环反应。
H
110℃
250℃
1)
?
H
H
light
2)
?
?
H
H
3)
Me
?
Et
1
2
H
CO2R 4)
N CO2R Ar
?
R' O2C
CO2R
?
N Ar
R' O2C
CO2R
H
+ Me H Et
H
2
3 4)
1
light
4
1 2
43
1
11
3
4
2
1
12 3
4
2
关环生成 2 时过渡态两个叔丁基很拥挤,所以不发生此反应。 1 形成 Kekulé 结构不能经过周环反应来实现。
O
O
5)
+
O
O
O O
+
O
O
Ph
O
Ph
+
O
Ph
O
Ph
O
位阻效应使丁二烯共轭性能下降,共平面性差, 所以很难反应。
OH O
6)
O
O
HOH +
-H +
经过周环反应中的开环,4 个 π 电子,加热顺旋开环。
Cl OH
10
H 2)
H
1 H
H1
H
H
2
.
.
H
H
2
1 如果经过周环反应中的开环,4 个 π 电子,加热顺旋开环,则得到张力很大的化合物 1
2 高温经过双自由基历程,得到化合物 2 ,这是可行的途径。
3) CH3O
3
O 1
12
2 3
7
CO2CH3
5)
CO2CH3
CO2CH3
解:
CO2CH3
1)
O
O
HO
MeSiCl OH 1
Me3SiO
CO2CH3
OSiMe3 H3C 2
Me3SiO
OSiMe3 CO2Me
HCl
CH3
HO 2)
OH CO2Me
CH3
O
OH CO2Me - HOH
CH3
O
CO2Me CH3
O
Pri 2NLi
THF/
Br2 Br
5)
O
1 Br
I
NaI
O
2I
+_
Na OH
O
[
3 - HOI
