有机化学 第17章 周环反应
克莱森Claisen重排

同)的则给出成键轨道,两个原子轨道的对称性不
同(位相不同)的则给出反键轨道。
原子轨道 S 轨道 P 轨道
图形
对称
不对称
第一节
周环反应的理论>二、周环反应的理论
分子轨道对称守恒原理中心内容及内函: 化学反应是分子轨道重新组合的过程,分 子轨道的对称性控制化学反应的进程,在一个
协同反应中,分子轨道对称性守恒。(即在一
反应物→中间体→产物 周环反应: 反应物→产物
第 一节
周环反应的理论
一、周环反应 二、周环反应的理论
第一节
周环反应的理论>一、周环反应
周环反应的特征: (1)多中心的一步反应,反应进行时键的断裂和 生成是同时进行的(协同反应)。
(2)反应进行的动力是加热或光照。不受溶剂 极性影响,不被酸碱所催化,不受任何引发剂的引发。
,用LUMO表示。
HOMO、LUMO统称为前线轨道,处在前线轨道上的电 子称为前线电子。 有的共轭体系中含有奇数个电子,它的已占有电子 的能级最高的轨道中只有一个电子,这样的轨道称为单
占轨道,用SOMO表示,单占轨道既是HOMO,又是LUMO。
第一节
周环反应的理论>二、周环反应的理论
ψ4
E4
ψ
3
E3 E
曾昭琼《有机化学》第三版CAI教学配套课件
有机化学
主讲:谢启明 教授
第十七章
周环反应
§17~1 周环反应的理论
§17~2 电环化反应
§17~3 σ- 键迁移反应
§17~4 环加成反应
第一节
周环反应的理论>一、周环反应
周环反应:反应中无中间体生成,而是通过形 成过渡态一步完成的多中心反应。
有机化学协同反应

四 前线轨道理论对电环化反应选择规则的解释
前线轨道理论认为: 一个共轭多烯分子在发生电环合反应时,必须掌握二项原则: (1)电环化反应中,起决定作用的分子轨道是共轭多烯的
HOMO,反应的立体选择主要取决于HOMO的对称 性。 (2)当共轭多烯两端的碳原子的p轨道旋转关环生成σ键 时,必须发生同位相的重叠(因为发生同位相重叠使 能量降低)。
光照条件下,到处于激发态的乙烯分子中的一个电子跃迁π*轨道 上去,因此,乙烯的HOMO是π*,另一乙烯分子基态的LUMO也 是π*,两者的对称性匹配是允许的,故环加成允许。
24
[4+2] 环加成 以乙烯与丁二烯为例
从前线轨道来看,乙烯与丁二烯HOMO和LUMO如下图:
LUM Oπ* HOM π O 乙 烯 的 前 线 轨 道 图
+
a b - c
a + = b - c
例如:
+
-C N -C
+
-CN -O
+
N N -C
+
-C = N -C (腈叶利德) -C += N -O(氧化腈)
N += N -C(重氮烷)
31
1,3-偶极化合物的结构特点
这类化合物都具有“在三个原子范围内包括4个电子的体系”
O3
-OO-O CH2N2
2C-H N-N RN3
1,3-偶极化合物的分子轨道的特点:
-N-RN-N
LUMO HOMO
与烯丙基负离
子具有类似的分
子轨道的特点。
32
2. 1,3-偶极环加成反应
定义:1,3-偶极化合物和烯烃、炔烃或相应衍生物生成五元 环状化合物的环加成反应称为1,3-偶极环加成反应。
周环反应的理论解释PPT课件

有机反应的类型 离子型反应
分子型反应(周环反应、协同反应)
分子型反应的基本特征: 1. 反应过程中不产生离子或自由基等活性中间体. 2. 反应不受溶剂极性的影响,一般也不被酸或碱所催化。 3. 反应为一步到位过程且只经过一个多中心环状过渡态。 4. 旧键的断裂和新键的形成是同步发生的。
(3) 反应有显著的立体选择性,生成空间定向产物。
R hv
R
R
R
R
R = - COOCH3
R
(一) 分子轨道对称性守恒原理(Conservation of orbital symmetry)
1. 原理的提出:
1965年伍德沃德和霍夫曼(R . B . Woodward , R . Hoffmann)在 系统研究大量协同反应的试验事实的基础上从 量 子 化 学 的 分 子 轨 道 理 论 出 发提出了分子轨道对称性守恒原理。 1971年福井谦一 提出了完整的前线轨道(ontier orbital)理论。
SO2
1,3-偶极加成: CH2 N N
CHCO2Me CHCO2Me
N N
CO2Me CO2Me
[4+2]环加成: CH2 CH CH CH2 CH2 CH2
对称允许的[4π+2π]热环化加成反应
Ψ2(A) Ψ2(A)
Ψ3(S) Ψ1(S)
对称禁阻的[2 π +2 π]热环化加成反应
前线轨道 (FMO)理论认为,在双分子光反应中,两 组分均为具有两个成单电子的激发态分子,单电子占据 的MO又称为SOMO,。故光照下的环加成方式为: 两组分能量较高的两个SOMO组合形成一个σ单键; 两组分能量较低的两个SOMO组合形成另一个σ单键。 两组分相互组合的SOMO必须具有相同的对称性且能量相 近才能重叠。若对称性不同则不能发生环加成反应
有机化学(第五版)下册课后答案 李景宁
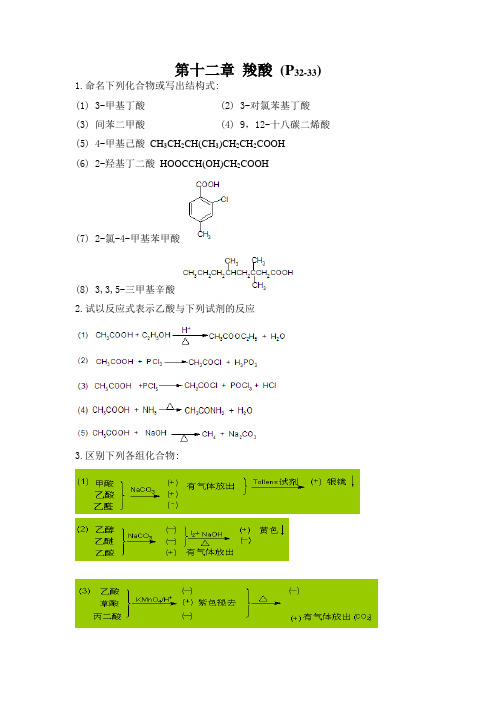
第十二章羧酸(P32-33) 1.命名下列化合物或写出结构式:(1) 3-甲基丁酸 (2) 3-对氯苯基丁酸(3) 间苯二甲酸 (4) 9,12-十八碳二烯酸(5) 4-甲基己酸CH3CH2CH(CH3)CH2CH2COOH(6) 2-羟基丁二酸HOOCCH(OH)CH2COOH(7) 2-氯-4-甲基苯甲酸(8) 3,3,5-三甲基辛酸2.试以反应式表示乙酸与下列试剂的反应3.区别下列各组化合物:4.指出下列反应的主要产物:(第四版保留)(1)C6H5CH2Cl 干醚MgC6H5CH2MgCl(1) CO2(2) H2OC6H5CH2COOH SOCl2C6H5CH2COCl 4.完成下列转变:5、怎样由丁酸制备下列化合物?6、解:7、指出下列反应中的酸和碱。
按lewis酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱。
8.(1)按酸性降低的次序排列下列化合物:①酸性: 水>乙炔>氨;②酸性: 乙酸>环戊二烯>乙醇>乙炔(2)按碱性降低的次序排列下列离子:>>①碱性:CH3HC C CH3O②碱性:(CH3)3CO>(CH3)2CHO>CH3O9. 解:化合物A有一个不饱和度,而其氧化产物B含有两个不饱和度。
产物DC5H10有一个不饱和度。
从题意可知:D的结构式可能为环戊烷;C的结构为环戊酮;B的结构为己二酸;A的结构式为环己醇。
10.解:(1)由题意:该烃氧化成酸后,碳原子数不变,故为环烯烃,通式为CnH2n-2。
(2)该烃有旋光性,氧化后成二元酸,所以分子量=66*2=132。
故二元酸为CH3CH(CH2COOH)COOH11.由题意:m/e=179,所以马尿酸的分子量为179,它易水解得化合物D和E,D 的IR谱图:3200-2300cm-1为羟基中O-H键的伸缩振动。
1680为共扼羧酸的>C=O的伸缩振动;1600-1500cm-1是由二聚体的O-H键的面内弯曲振动和C-O 键的伸缩振动之间偶合产生的两个吸收带;750cm -1和700cm-1是一取代苯的C-H 键的面外弯曲振动。
李景宁《有机化学》(第五版)笔记和课后习题(含考研真题)详解-周环反应【圣才出品】

HOMO 决定。
17.2 课后习题详解
1.推测下列化合物电环化反应产物的结构。
((11))
(2) HH
(1)
(2)(1)
(2)
HH
((12))
(2)
)
H H3C
H CH3
H
(3)
H3C
CH3
hv
(2)
HH
H CH3
hv
(3) H(4) H
(3) H3HC HCH3
(3) H3CHH3C CHHC3H3 (5)
8 / 18
圣才电子书
答:
十万种考研考证电子书、题库视频学习平台
9.通过什么反应和条件,完成下面的反应。
Ph
O
O
O
Ph
O
O
Ph
Ph
O
答:通过光照和加热能得到给出的结果,反应过程如下:
Ph
hv
对旋
Ph
Ph
O
O
O
Ph
Ph
Ph
O
O O
10.如何使反-9,10-二氢萘转化为顺-9,10-二氢萘?
圣才电子书
十万种考研考证电子书、题库视频学习平台
第 17 章 周环反应
17.1 复习笔记
一、电环化反应 1.电环化反应 (1)电环化反应的概念 电环化反应是指在加热或光照条件下,共轭多烯烃环合形成环烯烃的反应及其逆反应。 (2)电环化反应的规律性 共轭多烯烃电环化反应有高度的立体选择性,反应与共轭体系的π电子数目有关,主要 分为 4n 型共轭多烯和 4n+2 型共轭多烯。其关系见表 17-1。
子的 HOMO 与另一个反应分子的 LUMO 对称性符合正正重叠或者负负重叠,形成化学键,
chapt17周环反应中科大有机化学

顺旋
CH3 CH3
175℃
顺旋
H
HCH3 (Z,E)-2,4-己二烯
CH3 CH3
结果一样
H CH3
(Z,E)-2,4-己二烯
H
电环合与开环 是逆反应
遵守同一 规则
CH3 175℃
CH3
顺旋
CH3 175℃
顺旋
CH3
H
CCHH33(Z,Z)-2,4-己二烯
H
极少
CH3
H H
(E,E)-2,4-己二烯
原
子
的
CC CC CC NN NC
双
O O, N C, O C, C C, C C
烯
亲
CN
双
CN , CC ,CO,NN ,NO
烯
体
Organic Chem
University of Science and Technology of China
反应实例:
O 180℃ +
CH2
O 66%
+ N C6H5 乙 醇 , 0 ℃
有 机 化 学
第十七章
周环反应
Pericyclic reaction
University of Science and Technology of China
University of Science and Technology of China
一、概述
对溶剂极化不敏感
反应过程中不能证
不能被酸碱催化
从实验事实发现这类反应有以下的特点:
① 反应进行的动力是加热或者光照 ② 有两个以上的键同时断裂或形成
多中心一步完成 ③ 有突出的立体选择性
Organic Chem
有机合成机理1周环反应机理
分子轨道对称守恒原理和前线轨道理论是近代有机化学中的重大
成果之一。为此,轨道对称守恒原理创始人之一R.霍夫曼和前线轨
道理论的创始人福井谦一共同获得了1981年的诺贝尔化学奖。
1.σ-键的形成 当两个原子轨道沿着键轴方向对称重叠时,可形成两个σ-键的分
子轨道。对称性相同的原子轨道形成σ-成键轨道,对称性不同的原 子轨道形成σ*反键轨道。
以丁二烯为例讨论——丁二烯电环化成环丁烯时,要求: 1.C1—C2,C3—C4沿着各自的键轴旋转,使C1和C4的轨道结合形 成一个新的σ-键。 2.旋转的方式有两种,顺旋和对旋。 3.反应是顺旋还是对旋,取决于分子是基态还是激发态时的HOMO 轨道的对称性。 丁二烯在基态(加热)环化时,起反应的前线轨道HOMO是ψ2 所以丁二烯在基态(加热)环化时,顺旋允许,对旋禁阻。
25 ℃ 顺旋
CH3 Ph
CH3
CH3 H H CH3
顺旋 H3C H H
hυ 对旋 CH3
HH CH3 CH3
二、4n+2个π电子体系的电环化
以己三烯为例讨论,处理方式同丁二烯。先看按线性组合的己三烯的六个分子轨道。
ψ6
E6
ψ5
E5
ψ4
E4
E
ψ3
E3
ψ2
E2
ψ1
E1
基态 激发态
从己三烯为例的π轨道可以看出: 4n+2π电子体系的多烯烃在基态(热反应时)ψ3为HOMO,电环化
时对旋是轨道对称性允许的,C1和C6间可形成σ-键,顺旋是轨道对称 性禁阻的,C1和C6间不能形成σ-键。
顺旋(禁阻)
对旋(允许)
ψ3 己三烯的热环合
130 ℃
CH3 H
经典:有机化学-第17章-协同反应
CH3
基态 激发态
相同
15
例:
CH3 H H CH3
hv
CH3
CH3
CH3 H CH3 H
H 3C H H
CH3
H 3C H H
CH3
LUM O
LUMO HOMOLeabharlann H 3C H HCH3
hv 顺旋
H 3C H H
CH3
HOM O
对旋
H 3C H H
CH3
1
H 3C H H
CH3
基态 激发态
外消旋体
H H 3C
8
四 直链共轭多烯的分子轨道的一些特点
1. π分子轨道的数目与参与共轭体系的碳原子数是一致 的。
2. 对镜面(δv)按对称--反对称--对称交替变化。对二 重对称轴(C2)按反对称--对称--反对称交替变化。
3. 结(节)面数由0→1→2…逐渐增多。 4 轨道数目n为偶数时,n /2为成键轨道,n /2为反键
第十七章 周环反应 (协同反应)
1
第一节 周环反应和分子轨道对称守恒原理 一 周环反应概况简介 二 分子轨道对称守恒原理简介 三 前线轨道理论的概念和中心思想 四 直链共轭多烯π分子轨道的一些特点
2
一 周环反应概况简介
1. 定义
周环反应 在化学反应过程中,能形成环状过渡态的协同反应。
协同反应 协同反应是指在反应过程中有两个或两个以上的化学 键破裂和形成时,它们都相互协调地在同一步骤中完成。
4n+2电子体系?
HH
18
第三节 环加成反应
一 环加成反应的定义、分类和表示方法 二 环加成反应的选择规则 三 前线轨道理论对环加成反应选择规则的
有机化学 第十七章 胺
邻苯二甲酰亚胺氮上的氢受到两个拉电子基团
影响呈现酸性(pKa8. 3),用K0H处理很容易生成相 应的钾盐。
该法除合成伯胺外,还用于合成α-氨基酸(参
阅第二十一章)。
三、硝基化合物还原 通过硝基化合物还原制备胺类是极为重要的方
法,因芳香硝基化合物很容易由芳烃硝化得到,因 此该法主要用于合成芳香伯胺。还原主要有催化氢 化和化学还原两种方式。
二、盖布瑞尔(Gabriel)合成 由卤代烃直接氨解制备伯胺时常会有仲、叔胺
生成,盖布瑞尔[S. Gabriel(1851—1924)出生于 德国,在Berlin大学获博士学位,而后在该校任化 学教授,主要在胺及氨基酸合成方面作出了贡献。] 提供了一个由卤代烃制备纯伯胺的好方法。邻苯二 甲酰亚胺的钾盐与卤代烃发生亲核取代反应,生成 N-取代亚胺后水解或肼解可获得高产率伯胺。
ቤተ መጻሕፍቲ ባይዱ
工业上由油脂水解得到高级脂肪酸(14.4节), 把该酸转化为酰胺,进而脱水生成腈,催化氢化可 得到长链伯胺(参看15. 3节)
2.酰胺还原
酰胺在醚中用LiAlH4处理可把羰基还原为亚甲 基获得较高产率的胺。氮上无取代基的酰胺可得到
伯胺,N-取代酰胺可得到仲、叔胺。
3.肟的还原 醛、酮与羟氨反应生成肟,肟是不饱和含氮化
17.4 胺的化学反应 由于胺中氮上具有孤对电子,使得它能在化学反
应中提供电子,体现了胺的一系列化学性质,如碱性、 亲核反应及氨基致活芳环上的亲电取代反应等。 一、碱性与成盐
1.碱性 按路易斯(Lewis)酸碱概念讲,反应中接受质子 或提供电子对的化合物为碱。由于胺中孤对电子的存 在,能从水中接受质子,故呈碱性。
七、曼尼希(Mannich)反应 具有α氢的酮与甲醛(或其他简单脂肪醛)及
第十七章 周环反应
第十七章周环反应第一节周环反应的理论一周环反应1.定义:在最近的五十年里,有机化学家研究有机化学机理,主要有两种。
一种是游离基型反应,一种是离子型反应,它们都生成稳定或不稳定的中间体。
离子型或游离基型反应:反应物→中间体→产物另一种机理是,在反应中不形成离子或游离基的中间体,而认为是有电子重新组织经过四或六中心环的过渡态而进行的。
这类反应不受溶剂极性的影响,不被碱或酸所催化,没有发现任何引发剂对反应有什么关系。
这类反应似乎表明化学键的断裂和生成是同时发生的。
这种一步完成的多种心反应叫周环反应。
周环反应:反应物→产物2.周环反应的特征:①反应进行的动力,是加热或光照。
②反应进行时,有两个以上的键同时断裂或形成,是多中心一步反应。
③反应时作用物的变化有突出的立体选择性。
④在反应过渡态中原子排列是高度有序的。
二. 分子轨道理论几个原子轨道线性组合,形成几个分子轨道,比原子轨道能量低的为成键轨道,比原子轨道能量高的为反键轨道。
其电子填充符合Pauli原理和Hund规则。
σ轨道:Л轨道:丁二烯的分子轨道:镜面节面直链共轭多烯烃分子轨道特点:①节面数:若共轭多烯烃有几个原子,它的n个轨道就有n-1个节面。
②轨道的节面越多,能量越高。
③高一能级的轨道和低一能级的轨道的对称性是相反的。
④图中的共轭多烯烃的对称性都是指类顺型(像顺型)的。
三.前线轨道.福井认为最高的已占分子轨道(HOMO)上的电子被束缚得最松弛,最容易激发到能量最低的空轨道(LUMO)中去。
这些轨道是处于前线轨道(FMO),前线轨道理论认为:化学键的形成主要是由FMO的相互作用决定的。
分子的HOMO与LUMO 能量接近,容易组成新轨道。
第二节电环化反应1.定义:在n个Л电子的线型共轭体系中,在其两端点之间生成一个单键的反应及其逆过程称为电环化反应。
电环化反应中,多烯烃的一个Л键变成环烯烃里的一个σ键。
如:(Z,E)2,4-己二烯根据微观可逆性原则,正反应和逆反应所经过的途径是相同的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Diels-Alder反应
W +
W
W
例:
+
O
O O
H H O O O + H H
O O O
顺式加成
endo(内型) 动力学控制产物
exo(外型) 热力学控制产物
[3, 3]s迁移(Claisen重排、Cope重排)
X H X
X
X=O or CH2
例:
H CH3 H CH3 225oC
Z型 CH3 E 型 CH3 CH3 H CH3 H 椅式构象过渡态 H
The Nobel Prize in Chemistry 1981
"for their theories, developed independently, concerning the course of chemical reactions"
Kenichi Fukui
Japan Kyoto University Kyoto, Japan (1918 – 1998)
CH3 hv
对旋 a
3 H H 1 CH3
H
a b
H hv CH3 CH3 2 H
1与2为 对映体
CH3 H
cis, trans
对旋 b
trans-二取代
trans-二取代
CH3 H CH3 H 3
cis-二取代
CH3 hv H H CH3
a
b hv
H
对旋 a
对旋 b
4
CH3 H CH3
3与4 相同
Roald Hoffmann USA Cornell University Ithaca, NY, USA 1937 -
在能量相关图中,若产物的成键轨道都只和反应物的 成键轨道相关联,则反应活化能低,易于反应,称作对称 允许,加热即可实现;若有成键轨道和反键轨道相关联, 则反应活化能高,难于反应,称作对称禁阻,需要光照将 电子激发到激发态。所以分子轨道的对称性控制基元反应 进行的条件和方式。 对C2轴对称,采用顺旋方式;对镜面σ对称,采用对 旋方式。 含有4m个π电子体系,如丁二烯电环合或环丁烯开环, 加热条件下进行的是顺旋反应,光照条件下进行对旋反应; 含有4m+2个π电子体系,加热条件下进行的是对旋反应, 光照条件下进行的是顺旋反应。产物分子的构型可根据分 子轨道对称性和反应条件选择。
CH3 H CH3 H
Cope重排
H CH3 H CH3
H
二.电环化反应 (Electrocyclic reaction)
hv or
4n p电子
环状过渡态
hv or
4n+2 p电子
• 反应可逆 • 协同机理,经环状过渡态 • 反应前后双键位置的变化
1. 电环化反应的立体化学 —— 立体专一性反应
Robert Burns Woodward (1917-79) and Roald Hoffmann
前线轨道理论:一个共轭多烯在发生电 环化反应时,起决定作用的分子轨道是 HOMO(Highest Occupied Molecular
R. B. Woodward Nobel Prize Winner (1965)
The Nobel Prize in Chemistry 1965
"for their theories, developed independently, concerning the course of chemical reactions"
伍德沃德美国化学家。1917年4月10日生于 马萨诸塞州波士。在1936年,当他的同班同 学以学士学位毕业时,二十岁的他获得了哲 学博士学位。然后他立即进入哈佛大学从事 博士后研究工作,他以极其情巧的技术,合 成了胆固醇、皮质酮、马钱子碱、利血平、 叶绿素等多种复杂有机化合物。据不完全统 计,他合成的各种极难合成的复杂有机化合 物达24种以上,所以他被称为“现代有机合 成之父”。
- ψ2
+ -
-
+
+
+ ψ1 -
A S S A
S
A
+ + - -
S
S
ψ4 ,S ψ3 ,A
C2 A,s* S ,π*
ψ4 ,A ψ3 ,S
sV
A , s* A,π*
ψ2,S ↑↓
ψ1,A ↑↓
↑↓ A,π
↑↓ S, s
ψ2, A ↑↓
ψ1 ,S ↑↓
↑↓ S,π
↑↓ S,s
(a)
(b)
丁二烯-环丁烯顺旋(a)和对旋(b)相互转化时的 轨道能级相关图
例:
CH3 H H CH3 hv CH3 CH3
6 H3C HH CH3
5 H3 C HH CH3
LUMO
外消旋体
hv
4 H3 C HH CH3 LUMO HOMO
H H3C CH3 H
+
CH3 H H CH3
顺旋
3 H 3C HH CH3
H
HOMO
H
+
对旋
CH3 CH3
CH3 CH3 H H
CH3 H CH3 H
2 H3 C HH CH3
相同
1 H 3C HH CH3
基态 激发态
电环化反应举例
1.
H H
4n p电子体系
hv
H H
2.
trans
4n p电子体系 4n+2p电子体系?
思考题: 如何用电环化反应完成下列转变?
H H
H
方法 1
H
H
H
H
方法 2:
H cis H
美国化学家,1937年7月18日出生于波兰兹洛乔夫。 1955年进入哥伦比亚大学成为一名医科大学预科生。 1957年获学士学位,先后在华盛顿国家标准局、布 鲁克黑文国家实验室工作。同时在哈佛大学师从古 特曼学习理论化学。1959年参加瑞典乌普萨拉大学 量子化学项目的工作,后又参加美苏交流项目在莫 斯科大学和戴维达夫一起研究激子理论。1960年回 哈佛大学学习,1962年获博士学位。1962年~1965年 任该大学低级研究员。1965年任康奈尔大学化学副 教授,1968年升为教授。1974年成为钮曼物理学教 授。
4n p电子体系(共轭二烯型)
CH3
cis, trans
H CH3 H hv CH3
CH3 H CH3 H hv CH3
cis-二取代 内消旋体
trans-二取代 外消旋体
H H CH3
H H CH3
trans, trans
(4n+2)p电子体系(共轭三烯型)
CH3
trans, cis, trans cis
CH3
cis-二取代 H CH3 内消旋体 H
CH3 hv CH3
hv CH3 CH3 trans, cis, cis
cis
trans-二取代 外消旋体
H H CH3
2. 反应立体选择性的判断方法(顺旋和对旋规律)
4n p电子体系——加热(规律: 顺旋 conrotatiory)
H CH3 H CH3 1 CH3 a b CH3 H CH3 H 2
CH3 H CH3 H
4
H
CH3 H
CH3
LUMO
外消旋体 hv H H3 C H3C H CH3 + H CH3 + 顺旋 H H3C 相同 CH3 H H CH3 H H3C H
3
H
CH3 H
CH3 LUMO HOMO 对旋
2
H CH3 H CH3 HOMO
1
H
CH3 H
CH3
基态 激发态
H H
?
前线轨道理论 五十年代,福井谦一在研究芳香烃的亲电取代反应 时指出,这些分子的最高占据分子轨道(HOMO)上, 电荷密度最大位置最易发生反应;而亲核芳香取代反 应中最低未占据分子轨道(LUMO),假想电荷集居数 最大处反应活性最大。六十年代他又进一步提出 HOMO与LUMO相互作用时,不仅是电荷的分布, 而且是这些轨道的对称性决定反应的选择性,只有轨 道对称性匹配时,反应才能进行。
R. B. Woodward
Nobel Prize Winner (1965)
The Nobel Prize in Chemistry 1981
"for their theories, developed independently, concerning the course of chemical reactions"
trans, trans
cis-二取代
(4n+2)p电子体系——加热(规律: 对旋)
H CH3 H CH3
cis-二取代
对旋 a
CH3 a b CH3
对旋 b
CH3 H CH3 H
cis-二取代
trans, cis, trans
CH3 H H CH3
trans-二取代
对旋 a
CH3 ab CH3
第十七章 周环反应
主要内容:电环化反应、环加成反应、α迁移反应、
前线轨道理论、分子轨道对称守恒原理
周环反应的定义
周环反应:一些经过环状过渡态的协同反应 特点:1. 反应机理中不涉及离子或自由基中间体。 2. 反应一般在光照或加热下进行。 3. 反应一般有较好的立体选择性。
一.复习:已学过的周环反应:
顺旋 丁二烯 Δ 环丁烯 丁二烯
