人教版初中化学九年级上册溶液的浓度导学案
初三九年级化学第九单元溶液的浓度导学案

实验活动5一定溶质质量分数的氯化钠溶液的配制【学习目标】1.理解溶液组成的含义。
2.掌握一种溶液的配制方法和步骤。
3.初步学会根据需要配制一定溶质质量分数的溶液。
【学习重点】配制溶液的操作步骤与注意事项。
【学习难点】实验误差的分析。
情景导入生成问题1.展示:农业生产中,用16%的食盐水选种;医用生理盐水的浓度为0.9%。
那么,同学们这些溶液是怎么配制出来的?2.出示学习目标,由学生对学习目标进行解读。
自学互研生成能力知识模块一复习溶质质量分数概念1.思考:溶质质量分数是定量表示溶液的一种方法。
2.溶质质量分数。
溶液中的溶质质量分数是质量与质量之比。
表达式:溶质的质量分数=溶质质量溶液质量×100%知识模块二明确实验步骤和操作方法视频学习,了解实验操作步骤和操作要领。
知识点1 固体与水配制溶液【活动与探究1】用氯化钠和水配制50g质量分数为16%的氯化钠溶液,归纳出实验步骤及注意事项。
步骤:①计算;②;③;④;⑤装瓶贴标签。
仪器:、、量筒、、烧杯、。
【提出问题】请同学们思考讨论分析:哪些因素造成配制溶液的质量分数偏低或偏高?【讨论解答】①溶质的质量分数:称取固体溶质质量偏大或量取浓溶液时仰视读数。
②溶质的质量分数:用量筒量取水时,读数时俯视液面;水量好后,向烧杯中倾倒时有液体洒落。
③溶质的质量分数:称量固体溶质的质量偏小;所用固体溶质不纯、不干燥或已潮解;④溶质的质量分数:称量时“左码右物”并使用了游码;量取浓溶液时俯视读数。
⑤溶质的质量分数:量取水时仰视读数;烧杯内有残留的水。
⑥溶质的质量分数:装瓶时将溶液洒落。
知识点2 溶液与水配制溶液【活动与探究2】用20%氯化钠溶液和水配制50g质量分数为16%的氯化钠溶液,归纳出实验步骤及注意事项。
步骤:①计算、②、③④装瓶贴标签。
仪器:、、、。
【课堂小结】本节课的收获。
2.问题交流,突出重点、突破难点⑴以上两种配制过程中,配制步骤和所用的仪器有什么不同?⑵用托盘天平称量氯化钠时,有哪些注意事项?⑶用量筒量取液体时,应注意什么?交流展示生成新知知识模块一:复习巩固知识模块二:明确实验步骤和操作方法检测反馈达成目标一、【当堂例题】1.如图是配制50g质量分数为5%的氯化钠溶液的相关操作过程示意图:试回答:(1)配制该氯化钠溶液的正确的操作顺序是。
新课标人教版九年级化学——溶液的浓度导学案(第2课时)

需要加入_________g(结果精确到0.1g)的葡萄糖。
二、主题探究及展示:
活动一:一定溶质质量分数的氯化钠溶液的配制
1、配制50g质量分数为6%的氯化钠溶液
【主要仪器】托盘天平、量筒、____________、_____________、药匙、胶头滴管。
2、用上述配好的氯化钠溶液,配制50g3%的氯化钠溶液。
【主要仪器】量筒、____________、_____________、胶头滴管。
【实验步骤】
(1)计算:需6%的氯化钠溶液(密度为1.04g/cm3)__________g,体积为_________mL;需水的质量__________g,体积为_________mL;
2、用量筒最取蒸馏水时
(1)读数时若仰视,会导致所配溶液的溶质质量分数____________(填“偏大”或“偏小”)。
(2)读数时若俯视,会导致所配溶液的溶质质量分数____________(填“偏大”或“偏小”)。
三、随堂导练及展示:
1、某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
①计算:氯化钠的质量为g,水为g。
②称量:用托盘天平称量,氯化钠应放在(填“左盘”或“右盘”)。
溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是(从下列中选用:10mL、25 mL、50 mL、100 mL)。量取液体时,量筒必须放平,视线与液体的_________保持水平。溶解氯化钠要用到玻璃棒,其作用是。
④反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会(填“偏大”、“偏小”或“无影响”)。
2、某化学兴趣小组进行溶液的配制和粗盐的初步提纯实验。
初中化学浓度教案

初中化学浓度教案【教学目标】1. 了解溶液浓度的概念及其表示方法。
2. 掌握溶液浓度的计算方法。
3. 能够运用溶液浓度知识解决实际问题。
【教学重点】1. 溶液浓度的概念及其表示方法。
2. 溶液浓度的计算方法。
【教学难点】1. 溶液浓度计算公式的运用。
2. 解决实际问题能力的培养。
【教学方法】1. 采用实验演示法,让学生直观地了解溶液浓度的概念。
2. 采用讲授法,讲解溶液浓度的表示方法及计算方法。
3. 采用案例分析法,培养学生的实际应用能力。
【教学过程】一、导入(5分钟)1. 教师通过展示日常生活中常见的溶液(如饮料、药水等),引导学生思考:什么是溶液?溶液有哪些特点?2. 学生回答后,教师总结:溶液是由溶剂和溶质组成的均匀混合物,具有均一性和稳定性。
二、新课导入(10分钟)1. 教师介绍溶液浓度的概念:溶液浓度是指单位体积或单位质量的溶液中溶质的含量。
2. 教师讲解溶液浓度的表示方法:质量分数、摩尔浓度、质量浓度等。
3. 学生跟随教师一起总结溶液浓度的计算方法:质量分数=溶质质量/溶液质量×100%,摩尔浓度=溶质的物质的量/溶液的体积,质量浓度=溶质质量/溶液体积。
三、实验演示(15分钟)1. 教师准备实验:准备两个烧杯,分别加入等质量的水和酒精,再分别加入等质量的盐。
2. 学生观察实验现象:盐在水中溶解得更快,而在酒精中溶解得更慢。
3. 教师引导学生思考:为什么会出现这种现象?与溶液的浓度有什么关系?四、案例分析(10分钟)1. 教师给出案例:一瓶饮料的标签上写着“含糖量20%”,问这瓶饮料中糖的质量是多少?2. 学生运用溶液浓度的计算方法,计算出糖的质量。
3. 学生分享计算结果,教师点评并总结。
五、课堂小结(5分钟)1. 教师引导学生回顾本节课所学内容,总结溶液浓度的概念、表示方法和计算方法。
2. 学生分享学习收获,教师点评并鼓励。
六、作业布置(5分钟)1. 教师布置作业:计算一瓶500ml的0.1mol/L的盐酸溶液中HCl的质量。
人教版九年级化学 课题3 溶液的浓度(1)导学案

人教版九年级化学课题3 溶液的浓度(1)导学案一、导入1. 导入问题- 请问你在日常生活中遇到过哪些溶液?你了解这些溶液的浓度是如何计算的吗?2. 导入概念- 溶液的浓度指的是溶质在溶液中的含量。
- 溶液的浓度可以用不同的表示方法来表示,如质量浓度、体积浓度等。
二、知识讲解1. 溶液的质量浓度 - 溶液的质量浓度是指单位体积(单位为mL)溶液中所溶质的质量。
- 质量浓度(C)的计算公式为:C = (溶质质量(g)/ 溶液体积(mL)) × 100%2. 溶液的体积浓度 - 溶液的体积浓度是指单位体积(单位为L)溶液中所溶质的体积。
- 体积浓度(V)的计算公式为:V = (溶质体积(mL)/ 溶液体积(L)) × 100%3. 溶液的摩尔浓度 - 溶液的摩尔浓度是指单位体积(单位为L)溶液中所溶质的物质的量。
- 摩尔浓度(M)的计算公式为:M = 溶质物质的量(mol)/ 溶液体积(L)三、例题解析例题1若有一瓶体积为250 mL 的盐水溶液,其中含有5 g 的NaCl,求此溶液的质量浓度。
解答:质量浓度(C)的计算公式为:C = (溶质质量(g)/ 溶液体积(mL)) × 100%根据题目,溶质质量为5 g,溶液体积为250 mL,代入公式进行计算: C = (5 g / 250 mL) × 100% = 2%所以,此溶液的质量浓度为2%。
例题2已知一瓶体积为500 mL 的氨水溶液中含有30 mL 的氨气(NH3),求此溶液的体积浓度。
解答:体积浓度(V)的计算公式为:V = (溶质体积(mL)/ 溶液体积(L)) × 100%根据题目,溶质体积为30 mL,溶液体积为500 mL,将溶液体积单位转换为升:溶液体积 = 500 mL = 0.5 L代入公式进行计算:V = (30 mL / 0.5 L) × 100% = 60%所以,此溶液的体积浓度为60%。
溶液的浓度教学设计

人教版九年级化学第九单元课题三溶液的浓度第一课时导学案教学目标【知识与技能】1、学生通过动手实验、观察现象以及思考问题得出一种表示溶液浓度的方法一一溶质的质量分数。
2、能进行溶质质量分数的简单计算。
【过程与方法】1、会分析问题、解决问题,提高解题能力。
2、能找准各量的关系。
【情感态度与价值观】1、学会严谨求实的科学学习方法。
2、培养具体问题具体分析的能力。
教学重点和难点:重点:(1)溶质的质量分数的概念及意义(2)溶质的质量分数的简单计算。
难点:溶质的质量分数的简单计算。
教与学方法:自主学习法,讨论法,练习法,对比分析法,实验探究的教学方法。
教学流程框图:教学过程环节溶质质量分数有关的标签。
【情景1】方法可以判断那杯白糖水溶解 的白糖多?”糖、纯净水配制一杯白糖水,倒 成两杯,一杯留着,另一杯与其 他小组交换,分别尝一尝,感觉 哪杯甜。
并且让学生表达他的感 同学发言,通过口感上的体定的认识。
教学教师活动 学生活动 设计意图1、了解无土栽培的相关知识,1、利用课余时间收集生活 充分利用课余时 课 前 准备收集相关的无土栽培营养液配 方。
2、利用课余时间收集生活中与 中见到的营养成分表标签, 与同学们交流思考这些标 签上数据的含义。
间,让同学们意识 到我们所学的内容 都与生活息息相 关,并且为本节课 的学习做好铺垫。
[引入]展示两杯白糖水。
问:“这是两杯白糖水,有什么答:喝一口,哪杯甜,它溶 解的白糖就多。
从生活中学生熟悉 的事物入手,使质 量分数这一抽象的 概念具体化。
[学生实验]每组用自带的白 将同学们分为若干小组觉。
[教师提问]你觉得自己的糖水 验,大家很容易对糖水的浓 甜,还是别人的甜?为什么会这度与溶剂溶质的关系有一 样?【情景2】[展示]两只试管乘有不同颜色的硫酸铜溶液。
冋:这是两杯硫酸铜溶液,它们是不能喝的,因为喝下去对人体有害。
那么,有什么方法判断哪只硫酸铜溶液浓呢?问:颜色深的就一定浓吗?下面我们来做个实验看看。
九年级化学《溶液的浓度》导学案
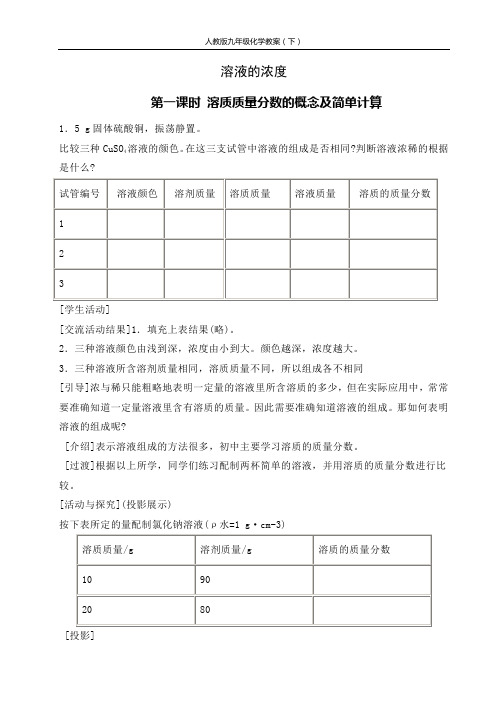
溶液的浓度第一课时溶质质量分数的概念及简单计算1.5 g固体硫酸铜,振荡静置。
溶液的颜色。
在这三支试管中溶液的组成是否相同?判断溶液浓稀的根据比较三种CuSO4是什么?[学生活动][交流活动结果]1.填充上表结果(略)。
2.三种溶液颜色由浅到深,浓度由小到大。
颜色越深,浓度越大。
3.三种溶液所含溶剂质量相同,溶质质量不同,所以组成各不相同[引导]浓与稀只能粗略地表明一定量的溶液里所含溶质的多少,但在实际应用中,常常要准确知道一定量溶液里含有溶质的质量。
因此需要准确知道溶液的组成。
那如何表明溶液的组成呢?[介绍]表示溶液组成的方法很多,初中主要学习溶质的质量分数。
[过渡]根据以上所学,同学们练习配制两杯简单的溶液,并用溶质的质量分数进行比较。
[活动与探究](投影展示)按下表所定的量配制氯化钠溶液(ρ水=1 g·cm-3)[投影]例1.在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。
现要配制150 kg 的这种溶液,需要氯化钠和水的质量各是多少?[讨论]1.溶质质量与溶质质量分数、溶液质量的关系。
2.溶液质量、溶质质量、溶剂质量的关系。
[小结板书]1. 溶质质量=溶液质量×溶质质量分数2.溶液质量=溶质质量+溶剂质量[学生活动](一名学生板演例题解析过程,其他学生提出异议。
教师最后强调做题格式) [小结板书]2.已知溶液质量和溶质的质量分数,求溶质和溶剂的质量。
[引入]溶质的质量分数在实际生活中应用广泛,而在实际生产中又往往需要把现有的溶液中溶质的质量分数增大或减小呢。
[讨论]在温度不变的条件下,如何使原有溶液的溶质质量分数增大或减小?[讨论回答]1.增加溶质的质量,可使溶质的质量分数增大。
2.增加溶剂质量,可使溶质的质量分数减小。
[投影]用A、B两个烧杯各取90克溶质的质量分数为10%的硝酸钾溶液,再向A烧杯中加入10 g硝酸钾,向B烧杯中加入10 g水,并用玻璃棒搅拌至全部溶解。
《溶液的浓度》说课稿

《溶液的浓度》说课稿尊敬的各位评委、老师:大家好!今天我说课的内容是《溶液的浓度》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程、板书设计这几个方面来展开我的说课。
一、教材分析《溶液的浓度》是人教版九年级化学下册第九单元课题 3 的内容。
溶液在生产生活和科学研究中具有广泛的应用,而溶液的浓度是定量表示溶液组成的一种方法,是初中化学的重要知识点之一。
通过本课题的学习,学生能够进一步加深对溶液的理解,掌握溶质质量分数的计算方法,并为后续学习酸碱盐的相关知识打下基础。
二、学情分析学生在之前的学习中已经对溶液的组成有了一定的认识,了解了溶液的形成过程和溶解现象。
但对于如何定量表示溶液的浓度,学生还缺乏系统的学习和理解。
此外,九年级的学生已经具备了一定的观察、分析和解决问题的能力,但抽象思维能力和逻辑推理能力还有待进一步提高。
因此,在教学过程中,要注重引导学生通过实验探究和分析思考来掌握知识。
三、教学目标基于对教材和学情的分析,我制定了以下教学目标:1、知识与技能目标(1)理解溶液浓度的概念,掌握溶质质量分数的表达式。
(2)能够进行溶质质量分数的简单计算。
(3)学会配制一定溶质质量分数的溶液。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力和实验操作能力。
(2)通过对溶质质量分数的计算,提高学生的分析问题和解决问题的能力。
3、情感态度与价值观目标(1)让学生体会化学知识与生活实际的紧密联系,激发学生学习化学的兴趣。
(2)培养学生严谨的科学态度和实事求是的精神。
四、教学重难点1、教学重点(1)溶质质量分数的概念及计算。
(2)配制一定溶质质量分数的溶液的步骤和操作。
2、教学难点(1)理解溶质质量分数的概念。
(2)有关溶质质量分数的计算中溶液质量的计算。
五、教法与学法1、教法为了突出重点、突破难点,我主要采用了以下教学方法:(1)实验探究法:通过实验让学生直观地感受溶液浓度的变化,从而引出溶质质量分数的概念。
初中化学浓度教案

初中化学浓度教案
教学内容:浓度
教学目标:
1. 理解什么是浓度,并能够用化学式表示出来。
2. 掌握计算溶液浓度的方法。
3. 能够应用浓度的概念解决实际问题。
教学重点:
1. 浓度的概念和计算方法。
2. 浓度在化学实验中的应用。
教学难点:
1. 理解浓度的概念。
2. 熟练运用浓度的计算方法。
教学准备:
1. PPT课件
2. 实验器材:量筒、烧杯、玻璃棒等
教学过程:
一、导入(5分钟)
通过一个日常生活中加水的例子引出浓度的概念,并与学生一起探讨什么是浓度。
二、讲解浓度概念(10分钟)
1. 定义:浓度是指单位体积或单位质量内所含溶质的量。
2. 讲解浓度计算的方法,包括质量百分浓度、体积百分浓度和摩尔浓度。
3. 举例说明浓度的计算方法。
三、实验演示(15分钟)
老师进行实验演示,让学生观察实验过程和结果,理解浓度的计算方法,并解释实验现象。
四、练习与讨论(15分钟)
1. 学生进行浓度计算练习,并互相讨论验证答案。
2. 学生提问解答浓度相关问题,加深对浓度概念的了解。
五、实际应用(10分钟)
讨论实际生活中浓度的应用场景,并进行相关例题讲解。
六、课堂小结(5分钟)
回顾本节课的重点内容,巩固学生对浓度概念的理解,对下节课的内容进行铺垫。
教学反思:
通过本节课的教学,学生对浓度的概念有了初步的了解,并学会了浓度的计算方法。
在教学中要注重培养学生的实际应用能力,提高学生的解决问题的能力,让学生在日常生活中能够灵活运用所学知识。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
课题3 溶液的浓度
学习目标
1.理解溶液组成的含义。
2.掌握一种溶液组成的表示方法——溶质质量分数能进行溶质质量分数的简单计算。
3. 初步学会根据需要配制一定溶质质量分数的溶液。
重点、难点
重点:了解溶质质量分数概念;
难点:有关溶质质量分数的计算。
情境导入——鸡蛋在水中的沉浮
取一个烧杯,加入250 mL水后放入一只鸡蛋。
按
下面的步骤进行实验并如实填写下表。
分析,在此过
程中所得的几种溶液的组成是否相同,判断的依据是
什么?
次序清水量加入的食盐量鸡蛋小结
1 250 g 不放食盐沉?浮?
2 250 g 1匙(约5克)沉?浮?
3 250 g 2匙(约10克)沉?浮?
4 250 g 3匙(约15克)沉?浮?
…………
学习研讨
一、溶质的质量分数
【自主学习】
【活动与探究一】
【实验9-7】在三个小烧杯中各加入20 mL水,然后分别加入约0.1 g、0.5 g、2 g无水硫酸铜。
比较三种硫酸铜溶液的颜色。
分析,在这三支试管中溶液的组成是否相同,判断的依据是什么?
填写下表
【交流讨论】如何区分溶液的浓稀?
【归纳小结】即溶质的质量分数。
【自主学习】阅读课本P43,知道表示溶液组成的方法——溶质质量分数。
溶液中的溶质质量分数是_________________________________________。
表达式:
【交流讨论】
1、实验9-7中,三种溶液的溶质质量分数分别是多少?
2、表达式的几种变形
【巩固练习】课后习题1
【交流讨论】
【活动与探究二】:【实验9-8】
3【设问】已知溶质和溶剂的量,这样的溶液,我们会配制了。
那如果告诉你一定量的一定质量分数的溶液,你会配制吗?
【交流讨论】欲配制50g 质量分数为6%的氯化钠溶液该如何操作?请你试一试。
【活动与探究三】:P47【实验活动5】 【小结】
1.配制溶液的步骤: 、 、 、 、 。
2.实验仪器:所需仪器:
溶解: ; 。
3.注意事项: 学情分析
1、判断题(正确打“√”,不正确打“×”)
(1)在100 g 水里加入20 g 氯化钠,溶液中氯化钠的质量分数为20%( ) (2)“10%的食盐溶液”表示100 g 水中溶解了10 g 食盐( )
(3) 10 g 硝酸钾完全溶解于90 kg 水中,得到10%的硝酸钾溶液( )
(4) 40 g 20%的NaCl 溶液等分成四份,则每一份溶液中氯化钠的质量分数为5%( ) 2.在用固体氯化钠配制一定量一定溶质质量分数的氯化钠溶液的实验中,必须用到的一组仪器是( )
A . 托盘天平、药匙、烧杯、玻璃棒、酒精灯
B . 量筒、烧杯、玻璃棒、药匙、酒精灯
C . 量筒、托盘天平、玻璃棒、药匙、烧杯
D .
烧杯、药匙、漏斗、玻璃棒
3.60℃时,硝酸钾的溶解度为110 g ,该温度下硝酸钾饱和溶液中有关质量关系正确的是
()
A.溶质质量∶溶剂质量=1∶10
B.溶剂质量∶溶液质量=20∶21
C.溶质质量∶溶剂质量=11∶10
D.溶液质量∶溶质质量=21∶10
拓展提升
【必做题】
1.实验室欲配制50 g质量分数为5%的NaCl溶液。
试回答下列下列问题。
(1)该实验的主要操作步骤是、、、。
(2)分别说明图中A、B操作对实验结果的影响,并改正。
A操作导致所配溶液溶质的质量分数,(填偏大、偏小或不变,下同)
改正,若其他操作都正确,A操作导致最后的溶质质量分数为%;B操作导致所配溶液溶质的质量分数,改正。
【选做题】
2.“烟台苹果”享誉全国,波尔多液是烟台果农常用的一种果树杀菌农药。
一果农管理了5亩果园,准备为果树喷洒一次波尔多液。
他现有8%的硫酸铜溶液300 kg、蓝矾(CuSO4·H2O)10 kg、每亩地需要用150 kg1%的硫酸铜溶液来配制波尔多液。
请你计算一下他现有的硫酸铜药品是否能满足需要?(已知:蓝矾中CuSO4的质量分数为64%)
课堂小结
课题3 溶液的浓度(第二课时)
学习目标
1.掌握溶质质量分数。
2. 能进行溶质质量分数的计算。
重点、难点
有关溶质质量分数的计算。
情境导入
写出溶质质量分数的公式及其变形:
那么你能用公式或公式变形来解决问题吗?
学习研讨
二、溶质质量分数的计算
1. 已知溶质和溶剂的量,求溶质的质量分数;或要配制一定量的溶质的质量分数一定的溶液,计算所需溶质和溶剂的量
【例题】:配制500mL质量分数为10%的氢氧化钠溶液(密度为1.1g/cm3),需要氢氧化钠和水各多少克?
【讨论】该如何来解决这个问题呢?
解:
2.溶液稀释和配制问题的计算。
【例题2】:把50g质量分数为98%的浓硫酸稀释成质量分数为20%的硫酸溶液,需要多少克水?
【讨论】解这道题的关键是什么?
【分析】抓住关键:。
解:
【拓展】如果把50g换成50mL那么还需什么条件才能解题?
【巩固练习】课后习题3、4题。
3. 把溶质的质量分数运用于化学方程式的计算。
【例题3】:100g某硫酸溶液恰好与13g锌完全反应。
试计算这种硫酸溶液中溶质的质量分数。
【分析】这种与化学方程式结合起来的题目怎样来寻找溶质溶剂溶液的量呢?
解:
【巩固练习】课后习题第6题。
学情分析
1.浓溶液在用水稀释的过程中保持不变的是()
A.溶液质量
B.溶液体积
C.溶质质量
D.溶质的质量分数
2.有40 g 5%的CaCl2溶液,若将其溶质质量分数增加到10%,应采用的方法是()A.加入40 g 15%的CaCl2溶液B.把溶液倾倒一半
C.加入2 g CaCl2固体D.把溶剂蒸发掉20 g
3.配制一定溶质质量分数的氯化钠溶液的一些操作步骤见下图,正确的操作顺序是()
A.④⑤①②③
B.①②③④⑤
C.③④①②⑤
D.②①④③⑤
4.预防“非典”(SARS),家庭、学校经常使用过氧乙酸(CH3COOOH)作消毒剂,它是一种具有腐蚀性、强烈刺激性气味的无色液体,易分解产生氧气,有杀菌、漂白作用。
它的相对分子质量是。
市售过氧乙酸溶液的质量分数为20%,若要配制0.1%的该消毒液2 000 g,需20%的过氧乙酸溶液质量为。
5.20 ℃时将60 g NaCl放入150 g水中,充分搅拌,求所得溶液中溶质的质量分数(20 ℃时NaCl的溶解度为36 g)。
拓展提升
【必做题】
1.配制500 g 20%的硫酸,需密度为1.84 g/cm3 98%的浓硫酸多少毫升?同时需水的质量为多少?
【选做题】
2.溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作。
下表为硫酸溶液和氨水的密度与其溶质的质量分数对照表(20 ℃)
请仔细分析回答下列问题:
(1)20 ℃时,随着溶液中溶质的质量分数逐渐增大,硫酸溶液的密度逐渐(填增大、减或不变);氨水的密度逐渐(填增大、减或不变)。
(2)取12%的硫酸溶液100 g配制成6%的溶液,向100 g12%的硫酸溶液中加水的质量应100 g(填大于、小于或等于)。
(3)向100 g24%的氨水中加入100 g水,摇匀,溶液体积是 mL(保留到0.1)。
课堂小结。
