配位化合物
第五章配位化合物

[Ag(S2O3)2]3-, [Fe(CN)6]4-, [Fe(SCN)6]3-, [HgI4]2- , [Fe(CN)6]3-等 或原子)和一定数目 配位单元:由中心离子(或原子 配位单元:由中心离子 或原子 和一定数目 的中性分子或阴离子以配位键结 合而成的中性分子或复杂离子。 合而成的中性分子或复杂离子。 [Ni(CO)4], [Co(NH3)3F3], [Pt(NH3)2Cl2], K3[Fe(SCN)6], [Ag(NH3)2]NO3。 配合物: 含配位单元的化合物。 配合物 含配位单元的化合物。
6
{
多齿配体数≠( ) 多齿配体数 (<) 配位数 中心离子的配位数一般等于其电荷数的二倍 如:M+——2、M2+——4、M3+——6 、 、 ④.配离子的电荷数 a. 配离子的电荷数等于中心原子的氧化数 和配体总电荷数的代数和。 和配体总电荷数的代数和。 b. 外层电荷数的相反数。 外层电荷数的相反数。 K3[Fe(SCN)6] [Ag(NH3)2]NO3 中心离子的电荷数: 中心离子的电荷数 +3(Ⅲ) +1(Ⅰ) [Pt(NH3)2NO2NH2 Cl2] +4(Ⅳ) Ⅳ
13
[Co(NH3)5(ONO)]Cl2 氯化亚硝酸根•五氨合钴 Ⅲ) 氯化亚硝酸根 五氨合钴(Ⅲ 五氨合钴 六氯合铂( 六氯合铂(Ⅳ)酸 H2[PtCl6] Na3[Ag(S2O3)2] [Cu(NH3)4](OH)2 K3[Fe(SCN)6] 二硫代硫酸根合银(Ⅰ 酸钠 二硫代硫酸根合银 Ⅰ)酸钠 氢氧化四氨合铜(Ⅱ 氢氧化四氨合铜 Ⅱ) 六硫氰合铁(Ⅲ 酸钾 六硫氰合铁 Ⅲ)酸钾
12
首页 上页 下页 返回
[Ag(S2O3)2]3[Cr(NH3)5(H2O)]3+ [Cu(NH3)4]2+ [Fe(NH3)2(en)2]3+ [Co(NH3)5(ONO)]2+ [Cr(NH3)3Cl3]
_配位化合物

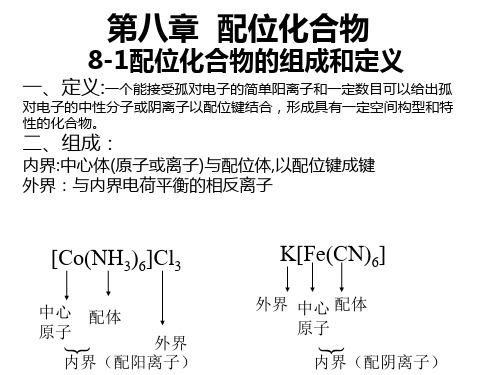
配合物 内界 外界 +
[Ag(NH3)2]
中 心 离 子 配 位 原 子 配 位 体 配 位 体 数
Cl
外 界 离 子
-
配 离 子 电
荷
配位原子
[Fe(CO)5]
中心 配 配 原子 体 位 (形成体) 数
1. 含有配离子的配合物
[Cu(NH3)4]SO4
中 心 离 子 配 体 配 位 数
K2[HgI4]
②外界离子具有简单离子的性质。
③有的配位单元是电中性的,如:[Ni(CO)4]、[Fe(CO)5]。
• 2. 形成体 • 位于配位单元中心的原子或离子 。
• 3.配位体、配位原子 • 与形成体通过配位键结合的分子或离子 称为配位体 。其中直接 提供孤电子对的 原子称配位原子。
• 4.配位数(coordination number) • 配位数—— 与形成体形成配位键的配位 原子数
3) 在电镀工艺中,需要控制金属离子的浓度,往往
用配离子溶液作电镀液,以降低电镀液中自由金 属离子的浓度,使之在镀件上缓慢析出,这样可 得到晶粒细小、光滑均匀的镀层。如:镀锌。 4) 照相术中的定影,利用定影剂硫代硫酸钠Na2S2O3 (俗名海波),与照相底片上未分解的溴化银AgBr作 用转变成可溶性配离子[Ag(S2O3)2]3-,从而实现底 片上的定影。然后在其中加入硫化物,得到黑色的 Ag2S沉淀,最后采用HNO3氧化法,使之转变为可 溶性的AgNO3而回收。
(1)[配阳离子] + 阴离子: 阴离子 + 酸[配阳离子] 或 阴离子 + 化[配阳离子] [Cu(NH3)4]SO4 硫酸四氨合铜(II) [Ag(NH3)2](OH) 氢氧化二氨合银(I)
配位化合物
8.2 配合物的空间结构和异构现象
1、配合物的空间结构 空间构型
配位数 2 杂化轨道 sp 空间构型 直线型 实例 [Ag(NH3)2]+
3
4
sp2
sp3
平面三角形
平面正方形
[HgI3][Ni(CN)4]-、[PdCl4]2-
四面体
5 dsp3或d3sp d2sp2 6 d2sp3或sp3d2 三角双锥 正方锥形 正八面体
配位数(不一定是配体数)
与中心原子直接以配位键结合的配位原子的数目 称为中心原子的配位数。中心原子的配位数一般可为 2-12,以配位数2,4,6最为常见。 中必原子的配位数与配体的齿数有关,
配体是单齿,那么中心原子的配位数就是配体的数目; 配体是多齿,那么中心原子的配位数则是配体的数目 与其齿数的乘积。 例如: [Co Br(NH3)5] (SO4),
1.62×107=(0.02-x)/4x3
x=6.8×10-4
二、配位解离平衡移动
1. 与弱电解质平衡的竞争
M+ + L+ + OHH+ [ML]
当Ka, Kb越小,配离子越易解离 平衡向生成弱酸、弱碱方向移动 MOH HL
[ Fe(C2O4 )3 ]3
Fe3 3C2O4 2
+ 6H+
→
3. 杂化轨道形式与配合物的空间构型
配 位 数 2 3
空间构型
直线形 平面三角形
杂化轨 道类型 sp sp2
实例
Ag(NH3)2+ , Ag(CN)2– Cu(CN)32 – ,HgI3–
4 4 5
5 6
正四面体 四方形 三角双锥
四方锥 八面体
配位化合物
(2) 形成配位键的必要条件是:配体L至少含有一
对孤对电子对,而中心体M必须有空的价轨道。
(3) 在形成配合物(或配离子)时,中心体所提 供的空轨道(s、p,d、s、p或s、p、d)必须首 先进行杂化,形成能量相同的与配位原子数目 相等的新的杂化轨道。 (4)轨道的杂化类型决定了配离子的空间构型、 配位数和稳定性。
B A B A A 面 式 B B A B B A A
经式(子午式)
[M(AB)3]也有面式和经式的两种异构体:
A B A B B 面 式 A B A A B A B 经 式
[MA3(BC)D](其中BC为不对称二齿配体)也有面式 和经式的区别。在面式的情况下三个A处于一个三角面 的三个顶点, 在经式中, 三个A在一个四方平面的三个顶 点之上。
4 配位异构
在阳离子和阴离子都是配离子的化合物中, 配体的 分布是可以变化的, 这种异构现象叫配位异构。如 [Co(NH3)6][Cr(CN)6]和[Cr(NH3)6][Co(CN)6]
[Cr(NH3)6][Cr(SCN)6]和Cr(SCN)2(NH3)4][Cr(SCN)4(NH3)2]
[PtII(NH3)4][PtⅣCl6]和[PtⅣ(NH3)4Cl2][PtIICl4]
NO2 en Co NO2 en en en NO2 O2N Co NO2 O2N en Co en
反式-[Co(en)2(NO2)2], 无旋光对映体
顺式-[Co(en)2(NO2)2] 有旋光对映体
2 配位化合物的化学键理论
一、价键理论 1.价键理论的基本内容: (1) 配合物的中心体M与配体L之间的结合,一般 是靠配体单方面提供孤对电子对与M共用,形成 配键M ←∶L,这种键的本质是共价性质的,称 为σ配键。
配位化合物

Ni2+可以利用丁二肟在氨溶液中与Ni2+配位生成桃红 色絮状螯合物沉淀物来鉴定。
首页
上一页
下一页
末页
32
利用硫氰根负离子可以与Co2+形成蓝紫色的四硫氰 根 合 钴 ( II ) [Co(SCN)4]2- 来 检 验 Co2+ 的 存 在 。 与 Fe3+形成血红色配合离子可供检验Fe3+的存在。
K4[Fe (CN)6]
六氰合铁(Ⅱ)酸钾
H4[Fe (CN)6]
六氰合铁(Ⅱ)酸
[Co(NH3)5H2O]Cl3
氯化五氨·水合钴(Ⅲ)
首页
上一页
下一页
末页
18
配合物的类型
(1)简单配合物 由单齿配体与中心原子直接配位而成的配位化合 物。
例:[Ag(NH3)2]+ BF4[Fe(H2O)6]Cl3 [CoCl3(NH3)3] 等
28Ni 3d84s2 3d
Ni2+
4s 4p
[Ni(CN)4]2-
dsp2杂化
CN- CN- CN-CN-
首页
上一页
下一页
末页
24
[NiCl4]2-的空间构型为四面体。
28Ni 3d84s2
3d
Ni2+
4s 4p
[NiCl4]2-
3d sp3杂化
4s
4p
Cl- Cl- Cl- Cl-
首页
上一页
下一页
首页
上一页
下一页
末页
38
配合物与配位作用用于医学
什么是配位化合物

什么是配位化合物?配位化合物是指由一个或多个配位体(ligand)与一个中心金属离子(或原子)通过配位键(coordination bond)结合形成的化合物。
在配位化合物中,配位体通过共用电子对与中心金属离子形成配位键,将其固定在配位体的周围形成配位球形结构。
1. 配位体:配位体是能够提供一个或多个电子对给中心金属离子的分子或离子。
配位体通常是具有孤对电子的原子或分子,包括有机分子如胺、醇和酸以及无机分子如氨、水和卤素离子等。
配位体通过配位键与中心金属离子结合,形成稳定的配位化合物。
2. 配位键:配位键是指配位体与中心金属离子之间的共用电子对。
配位键通常是通过配位体中的孤对电子与中心金属离子中的空轨道形成。
这种共用电子对的形成使得配位体与中心金属离子之间形成了较强的化学键。
配位键可以是单个配位体提供一个电子对形成的单配位键,也可以是多个配位体提供多个电子对形成的多配位键。
根据配位键的数量,配位体可以分为单齿配位体、多齿配位体和桥配位体等。
3. 配位球形结构:配位化合物中的配位体通过配位键与中心金属离子结合,形成了一个稳定的配位球形结构。
在这个结构中,中心金属离子被配位体包围,形成一个多面体的结构。
配位球形结构的形状和几何构型取决于配位体的种类和数量,以及中心金属离子的电子构型。
常见的配位球形结构包括八面体、四方体、正方形平面、三角双锥等。
这些不同的结构对于化合物的性质和反应有重要影响。
配位化合物具有许多特点和性质。
首先,配位化合物通常具有良好的溶解性和热稳定性,因为配位键是较强的化学键。
其次,配位化合物的颜色通常取决于中心金属离子的电子结构和配位体的取代情况。
这使得配位化合物在催化、荧光和生物活性等领域具有重要应用。
此外,配位化合物还可以通过改变配位体的种类和数量来调节其性质和功能,如选择性吸附、储能和分子识别等。
配位化合物是化学中的重要概念,对于理解过渡金属化学、配位化学和配位聚合物等领域具有重要意义。
配位化合物

[Cu(NH3)2]Ac + CO + NH3 ===== [Cu(NH3)2]Ac.CO
减压加热
H = -35kJ
Cu2+ + 5CN- = Cu(CN)43- + 0.5(CN)2 K稳 =2×1030 (极为稳定,加入H2S也无沉淀,Ksp=2.5×10-50))
Cu(CN)4 3 - + e == Cu + 4CNE = -1.27V Zn(CN)42- + 2e == Zn + 4CNE = -1.26V 这两个电对的电势值相近,所以镀黄铜(Cu-Zn合金)所 用的电镀液为上述混合物.
[AlCl4][BF4][AgI4]2- 从这些配离子你看出配位数有什么规律? 从这些配离子你看出配位数有什么规律?
二,化学键理论
维尔纳(Werner.A):Nobel Prize提出三点: 维尔纳( 提出三点: 提出三点 1,主价和副价 , 主价指氧化数,副价指配位数. 主价指氧化数,副价指配位数. 2,倾向于既要满足主价,又要满足副价. ,倾向于既要满足主价,又要满足副价. 3,副价指向空间的确定位置. ,副价指向空间的确定位置. 1,价键理论:中心离子和配位原子都是通过杂化了的共价配位键 ,价键理论: 结合的. 结合的. (1)配位键的本质: )配位键的本质: a,σ配位键: 配位键: , 配位键
2,复盐 ,
CsRh(SO4)2.4H2O + BaCl2 无沉淀出现. 无沉淀出现. [Rh(H2O)4(SO4)2]-(二硫酸根四水合铑(III)) 二硫酸根四水合铑( )) 二硫酸根四水合铑 KCl.MgCl2.6H2O不是配合物 不是配合物
3,组成 ,
(1)配位体:是含有孤电子对的分子和离子 )配位体:
配位化合物知识总结

VS
磁性配合物在磁学、磁记录、信息存 储和分子基磁体等领域有广泛的应用 前景。
Part
04
配位化合物的应用
在化学反应中的作用
催化反应
配位化合物可以作为催化剂,通 过与反应物结合,改变反应途径,
降低反应活化能,从而加速化学 反应的进行。
分离和提纯
利用配位化合物的独特性质,如选 择性络合、稳定性差异等,可以实 现化学物质的分离和提纯。
配位化合物的稳定性取决于多个因素 ,包括中心离子的性质、配位体的类 型和数量、以及配位环境等。
稳定性规律
一般来说,中心离子的电荷数越高、 半径越小,配位化合物的稳定性越强 ;配位体的电子给予能力越强、数目 越多,稳定性也越高。
配位化合物的合成方法
有机合成
通过有机合成方法,可以制备出结构复杂、功能多样的配 位化合物。常见的合成方法包括重氮化反应、氧化还原反 应等。
配位化合物的分类
按中心原子分类
根据中心原子的种类,可以将配位化合物分为金属配位化合物和非金属配位化合物。金属配位化合物是指中心原 子为金属元素的配位化合物,如铜、钴、铁等;非金属配位化合物是指中心原子为非金属元素的配位化合物,如 硫、氮、磷等。
按配位数分类
根据配位数的大小,可以将配位化合物分为低配位数(2-4)和高配位数(≥6)的配位化合物。低配位数配位化 合物是指中心原子周围参与配位的配位体数目较少的配位化合物;高配位数配位化合物是指中心原子周围参与配 位的配位体数目较多的配位化合物。
02
动态配位化合物
03
超分子配位化合物
具有可逆的结构变化和反应性, 可用于传感器、分子机器等领域。
由多个分子或离子通过非共价相 互作用形成的复杂结构,具有独 特的物理和化学性质。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
NH3
Ag+
NH3
[Ag(NH3)2]+
配位体
SO4
内 界 配合物
外界
注:内外界是离子键结合,在溶液中相当于强电 解质,完全解离。中心原子与配体间是配位键, 在溶液中相当于弱电解质,部分解离。
(一)中心原子(central atom) : 离子—— Cu2+、Ni2+、Zn2+ 原子—— Ni: [Ni(CO)4]
(二)配位体(ligand) 中性分子—— NH3 、CO、H2O 负离子—— CN-、Cl-、EDTA4-(Y4-)
稳度性 一般稳定
当配体的数目不同时,必须通过计算才能判断 配离子的稳定性。[CuY]2- 的Ks =5 ×1018 、 [Cu(en)2]2+ 的Ks =5.1×1021,不同类型,要计算。
分别计算0.1mol· L-1[Cu(en)2]2+溶液与0.1mol· L-1CuY2-
溶液中Cu2+离子的浓度。并比较二者的稳定性。已知
单齿配体:配位数=配位体个数, [Cu(NH3)4]2+ 多齿配体:配位数=配位体个数, [Cu(en)2]2+
[Co(NH3)4Cl2]Cl 配位数是多少? [Cr(en)2Cl2]Cl配位数是多少?4? 6? [FeY]-配位数是多少? 1?6?
二、配位化合物的命名
1. 对于内、外界的命名,阴离子在前,阳离子 在后 某化某: [Cu(NH3)4]Cl2、 [Ag(NH3)2]OH 某酸某: [Cu(NH3)4]SO4 某 酸: H2[PtCl6]
[Cu2+] = x = 6.3×10-8 mol· L-1
Cu
平衡时 y
2
Y
y
4
[CuY]
2
0.1 - y ≈0.1
[CuY 2 ] 0.1 18 Ks 5.0 10 [Cu 2 ] [Y4 ] y y
[Cu2+] = y = 1.4×10-10 mol· L-1
2. 配离子或配位分子的命名顺序
配体数(汉字数字) - 配体名-“合”-中心原子-(氧化数)(罗
马字表示)、 例如:[Cu(NH3)4]SO4 硫酸四氨合铜()
3. 多种不同配体的命名顺序
不同配体用 • 分开 先无机、后有机 先阴离子、后中性分子 若同为分子或离子则按配位原子的元素符号的英文字 母顺序(先氨N后水O)
第七章 配位化合物 Coordination Compound
本章要点 配位化合物的基本概念 配位平衡 螯合物
Alfred Werner
1866~1919 瑞士
l l l
配位化合物
H2的形成
H • + H • •
• )
sigma bond (
配位键的形成
H+ H 空轨道 + :NH3 H NH4+
K [ Pt (NH3)Cl3]
三氯•氨合铂()酸钾 氢氧化二氨合银(Ⅰ)
[Ag(NH3)2]OH
[Fe(en)3]Cl3 三氯化三(乙二胺)合铁(Ⅲ)
[Co(ONO)(NH3)5]SO4 硫酸(亚硝酸根)•五氨合钴(Ⅲ)
K[Co(NO2)4 (NH3)2] 四硝基•二氨合钴(Ⅲ)酸钾 NH4[Cr(NCS)4 (NH3)2] K2[Pb(SCN)2Cl4]
同一配体的两个配位原子之 间相隔两个或三个其他原子, 形成螯合环(五员或六员), 当同一配体中含有多个配位 原子时,可同时形成多个螯 合环。
2+
N N N
Ni
N N
N
[Ni(en)3]2+
二、影响螯合物稳定的因素
(一)螯合环的大小 螯合物的稳定性与螯合环的大小有关系,五员 环最稳定。六员环比较稳定 。 (二)螯合环的数目 在可能的情况下形成的螯合环的数目越多,稳 定性越大 。
Zn
2+
+
4NH3 + Cu2+
Ks3
Ks1
[Zn(NH3)4]2+
+ 4CNKs2
[Zn(CN)4]2- [Cu(NH3)4]2+
平衡朝哪个方向移动,取决于Ks1与Ks2、Ks1与 Ks3的相对大小 ,一般平衡总是向生成配离子稳定 性大的方向移动 。
第三节 螯合物
中心原子与多齿配体形成的具有环状结构的 配合物。
第一节
配位化合物的基本概念
Cu2+ + NH3· H2O (少量) Cu(OH)2 浅蓝色 + NH4+
Cu(OH)2 + NH3· H2O (过量) [Cu(NH3)4]2+(深兰色溶液)
医学上的意义
Cu(OH)2
[Cu(NH3)4]2+
CuSO4
一、 配合物的组成
[Cu
中心原子
(NH3)4]
配位原子(ligating atom) 配位体中提供孤电子对的原子,如: NH3、H2O、 CN-…… 常见的配位原子为:卤素X和O、S、N、C共 8种元素的原子
单齿配位(monodentate)和多齿配位(polydentate) 单齿配体:含有一个配位原子的配位体 H2O NH3 ClSCN-(硫氰酸根)、NCS-(异硫氰酸根) NO2-(硝基)、ONO-(亚硝酸根) 多齿配体:含有两个或两个以上配位原子的配 体: H2N-CH2-CH2-NH2,乙二胺 Ethylenediamine (en) O- - C=O │ O- - C=O ,草酸根
O2
血红素的结构
结论:
[Ni(NH3)4]2+
属顺磁性,外轨型
结论:
[NiCN)4]2-
属反磁性,内轨型
练习
[Co(H2O)(NH3)3Cl2]Cl
[Cr(en)(H2O)(OH)3]
配位共价键 (coordinate covalent bond)
一个原子提供空轨道另一个原子提供电子 对而形成的共价键
二、配位平衡的移动
(一)配位平衡与溶液酸度的关系 酸效应: 增大溶液[H+]浓度,导致平衡移动,配离 子稳定性降低
Cu2+ + 4NH3
+ 4H+
[Cu(NH3)4]2+
4NH4+
溶液的酸度越强,配离子越不稳定; 配离子的Ks越大,抗酸能力越强
二、配位平衡移动 (一)配位平衡与溶液酸度的关系
2
Ag+ + 2NH3 = [Ag(NH3)2]+
KS称为配位化合物稳定常数
Ks的大小反映了配合物的稳定性。Ks越大, 配合物越稳定,即同浓度溶液中中心原子浓度越 小。根据Ks的数值可以直接比较相同类型(配体 数相同)配离子的稳定性: [Ag(NH3)2]+ [Ag(S2O3)2]3- [Ag(CN)2]Ks 1.12×107 2.88 ×1013 次稳定 1.26×1021 最稳定
Ks([Cu(en)2]2+) = 1.0×1020,Ks(CuY2-) = 5.0×1018。
Cu
平衡时 x
2
2en
2x
[Cu(en)2 ]
2
0.1 – x ≈0.1
[Cu(en)2 2 ] 0.1 20 Ks 1.0 10 [Cu 2 ] [en]2 x (2 x )2
四(异硫氰酸根)•二氨合铬(Ⅲ)酸铵
四氯•二(硫氰酸根)合铅(Ⅳ)酸钾
[Ni(CO)4 ]
H2[PtCl6 ]
四羰基合镍(0)
六氯合铂(Ⅳ)酸
第二节 配位平衡
一、配位平衡常数(stability constant) M+nL MLn
[ML n ] Ks [M][ L]n
Ks [Ag(NH 3 ) 2 ] [Ag ][ NH3 ]
HOOCCH2 HOOCCH2
NCH2CH2N
CH2COOH CH2COOH
乙二胺四乙酸,EDTA
O
-
O NCH2CH2N CH2 C O CH2C
-
O CCH2
O CCH2
O
O
O
乙二胺四乙酸根,EDTA4-,Y4-
(三)配体数(配体总数)和配位数
心原子以配位键结合的配位原子的数目)
( 直接与中
小结Leabharlann l 配位化合物的基本概念:中心原子、配体、 配位数、命名 l 配位化合物的化学键理论—— 价键理论:杂化、内外轨 l 配位平衡的移动 l 螯合物 作业:1、2、8、28
组氨酸
H2C H3C CH2 H2C
CH2
CH3 N Fe N H 3C CH2 CH2 COOH N CH3 CH 2CH2COOH N
H3N ∶ + Ag+ + ∶NH3 →[Ag(NH3)2]+
[Cu(NH3)4]SO4 硫酸四氨合铜() 什么是配位化合物? 含配离子的化合物和配位分子 复杂结构单元: [Cu(NH3)4]2+离子, [PtNH3 Cl2] 核心的离子或原子——中心原子的价电子层 有空轨道; 围绕其周围的中性分子或负离子——配体含 有孤电子对,两者以配位键相结合。 如: [Cu(NH3)4]2+中Cu2+有空轨道,NH3中的N 有孤对电子。
M + L
H+
ML
HL
增大溶液[H+]浓度,可导致配位平衡移动,使配离 子稳定性降低,这种现象称为酸效应(acid effect)
M + L
OH-]浓度增加,金属离 因 [OH ML 子与OH-结合致使配离子解 离的作用称为水解效应 (hydrolytic effect)
