第七章 配位化合物
配位化合物

• 配位反应与氧化还原反应的关系 配位离解平衡与氧化还原平衡的关系,主 要体现在配位化合物的生成对电极电势的影 响。
根据能斯特方程: 若氧化型生成配位化合物,浓度减小,则E减小; 若还原型生成配位化合物,浓度减小,则E增大。
中心原子(阳离子或原子)与一定数目的配体(离子或 中性分子) ,通过配位键结合,并按一定组成和空间 构型形成的复杂离子称为配离子
例如, [Cu(H2O)4] 2+
含有配离子的化合物以及中性配位分子统称为 配合物。 例如, H[AuCl4] 、[Co(NH3)Cl3]
配位键 配体 中心原子
[Cu (NH3)4]SO4 [Cu (NH3)4]2+
• 当配位体接近中心离子时,为了增强成键 的能力,中心离子用能量相近的空轨道进 行杂化,形成数目相同,能量相等的具有 一定方向性的杂化空轨道,以容纳配位体 提供的电子形成配位键。配离子的空间构 型、配位数及稳定性等主要取决于杂化轨 道的数目和类型。 • M :L(L代表配位体)
第三节 配位化合物的离解平衡
中 心 离 子 配 位 配 体 位 原 子 配 位 数 离 子 电 荷
内界(配离子)
外界 SO42-
内界
在配合物化学式中用方括号表示内界。 配合物的内界能稳定地存在于晶体及水溶液中。 它是配合物的特征部分,它的结构和性质与其他离 子不同。 如: [ Cu (NH3) 4 ]2+
外界
不在内界的其他离子,如SO42- 构成配合物的外界。 写在方括号外,
单齿配体:一个配体中只有一个配位原子 例如: Ag+ 与NH3 结合
配位化合物.pptx

为一类具有特征化学结构的化合物,由中心原子(或离子,统称中 心原子)和围绕它的分子或离子(称为配位体/配体)完全或部分 通过配位键结合而形成。
包含由中心原子或离子与几个配体分子或离子以配位键相结合 而形成的复杂分子或离子,通常称为配位单元。凡是含有配位单 元的化合物都称作配位化合物。研究配合物的化学分支称为配位 化学。
配合物是化合物中较大的一个子类别,广泛应用于日常生活、 工业生产及生命科学中,近些年来的发展尤其迅速。它不仅与无 机化合物、有机金属化合物相关连,并且与现今化学前沿的原子 簇化学、配位催化及分子生物学都有很大的重叠
一、配位化合物的概念
配位化合物,简称配合物。是无机化学研究的 主要对象之一,它是一类复杂、特点多样、应 用广泛的化合物。 它与医学有密切关系,生物体内的金属离子大 多以配合物的形式存在,在生命活动中起着极 其重要的作用。
二、配位化合物的组成
• 1.内界和外界 • 配合物一般由内界和外界两部分组成。 • 内界:即配位单元,是配合物的特征部分 • 外界:除内界以外的部分 • 以硫酸四氨合铜(II)为例说明内界和外界
(一)内界 1.中心离子 2.配体和配位数 3.配离子 (二)外界
三、配离子和配合物的命名
1.配离子的命名顺序 配位数目(用一、二、三、四等 +配体+合=中心离子+ 化合价(用罗马数字表示)+离子 如:书P33 2.配合物的命名 原则:阴离子在前,阳离子在后 如:书P33-34
第七章 配位化合物

1 1.73
2 2.83
3 3.87
4 4.90
5 5.92
如:实验测出 [FeF6]3﹣的µ= 5.9 → n = 5 可知它是外轨型配合物 再如: 再如:实验测出 [Fe(CN)6]3﹣的µ= 1.9 → n = 1 可知它是内轨型配合物 外轨型,中心离子电子结构未变, 外轨型,中心离子电子结构未变,单电子数未变 内轨型,中心离子电子结构改变, 内轨型,中心离子电子结构改变,单电子个数改变
配
配
4
7.1.2 配位化合物的组成
[Cu(N 配 [Cu(NH3)4] SO4
中 心 离 子 配 位 原 子 界 位 体
配 离 子 电 荷
2+
配 位 数
外 界
配位化合物
5
中心离子(原子) ① 中心离子(原子):位于配位化合物的中心位置的离子 或原子,是配合物的核心, 或原子,是配合物的核心, 通常是某些金属阳离子或金属原子以及高 氧化态的非金属元素
和中心离子配合的负离子或分子, ② 配位体: 和中心离子配合的负离子或分子,简称配体
③ 配位原子:直接与中心原子配位的原子。配位原子上均 配位原子:直接与中心原子配位的原子。
有孤对电子, 有孤对电子,N、O、S、Cl、C、F、Br、I等 Cl、 Br、 直接与中心离子(或原子) ④配位数:直接与中心离子(或原子)结合成键的配位原子 数目,常见的为2 数目,常见的为2、4、6。
14
§7.2 配合物的化学键理论
中心离子和配位体之间是怎样结合的? 中心离子和配位体之间是怎样结合的? 关于配合物的化学键理论主要有: 关于配合物的化学键理论主要有: 价键理论√ 晶体场理论 配位场理论 分子轨道理论
15
第7章作业题解(配位化合物)

=4
3.2⇒ n=2 p3 正四面体 外轨型
[Mn(CN)6]4-
Mn2+:3d54s2 → 3d5
1.8 ⇒ n=1
d2sp3
正八面体
内轨型
[Co(NH3)6]3+
Co3+:3d74s2
0⇒
d2sp3
正八面体
内轨型
→ 3d64s0
n=0
5. (1) [Cd(NH3)4]2+,正四面体形
Cd2+: 4d105s2 → 4d10 应为sp3杂化,m=0(n=0)。
2 3 2] 3
Ksp, AgBr 2.89 1013 7.7 1013 22.25
x2 x K 22.25, 即 4.717 2 2.0 2 x (2.0 2 x) x 0.9mol dm 3
12.在100 cm3 K[Ag(CN)2]浓度为0.15 mol· -3的溶液中加入0.10 dm mol· 3KI溶液50 cm3,是否有AgI沉淀产生?若在上述混合溶 dm 液中加入0.20 mol· -3KCN溶液50 cm3,是否有AgI沉淀产生? dm 解:(1)已知:K稳,[Ag(CN)2]- = 1.26×1021, Ksp(AgI) = 1.5×10-16 c{[Ag(CN)2]-} = 0.15×100/(100+50) = 0.10 mol· -3 dm c(I-) = 0.10×50/(100+50) = 0.033 mol· -3 dm [Ag(CN)2]- ⇌ Ag+ + 2CN平衡浓度 / mol· -3 dm 0.10-x x 2x c{[ Ag(CN ) 2 ] } 0.10 x K稳 1.26 1021 c( Ag ) c 2 (CN ) x (2 x )2
南昌大学大学化学第七章习题答案
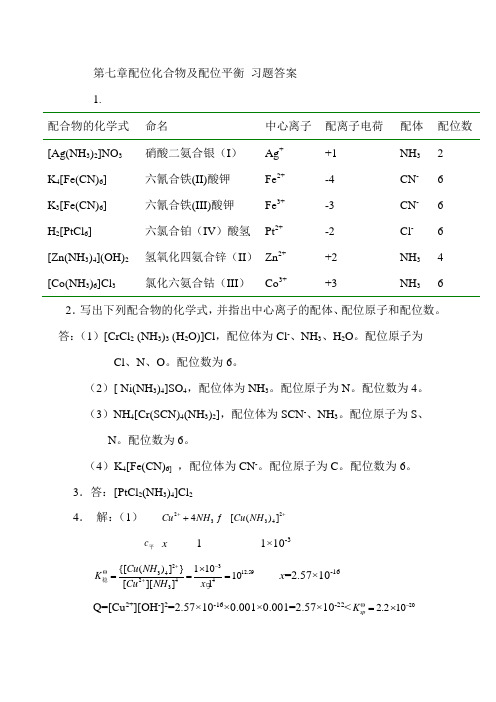
第七章配位化合物及配位平衡 习题答案 1.配合物的化学式 命名 中心离子 配离子电荷 配体 配位数 [Ag(NH 3)2]NO 3 硝酸二氨合银(I ) Ag + +1 NH 3 2 K 4[Fe(CN)6] 六氰合铁(II)酸钾 Fe 2+ -4 CN - 6 K 3[Fe(CN)6] 六氰合铁(III)酸钾Fe 3+-3 CN - 6 H 2[PtCl 6] 六氯合铂(IV )酸氢 Pt 2+ -2 Cl - 6 [Zn(NH 3)4](OH)2 氢氧化四氨合锌(II ) Zn 2+ +2 NH 3 4 [Co(NH 3)6]Cl 3氯化六氨合钴(III )Co 3++3NH 362.写出下列配合物的化学式,并指出中心离子的配体、配位原子和配位数。
答:(1)[CrCl 2 (NH 3)3 (H 2O)]Cl ,配位体为Cl -、NH 3、H 2O 。
配位原子为Cl 、N 、O 。
配位数为6。
(2)[ Ni(NH 3)4]SO 4,配位体为NH 3。
配位原子为N 。
配位数为4。
(3)NH 4[Cr(SCN)4(NH 3)2],配位体为SCN -、NH 3。
配位原子为S 、N 。
配位数为6。
(4)K 4[Fe(CN)6] ,配位体为CN -。
配位原子为C 。
配位数为6。
3.答:[PtCl 2(NH 3)4]Cl 24. 解:(1) 223344[()]Cu NH Cu NH +++ c 平 x 1 1×10-32312.59342443{[()]}11010[][]1Cu NH K Cu NH x +-Θ+⨯=== 稳x =2.57×10-16 Q=[Cu 2+][OH -]2=2.57×10-16×0.001×0.001=2.57×10-22<202.210sp K Θ-=⨯无沉淀。
(2) Q=[Cu 2+][S 2-]=2.57×10-16×0.001=2.57×10-19>366.310sp K Θ-=⨯,有沉淀。
第七章_配位化合物

第七章 配位化合物
•(2)配体命名次序: • 简单负离子-复杂负离子-有机酸根离子-中性分子 (H2O - NH3 -有机分子);不同配体之间用中圆点分开。 例如:H2[PtCl6] 六氯合铂(Ⅳ)酸 [Cr(H2O)4Cl2]Cl 一氯化二氯· 四水合铬(Ⅲ) (3)配体数用中文数字“一、二、三·· ·”表示,标在配体名 · 称之前。 (4)中心离子的电荷数用罗马数字“Ⅰ、Ⅱ 、 Ⅲ 、 Ⅳ” 标明,用圆括号括起来标在中心离子名称之后。
课本220页:表7-2 杂化轨道类型与配合物
–14 –
第七章 配位化合物
第七章 配位化合物
2、d 2sp3杂化:
[Fe(CN)6]3-,Fe3+:3d 5 与CN-配位时,Fe3+采取的是d2sp3杂化。
[Zn(NH3)4]2+, Zn:3d 104s2 →Zn2+:3d 10(4s04p0) 在NH3作用下,Zn2+采取了sp3杂化,形成正四 面体型的杂化空轨道,与配体中NH3中N原子的4对 孤对电子形成四个配位键。空间构型:正四面体 再如: [Ni(NH3)4]2+、 [CoCl4]2-、 [HgI4]2-
夹心配合物示意图
Fe
根据成环原子数目,可以分成四元环、五元环、六元 环、七元环,其中五元环和六元环最稳定,而且,环数 越多越稳定,[Cu(en)2]2+中有两个五元环,[CaY]2-有五 个五元环。 大多数螯合物都有特征颜色,难溶于水,所以分析中 常用EDTA来做配位滴定,其二钠盐易溶于水。
第七章 配位化合物
第七章 配位化合物
第七章
配位化合物 P208
1、掌握配合物的定义、组成及命名
2、掌握配合物价键理论的要点,并能运用杂化轨道理 论解释配离子的空间构型;
大学化学 第七章 配位化合物''

College Chemistry
3.配体类型相同,按配位原子元素符号英文字母顺 序排列;[Co(H2O)(NH3)5]Cl3 三氯化五氨·一水合钴(Ⅲ) 4.配体类型、配原子都相同,原子数少的在前;
[Pt(Py)2(en)2]Cl2 氯化二吡啶·二乙二胺合铂(Ⅱ)
第七章 配位化合物
大 学 化 学
(二)螯合物(chelate)
多齿配体与中心离子形成的具有环状结构的 配合物。 最常见的螯合剂:en,EDTA
第七章 配位化合物
大 学 化 学
College Chemistry
五个五元环
第七章 配位化合物
大 根据成环原子数目,可以分成四元环、五元 学 环、六元环、七元环,其中五元环和六元环最稳 化 定,而且环数越多越稳定。[Cu(en)2]2+中有两个五 学 2-
元环, [CaY] 有五个五元环。分析中常用 EDTA 来做配位滴定。 大多数螯合物都有特征颜色,难溶于水。
College Chemistry
第七章 配位化合物
大 学 化 学
(三)金属有机化合物: 金属原子与有机配体中的C原子结合而形成的 配合物。
1973 年 慕 尼 黑 大 学 的 恩 斯 特 ·奥 托 ·菲舍尔及伦敦帝国学院的杰弗 里 ·威尔金森爵士被授予诺贝尔化 学奖,以表彰他们在有机金属化学 领域的杰出贡献。
2
College Chemistry
反过来,根据配离子的电荷数和配体的电荷 数,也可以推算出中心离子的电荷数。
第七章 配位化合物
大 配合物的种类非常多,主要有两大类: 学 化 (一)简单配合物(complex) 学
单齿配体与中心离子形成的配合物。
三、配合物的类型
College Chemistry
第七章 配位化合物

sp 3d 2杂杂 sp3d 2杂杂杂杂
3d
3d 7
NH3 NH3 NH3 NH 3 NH 3 NH 3
8
外轨型配合物,高自旋 µ = 3.87B.M. 八面体构型
说明 Co(CN)64–不稳定,易被氧化
4d 4p 4s 3d 7
激激 3d6
d 2 sp 杂杂 3d
CN
-
Co(CN)64 –氧化成Co(CN)63–
(3).多核配合物 一个配位原子与二个中心离子结合所成的配合物称多核 配合物,例如:
(4).金属有机配合物 有机基团与金属原子 之间生成碳—金属键 的化合物。A)金属与 碳直接以σ键合的配合 物;B)金属与碳形成 不定域配键的配合物。
7-2 配合物的化学键理论
用来解解释配合物化学键的本质,配合物的结构、稳定性以及一 般特性(如磁性、光譜等)的主要理论有①价键理论、②晶体场理 论、③分子轨道理论。 一,价键理论
4d 4p 4s
4d
CN CN - CN
-
-
CN - CN -
(3).磁性——可通过磁矩来判断内轨型配合物或外轨型的 配合物
形成外轨型的配合物,中心离子电子结构未发生变化,单电子数 与原来自由离子相同; 而形成内轨型的配合物,中心离子的成单电 子数一般会减少,比自由离子的磁矩相应降低,所以可通过磁矩来判 断内、外轨型配合物。. 物质的永磁矩主要是电子的自旋造成的,永磁矩µ与原子或分子中 未成对电子数n有如下关系式:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第七章 配位化合物一、单项选择题1. 下列物质中不能作为配体的是 ( B )A. NH 3B. NH 4+C. OH -D. NO 2-2. 下列离子或化合物中,具有顺磁性的是 ( B )A. Ni(CN)-24B. CoCl -24C. Co(NH 3)+36D. Fe(CO)53.在配合物[Co(NH 3)4(H 2O)]2(SO 4)3中,中心离子的配位数为 ( B )A. 4B. 5C. 9D. 124. 配离子[Co(NH 3)6]2+的空间构型为 ( A ) A. 八面体 B. 四方锥形 C. 四面体 D. 三角双锥5. EDTA 是四元弱酸,当其水溶液pH ≥ 12时,EDTA 的主要存在形式为 ( C ) A. H 4Y ; B. H 3Y -; C. Y 4-; D. HY 3-6.下列关于价键理论对配合物的说法正确的是 ( C ) A. 任何中心离子与任何配体都可形成外轨型化合物; B. 任何中心离子与任何配体都可形成内轨型化合物;C. 中心离子用于形成配位键的原子轨道是经过杂化的等价轨道;D. 以sp 3d 2和d 2sp 3杂化轨道成键的配合物具有不同的空间构型。
7.下列物质中能被氨水溶解的是 ( B ) A. Al(OH)3 B. AgCl C. Fe(OH)3 D. AgI 8. 下面哪一个不属于EDTA 与金属离子形成螯合物的特点 ( B ) A. 具有环状结构 B . 稳定性差 C. 配位比一般为1:1 D. 易溶于水 9. 下列说法欠妥的是: ( C ) A. 配合物的形成体(中心原子)大多是中性原子或带正电荷的离子。
B. 螯合物以六员环、五员环较稳定。
C. 配位数就是配位体的个数。
D. 二乙二胺合铜(Ⅱ)离子比四氨合铜(Ⅱ)离子稳定。
10. AgCl 在11mol L -⋅氨水中比在纯水中的溶解度大,其原因是 ( B ) A. 盐效应 B. 配位效应 C. 酸效应 D. 同离子效应11. 离子以dsp 2杂化轨道成键而形成的配合物,其空间构型是 ( A ) A. 平面正方形 B. 四面体形 C. 直线形 D. 八面体形12. 22Cu(en)+的稳定性比234Cu(NH )+大得多,主要原因是前者 ( B )A. 配体比后者大;B. 具有螯合效应;C. 配位数比后者小;D. en 的分子量比NH 3大。
13. Al 3+与EDTA 形成 ( A ) A. 鳌合物 B. 聚合物 C. 非计量化合物 D. 夹心化合物 14.下列说法中错误的是 ( D ) A. 配体的配位原子必须具有孤电子对。
B. 配离子的配位键愈稳定,其稳定常数愈大。
C. 配合物的颜色最好用晶体场或配位场理论解释。
D. 配合物的颜色最好用价键理论来解释。
15. 下列几种物质中最稳定的是 ( A ) A. [Co(en)3]Cl 3 B. [Co(NH 3)6] (NO 3)3 C. [Co(NH 3)6]Cl 2 D. Co(NO 3)316. 下列配离子在强酸中能稳定存在的是 ( D ) A. [Fe(C 2O 4)]3- B. [AlF 6]3- C. [Mn(NH 3)6]2+ D. [AgCl 2]- 17.下列叙述中正确的是 ( D ) A. 配合物中的配位键必定是由金属离子接受电子对形成的 B. 配合物都有内界和外界C. 配位键的强度低于离子键或共价键D. 配合物中,中心原子(离子)与配位原子间以配位键结合18. 下列水溶液中的反应,其标准平衡常数可作为[FeF 6]3-的稳定常数的是( A ) A. [Fe(H 2O)6]3+ + 6F - = [FeF 6]3- + 6H 2O B. [FeF 6]3- = Fe 3+ + 6F -C. [FeF 6]3- + 6H 2O = [Fe(H 2O)6]3+ + 6F -D. [FeF 6]3- + H 2O = [FeF 5(H 2O)]2- + F -19. 下列物质中的中心离子磁矩最小的是 ( B ) A. [Fe(CN)6]3- B . [Co(CN)6]3- C. [Cu(NH 3)4]2+ D. [FeF 6]3- 20. 配合物K 2[Zn(OH)4]的名称是: ( C ) A. 氢氧化锌钾 B. 四氢氧化锌(II)钾 C. 四羟基合锌(II)酸钾 D. 四羟基合锌(II)钾21. 下列配离子都具有相同的强场配体CN -,其中属于外轨型配合物的是( A ) A . [Zn(CN)4]2- B. [Fe(CN)6]3- C. [Ni(CN)4]2- D. [Co(CN)6]3- 22. 下列说法中错误的是 ( D ) A. 一般说来内轨型配合物较外轨型配合物稳定 B. 在[Cu(en)2]2+中,Cu 2+的配位数是4 C. CN -和CO 作为配体时力图形成内轨型配合物 D. 金属原子不能作配合物的形成体 23. NH 4[Cr(NCS)4(NH 3)2]的正确名称是 ( B ) A. 四(硫氰酸根)·二氨合铬(Ⅲ)酸铵 B. 四(异硫氰酸根)·二氨合铬(Ⅲ)酸铵 C. 四(异硫氰酸根)·二氨合铬酸铵 D. 四(硫氰酸)·二氨合铬(Ⅲ)酸铵24. 内轨型配离子[Fe(CN)6]3-的磁距等于2.0 B.M.,判断其空间构型和中心离子的杂化轨道分别为 ( D ) A. 四面体形和sp 3 B. 正方形和dsp 2 C. 八面体形和sp 3d 2 D. 八面体形和d 2sp 325. 下列配离子中最稳定的离子是: ( D ) A. [AgCl 2]- B. [Ag(NH 3)2]+ C. [Ag(S 2O 3)2]3- D. [Ag(CN)2]- 26. 以下表达式中,正确的是: ( C )A. ()()()/MY (MY)M Y =fc K c c Θ B. [][][]/f MY M Y =K Θ C. [][][]f MY (MY)M Y =K D. [][][]f M Y (MY)MY =K27. 利用生成配合物而使难溶电解质溶解时,最有利于沉淀的溶解的条件是 ( B )A. lg K MY 愈大,K sp 愈小B. lg K MY 愈大,K sp 愈大C. lg K MY 愈小,K sp 愈大D. lg K MY >>K sp28. 在[Co(en)2Cl 2]+离子中,钴的氧化数和配位数分别为: ( C ) A. 0和4 B. +2和4 C. +3和6 D. +2和629. 某金属离子生成的两种配合物的磁矩分别为μ=4.90 BM 和μ=0.00 BM ,则该金属可能是: ( B ) A. Cr 3+ B . Fe 2+ C. Mn 2+ D. Zn 2+ 30. 配合物K 3[Fe(CN)5CO]的中心离子杂化类型是: ( C ) A. sp 3d 2 B. dsp 3 C. d 2sp 3 D. sp 3d 31. EDTA 与金属离子形成的配合物的配位比一般为 ( A ) A. 1﹕1 B. 1﹕2 C. 2﹕1 D. 1﹕332. 在0.20 1mol L -⋅ [Ag(NH 3)2]Cl 溶液中,加入等体积的水稀释(忽略离子强度影响),则下列各物质的浓度为原来浓度的21的是 ( D )A. c ([Ag(NH 3)2]Cl)B. 解离达平衡时c (Ag +)C. 解离达平衡时c (NH 3·H 2O)D. c (Cl -)33. 向 [Cu(NH 3)4]2+水溶液中通入氨气,则 ( D ) A. K 稳([Cu(NH 3)4]2+)增大 B. [Cu 2+]增大 C. K 稳([Cu(NH 3)4]2+)减小 D. [Cu 2+]减小34. 对于配合物中心体的配位数,说法不正确的是 ( A ) A. 直接与中心体键合的配位体的数目 B. 直接与中心体键合的配位原子的数目 C. 中心体接受配位体的孤对电子的对数 D. 中心体与配位体所形成的配价键数35. [Ca(EDTA)]2-配离子中,Ca 2+的配位数是 ( D ) A. 1 B. 2 C. 4 D. 636. 在[Co(en)(C 2O 4)2]配离子中,中心离子的配位数为 ( D ) A. 3 B. 4 C. 5 D. 637. 在[Ru(NH 3)4Br 2]+中,Ru 的氧化数和配位数分别是 ( C ) A. +2和4 B. +2和6 C. +3和6 D. +3和438. Fe 的原子序数为26,化合物K 3[FeF 6]的磁矩为5.9 B.M.,而 K 3[Fe(CN)6]的磁矩为2.4 B.M.,这种差别的原因是 ( C ) A. 铁在这两种配合物中有不同的氧化数 B. CN -比F -引起的晶体场分裂能更小 C. F 比C 或N 具有更大的电负性 D. K 3[FeF 6]不是配位化合物39. 对配位反应的条件稳定常数K 'MY 而言,下列说法正确的是: ( C ) A. K 'MY 是常数,不受任何条件限制; B. K 'MY 的大小完全是由K MY 决定的;C. K 'MY 的大小表示有副反应发生时主反应进行的程度;D. K 'MY 的大小只受溶液酸度的影响40. 影响EDTA 滴定反应平衡常数的因素有: ( A ) A. 温度; B. 催化剂; C. 反应物浓度; D. 反应速率41. 已知lg K AlY =16.1,pH=10时lg αY(H)=0.5,AlY 的条件稳定常数lg K AlY '是: ( B ) A. 16.6; B. 15.6; C. 15.1; D. 8.542.Fe 3+具有d 5电子构型,在八面体场中要使配合物为高自旋态,则分裂能△和电子成对能P 所要满足的条件是 ( C ) A . △和P 越大越好 B. △> P C . △< P D. △= P43. 根据晶体场理论,在八面体场中,由于场强的不同,有可能产生高自旋和低自旋的电子构型是 ( C ) A. d 2 B. d 3 C. d 4 D. d 844. 下列说法中正确的是( D)A. 配位原子的孤电子对越多,其配位能力就越强B. 电负性大的元素充当配位原子,其配位能力也强C. CH 3-C-OH 配体是双齿配体D. 在[Cu(en)2]2+中,Cu 2+的配位数是4 45. 解释在FeCl 3溶液中滴加KCNS 试剂,溶液变红的原因是( B ) A. FeCl 3溶液被稀释放 B. 生成了[Fe(CNS)6]3- C. 没有反应 D. 生成了Fe(CNS)3沉淀46. 以CN-和CO 作配体时较之以F-和H 2O 作配体时形成的配合物多为内轨型,其原因是( A )A. 在CN-和CO 中的C 较之F 和O 更易提供电子对B. C 比O 和F 的原子半径大,极化率大,易变形,所提供的电子对易进入中心体的内层空轨道C. C 的原子量较之F 和O 小D. CN-和CO 的式量较之F 和O 的原子量大47. 已知AgI 的Ksp=K1,[Ag(CN)2]-的K 稳=K 2,则下列反应的平衡常数K 为( A )AgI(s)+2CN [Ag(CN)2]-+I -A. K1.K2B. K2/K1C. K1/K2D. K1+K2 48. 下面叙述正确的是 ( D ) A . Fe (H 2O)4(C 2O 4)+的配位数为5B . 产生d-d 跃迁光谱时,Co(CN)63-与Co(NH )363+相比较,前者将吸收波长较长的光C . s 轨道和p 轨道在八面体场中发生分裂D . 在四面体和八面体场中,d 2型离子配合物不存在高低自旋之分 49. 比较下列各对配合物的稳定性,错误的是 ( B )A . [Fe (CN)6]3- > [Fe (C 2O 4)3]3-B. HgCl 42->HgI 42-C . [Al F 6]3- > [Al Br 6]3- D. [Al (OH)4]- > [Zn (OH)4]2-50. 影响中心离子(或原子)配位数的主要因素有 ( D ) A. 中心离子(或原子)能提供的价层空轨道数B .空间效应,即中心离子(或原子)的半径与配位体半径之比越大,配位数越大C .配位数随中心离子(或原子)电荷数增加而增大D .以上三条都是51. 乙二胺能与金属离子形成下列中的哪种物质?( C ) A .复合物 B. 沉淀物 C. 螯合物 D. 聚合物B52. [Co(SCN)4]2-离子中钴的价态和配位数分别是 ( ) A 、-2,4 B 、+2,4 C 、+3,2 D 、+2,12 53. 当0.01 mol CrCl 3·6H 2O 在水溶液中用过量硝酸银处理时,有0.02 mol 氯化银沉淀出来,此样品中配离子的最可能表示式是 ( B ) A 、 [Cr(H 2O)6]2+ B 、 [CrCl(H 2O)5]2+ C 、 [CrCl(H 2O)3]2+ D 、 [CrCl 2(H 2O)4]+二、填空题1. [Fe(CN)6]4-Fe 2+以 d 2sp 3 杂化轨道与CN -成键,故[Fe(CN)6]4-称为 低 自旋配合物;[FeCl 6]3-中Fe 3+以 sp 3d 2 杂化轨道与Cl -成键,配离子的稳定性是[Fe(CN)6]4- 大于 [FeCl 6]3-.2. 配合物Fe(CN)63-中心离子的杂化轨道类型是d2sp3,空间构型:正八面体。
