配位化合物
第五章配位化合物

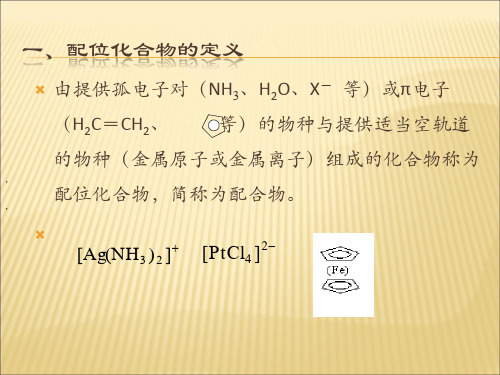
[Ag(S2O3)2]3-, [Fe(CN)6]4-, [Fe(SCN)6]3-, [HgI4]2- , [Fe(CN)6]3-等 或原子)和一定数目 配位单元:由中心离子(或原子 配位单元:由中心离子 或原子 和一定数目 的中性分子或阴离子以配位键结 合而成的中性分子或复杂离子。 合而成的中性分子或复杂离子。 [Ni(CO)4], [Co(NH3)3F3], [Pt(NH3)2Cl2], K3[Fe(SCN)6], [Ag(NH3)2]NO3。 配合物: 含配位单元的化合物。 配合物 含配位单元的化合物。
6
{
多齿配体数≠( ) 多齿配体数 (<) 配位数 中心离子的配位数一般等于其电荷数的二倍 如:M+——2、M2+——4、M3+——6 、 、 ④.配离子的电荷数 a. 配离子的电荷数等于中心原子的氧化数 和配体总电荷数的代数和。 和配体总电荷数的代数和。 b. 外层电荷数的相反数。 外层电荷数的相反数。 K3[Fe(SCN)6] [Ag(NH3)2]NO3 中心离子的电荷数: 中心离子的电荷数 +3(Ⅲ) +1(Ⅰ) [Pt(NH3)2NO2NH2 Cl2] +4(Ⅳ) Ⅳ
13
[Co(NH3)5(ONO)]Cl2 氯化亚硝酸根•五氨合钴 Ⅲ) 氯化亚硝酸根 五氨合钴(Ⅲ 五氨合钴 六氯合铂( 六氯合铂(Ⅳ)酸 H2[PtCl6] Na3[Ag(S2O3)2] [Cu(NH3)4](OH)2 K3[Fe(SCN)6] 二硫代硫酸根合银(Ⅰ 酸钠 二硫代硫酸根合银 Ⅰ)酸钠 氢氧化四氨合铜(Ⅱ 氢氧化四氨合铜 Ⅱ) 六硫氰合铁(Ⅲ 酸钾 六硫氰合铁 Ⅲ)酸钾
12
首页 上页 下页 返回
[Ag(S2O3)2]3[Cr(NH3)5(H2O)]3+ [Cu(NH3)4]2+ [Fe(NH3)2(en)2]3+ [Co(NH3)5(ONO)]2+ [Cr(NH3)3Cl3]
配位化合物

Ni2+可以利用丁二肟在氨溶液中与Ni2+配位生成桃红 色絮状螯合物沉淀物来鉴定。
首页
上一页
下一页
末页
32
利用硫氰根负离子可以与Co2+形成蓝紫色的四硫氰 根 合 钴 ( II ) [Co(SCN)4]2- 来 检 验 Co2+ 的 存 在 。 与 Fe3+形成血红色配合离子可供检验Fe3+的存在。
K4[Fe (CN)6]
六氰合铁(Ⅱ)酸钾
H4[Fe (CN)6]
六氰合铁(Ⅱ)酸
[Co(NH3)5H2O]Cl3
氯化五氨·水合钴(Ⅲ)
首页
上一页
下一页
末页
18
配合物的类型
(1)简单配合物 由单齿配体与中心原子直接配位而成的配位化合 物。
例:[Ag(NH3)2]+ BF4[Fe(H2O)6]Cl3 [CoCl3(NH3)3] 等
28Ni 3d84s2 3d
Ni2+
4s 4p
[Ni(CN)4]2-
dsp2杂化
CN- CN- CN-CN-
首页
上一页
下一页
末页
24
[NiCl4]2-的空间构型为四面体。
28Ni 3d84s2
3d
Ni2+
4s 4p
[NiCl4]2-
3d sp3杂化
4s
4p
Cl- Cl- Cl- Cl-
首页
上一页
下一页
首页
上一页
下一页
末页
38
配合物与配位作用用于医学
什么是配位化合物

什么是配位化合物?配位化合物是指由一个或多个配位体(ligand)与一个中心金属离子(或原子)通过配位键(coordination bond)结合形成的化合物。
在配位化合物中,配位体通过共用电子对与中心金属离子形成配位键,将其固定在配位体的周围形成配位球形结构。
1. 配位体:配位体是能够提供一个或多个电子对给中心金属离子的分子或离子。
配位体通常是具有孤对电子的原子或分子,包括有机分子如胺、醇和酸以及无机分子如氨、水和卤素离子等。
配位体通过配位键与中心金属离子结合,形成稳定的配位化合物。
2. 配位键:配位键是指配位体与中心金属离子之间的共用电子对。
配位键通常是通过配位体中的孤对电子与中心金属离子中的空轨道形成。
这种共用电子对的形成使得配位体与中心金属离子之间形成了较强的化学键。
配位键可以是单个配位体提供一个电子对形成的单配位键,也可以是多个配位体提供多个电子对形成的多配位键。
根据配位键的数量,配位体可以分为单齿配位体、多齿配位体和桥配位体等。
3. 配位球形结构:配位化合物中的配位体通过配位键与中心金属离子结合,形成了一个稳定的配位球形结构。
在这个结构中,中心金属离子被配位体包围,形成一个多面体的结构。
配位球形结构的形状和几何构型取决于配位体的种类和数量,以及中心金属离子的电子构型。
常见的配位球形结构包括八面体、四方体、正方形平面、三角双锥等。
这些不同的结构对于化合物的性质和反应有重要影响。
配位化合物具有许多特点和性质。
首先,配位化合物通常具有良好的溶解性和热稳定性,因为配位键是较强的化学键。
其次,配位化合物的颜色通常取决于中心金属离子的电子结构和配位体的取代情况。
这使得配位化合物在催化、荧光和生物活性等领域具有重要应用。
此外,配位化合物还可以通过改变配位体的种类和数量来调节其性质和功能,如选择性吸附、储能和分子识别等。
配位化合物是化学中的重要概念,对于理解过渡金属化学、配位化学和配位聚合物等领域具有重要意义。
配位化合物

[Cu(NH3)2]Ac + CO + NH3 ===== [Cu(NH3)2]Ac.CO
减压加热
H = -35kJ
Cu2+ + 5CN- = Cu(CN)43- + 0.5(CN)2 K稳 =2×1030 (极为稳定,加入H2S也无沉淀,Ksp=2.5×10-50))
Cu(CN)4 3 - + e == Cu + 4CNE = -1.27V Zn(CN)42- + 2e == Zn + 4CNE = -1.26V 这两个电对的电势值相近,所以镀黄铜(Cu-Zn合金)所 用的电镀液为上述混合物.
[AlCl4][BF4][AgI4]2- 从这些配离子你看出配位数有什么规律? 从这些配离子你看出配位数有什么规律?
二,化学键理论
维尔纳(Werner.A):Nobel Prize提出三点: 维尔纳( 提出三点: 提出三点 1,主价和副价 , 主价指氧化数,副价指配位数. 主价指氧化数,副价指配位数. 2,倾向于既要满足主价,又要满足副价. ,倾向于既要满足主价,又要满足副价. 3,副价指向空间的确定位置. ,副价指向空间的确定位置. 1,价键理论:中心离子和配位原子都是通过杂化了的共价配位键 ,价键理论: 结合的. 结合的. (1)配位键的本质: )配位键的本质: a,σ配位键: 配位键: , 配位键
2,复盐 ,
CsRh(SO4)2.4H2O + BaCl2 无沉淀出现. 无沉淀出现. [Rh(H2O)4(SO4)2]-(二硫酸根四水合铑(III)) 二硫酸根四水合铑( )) 二硫酸根四水合铑 KCl.MgCl2.6H2O不是配合物 不是配合物
3,组成 ,
(1)配位体:是含有孤电子对的分子和离子 )配位体:
配位化合物知识总结

VS
磁性配合物在磁学、磁记录、信息存 储和分子基磁体等领域有广泛的应用 前景。
Part
04
配位化合物的应用
在化学反应中的作用
催化反应
配位化合物可以作为催化剂,通 过与反应物结合,改变反应途径,
降低反应活化能,从而加速化学 反应的进行。
分离和提纯
利用配位化合物的独特性质,如选 择性络合、稳定性差异等,可以实 现化学物质的分离和提纯。
配位化合物的稳定性取决于多个因素 ,包括中心离子的性质、配位体的类 型和数量、以及配位环境等。
稳定性规律
一般来说,中心离子的电荷数越高、 半径越小,配位化合物的稳定性越强 ;配位体的电子给予能力越强、数目 越多,稳定性也越高。
配位化合物的合成方法
有机合成
通过有机合成方法,可以制备出结构复杂、功能多样的配 位化合物。常见的合成方法包括重氮化反应、氧化还原反 应等。
配位化合物的分类
按中心原子分类
根据中心原子的种类,可以将配位化合物分为金属配位化合物和非金属配位化合物。金属配位化合物是指中心原 子为金属元素的配位化合物,如铜、钴、铁等;非金属配位化合物是指中心原子为非金属元素的配位化合物,如 硫、氮、磷等。
按配位数分类
根据配位数的大小,可以将配位化合物分为低配位数(2-4)和高配位数(≥6)的配位化合物。低配位数配位化 合物是指中心原子周围参与配位的配位体数目较少的配位化合物;高配位数配位化合物是指中心原子周围参与配 位的配位体数目较多的配位化合物。
02
动态配位化合物
03
超分子配位化合物
具有可逆的结构变化和反应性, 可用于传感器、分子机器等领域。
由多个分子或离子通过非共价相 互作用形成的复杂结构,具有独 特的物理和化学性质。
化学中的配位化合物

化学中的配位化合物化合物是由不同原子通过共价或离子键相互结合形成的物质,而配位化合物则是在这个基础上引入了一个中心离子,使得周围的分子(配体)以孪晶体的方式围绕中心离子达到稳定的结构。
配位化合物的结构一般有两种,一种是具有点群对称的配位化合物,形成简单、对称的分子结构,大部分金属的情况都可以用点群的理论来解释。
另一种是非点群对称的配位化合物,由于存在不对称的原子、分子轨道、配体偏离等因素,使得其结构更为复杂。
不同种类的配位化合物均有着精细的内部结构和相关的理论研究。
以下将简单介绍一些常见的配位化合物及其特性。
1. 氨基酸配合物氨基酸是生物体中基础的分子构成单元,能通过阳离子交换、水解、还原等方式形成两性离子、金属离子配合物等,而在生命的进化过程中扮演了重要的角色。
例如,在乳酸菌中形成的结晶化氢桥纤维素(HBNC)中,氧原子上存在的羧基(O-H)和羧酸根基相连形成具有羟基和羧基的链状结构,进而与其它羟基和尿酸等形成氢键和金属离子配合物。
这些配合物有着天然的抗氧化、生物酸等很好的保健作用。
2. 金属络合物金属络合物即为金属离子与配体发生协同作用形成的化合物。
一般来说,金属离子具有可导电性、电子电离能低、主量子数较低、容易失去电子等特性,而其与配体之间的协同作用则存在着多种络合键,如项链式、夹心戒指式、四面体结构等。
这些络合物往往具有一定的生物活性、化学稳定性和物理性能特征,同时也在催化、光催化等领域为人们所利用。
例如,著名的血红蛋白就是由铁离子与血红蛋白配体组成,具有保护红细胞、传递氧气等作用。
而且通过控制金属离子的丰度、配合物的带电性等可以实现多种功能,例如合成光致消除材料、催化剂及光电转换器件等等。
3. 铁与铜络合物铁与铜被广泛应用在催化剂、生物学等领域,其化学性质与络合物的结构密切相关。
铁与铜的化合物因其含有容易发生氧化还原反应的过渡金属离子而具有很大的生物活性;而其复杂的化学结构和理论分析则常常是人们探寻其性质的难点。
基础化学第十一章(配位化合物)

1、正八面体场(Oh场)
自由离子
Es 球对称场
六个配体分别位于三个坐标轴的正反两个方向
自由离子
Es 球对称场
Eeg Et2g 10Dq 2Eeg 3Et2g 0
d轨道能级的分裂
d x2 y2
d z2
eg
分裂能
dxy dxz
Δo=10Dq dyz t2g
八面体场
Eeg 6Dq ( 或0.60 ) Et2g 4Dq ( 或 0.40 )
y =2.7×10-3
[Ag(NH3)2]+比[Zn(NH3)4]2+更稳定
0.1mol·L-1AgNO3溶液和0.2 mol·L-1
NH3 ·H2O溶液等体积混合
Ag+ + 2NH3 ⇌ Ag(NH3)2+
初始:
0
0.05
平衡: X 2X
0.05-X= 0.05
0.1mol·L-1AgNO3溶液和0.4 mol·L-1 NH3 ·H2O溶液等体积混合
[Cu(NH3)3]2++NH3 ⇌[Cu(NH3)4]2+ Ks4=1.39×102
Ks1·Ks2·Ks3·Ks4=Ks,Ks称为总稳定常数
1、类型相同的配合物Ks越大,配合物越稳定 计算0.10mol/L [Ag(NH3)2] +中[Ag+]
Ag++2NH3 ⇌ [Ag(NH3)2] +
初始:
中心原子(central atom):一般为副族元素
配体(ligand):一般为负离子或中性分子
如:H2O、CO、NH3 、 X- 、 OH- 、 CN- 、 NO2-、ONO-、SCN-、NCS-、乙二胺
配位化合物
配位数
2 3 4 4 5 5 6 6
中心 杂化方式
构型
实例
sp sp2 sp3 dsp2 dsp3 sp3d sp3d2 d2sp3
直线形 [ Ag( NH3)2 ]+ 三角形 [ Cu(CN)3 ]2- 四面体 [ Zn(NH3)4 ]2+ 正方形 [ N(i CN)4 ]2-
三角双锥 [ F(e CO)5 ] 三角双锥 [ Fe(SCN)5 ]2-
2 溶剂合异构
当溶剂分子取代配位基团而进入配离子的内界所
产生的溶剂合异构现象。与电离异构极为相似, 最熟悉 的例子是:
[Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2·H2O [Cr(H2O)4Cl2]Cl·2H2O 在配合物的内界,各含有6、5、4个配位水分子 和0、1、2个配位氯离子, 在配合物的外界各含有0、1 、2个溶剂合水分子和3、2、1个可电离的氯离子。这 些异构体在物理和化学性质上有显著的差异,如它们的 颜色分别为绿、蓝绿、蓝紫。
4p 4s
dsp2杂化
Ni(CN)24
八面体构型
对于F-,H2O等配体而言,配位原子F,O的电负性大, 不易给出孤对电子对,所以对中心体的3d轨道上的 电子不发生明显的影响,因此3d轨道上的电子排布 情况不发生改变 ,形成外轨型配合物。
对于CN-,CO等配位体而言,配位原子C的电负性小, 较易给出孤对电子对,对中心体的3d轨道发生重大 影响,从而使3d发生了电子重排,腾出能量较低的 内层(n-1)d轨道与ns,np轨道杂化,形成内轨型配合 物。
en
en
AACoe Nhomakorabea enCo
en
en
[Co(en)3])
A M
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第9章配位化合物
1.下列说法是否正确?对错误的说法给予纠正。
(1)配合物溶于水时往往容易离解成内界和外界,而内界的中心原子与配体之间却难离解。
这说明中心原子和配体之间的结合力大于内界和外界之间的结合力。
(2)不仅金属元素的原子可作为中心原子,非金属元素的原子也可作中心原子;不仅正氧化态原子可作中心原子,中性原子和负氧化态原子也可作中心原子。
(3)配合物中配体的数目称为配位数。
(4)配位化合物的中心原子的氧化态不可能等于零,更不可能为负值。
(5)羰基化合物中的配体CO是用氧原子与中心原子结合的,因为氧的电负性比碳大。
(6)Dq是相对的能量单位。
每Dq代表的能量数值,即使对同一构型配合物(如八面体)也随中心原子和配体的不同而不同。
(7)分裂能的大小与配体和中心原子的性质有关。
(8)凡Δ>P,总是形成低自旋配合物;凡Δ<P,总是形成高自旋配合物。
(9)内轨型配合物就是低自旋配合物,外轨型配合物就是高自旋配合物。
(10)配合物的价键理论和晶体场论都可解释配合物的稳定性、磁性和颜色。
(11)多齿配体与中心原子形成的配合物都是螯合物。
(12)配位数相同的配合物,K稳越大,则配合物越稳定。
2-的稳定性按F-→I-的顺序降低。
(13)HgX
4
(14)CuX2-的稳定性按Cl-→Br-→I-→CN-顺序增加。
答:
(1)错。
内界和外界之间是离子键,极性强,在极性溶剂中易离解;中心原子和配体之间是配位键,极性较弱,难离解。
离解难易主要与键型有关(严格说,与离解前后总能量变化有关),而不能说明结合力的大小。
(2)对。
(3)错。
配合物中配位体的数目不一定等于配位数;如:en,一个配体,配位数为2。
(4)错。
中心原子的氧化态可为零如Ni(CO)4;有的还可以是负如V(CO)6-。
(5)错。
羰基配合物中配位原子为C,在CO中C因氧原子的电子进入其空轨道反而呈,C原子更易提供电子对。
(6)对。
(7)对。
(8)错。
以八面体配合物为例,当中心原子d电子数为1-3时,不管△和P哪个大,这些电子总是在dε轨道,都是高自旋配合物;当中心原子d电子数为8-10时,这些电子也都只有一种排布方式。
(9)错。
两者含义不同。
内外轨型配合物是看内层d轨道有没有参加杂化,而高低自旋配合物是看形成配合物后中心原子d轨道自旋平行的单电子数有没有减少。
但对八面体配合物来说,当中心离子的d电子数为4~7时,这句话是正确的。
(10)错。
价键理论不能解释配合物的颜色。
(11)错。
多齿配体与多个中心原子配位不一定成环。
多齿配体与同一中心原子配位才是螯合物。
(12)错。
配位数相同并不意味着配位体数相同。
只有配位体数目相同的配合物才能说K稳越大,配合物越稳定。
(13)错。
依软硬酸碱理论,Hg2+是软酸,而碱的软度依F-→I-增强,Hg2+与
I-结合更稳定。
因此HgX4的稳定性按F-→I-的顺序增强。
(14)对。
2.预测下列各组配合物的稳定性,并说明理由。
(1) [Co(NH3)6]3+和[Co(NH3)6]2+(2)Al F 63-和Al Cl 63-
(3) [Cu(CN)4]3-和[Zn(CN)4]2-(4) [Ag(S2O3)2]3-与[Ag(NH3)2]+
(5) Pd(II)与RSH或ROH配合(6) [FeF6]3-与[Fe(CN)6]3-
(7) Ag+或Cu2+分别与NH3或H2N-CH2-CH2-NH2配合
答:(1) 稳定性[Co(NH3)6]3+>[Co(NH3)6]2+,因前者中心离子的正电荷高、离子半径小,对配体的引力大,形成低自旋配合物,而后者是高自旋配合物。
(2) 稳定性AlF63->AlCl63-,依照软硬酸碱理论,Al3+为硬酸,而碱的硬度F->Cl-,因而Al3+与F-结合更稳定。
(3) 稳定性[Cu(CN)4]3->[Zn(CN)4]2-,依照软硬酸碱理论,Cu+为软酸,Zn2+为交界酸,CN-为软碱,Cu+与CN-结合更稳定。
(4) 稳定性[Ag(S2O3)2]3->[Ag(NH3)2]+,依照软硬酸碱理论,Ag+为软酸,S2O32-为软碱,NH3为硬碱,Ag+与S2O32-结合更稳定。
(5)Pd(II)与RSH或ROH配合,前者稳定性高于后者。
依照软硬酸碱理论,Pd(II) 为软酸,与软碱的RSH结合更稳定。
(6) 稳定性[FeF6]3-<[Fe(CN)6]3-,因为CN-为强场配体,[Fe(CN)6]3-为低自旋配合物,[FeF6]3-为高自旋配合物。
(7) Cu2+分别与NH3或H2N-CH2-CH2-NH2配合时,后者的稳定性高于前者。
因为后者形成了五元螯合环,存在螯合效应,螯合物具有更高的稳定性;而当Ag+分别与NH3或H2N-CH2-CH2-NH2配合时,前者的稳定性高于后者。
因为当Ag+形成配合物时,采用sp杂化轨道与配体形成配位键,因此Ag+与H2N-CH2-CH2-NH2配合时,五元环中键角∠NAgN 存在很大的张力,不能形成稳定的五元螯合环。
故Ag+与NH3结合更稳定。
M2+
3. 计算下列反应的平衡常数,并判断反应进行的方向:
[HgCl4]2- + 4I- [HgI4]2- + 4Cl-,已知:K([HgCl4]2-) = 1.17⨯1015;K([HgI4]2-) = 6.76⨯1029
解:[HgCl4]2- + 4I- [HgI4]2- + 4Cl-
K=
= =5.78⨯1014
因为K很大,所以反应向右进行。
4.已知E(Ag+/Ag)=0.7996V,K(AgBr)=5.35⨯10-13。
E([Ag(S2O3)2]3-/Ag)= 0.017V,计算[Ag(S2O3)2]3-的稳定常数;若将0.10mol的AgBr固体完全溶解在1L的Na2S2O3溶液中,Na2S2O3的最小浓度应为多少?
解:Ag+ + e →Ag
[Ag(S2O3)2]3- + e →Ag + 2S2O32-
E(Ag+/Ag) = E([Ag(S2O3)2]3-/Ag)
所以:φ(Ag+/Ag)+0.0592 lg c(Ag+)=φ([Ag(S2O3)2]3-/Ag)+
0.0592 lg
即:0.7996–0.017 = 0.0592 lg K([Ag(S2O3)2]3-)
则:K([Ag(S2O3)2]3-) = 1.66 ⨯ 1013
AgBr + 2 S2O32- [Ag(S2O3)2]3- + Br-
K= = K(AgBr) ·K([Ag(S2O3)2]3-)
5.35⨯10-13⨯ 1.66 ⨯ 1013 = 8.88
=
设Na2S2O3的最小浓度应为x,则有:
解得:x = 0.234 mol·L-1
即Na2S2O3的最小浓度应为0.234 mol·L-1
5.为了测定难溶盐Ag2S的K sp,装有如下原电池:电池的正极是将银片插入0.10 mol·L-1 AgNO3溶液中,并将H2S气体不断通入AgNO3溶液中直至溶液中的H2S达到饱和;电池的负极是将锌片插入0.10 mol·L-1ZnSO4溶液中,并将氨气不断通入ZnSO4溶液中,直至游离氨的浓度达到0.10 mol·L-1为止,再用盐桥连接两种溶液,测得该电池的电动势为0.852 V,试求Ag2S的K sp。
(Ag+/Ag) = 0.7996 V,(Zn2+/Zn) = -0.7618 V,K a1(H2S) = 1.07 ⨯ 10-7,
K a2(H2S) = 1.26 ⨯ 10-13,[H2S] = 0.10 mol·L-1,K稳(Zn(NH3)) = 2.88 ⨯ 109
解:
2+/Zn) +lg[Zn2+]
Zn2+ + 4NH3 Zn(NH3)
平衡浓度/mol·dm-3x0.10 0.10 - x
= 2.88 ⨯ 109x = [Zn2+] = 3.47 ⨯ 10-7 mol·dm-3
2+] = -0.7618 + lg(3.47 ⨯ 10-7) = -0.953 (V) 负= -0.7618 + lg[Zn
+/Ag) + 0.0592 lg[Ag+]
正极=(Ag
E =正–负= 0.7996 + 0.0592 lg[Ag+] + 0.953 = 0.852 (V)
lg[Ag+] == -15.21
[Ag+] = 6.17 ⨯ 10-16 mol·dm-3
当2Ag+ + H2S Ag2S + 2H+反应完全时:[H+] ≈ 0.20 mol·dm-3
所以[S2-] == 3.38 ⨯ 10-20 mol·dm-3
K sp(Ag2S) = [Ag+]2·[S2-] = (6.17 ⨯ 10-16)2 (3.38 ⨯ 10-20) = 1.3 ⨯ 10-50。
