物理化学讲义.
物理化学讲义02 热力学第一定律

第二章 热力学第一定律一.基本要求1.掌握热力学的一些基本概念,如:各种系统、环境、热力学状态、系统性质、功、热、状态函数、可逆过程、过程和途径等。
2.能熟练运用热力学第一定律,掌握功与热的取号,会计算常见过程中的和的值。
3.了解为什么要定义焓,记住公式的适用条件。
4.掌握理想气体的热力学能和焓仅是温度的函数,能熟练地运用热力学第一定律计算理想气体在可逆或不可逆的等温、等压和绝热等过程中,的计算。
5.掌握等压热与等容热之间的关系,掌握使用标准摩尔生成焓和标准摩尔燃烧焓计算化学反应的摩尔焓变,掌握与之间的关系。
6.了解Hess定律的含义和应用,学会用Kirchhoff定律计算不同温度下的反应摩尔焓变。
二.把握学习要点的建议学好热力学第一定律是学好化学热力学的基础。
热力学第一定律解决了在恒定组成的封闭系统中,能量守恒与转换的问题,所以一开始就要掌握热力学的一些基本概念。
这不是一蹴而就的事,要通过听老师讲解、看例题、做选择题和做习题等反反复复地加深印象,才能建立热力学的概念,并能准确运用这些概念。
例如,功和热,它们都是系统与环境之间被传递的能量,要强调“传递”这个概念,还要强调是系统与环境之间发生的传递过程。
功和热的计算一定要与变化的过程联系在一起。
譬如,什么叫雨?雨就是从天而降的水,水在天上称为云,降到地上称为雨水,水只有在从天上降落到地面的过程中才被称为雨,也就是说,“雨”是一个与过程联系的名词。
在自然界中,还可以列举出其他与过程有关的名词,如风、瀑布等。
功和热都只是能量的一种形式,但是,它们一定要与传递的过程相联系。
在系统与环境之间因温度不同而被传递的能量称为热,除热以外,其余在系统与环境之间被传递的能量称为功。
传递过程必须发生在系统与环境之间,系统内部传递的能量既不能称为功,也不能称为热,仅仅是热力学能从一种形式变为另一种形式。
同样,在环境内部传递的能量,也是不能称为功(或热)的。
例如在不考虑非膨胀功的前提下,在一个绝热、刚性容器中发生化学反应、燃烧甚至爆炸等剧烈变化,由于与环境之间没有热的交换,也没有功的交换,所以。
03-物理化学课程讲义-第三章1

B
TdS pdV B dnB
B
dH TdS V dp B dnB
B
TdS Vdp B dnB
B
dG S dT V dp B dnB
B
SdT Vdp B dnB
B
dA S dT p V B dnB
B
SdT pdV B dnB
例如:体系只有两个组分,其物质的量和偏摩尔 体积分别为 n1,V1 和 n2 ,V2 ,则体系的总体积为:
V n1V1 n2V2
偏摩尔量的集合公式
写成一般式有:U nBUB
B
H nB HB B
A nB AB
B
S nBSB B
G nBGB B
U U B ( nB )T , p,nc (cB)
物理化学课程讲义
—— 第三章 多组分系统热力学
引言
多组分系统 两种或两种以上的物质(或称为组分)所形
成的系统称为多组分系统。 多组分系统可以是均相的,也可以是多相的。
混合物(mixture) 多组分均匀系统中,各组分均可选用相同的方 法处理,有相同的标准态,遵守相同的经验定律, 这种系统称为混合物。
则
dZ Z1dn1 Z2dn2 Zkdnk
k
= ZBdnB B=1
在保持偏摩尔量不变的情况下,对上式积分
Z Z1
n1 0
dn1
Z2
n2 0
dn2
Zk
nk 0
dnk
n1Z1 n2 Z2 nk Zk
偏摩尔量的集合公式
k
Z= nB ZB
B=1
这就是偏摩尔量的集合公式,说明体系的总的容 量性质等于各组分偏摩尔量的加和。
组分体系
物理化学实验讲义

物理化学实验讲义物理化学实验讲义实验六过氧化氢的催化分解一、实验目的1、测定一级反响速率常数k,验证反响速率常数k与反响物浓度无关。
2、通过改变催化剂浓度试验,得出反响速率常数k与催化剂浓度有关。
二、实验原理H2O2在常温的条件下缓慢分解,在有催化剂的条件下,分解速率明显加快,其反响的方程式为: H2O2= H2O+1/2O2在有催化剂〔如KI〕的条件下,其反响机理为:H2O2+KI→KIO+ H2O 〔1〕 KIO→KI + O2 〔2〕其中〔1〕的反响速度比〔2〕的反响速度慢,所以H2O2催化分解反响的速度主要由〔1〕决定,如果假设该反响为一级反响,其反响速度式如下:?dcH2O2/dt?k'cKIcH2O2 〔3〕在反响的过程中,由于KI不断再生,故其浓度不变,与k'合并仍为常数,令其等于k上式可简化为:?dcH2O2/dt?kcH2O2 〔4〕积分后为: ln(ct/c0)??kt 〔5〕c0--- H2O2的初始浓度ct----反响到t时刻的H2O2浓度k---- KI作用下, H2O2催化分解反响速率常数反响速率的大小可用k来表示,也可用半衰期t1/2来表示。
半衰期表示反响物浓度减少一半时所需的时间,即c?c0/2代入〔5〕式得:t1/2=(ln2)/k关于t时刻的H2O2浓度的求法有许多种,本实验采用的是通过测量反响所生成的氧的体积量来表示,因为在分解的过程中,在一定时间内,所产生的氧的体积与已分解的H2O2浓度成正比,其比例常数是一定值即1H2O2?H2O?O22 - 1 -物理化学实验讲义t?0 c0 0 0t?t ct?c0?x x ct?K(V??Vt) c0?KV?1x 2V?—H2O2全局部解所产生的氧气的体积Vt----反响到t时刻时,所产生的氧气的体积x—反响到t时刻时,H2O2已分解的浓度式中K为比例常数,将此式代入速率方程式中,可得到:ln(ct/c0)?ln(V??Vt)/V???kt 即:ln(V??Vt)??kt?lnV?如果以t为横坐标,以ln(V??Vt)为纵坐标,假设得到一直线,即可验证H2O2催化分解反响为一级反响,由直线的斜率即可求出速率常数k值。
物理化学第一章讲义

第一章气体的pVT 关系§1.1 理想气体状态方程§1.2 理想气体混合物§1.3 真实气体的液化及临界参数§1.4 真实气体状态方程§1.5 对应状态原理及普遍化压缩因子图教学重点及难点教学重点1.理解理想气体模型、摩尔气体常数,掌握理想气体状态方程。
2.理解混合物的组成、理想气体状态方程对理想气体混合物的应用,掌握理想气体的分压定律和分体积定律。
3.了解气体的临界状态和气体的液化,理解液体的饱和蒸汽压。
4.了解真实气体的pV m - p图、范德华方程以及压缩因子和对应状态原理。
教学难点:1.理想气体的分压定律和分体积定律。
前言宏观的物质可分成三种不同的聚集状态:气态:气体则最为简单,最易用分子模型进行研究。
液态:液体的结构最复杂,对其认识还很不充分。
固态:结构较复杂,但粒子排布的规律性较强,对其研究已有了较大的进展。
当物质的量n确定后,其pVT 性质不可能同时独立取值,即三者之间存在着下式所示的函数关系:f(p,V, T)= 0也可表示为包含n在内的四变量函数式,即f(p,V,T,n)= 0这种函数关系称作状态方程。
§1-1 理想气体的状态方程1.理想气体状态方程(1)气体的基本实验定律:波义尔定律:PV = 常数(n,T 恒定)盖·吕萨克定律:V/T = 常数(n,p恒定)阿伏加德罗定律:V/n=常数(T,p恒定)( 2 ) 理想气体状态方程上述三经验定律相结合,可整理得理想气体状态方程:pV=nRT(p: Pa(帕斯卡)V: m3(米3) T:K(开尔文)R(摩尔气体常数): J·mol-1·K-1(焦·摩尔-1·开-1))因为摩尔体积V m = V/n,气体的物质的量n=m /M理想气体状态方程又常采用下列两种形式:p V m=RT、pV=(m/M)RT2.理想气体模型(1)分子间力:分为相互吸引和相互排斥,按照兰纳德一琼斯的理论:E=E吸引+E排斥=-A r6+B r12由图可知:[1]当两个分子相距较远时,它们之间几乎没有相互作用。
湖南大学精编物理化学讲义课后答案

湖南大学精编物理化学讲义课后答案1、11.小明正在家里练习弹吉他,下列有关吉他的说法正确的是()[单选题] *A.吉他发出的声音一定不是噪声B.吉他发出的声音是吉他弦振动产生的(正确答案)C.弹吉他时,用力越大,发出声音的音调越高D.弹吉他时,手按压吉他弦不同位置是为了改变响度2、41.下列物态变化现象中,说法正确的是()[单选题] *A.夏天从冰箱取出的冰棍周围冒“白气”,这是空气中水蒸气的凝华现象B.市场上售卖“冒烟”的冰激凌,是由于其中的液氮汽化吸热致使水蒸气液化形成(正确答案)C.在饮料中加冰块比加冰水的冰镇效果更好,是因为冰块液化成水的过程中吸热D.手部消毒可以用酒精喷在手上,感到凉爽是因为酒精升华吸热3、4.电火花计时器接学生电源直流输出端.[判断题] *对错(正确答案)4、关于物质的密度,下列说法正确的是()[单选题] *A. 一罐氧气用掉部分后,罐内氧气的质量变小,密度不变B. 一只气球受热膨胀后,球内气体的质量不变,密度变大C. 一支粉笔用掉部分后,它的体积变小,密度变小D. 一块冰熔化成水后,它的体积变小,密度变大(正确答案)5、34.关于物质的密度,下列说法正确的是()[单选题] *A.铜的密度是9×103kg/m3,表示lm3铜的质量为9×103kg(正确答案)B.一罐氧气用掉部分后,罐内氧气的质量变小密度不变C.一块砖切成体积相等的两块后,砖的密度变为原来的一半D.密度不同的两个实心物体,其质量一定不同6、仅受地磁场作用,可自由转动的小磁针静止时,N极指向地理北极附近[判断题] *对(正确答案)错答案解析:受地磁场作用,小磁针N极指北方,S极指南方7、50.下列现象中与电视机的荧光屏表面常沾有许多灰尘的物理道理相同的是()[单选题] *A.塑料梳子梳头发,头发变得蓬松B.冬天脱毛衣时产生电火花C.塑料泡沫容易吸在化纤衣服上(正确答案)D.油罐车后拖有长长的铁链8、继共享单车之后,共享汽车已经悄然走进我们的生活。
物理化学讲义演示教案

物理化学讲义演示教案一、教学内容本节课选用教材《物理化学》第四章“溶液”节选,详细内容包括溶液的定义、类型及制备方法,溶解度和溶度积的概念,溶液的稀释定律,以及离子积的概念和应用。
二、教学目标1. 学生能理解溶液的基本概念,掌握溶液的制备方法。
2. 学生能够理解溶解度和溶度积的概念,并能运用其解决实际问题。
3. 学生能掌握溶液的稀释定律,并能在实际操作中正确应用。
三、教学难点与重点1. 教学难点:溶解度、溶度积、离子积的概念及其应用。
2. 教学重点:溶液的制备方法,溶液的稀释定律。
四、教具与学具准备1. 教具:多媒体教学设备,黑板,粉笔。
2. 学具:教材《物理化学》,实验器材(烧杯、量筒、滴定管等),笔记本。
五、教学过程1. 实践情景引入:以日常生活中的饮料为例,引导学生思考溶液的概念和特点。
2. 理论讲解:讲解溶液的定义、类型及制备方法,溶解度和溶度积的概念,溶液的稀释定律,以及离子积的概念和应用。
3. 例题讲解:运用实际案例,讲解溶解度和溶度积在实际问题中的应用。
4. 随堂练习:学生自主完成教材中的练习题,教师进行点评和解答。
5. 实验操作:学生分组进行实验,操作制备溶液,观察溶液的性质。
六、板书设计板书设计如下:溶液定义:均匀混合物类型:均相溶液、非均相溶液制备方法:混合、溶解、蒸馏等溶解度概念:在一定温度下,固体溶质在溶剂中达到动态平衡时的最大溶解量应用:溶解度曲线、溶解度积溶度积概念:在一定温度下,溶液中固体溶质溶解度的乘积应用:溶度积常数、沉淀溶解平衡溶液的稀释定律内容:溶液的浓度与体积成反比应用:溶液的稀释计算离子积概念:溶液中离子浓度的乘积应用:离子积常数、酸碱滴定七、作业设计1. 完成教材中的练习题。
2. 运用溶解度和溶度积的知识,分析实际问题,如:如何配制一定浓度的溶液?八、课后反思及拓展延伸1. 课后反思:本节课的教学效果如何?学生对溶液的概念和制备方法的理解程度如何?2. 拓展延伸:引导学生思考溶液在生活中的应用,如:溶液的稀释在医疗上的重要性。
物理化学讲义

第一章 热力学第一定律基 本 要 求1.理解体系与环境、状态与状态函数等基本概念。
了解可逆过程的概念。
2.理解功、热、热力学能、焓、热容、摩尔相变焓、标准摩尔生成焓、标准摩尔燃烧焓、反应焓变等概念。
掌握相变过程、化学变化过程热效应的计算。
内 容 提 要一.热力学第一定律封闭系第一定律: ∆U = Q+W或: W Q dU δδ+= (1-1)U :热力学能,即体系内质点各能量之和,包括分子的动能、势能和分子内部能量。
热力学能是状态函数(广延性质)。
对于物质的量、组成一定的均相系,热力学能是任意两个独立状态参量的函数,如: U=f (T 、V) 或U=f (T 、P)Q :热。
规定系统吸热为正,放热为负。
W :功。
规定环境对系统做功为正,系统对环境做功为负。
二.体积功体积功的计算: dV P W V V ⎰-=21环 (1-2) 1.气体向真空膨胀(自由膨胀)过程: ∵P 外=0,∴W=0 (1-3)2.恒外压过程: )(12V V P W --=环 (1-4)3.理想气体等温可逆过程: 1221V V nRTLn dV P W V V -=-=⎰ (1-5) 4.相变过程: 等压相变过程:)(12V V P W --=环液体或固体的汽化过程:例如 W= —P(V g —V L )≈—PV g = — n RT (1-6)5.化学变化过程:压力一定:W= —RT[∑νB (g)产物-∑νB (g)反应物]= —RT ΔνB (g) (1-7) :)(g B ν 气态物质B 的化学计量系数。
三.热力学可逆过程某过程发生之后,系统恢复原状的同时环境也复原,而没有留下任何变化,该过程称为热力学可逆过程。
可逆过程特征:(1)在可逆变化过程中,体系始终处于接近平衡的状态。
(2)在恒温可逆过程中,系统对环境做最大功,环境对系统做最小功。
四.焓(H )与焓变1.焓的定义: H = U + PV (1-8)焓变:∆H =∆U + ∆ (PV) (1-9)2. 等容热 (Q V ) :等容、非体积功W ’为零时,系统与环境交换的热为等容热。
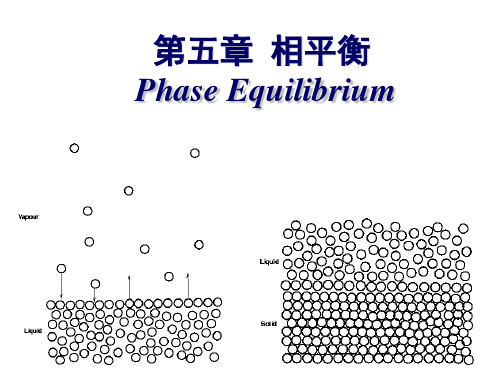
物理化学-相平衡讲义1
则平衡时mol(PCl3)/mol(Cl2)=1:1,这时就存在一浓度限制条件.
例4:
问CaCO3分解成CaO和CO2 之组分数?
CaCO3(s) CaO(s) CO2(g)
S = 3, R = 1, R’= 0 K=3–1–0=2
CaCO3的分解, 虽mol(CaO)/mol(CO2)=1:1, 但是由于一 个是固相一个是气相,浓度限制条件不成立,K= 2 1.
在水溶液中不稳定又不易结晶时,快速冷冻其水溶液以结冰,同时将 系统压力降至冰的饱和蒸气压之下,进行升华操作除去溶剂水后封口, 从而得到可长时间储存的粉针剂。重要参数:三相点压力
CO2的相图:与水的相图有何不同?
超临界流体区:
对有机物溶解能力强、 选择性好,接近室温。
“干冰”
194.65K
大气压力
应用:超临界萃取
问:反应平衡时,K = ? 问:若反应前只有HI (g) ,K = ?
K = S – R – R’ 独立的化学平衡&浓度限制条件
K = S – R – R'
R —— 独立的化学平衡数
R’—— 独立的浓度限制条件
例1:氯化钠盐水 (不考虑电离平衡)
S=2
K = 2-0-0 = 2
例2:PCl5, PCl3, Cl2三种物质组成系统, 存在化学平衡:
解:系统的K=2,增加含水盐不增加K,因为S增加1,R也
同时增加1.
(1)指定压力下: f* = K - + 1 = 2 - + 1 = 3 - 含水盐最多时,f=0, =3,其中一相是水溶液,一相是
冰,因此最多只有一种含水盐.
(2)指定温度下: f*=3- f=0, =3,一个相是水蒸气,最多可有两种含水盐.
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
化学动力学
上一内容
下一内容
回主目录
返回
2019/3/20
化学动力学的任务和目的 对任何反应:
eE fF gG hH
化学动力学
化学热力学
U, H, S, A, G, W,Q,Kθ
化学反应速v=f(c,t,T) 反应机理
局限性:研究化学变化的方向、能达到的最大限度以及外界条件对平衡的影 响。化学热力学只能预测反应的可能性,但无法预料反应能否发生?反应的 $ 1 1 3 G / kJ mol 速率如何?反应的机理如何? N 2 H 2 NH 3 (g) θr m θ
单位:mol.s-1
上一内容
下一内容
回主目录
返回
2019/3/20
反应速率 单位体积的转化速率------反应速率
1d d r v= — V dd tt
V
1 1 dn d dn B B ( ) d t Bdd tt
B
1 dcB 1 dnB / V B dt B dt
基元反应: 就完成的反应。基元反应是组成一切化学反应的基本
单元。
上一内容 下一内容 回主目录
返回
2019/3/20
2.化学反应的速率方程 经历若干个基元反应才能完成的反应称为非基元反应
物理化学电子教案—第十一章
积分法 微分法 半衰期法 孤立法
一级反应 对峙反应
上一内容 下一内容
平行反应
连续反应 链反应
返回
2019/3/20
回主目录
化学动力学的任务和目的 研究任一化学反应有两个基本问题需要考虑:
(1)有无可能性,其最后结果如何?
…………化学反应的方向和限度问题
化学热力学
(2)若能进行,多长时间能实现?微观上如何进行? .……..….化学反应的速率和机理问题
.mol-1 2 2 △ G (298K)/kJ K m 16.63 r 1 3 N 2 1 H 2 NH 3 (g) 41 H O H 2 O(l) 2 2 2 2 3.78 × 10 237.19 2 1 -5.39 8.8 2NO (g) N O4(g) H H O(l) 2 2 O 2 22 2 下一内容 回主目录
1956 Semenoff
Hinslelwood 苏联 美国
因在链反应方面的卓越贡
献而获得Nobel化学奖
二十世纪五十年代以后,快速反应的研究,建立了分子反应动态 第三阶段: 学,即用分子束方法研究化学反应,从分子反应层次的一次具体
碰撞行为来观察化学过程的动态行为。
1986年,美籍华人李远哲教授因在此方面的卓越贡献而获Nobel化学奖
返回
1 dPR
1 dPP
上一内容
下一内容
回主目录
2.化学反应的速率方程 1).化学反应速率方程
反应速率与浓度等参数或浓度与时间等参数的关系式称为 化学反应的速率方程 v∝c,t…….. c∝f(t)…….. 微分方程 积分方程
不同类型的反应,其速率方程不同
2).基元反应和非基元反应
反应物分子在碰撞中直接转化为产物分子即一次碰撞
上一内容 下一内容 回主目录
返回
2019/3/20
11.1化学反应的反应速率及速率方程
1. 反应速率的定义
任一反应的化学计量式
0 B B
B
a.反应步骤中存在中间物,随反应进行,C中间物 ,然后积累,将不
符合总的计量式--------依时计量学反应
b.反应步骤中不存在中间物,或C中间物≈0,可以忽略,符合一定
若a≠z,则同一反应,vA ≠vZ,同一反应用不同组分
体积一定 体积一定
若用反应物表示
若用产物表示
存在问题
表示时,v值不同。
上一内容 下一内容 回主目录
返回
反应进度 : 1. 反应速率的定义
2).用反应进度来表示
0 B B
B
=
微分形式:
nB(t) - nB(0)
B
=
△n B
下一内容
回主目录
返回
化学动力学的发展简史
开始研究反应速率至今约有二百年历史,但作为一门独立的学科 发展不到一百年,主要分为三个阶段: 第一阶段:十九世纪后半叶到二十世纪初,经典动力学阶段,确定了质量作
用定律,提出了Arrhenius方程(对反应速率理论的发展有决定性意义)
第二阶段:二十世纪初至四十年代前后,发现链反应,提出反应速率理论。
上一内容
返回
2019/3/20
化学动力学的任务和目的
(1)研究化学反应速率,研究c,p,T,催化剂等对v的影响 (2)研究反应实际进行时,要经历哪些步骤(反应机理) (3)如何控制反应条件,提高主反应速率,减少副反 应速率,提高产率
任 务 目 的
(4)提出最适宜的操作条件,得到预期产品
上一内容
的计量关系--------非依时计量学反应
上一内容
下一内容
回主目录
返回
1. 反应速率的定义
1).惯用表示法
单位时间、单位体积反应器中,反应物消耗或产物生成的物质的量
aA+bB=yY+zZ vA= -(1/V)(dnA/dt) ===== -(dcA/dt) vZ= (1/V)(dnZ/dt) ===== (dcZ/dt)
B
d
dnB
B
同一反应用任一反应物或生成物来表示反应进行的程度,所得 的值都是相同的;的大小与化学反应的写法有关
上一内容 下一内容 回主目录
返回
2019/3/20
转化速率 ---转化速率
d 1 dnB dt B dt
或mol.L-3.s-1 2.气相反应,可用分压代替浓度表示速率
例如气相反应:
R P
1 dcR
或
dcP 1 — vc=- — = — — dt RR P dP t vP=- — — = — —
可证明:
vp=RTvc
R dP d t t R P
对任何反应: eE fF gG hH
1 d[E] 1 d[F] 1 d[G] 1 d[H] r v e dt f dt g dt h dt
上一内容 下一内容 回主目录
返回
2019/3/20
反应速率
说明
1.速率的单位:[浓度.时间-1],即mol.m-3.s-1
