重组蛋白IFNGA在大肠杆菌中的表达与纯化
重组蛋白的高效表达与纯化工艺研究

重组蛋白的高效表达与纯化工艺研究重组蛋白是指利用基因工程技术将目标蛋白基因表达在外源宿主细胞中,通过特定的工艺流程制备出来的蛋白质。
由于其纯度较高,无传染性等特点,已被广泛应用于药物、生化分析、诊断试剂以及生物制品等领域。
而蛋白高效表达与纯化工艺则是重组蛋白的制备过程中重要的环节,决定了最终的产量和纯度,因此受到广泛关注。
一、重组蛋白表达系统目前常用的表达系统主要有哺乳动物细胞系统、细菌表达系统、酵母表达系统和昆虫细胞表达系统。
这些系统各自有其优缺点,选择合适的系统取决于蛋白质的性质以及应用场景。
一般来说,哺乳动物细胞系统表达的蛋白相对较为复杂,需要进行多种后续处理,但产生的蛋白具有较好的生物活性和免疫原性,适用于药物等要求严格的领域。
而细菌表达系统则具有表达量高、快速、简便的优点,但其表达的蛋白在折叠和修饰方面有局限性,一些复杂的蛋白可能需要在其他表达系统中获得更好的表达。
因此,在实际应用中需要根据实际需要和性质选用最合适的表达系统。
二、重组蛋白纯化工艺重组蛋白的纯化过程决定了最终产物的纯度和质量,而不同的表达系统生成的蛋白具有不同的特点,需要针对性地制定纯化工艺。
纯化工艺的主要步骤包括:细胞破碎、初步筛选、中间层析和后续纯化。
其中,中间层析是纯化工艺的重点,需要针对不同蛋白的特性选择不同的层析介质。
常用的层析介质包括亲和柱、离子交换柱、逆流层析柱、尺寸排阻柱等,这些介质可以根据蛋白特性进行组合,以达到最好的分离和纯化效果。
此外,采用特定的添加剂和离心操作可以进一步增加纯化效率。
三、重组蛋白高效表达与纯化技术的研究进展近年来,为提高重组蛋白的表达效率和纯化效率,不断涌现出一些新的技术手段和方法。
其中,一些常用的技术如下:1、融合表达技术:融合表达是指将目标基因与一个易于表达的载体基因融合,通过转录和翻译的过程共同表达,从而提高目标蛋白的表达效率。
常用的融合载体包括GST、His、MBP等。
这些载体向目标蛋白的N端或C端融合,可以提高目标蛋白的稳定性、纯度和溶解度。
CGGBP1蛋白在大肠杆菌中的表达及其纯化

CGGBP1蛋白在大肠杆菌中的表达及其纯化【关键词】 CGGBP1;基因表达;纯化0引言脆性X综合征(fragile X syndrome, FXS)是一种最多见的遗传性智力发育不全综合征,有超过99%的FXS是由脆性X智障基因1(fragile X mental retardation, FMR1)中5′端非编码区CGG三核苷酸重复序列不稳固扩增及其CpG岛异样甲基化致使. FMR1基因的表达产物FMRP的缺乏致使FXS的发生[1-2]. 本实验对编码基因存在于3号染色体[3],能与FMR1 基因5′ d (CGG)n3′重复序列特异性结合的蛋白CGGBP1进行原核表达,并对其DNA结合活性进行研究.1材料和方式材料大肠杆菌DH5α, BL21( DE3)和表达载体pRSET A均为本实验室保留. 质粒提取试剂盒购自Sigma公司;限制性内切酶BamH I 和KpnI购自宝生物工程公司;T4 DNA连接酶购自Promega公司; Ni2+NTA金属螯合蛋白质纯化系统购自Qiagen公司;链酶亲和素磁珠购自Dynal公司;低分子质量蛋白标准购自上海西巴斯生物技术.方式表达载体的构建依照CGGBP1基因起始密码子和终止子临近序列设计PCR引物:CGGBP1F CGC GGA TCC GAG CGA TTG TAG TAA CAG CA,CGGBP1R GGG GTA CCT CAA CAA TCT TGT GAG TTG AG. 其上游及下游引物别离加入BamHI和KpnI酶切识别位点序列(引物序列下划线部份). PCR反映以人淋巴细胞cDNA文库为模板,扩增编码CGGBP1的基因序列. 设计PCR 扩增体系25 μL,灭菌去离子水10 μL,10×反映缓冲液μL,25 mmol/L MgCl2 μL,DMSO μL,4× dNTP混合物(每种 mmol/L)2 μL,CGGBP1F和CGGBP1R各10 pmol,模板μL(50 ng/μL), Taq DNA (5 μ/μL)聚合酶μL. 扩增条件:95℃预变性5 min,再94℃ 30 s, 53℃ 1 min,72℃ 1 min循环40次,最后72℃终末延伸产物10 min. PCR产物经琼脂糖电泳分离,用胶回试剂盒回收目的基因. 用BamHI和KpnI酶切PCR产物和pRSET A,酶切产物电泳后回收,在T4连接酶作用下,目的片段定向克隆至pRSET A的BamHI和KpnI克隆位点. 将重组质粒转入大肠杆菌DH5α,接种到含氨苄青霉素的LB培育基平板并挑取单菌落.融合蛋白的诱导表达将测序正确的重组质粒转入BL21( DE3). 挑取携带目标质粒的单菌落接种于含100 mg/L氨苄青霉素的LB培育基中, 37℃振荡培育12 h,按10 mL/L比例转接于新鲜培育基,37℃振荡培育至对数生长期时,加入IPTG至终浓度1 mmol/L,32℃诱导振荡培育4 h,离心搜集菌体,SDS PAGE分析重组蛋白的表达.蛋白表达形式的分析取5 mL菌液离心,用500 μL的裂解液(10 mmol/L 咪唑,300 mmol/L NaCl及50 mmol/L磷酸二氢钠 pH )重悬,加溶菌酶至终浓度为1 mg/mL,冰浴30 min,超声波裂菌,离心后别离将上清和沉淀进行SDS PAGE分析.融合蛋白的纯化将1 mL 500 mL/L Ni2+NTA悬液和4 mL细菌裂解上清液轻轻混匀4℃放置60 min,直接过柱. 过柱终止后,用4 mL漂洗液(20 mmol/L 咪唑,300 mmol/L NaCl及50 mmol/L 磷酸二氢钠 pH ),洗脱未和Ni珠结合的杂蛋白. 通过2次漂洗后再用 mL洗脱液(250mmol/L 咪唑,300 mmol/L NaCl及50 mmol/L 磷酸二氢钠 pH 3次洗脱特异结合的目的蛋白,分步搜集. 取搜集液,进行SDS PAGE 分析.与(CGG)29重复序列双链DNA结合实验取10 μL磁珠用1 mL的无RNA酶的三蒸水清洗磁珠2次,除去防腐剂. 1×生物素亲和素结合缓冲液(10 mmol/L Tris HCl,2 mol/L NaCl,1 mmol/L EDTA,1 g/L Tween 20)15 μL重悬磁珠,各5 μL分3组实验. 其中一组加入25 μL(100 ng/μL)生物素化的(CGG)29重复序列双链DNA,另外两组别离加入25 μL(100 ng/μL)非生物素化的(CGG)29重复序列双链DNA和25 μL三蒸水做对照;三组别离再加入2×生物素亲和素结合缓冲液30 μL,25℃轻摇1 h. 经磁力吸附后,弃上清. 重复上述步骤3次;加入纯化后CGGBP1(500 μg/mL)15 μL 和2×核酸蛋白结合缓冲液(20 mmol/L HEPES,100 mmol/L NaCl, mmol/L DTT,100 g/L甘油)20 μL,室温下静置30 min;经磁力吸附后,弃上清;用1×核酸蛋白结合缓冲液清洗磁珠2次;加三蒸水10 μL,滚水煮10 min,进行SDS PAGE 分析.2结果原核表达载体的构建及鉴定扩增产物在15 g/L的琼脂糖凝胶电泳,可观看到一条约504 bp的条带(图1);重组质粒pRSET A/CGGBP1及质粒pRSET A别离用BamHI和KpnI酶切,pRSET A/CGGBP1分为两个片段,别离为 ku和504 bp(图2),均与估量结果相同. 的表达用BamHI和KpnI双酶切pRSET A/CGGBP1表达质粒,挑选阳性重组质粒. 携带有pRSET A/CGGBP1质粒的 BL21(DE3)菌株,经IPTG 诱导后,在Mr 约25 000处显现1条表达条带;而未经IPTG诱导的菌体那么无此条带. 诱导后的菌体经溶菌酶及超声波裂解,离心后分为上清和沉淀两部份. 经SDS PAGE分析说明,CGGBP1部份存在于细菌裂解液的上清中,为可溶性蛋白,上清液中的目标蛋白相对较少(图3).蛋白纯化在表达质粒pRSET A多克隆酶切位点的上游,插入有持续6个组氨酸的序列—(His )6 tag. 重组质粒经诱导表达后,(His )6 tag 能够和外源插入片段一起表达. 利用(His )6 tag 和金属Ni2+的螯合所设计的固定化金属配体亲和柱层析方式,是纯化目的蛋白的一种高效而简单的方式. SDS PAGE显示,CGGBP1取得较高程度的纯化(图4).与5′d(CGG)293′重复序列双链DNA结合实验生物素化的5′d(CGG)29 3′重复序列双链DNA被固定到链酶亲和素磁珠上,非生物素化的5′d(CGG)293′重复序列双链DNA因无法固定到链酶亲和素磁珠上而被洗脱掉. 同理,加入CGGBP1后,未和5′ d (CGG)293′重复序列双链DNA 结合的蛋白也被洗脱(图5).3讨论关于微卫星的产生机制,普遍以为是DNA复制进程中DNA聚合酶的滑动[4],或DNA复制和修复时滑动链与互补链碱基错配,致使一个或几个重复单位的插入或缺失. 已发觉微卫星可能是一种超级活跃的碱基序列,通常各类简单的重复序列成簇地聚集在一个染色体区域,那个染色体区形成特异染色体结构的能力将会增强. 这些区域在核糖体RNA基因中超级复杂,同时这些重复序列所折叠形成的结构还能与特异的蛋白质相结合,成为“染色质折叠密码”[5-6],参与遗传物质的结构改变,基因调控及细胞分化等进程. 脆性X综合征是Igarashi等[7]研究报导的与三核苷酸重复片段扩增突变有关的7种神经变性疾病其中的一种. 该蛋白只和(CGG)n重复序列发生特异性结合,而与其它类型的三核苷酸重复序列不结合[8]. 因此,对该蛋白功能的研究具有重要的理论研究意义.本实验成功地构建了含CGGBP1的重组质粒,以可溶性蛋白形式取得较高表达. 通过Ni2+NTA柱纯化,取得纯化的目标融合蛋白质,同时证明了该蛋白能和人FMR1基因5′d (CGG)293′重复序列双链DNA特异性结合. 这将为进一步开展真核生物蛋白CGGBP1功能的研究和阐释CGG三核苷酸动态突变的致病机理奠定基础.【参考文献】[1]Wells RD, Warren ST. Genetic Instabilities and Hereditary Neurological Disorders [M]. Academic Press, San Diego,1998:46-96.[2]Cleary JD, Nichol K, Wang YH, et al. Evidence of cis acting factors in replication mediated trinucleotide repeat instability in primate cells[J]. Nat Genet, 2002, 31(1):37-46.[3]Deissler H, Wilm M, Genc B, et al. Rapid protein sequencing by tandem mass spectrometry and cDNA cloning of CGGBP1[J].Biol Chem, 1997,272(27):.[4]Sinden RR, Potaman VN, Oussatcheva EA, et al. Triplet repeat DNA structures and human genetic disease: Dynamic mutations from dynamic DNA [J]. Bioscience, 2002,27(1 Suppl 1):53-65.[5]Wahls WP. Meiotic recombination hot spots: Shapping the genome and insight into hypervariable minisatellite DNA change[J].Curr Top Dev Bio1, 1998,37:37-75.[6]Wahls WP, Moore PD. Recombination hotspot activity of hypervariable minisatellite DNA requires minisatellite DNA binding proteins[J].Somat Cell Mol Genet, 1998,24(1):41-51.[7]Igarashi S, Tsuji S. The molecular mechanisms of the instability of the CAG repeat[J]. Nippon Rinsho,1998,56(4):1064-1073.[8]Deissler H, Behn Krappa A, Doerfler W. Purification of nuclear proteins from human HeLa cells that bind specifically to the unstable tandem repeat (CGG)n in the human FMR1 gene[J]. Biol Chem, 1996,271(8):4327-4334.。
重组蛋白质的表达与纯化如何利用细胞工程技术生产高纯度的重组蛋白质

重组蛋白质的表达与纯化如何利用细胞工程技术生产高纯度的重组蛋白质高纯度的重组蛋白质在药物研发和生物工艺领域具有广泛应用。
细胞工程技术是一种常用的方法,用于在大规模生产中表达和纯化重组蛋白质。
本文将探讨细胞工程技术在重组蛋白质表达与纯化中的应用,以及实现高纯度蛋白质的方法和挑战。
一、重组蛋白质表达系统的选择细胞工程技术可以利用原核细胞或真核细胞来表达重组蛋白质。
选择合适的表达系统是确保高效表达目标蛋白质的关键。
原核表达系统如大肠杆菌表达系统具有许多优点,包括易操作、高表达水平和低成本。
然而,一些复杂的蛋白质,如多肽类和糖蛋白,可能需要使用真核表达系统,如哺乳动物细胞系统。
二、蛋白质表达优化为了实现高效表达目标蛋白质,一些优化技术可以被应用。
首先,合适的宿主细胞株应被选用,它应该具有高度的遗传稳定性和较低的自由蛋白质含量。
其次,基因的调控序列,如启动子和终止子,应被优化,以提高目标蛋白质的表达水平。
此外,引入外源的转录因子和促进蛋白分泌的信号肽序列,也可以改善蛋白质的表达。
最后,温度、培养基成分和培养时间也可以对蛋白质表达产量进行调控。
三、蛋白质纯化策略蛋白质纯化是实现高纯度重组蛋白质的关键步骤。
常见的蛋白质纯化策略包括亲和纯化、离子交换层析、凝胶过滤层析、逆流层析等。
亲和纯化是其中一种最常用的纯化方法,可以利用蛋白质与其特异性配体的结合来实现。
离子交换层析则通过样品与载体电荷之间的相互作用实现纯化。
凝胶过滤层析可以根据蛋白质的分子大小来纯化,而逆流层析则可以根据蛋白质的亲水性进行纯化。
四、纯化过程的优化为了确保高纯度的重组蛋白质产物,纯化过程应该被精细优化。
这包括优化各个纯化步骤的条件和参数,如洗脱剂的浓度和组成、各个步骤的pH值和温度等。
此外,每个步骤之间的连接也需要被仔细考虑,以防止目标蛋白质的丢失或污染。
五、纯化过程的监测和分析在纯化过程中,监测和分析方法被广泛应用来评估目标蛋白质的纯度和活性。
大肠杆菌系统表达和纯化流程
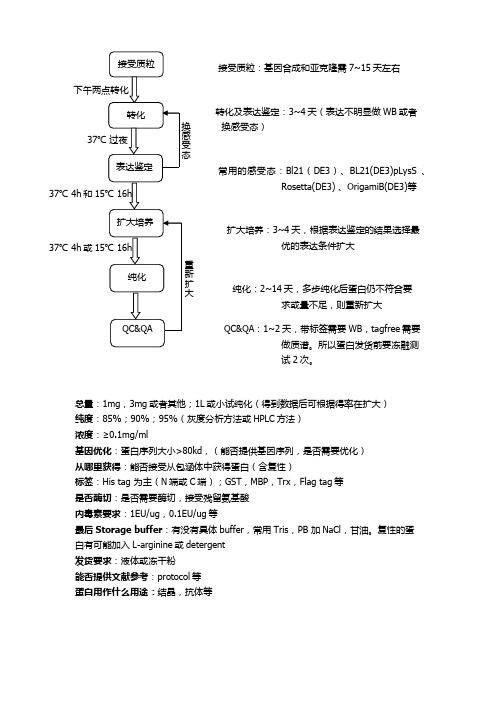
转化及表达鉴定:3~4天(表达不明显做WB或者
换感受态)
常用的感受态:Bl21(DE3)、BL21(DE3)pLysS 、
Rosetta(DE3) 、OrigamiB(DE3)等
扩大培养:3~4天,根据表达鉴定的结果选择最
优的表达条件扩大
纯化:2~14天,多步纯化后蛋白仍不符合要
求或量不足,则重新扩大
:1~2天,带标签需要WB,tagfree需要
做质谱。
所以蛋白发货前要冻融测
试2次。
总量:1mg,3mg或者其他;1L或小试纯化(得到数据后可根据得率在扩大)
纯度:85%;90%;95%(灰度分析方法或HPLC方法)
浓度:≥0.1mg/ml
基因优化:蛋白序列大小>80kd,(能否提供基因序列,是否需要优化)
从哪里获得:能否接受从包涵体中获得蛋白(含复性)
标签:His tag 为主(N端或C端);GST,MBP,Trx,Flag tag等
是否酶切:是否需要酶切,接受残留氨基酸
内毒素要求:1EU/ug,0.1EU/ug等
最后Storage buffer:有没有具体buffer,常用Tris,PB 加NaCl,甘油。
复性的蛋
白有可能加入L-arginine或detergent
发货要求:液体或冻干粉
能否提供文献参考:protocol等
蛋白用作什么用途:结晶,抗体等。
在大肠杆菌中表达重组蛋白的流程

在大肠杆菌中表达重组蛋白的流程
在大肠杆菌中表达重组蛋白的流程通常包括以下步骤:
1. 克隆:首先需要将目标基因克隆到适当的表达载体中。
这可以通过PCR扩增目标基因,然后将其与表达载体连接,形成重组质粒。
2. 转化:将重组质粒转化到大肠杆菌细胞中。
可以使用化学方法(如热冲击法)或电穿孔法将质粒导入细胞。
3. 选择:转化后,将细胞分散在含有适当抗生素的琼脂平板上培养。
只有带有重组质粒的细胞能够存活并形成菌落。
4. 培养:将含有重组细胞的培养液转移到适当的培养基中,并在适当的条件下培养。
这可能包括调节温度、pH值和搅拌速度等。
5. 表达:在培养期间,目标基因会被大肠杆菌细胞转录和翻译为蛋白质。
使用适当的启动子和调控序列,可实现目标蛋白的高效表达。
6. 细胞破碎:一旦细胞达到最佳表达水平,就需要破碎细胞以释放目标蛋白。
这可以通过多种方法实现,如超声波、高压破碎或化学方法。
7. 纯化:通过使用各种分离和纯化技术(如亲和层析、凝胶过滤、离子交换层析等),从细胞裂解液中纯化目标蛋白。
以上是在大肠杆菌中表达重组蛋白的一般流程。
具体的步骤和条件可能因实验设计和目标蛋白的特性而有所不同。
综述:大肠杆菌中重组蛋白的表达:进展与挑战

大肠杆菌中重组蛋白的表达:进展与挑战毫无疑问,重组蛋白在微生物中的表达革新了生物化学领域。
以前,纯化少量的目的蛋白需要处理几千克的动物或植物组织,或是大量的生物体液,这个时代已经一去不返了。
对于每个研究者来说,如果他要开始一个项目,需要某种纯化的蛋白。
他马上就会想到,怎样通过重组表达的方式获得这种蛋白。
目的重组蛋白的大量表达使人们能够对其生物化学性质进行分析,将其应用于工业并发展成为商业化产品。
从理论上来讲,获得重组蛋白的过程相当直接:获得目的基因,克隆到表达载体,转入表达宿主,诱导,纯化。
然而,实际上,事情通常并不是这样。
宿主菌生长差,包涵体的形成,蛋白无活性,甚至无法获得任何蛋白,这些都是实验中会遇到的问题。
在过去,有许多综述详细地介绍了这个课题。
综合来说,这些论文收集了2000多个例子。
然而在重组蛋白表达纯化领域,一直都在进步着。
因此,在本综述中,我们对本领域最近取得的进展做了评述。
同时,对于那些那些对异源表达还不大熟练的研究人员,我们通过回答项目开始就需要解决的问题,提供的许多选择和方法,。
这些选择和方法,在过去的几十年里,曾被成功的用来表达一系列的蛋白。
问题一:选择哪种生物体作为表达宿主?整个过程的开始就是要选择宿主细胞,利用它的蛋白合成机制来获得珍贵的蛋白。
宿主的选择决定了我们以后所需要的技术,包括各种分子工具,仪器或者试剂。
在这些微生物体中,现有的宿主系统包括细菌,酵母,filamentous fungi, 和 unicellular algae。
他们各有优点和缺点,宿主的选择可能取决于我们要表达的蛋白。
例如,如果目的蛋白需要翻译后的修饰,那么我们就要选择真核表达系统。
在本篇综述里,我们主要详细介绍大肠杆菌表达系统。
众所周知,利用大肠杆菌作为宿主具有很多优点。
1.它有无可比拟的快速生长机制,在glucose-salts培养基中,以及在最优的环境条件下,它扩增一倍的时间大约是20分钟。
大肠杆菌重组蛋白表达流程
大肠杆菌重组蛋白表达流程大肠杆菌重组蛋白表达流程主要包括以下几个步骤:1. 选择合适的表达载体:通常选择含有启动子、转录终止子、选择标记和适当的表达调控元件的表达载体。
启动子用于驱动基因转录,转录终止子用于确定转录产物的结束位置,选择标记有助于筛选含有目的基因的转化子,而表达调控元件可以调节基因的表达水平。
2. 构建表达载体:将目的基因插入表达载体中,构建成重组表达载体。
在此过程中,需要考虑目的基因的orientation(方向)、阅读框(ORF)以及表达调控元件的活性等因素。
3. 转化大肠杆菌:将构建好的重组表达载体转化到大肠杆菌中。
转化方法有多种,如化学法(如CaCl2法)、电转化、热激转化等。
转化后,大肠杆菌吸收了外源DNA,成为重组菌株。
4. 筛选重组菌株:在含有选择性抗生素的培养基上培养转化后的菌落,筛选出含有目的基因的重组菌株。
此外,可以通过鉴定菌落的形态、颜色等特征进行初步筛选。
5. 诱导表达:将筛选出的重组菌株接种到含有诱导剂(如IPTG)的培养基中,诱导目的基因的表达。
诱导剂IPTG可以与表达载体中的启动子结合,增强基因转录和翻译的效率。
6. 收集和纯化重组蛋白:诱导表达后,菌体中会含有目的蛋白。
可以通过离心、破碎细胞、柱层析等方法分离和纯化重组蛋白。
常用的纯化标签有His标签、GST标签等,这些标签可以帮助分离和纯化目的蛋白。
7. 蛋白活性检测和应用:对纯化的重组蛋白进行活性检测,如酶活测定、蛋白互作实验等。
确认蛋白活性后,可应用于生物学研究、药物研发等领域。
需要注意的是,大肠杆菌重组蛋白表达过程中可能会遇到表达量低、蛋白包涵体等问题。
为了解决这些问题,可以尝试优化表达载体、改变诱导条件、使用融合标签等策略。
重组人βNGF 在大肠杆菌中的可溶表达、纯化及活性鉴定
重组人βNGF 在大肠杆菌中的可溶表达、纯化及活性鉴定白羊;陈星;章永垒;邹有土;黄奋飞;陈胜亮;阮卡;葛平辉;马燕玲;王明灶【摘要】The goal of this work is to express the recombinant human nerve growth factor(rhβNGF)in Escherichia coli in soluble form, to separate and purify the expressed products,and to determine the biological activity. First,hβNGF gene was amplified and then inserted into expression vector pMAL-c2X,then E. coli expression system of hβNGF-MBP was constructed and induced for expression. Further,the MBP in purified expressed products was cleaved by Factor Xa enzyme,after identified by Western blot,the biological activity was examined by TF-1 method. The results showed that enzyme digestion and sequencing confirmed that the recombinant plasmid pMAL-c2X-hβNGF was constructed correctly,hβNGF-MBP was sec retory expressed under 2℃,180 r/min and 0.5 mmol/L IPTG induction. MBP tag in hβNGF-MBP was removed by Factor Xa digestion,and the purified hβNGF via SDS-PAGE was about 13 kD with the purity over 95%. The protein was identified as hβNGF by Western blot. Th e biological activity test showed that the specific activity was about 1×106 U/mg. Overall,recombinant hβNGF was successfully expressed in E. coli in soluble form with high biological activity.%旨在大肠杆菌中可溶表达重组人神经生长因子(Recombinant human β nerve growth factor,r hβNGF),并对表达产物进行分离纯化和生物学活性鉴定。
重组蛋白质的表达纯化和结构鉴定
重组蛋白质的表达纯化和结构鉴定在生物医学领域中,重组蛋白质凭借其广泛的应用前景成为了研究热点。
然而,要想获得高纯度的重组蛋白质,并对其结构进行准确的鉴定,需要经历一系列复杂而细致的实验步骤。
本文将从表达、纯化和结构鉴定三个方面介绍重组蛋白质的研究过程。
一、表达重组蛋白质的表达是研究重组蛋白质最初的关键步骤之一。
通常采用大肠杆菌(Escherichia coli)作为表达宿主。
首先,需要将目标基因克隆至表达载体中,确保其与启动子、转录因子等相互配合,并携带一定的标签,如His 标签、GST 标签等。
接着,将修饰好的表达载体转化至大肠杆菌中,采用选择性培养基筛选出目标菌株。
最后,将筛选得到的菌株进行大规模培养,促使目标基因在细胞内表达。
二、纯化获得表达目标蛋白的菌株后,需要将蛋白从细胞中纯化出来。
首先,采用超声波或高压颠破细胞壁,释放出蛋白质。
接着,通过离心等手段将蛋白质与其他细胞组分分离。
此时,可以利用目标蛋白质特异性的亲和层析柱,如镍柱、葡聚糖柱等,吸附目标蛋白质,并通过逆向洗脱等方法,得到高纯度的目标蛋白质。
三、结构鉴定获得纯度较高的重组蛋白质后,需要对其结构进行进一步的鉴定。
常用的结构鉴定方法包括X射线晶体学、核磁共振(NMR)、电子显微镜等。
X射线晶体学是目前应用最广泛的方法,通过将蛋白质结晶并进行X射线衍射实验,得到蛋白质的高分辨率结构。
NMR则通过测量蛋白质中核自旋的相对位置和相互作用关系,获取蛋白质的三维结构信息。
电子显微镜是一种能够获得蛋白质高分辨率结构的技术,主要应用于研究大分子复合物和纤维形态的蛋白质。
除了上述常用技术外,近年来还涌现出一些新的结构鉴定方法,如质谱联用技术、光学显微镜成像、负染电镜等。
这些方法的出现,为蛋白质结构鉴定提供了更多的选择和便利。
由于篇幅所限,本文仅对重组蛋白质的表达、纯化和结构鉴定进行了简要介绍。
事实上,研究重组蛋白质的过程还包括目标基因的设计与合成、蛋白质的功能分析等环节。
重组蛋白质的表达与纯化技术
重组蛋白质的表达与纯化技术蛋白质是生命体活动的重要组成部分,对于生命体的生长、繁殖和免疫功能起着至关重要的作用。
而重组蛋白质则是利用基因工程技术,将人工合成的外源基因导入到特定的宿主细胞中,通过细胞表达和纯化技术得到的转录翻译产物。
这种技术不仅可以生产天然蛋白质,还可以生产人工合成的新型蛋白质,对于疾病的治疗和新药的研发有着重要的意义。
一、蛋白质表达技术蛋白质表达是获得大量重组蛋白质的重要方法。
选择适当的宿主细胞和表达载体是获得高水平表达的关键。
常用的宿主细胞包括大肠杆菌、酵母菌、昆虫细胞、哺乳动物细胞等。
1.大肠杆菌表达系统大肠杆菌表达系统具有生长快、表达量高等优点,广泛应用于重组蛋白质的表达和纯化。
其表达载体主要有pET和pBAD两种,pET系统一般用于产生可以形成包涵体的重组蛋白,pBAD系统用于在分泌表达中产生滞留蛋白。
2.昆虫细胞表达系统昆虫细胞表达系统包括SF9、Sf21、HighFive等细胞系,常用的表达载体为pIB/V5-His、pFastBac等。
昆虫细胞表达系统通常用于表达大分子蛋白质,如糖蛋白、膜蛋白等。
3.哺乳动物细胞表达系统哺乳动物细胞表达系统是目前表达规模最大、表达产物最接近人体蛋白质的一种表达系统。
其表达载体主要有pCDNA3.1、pCI 等,常用于表达与人体有关的蛋白质,如抗体、生长因子等。
二、蛋白质纯化技术蛋白纯化是重组蛋白质生产的重要环节,其目的是得到高质量的、纯度较高的蛋白质样品。
常见的纯化方法包括亲和层析法、离子交换层析法、凝胶过滤层析法、逆流式层析法等。
1.亲和层析法亲和层析法是指因与载体中固定的亲和剂相互结合而纯化目标蛋白质的一种方法。
亲和剂通常是与目标蛋白质有特异性结合作用的化合物,如亲和标签、酶底物、抗体等。
常见的亲和层析方法有亲和柱层析、亲和膜层析等。
2.离子交换层析法离子交换层析法是根据蛋白质带有正或负电荷的差异性进行分离的一种方法。
离子交换层析的柱填充物常为离子交换树脂,其一般分为阴离子交换树脂和阳离子交换树脂两种。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中组 11年级生物化学3人项目重组蛋白IFNGA在大肠杆菌中的表达与纯化重组蛋白IFNGA在大肠杆菌中的表达与纯化摘要:干扰素γ(Interferon gamma,IFN-γ)是体内重要的细胞因子,能够通过调控免疫相关基因的转录协调机体的免疫反应,具有抗病毒、抗肿瘤、增强免疫力能功能。
目前对于IFN-α、IFN-β重组表达的较多,而关于IFN-γ 蛋白的纯化表达较少.因此,本研究使用PCR方法扩增IFN-γ基因,将IFN-γ基因分别插入原核表达载体pET-30构建重组表达质粒pET-30--IFN-γ,转化大肠杆菌BL21和Rosetta菌株,在IPTG诱导下表达IFN-γ,SDS-PAGE分析重组表达蛋白。
结果表明:成功构建重组表达质粒pET-30-IFN-γ;表达产物主要以包涵体形式存在;经Ni2+-NTA亲和层析纯化,获得高纯度重组蛋白。
本实验纯化的蛋白有望在今后用于医学和生物学研究中。
关键词:干扰素;IFN-γ 蛋白;大肠杆菌表达系统;重组表达;蛋白纯化;一、研究背景干扰素(IFN)是一种广谱抗病毒剂,并不直接杀伤或抑制病毒,而主要是通过细胞表面受体作用使细胞产生抗病毒蛋白,从而抑制病毒(比如:乙肝病毒)的复制。
其类型分为三类,α-(白细胞)型、β-(成纤维细胞)型,γ-(淋巴细胞)型;同时还可增强自然杀伤细胞(NK细胞)、巨噬细胞和T淋巴细胞的活力,从而起到免疫调节作用,并增强抗病毒能力。
干扰素是一组具有多种功能的活性蛋白质(主要是糖蛋白),是一种由单核细胞和淋巴细胞产生的细胞因子。
它们在同种细胞上具有广谱的抗病毒、影响细胞生长,以及分化、调节免疫功能等多种生物活性。
其中,IFN-γ是体内重要的免疫调节因子,能通过与细胞表面受体结合,诱导病毒感染细胞产生多种抗病毒蛋白,使细胞内产生抗病毒状态而发挥抗病毒作用。
在诱导效应因子表达的同时,由于IFN-γ能够提高细胞表面MHC分子的表达,增强免疫活性细胞对病原体的杀伤作用,从而协同促进了机体对病毒感染细胞的杀灭,而使机体处于抗病毒状态。
虽然各种类型的干扰素均能介导细胞对病毒感染的反应,但IFN-γ 的免疫调节活性在协调免疫反应和确定机体长期的抗病毒状态中发挥更为重要的作用。
其作用可大致总结为以下几点:①抗增生作用。
这是干扰素能用于治疗多种肿瘤的原因。
②抗病毒作用。
当我们的机体感染病毒时,体内会产生大量的干扰素。
③免疫调节作用。
干扰素是天然免疫的一部分,但干扰素也参与多种特异性的细胞免疫,如增强感染的肝细胞表达被T淋巴细胞识别的蛋白质,帮助T细胞识别病毒感染的细胞等。
④抗纤维化作用。
这是为什么干扰素治疗的病人肝纤维化会明显好转。
⑤干扰素还有抗新血管增生、促进细胞凋亡等多种功能。
但在治疗慢性乙肝方面,抗病毒作用和免疫调节作用,以及抗纤维化作用可能是主要的。
由于IFN-γ 能够抑制细胞增生,促进细胞凋亡,抑制肿瘤血管生成,具有抗病毒及免疫调节活性,还可抑制癌基因的表达,因此引起了人们对其在治疗恶性肿瘤方面的关注。
目前,已有文献报道将IFN-γ用于肝细胞癌(Hepatic cellular carcinoma,HCC)切除术后和消融术后,以预防复发,如Nishisuchi等对 30 例行 HCC 根治性术后患者进行长达 88 周的IFN-γ治疗,结果显示,IFN-γ 治疗可提高术后患者的累积生存率。
Lin 等也对行消融术后的HCC 患者进行IFN-γ 治疗,结果发现IFN-γ 能够降低肿瘤复发率,提高患者生存率。
IFN-γ局部用药,还可治疗暴露性肿瘤,如恶性黑色素瘤、恶性淋巴瘤、宫颈癌等。
所以我们对其进行了分析与纯化,进一步了解其成分和结构,并纯化出有用蛋白进行加以利用。
二、研究目的目前对于IFN-α、IFN-β重组表达的较多,而关于IFN-γ 蛋白的纯化表达较少;因此本研究希望通过实验研究,在大肠杆菌表达系统中成功表达IFN-γ 蛋白,并利用蛋白纯化技术获得较纯的IFN-γ 蛋白。
三、材料与方法1. 大肠杆菌表达载体构建1.1 材料DH5a感受态细胞(TAKARA);Antibotics(Sigma);Restriction enzyme(TAKARA);DNA Ladder(Novoprotein); pCold II;载体(TAKARA);1.2 仪器及品牌PCR仪(ThermoFisher);水平电泳仪(大连竞脉);凝胶成像仪(上海天能);台式离心机(湖南赛特)1.3 方法1.3.1 PCR扩增目的基因设计引物,以含目的基因质粒为模板,PCR扩增IFN-gamma目的基因。
1.3.2 重组表达载体构建经PCR扩增胶纯化获得目的基因,用Nde I 和Hind III酶切并胶纯化获得载体pCold II。
目的基因片段与pCold II以Sea mLess cloning方法重组克隆,转化DH5a感受态细胞,PCR鉴定阳性克隆,并测序。
2. 大肠杆菌表达筛选2.1 材料XY1培养基(Novoprotein);IPTG(Sigma);Protein Molecular Marker(Novoprotein);Antibotics(Sigma); Rosetta pLysS表达菌株(TAKARA); Antibodies(Sigma);2.2 仪器及品牌高速冷冻离心机(Beckman);摇床(上海博彩);超声破碎仪(宁波新芝);垂直电泳仪(上海天能)2.3 方法重组质粒转化BL21(DE3)表达菌株,37℃培养至OD600=0.8后,加IPTG(1mM) ,37℃诱导3 h,收菌。
SDS-PAGE检测表达。
重组质粒转化BL21(DE3)表达菌株,37℃培养至OD600=0.8后,冷却后加IPTG(0.1mM) ,16℃诱导过夜,收菌。
SDS-PAGE检测表达。
重组质粒转化Rosetta pLysS表达菌株,37℃培养至OD600=0.9后,加IPTG(1mM) ,37℃诱导3 h,收菌。
SDS-PAGE检测表达。
重组质粒转化Rosetta pLysS表达菌株,37℃培养至OD600=0.9后,冷却后加IPTG(0.1mM) ,16℃诱导过夜,收菌。
SDS-PAGE检测表达。
Antibotics(Sigma); Rosetta pLysS表达菌株(TAKARA); Antibodies(Sigma);3. 蛋白纯化M 13.1 材料基本无机试剂(Na 2HPO 4,KCl ,NaCl 等)(国药化学集团);透析袋(上海绿叶) 超声破碎仪(宁波新芝);AKTA purifier(GE);高速冷冻离心机(Beckman);垂直电泳仪(上海天能)Chelating HP(Ni) 亲和纯化色谱柱(柱体积 1 mL) 3.2方法Chelating HP(Ni)柱以20mM PB ,500mM NaCl , pH 7.4平衡液平衡,平衡后上样90 mL ,然后分别用含20,50,100, 200, 500mM 咪唑的20mM PB ,500mM NaCl ,pH7.4的洗脱液洗脱。
其中500mM 咪唑洗脱流份透析到最终缓冲液中作为蛋白产品保存。
4. 成品检测 4.1仪器及品牌垂直电泳仪(上海天能);核酸蛋白检测仪(Eppendorf); 4.2 方法终产品进行浓度,纯度检测合格后按要求分装保存。
四、实验结果与讨论4.1 表达载体的构建(包括目的基因的扩增,酶切、连接和转化,阳性克隆鉴定)4.1.1目的基因扩增用聚合酶链式反应(PCR )扩增目的基因(506 bp )Lane1: IFN-gamma (506bp) M :Dl2000 DNAMarker图1. 目的基因扩增1 2 3 4 5 6 M4.12酶切、连接和转化⏹ 将扩增的目的基因用限制性内切酶消化; ⏹ 连接到相应的空载体; ⏹ 将构建好的载体转入大肠杆菌 4.13阳性克隆的鉴定⏹ 用聚合酶链式反应(PCR )确认正确的构建载体Lane1-6: Clone 1-6 (expected product length 600bp)Mk: DL 2000 DNA MarkerPositive clone:1-6Positive clone for sequencing: 1,6 Sequencing correct clone :1,6 图2. PCR 鉴定阳性克隆4.2表达筛选(包括表达小试确定最佳的表达条件,放大培养) 4.2.1表达小试1 ⏹ 菌株:BL21(DE3) ⏹ 培养基: LB⏹ 在600 nm 波长光吸收值达到1.0时加入1 mmolIPTG 在37℃培养3 hLane A: 诱导前全菌 Lane B: 诱导后全菌 Lane C: 破菌上清 Lane D: 破菌沉淀 MK: 分子量标记B1 B2 B3 B4 MK A B C D从SDS-PAGE 电泳上可以看出目的蛋白有明显的可溶表达。
4.2.2表达小试2 ⏹ 菌株:BL21(DE3) ⏹ 培养基:LB⏹ 600 nm 波长光吸收值达到1.0时加入0.1 mmolIPTG 在16℃培养16 h图4. SDS-PAGE 检测表达条带 从SDS-PAGE 电泳上可以看出目的蛋白有明显的可溶表达 4.2.3表达小试3⏹ 菌株:Rosetta pLysS ⏹ 培养基: LB⏹ 在600 nm 波长光吸收值达到1.0时加入1 mmolIPTG 在37℃培养3 hB1 B2 B3 B4 MK A B C DLane A: 诱导前全菌 Lane B: 诱导后全菌 Lane C: 破菌上清 Lane D: 破菌沉淀 MK: 分子量标记Lane A: 诱导前全菌 Lane B: 诱导后全菌 Lane C: 破菌上清 Lane D: 破菌沉淀 MK: 分子量标记B1 B2 B3 B4 A MK B C D从SDS-PAGE 电泳上可以看出目的蛋白有明显的可溶表达。
4.2.4 表达小试4⏹ 菌株:Rosetta pLysS ⏹ 培养基:LB⏹ 在600 nm 波长光吸收值达到1.0时加入0.1 mmolIPTG 在16℃培养16 h图6. SDS-PAGE 检测表达条带从SDS-PAGE 电泳上可以看出目的蛋白有明显的可溶表达。
4.2.5 放大培养⏹ 菌株: BL21(DE3) ⏹ 培养基: XY1 2升⏹ 在600 nm 波长光吸收值达到1.0时加入0.5 mmolIPTG 在37℃培养3 hLane A: 诱导前全菌 Lane B: 诱导后全菌 Lane C: 破菌上清 Lane D: 破菌沉淀 MK: 分子量标记B1 B2 B3 B4 A MK B C DLane A: 诱导前全菌 Lane B: 诱导后全菌 Lane C: 破菌上清 Lane D: 破菌沉淀 MK: 分子量标记MK A B C D图7. SDS-PAGE检测表达条带4.2.6菌体裂解⏹裂解缓冲液: 20mM PB,500mM NaCl,pH 7.4Lane A:全菌Lane B :破菌上清Lane C:破菌沉淀MK:分子量标记A B C MK图8. SDS-PAGE检测表达条带4.3目的蛋白纯化4.3.1金属(镍离子)螯合层析纯化⏹样品: 破菌上清⏹平衡缓冲液:20mM PB,500mM NaCl,pH 7.4⏹洗脱缓冲液: 20mM PB,500mM NaCl,500mM 咪唑,pH 7.4⏹层析柱: Chelating His(Ni) Column (柱体积10 mL)图9. 样品纯化条带4.3. 2终产品MK: 分子量标记 Lane A: 样品 Lane B: 流穿Lane C: 20 mmol 咪唑(Imizadole )洗脱组分 Lane D: 50 mmol 咪唑(Imizadole )洗脱组分 Lane E: 100 mmol 咪唑(Imizadole )洗脱组分 Lane F: 200 mmol 咪唑(Imizadole )洗脱组分1 Lane G: 200 mmol 咪唑(Imizadole )洗脱组分2 Lane H: 500 mmol 咪唑(Imizadole )洗脱组分1 Lane I: 500 mmol 咪唑(Imizadole )洗脱组分2I120kD 90kD 60kD40kD30kD20kD 14kD⏹浓度:0.5 mg/ mL ⏹Volume: 6 mL ⏹总量: 3 mg⏹缓冲液: PBS ,pH 7.4Lane A: 终产品 ( 还原) Lane B:终产品(非还原) MK: 分子量标记图9. 终产品纯化条带五、收获与体会1、重组蛋白的纯化扩展了生物试剂应用的视野和多样性。
