实验 34 种子生活力的快速测定 - 食品伙伴网
种子生活力的快速测定定稿PPT课件

快速测定种子生活力实训结果报告单
作物名称
测定粒数
活种子数
种子生活力 (发芽率) (要求写出计算 公式及过程)
(%)
死种子数
实训结果评价
测定人姓名
第6页/共9页
第7页/共9页
第8页/共9页
感谢您的观看!
第9页/共9页
一 力的原理、方法及其发芽率的计算。
第1页/共9页
二、实训原理
理论依据:有生活力的细胞生物膜对物 质具有选择吸收的能力。
未染色种子
活种子
第2页/共9页
死种子
三、仪器设备、材料和试剂
(一)仪器设备 刀片、镊子、烧杯、放大镜、垫板、
盘子等。 (二)材料:小麦种子 (三)试剂:5%的红墨水
第3页/共9页
四、方法步骤
浸种
观察计算
切种
染色冲洗
第4页/共9页
五、操作要点及结果评价标准
(一)操作要点:切种方法正确,部 位准确;观察细心,分辨准确;操作 规范安全。 (二)结果评价标准:死种子、活种子 分辨准确;计算结果准确;操作规范、 安全;操作文明,台面地面干净整洁。
第5页/共9页
六、实训结果报告单的填写
种子生活力快速测定

种子生活力快速测定实验人员:候勇 2012年度国培班果蔬花卉专业试验目的:种子生活力是指种子的发芽潜力,即发芽力,是判断种子质量的重要指标;要了解种子生活力的大小,最可靠的方法是测定种子的发芽率。
种子的发芽率是指在适宜条件下种子发芽的百分数,它是鉴定种子质量的主要依据,在确定播种量以及种子生理研究中具有重要意义。
本实验的目的就是快速测定种子生活力的方法。
实验仪器及材料:1、仪器:电热恒温培养箱、培养皿、烧杯、镊子、单面刀2、试剂:3%TTC溶液、0.1%BTB溶液、1%BTB琼脂凝胶、红墨水5%3、材料:玉米、小麦吸胀种子方法一:红墨水染色法实验原理:红墨水染色法是根据活种子细胞的原生质膜具有选择性吸收物质的透性,而死种子的胚细胞原生质膜则丧失此性质,于是染料进入死细胞而染色。
操作步骤:1、浸种:取不同种子一部分用沸水煮5-10min,作为死种子;一部分用凉水浸泡一昼夜,吸涨备用。
2、染色:取已吸涨种子100粒,玉米种子可在中间阔面将胚纵切为两半将其中一半放入培养皿中,用5%红墨水染色。
3、结果观察:经过5-8min,倒出红墨水,多次用清水清洗后观察胚的颜色,凡是胚部不着色的为生活良好的种子,有略带红色的说明生活力较弱,都染红的说明无生活力。
结果:活种子%=胚不着色的种子数/供试种子*100 50%=5/10*100方法二:BTB变色法实验原理:活种子进行呼吸作用呼吸空气中的O2,放出CO2。
CO2溶于水成为H2CO3,H2CO3解离为H+和HCO3-,使得种子周围环境的酸度增加。
BTB法通过测定酸度的变化来判断种子活性。
BTB 变色范围为PH6.0—7.6,酸性呈黄色,碱性呈蓝色,中间经过绿色(变色点为PH7.1)。
色泽差异显著,易于观察。
操作步骤:1%BTB染色将吸胀的小麦种子分别整齐地埋于1%BTB琼脂凝胶两个培养皿中,胚向下,间距约1cm。
培养皿置于30C培养箱中培养0.5h,在光亮处下观察,种子附近呈现深黄色晕圈的是活种子,用沸水中杀死的种子分别进行对照。
种子生活力快速测定

种子生活力快速测定种子生活力快速测定实验人员:候勇 2012年度国培班果蔬花卉专业试验目的:种子生活力是指种子的发芽潜力,即发芽力,是判断种子质量的重要指标;要了解种子生活力的大小,最可靠的方法是测定种子的发芽率。
种子的发芽率是指在适宜条件下种子发芽的百分数,它是鉴定种子质量的主要依据,在确定播种量以及种子生理研究中具有重要意义。
本实验的目的就是快速测定种子生活力的方法。
实验仪器及材料:1、仪器:电热恒温培养箱、培养皿、烧杯、镊子、单面刀2、试剂:3%TTC溶液、0.1%BTB溶液、1%BTB琼脂凝胶、红墨水5%3、材料:玉米、小麦吸胀种子方法一:红墨水染色法实验原理:红墨水染色法是根据活种子细胞的原生质膜具有选择性吸收物质的透性,而死种子的胚细胞原生质膜则丧失此性质,于是染料进入死细胞而染色。
操作步骤:1、浸种:取不同种子一部分用沸水煮5-10min,作为死种子;一部分用凉水浸泡一昼夜,吸涨备用。
2、染色:取已吸涨种子100粒,玉米种子可在中间阔面将胚纵切为两半将其中一半放入培养皿中,用5%红墨水染色。
3、结果观察:经过5-8min,倒出红墨水,多次用清水清洗后观察胚的颜色,凡是胚部不着色的为生活良好的种子,有略带红色的说明生活力较弱,都染红的说明无生活力。
结果:活种子%=胚不着色的种子数/供试种子*100 50%=5/10*100方法二:BTB变色法实验原理:活种子进行呼吸作用呼吸空气中的O2,放出CO2。
CO2溶于水成为H2CO3,H2CO3解离为H+和HCO3-,使得种子周围环境的酸度增加。
BTB法通过测定酸度的变化来判断种子活性。
BTB 变色范围为PH6.0—7.6,酸性呈黄色,碱性呈蓝色,中间经过绿色(变色点为PH7.1)。
色泽差异显著,易于观察。
操作步骤:1%BTB染色将吸胀的小麦种子分别整齐地埋于1%BTB琼脂凝胶两个培养皿中,胚向下,间距约1cm。
培养皿置于30C培养箱中培养0.5h,在光亮处下观察,种子附近呈现深黄色晕圈的是活种子,用沸水中杀死的种子分别进行对照。
实验七种子生活力的快速测定(精)

种子冲洗l~2次,观察种胚被 染色的情况。凡种胚全部或 大部分被染成红色的即为具 有生活力的种子,种胚不被 染色的为死种子。如果种胚
(30℃~35℃)中保温
中非关键性部位(如子叶的
0.5~1h。另取100粒吸涨种 一部分)被染色,而胚根或
子,于沸水中煮5min后,
胚芽的尖端不染色,都属于
再加入0.5%TTC溶液染色。 不能正常发芽的种子。根据
2
实验原理
有生活力的种子能够进行呼吸代谢,在呼吸代谢途 径中由脱氢酶催化所脱下来的氢可以将无色的2,3, 5 - 三苯基氯化四唑(2,3,5 - triphenyl tetrazolium chloride 简称为TTC)还原为红色、不溶 性的甲月替,而且种子的生活力越强,代谢活动越
旺盛,被染成红色的程度越深。死亡的种子由于没 有呼吸作用,因而不会将TTC还原为红色。种胚生 活力衰退或部分丧失生活力,则染色较浅或局部被
染色。因此,可以根据种胚染色的部位以及染色的 深浅程度来判定种子的生活力。
2019/5/4
3
实验材料和器材
• 实验材料
水稻种子
• 器材:恒温箱、小白瓷碗、
镊子、刀片、小烧杯
• 试剂: 0.5% TTC溶液:
称取0.5 g TTC放入小烧杯 中,先加少许乙醇溶解后, 再用蒸馏水稀释定容至100 mL。TTC溶液最好随用随 配,不宜久藏。溶液应遮光
实验七:种子生活力的快速测定
(一)实验目的及意义 (二)实验原理 (三)实验步骤 (四)实验报告
2019/5/4
1
实验目的和意义
种子生活力(seed viability测定种子
生活力常采用萌发实验,即在适宜的条件下,
实验3 种子生活力的测定

实验3 种子生活力的测定目的要求用化学试剂测定种子生活力,可以在短时间内评定种子质量。
特别是对于有些树种种子的休眠期长,难于进行发芽测定,采用此法测定种子的生活力就具有明显的优越性。
通过实验要求了解测定种子生活力的基本原理,并学会其操作程序。
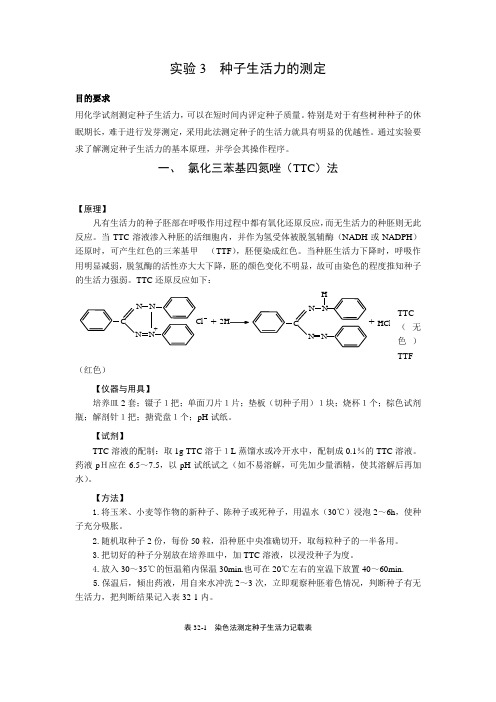
一、 氯化三苯基四氮唑(TTC )法【原理】凡有生活力的种子胚部在呼吸作用过程中都有氧化还原反应,而无生活力的种胚则无此反应。
当TTC 溶液渗入种胚的活细胞内,并作为氢受体被脱氢辅酶(NADH 或NADPH )还原时,可产生红色的三苯基甲 (TTF ),胚便染成红色。
当种胚生活力下降时,呼吸作用明显减弱,脱氢酶的活性亦大大下降,胚的颜色变化不明显,故可由染色的程度推知种子的生活力强弱。
TTC 还原反应如下:TTC(无色)TTF(红色)【仪器与用具】培养皿2套;镊子1把;单面刀片1片;垫板(切种子用)1块;烧杯1个;棕色试剂瓶;解剖针1把;搪瓷盘1个;pH 试纸。
【试剂】TTC 溶液的配制:取1g TTC 溶于1L 蒸馏水或冷开水中,配制成0.1%的TTC 溶液。
药液p H应在6.5~7.5,以pH 试纸试之(如不易溶解,可先加少量酒精,使其溶解后再加水)。
【方法】1.将玉米、小麦等作物的新种子、陈种子或死种子,用温水(30℃)浸泡2~6h ,使种子充分吸胀。
2.随机取种子2份,每份50粒,沿种胚中央准确切开,取每粒种子的一半备用。
3.把切好的种子分别放在培养皿中,加TTC 溶液,以浸没种子为度。
4.放入30~35℃的恒温箱内保温30min.也可在20℃左右的室温下放置40~60min.5.保温后,倾出药液,用自来水冲洗2~3次,立即观察种胚着色情况,判断种子有无生活力,把判断结果记入表32-1内。
表32-1 染色法测定种子生活力记载表+Cl+CN N NN +2HCN N NNHHCl【注意事项】1.TTC溶液最好现配现用,如需贮藏则应贮于棕色瓶中,放在阴凉黑暗处,如溶液变红则不可再用。
种子生活力快速测定

种子生活力快速测定一、实验原理通过本实验,掌握种子生活力快速测定的原理和方法。
二、实验原理(1)活细胞染色:脱氢辅酶(NADH或NAFPH)存在于活的细胞内,当TTC渗透进入细胞内作为受体被脱氢辅酶上的氢还原,便由无色的TTC变为红色的三苯基甲(TTE)。
当细胞死亡后,NADH会迅速被降解,不会发生相应的颜色反应,故TTC染色法可显示细胞是否存活。
(2)死细胞染色:有生命力的细胞膜是一个半透性膜,因此对内渗透的物质有选择性;而无生命力的细胞,其细胞膜已经消失,因此有的有色物质(如品红)不能进入活的细胞内,但可以进入已经死亡的细胞,从而使细胞内出现该有色成分特有的颜色,故可以据此鉴别细胞是否死亡。
三、实验材料、药品和器具1、实验材料:花生、黄豆2、实验药品和器具:品红、TTC、培养皿、吸水纸、镊子、解剖针、刀片等四、试验方法1、分别取10颗红豆和黄豆的种子,沿种子的培从中切成两半,将带胚的部分放入培养皿中,加入TTC培养1h左右,观察胚染色的情况。
胚被染色的为有活力种子,未被染色的为无活力的种子。
2、别取10颗红豆和黄豆的种子,沿种子的培从中切成两半,将带胚的部分放入培养皿中,加入品红培养10-20min,倒掉品红溶液,冲洗数次,观察胚染色的情况。
胚被染色的为无活力种子,未被染色的为有活力的种子。
五、实验结果品种测定方法测定种子总数有生活力种子粒数无生活力种子粒数种子生活率花生TTC 30 28 2 93% 品红30 28 2 93%黄豆TTC 30 30 0 100% 品红30 29 1 97% 实验结果可以得出选用TTC染色和品红染色得出的结果存在差异,用TTC染色得出的结果高于品红染色法。
结果分析:可能的原因是在清洗品红时没有清洗干净,品红粘在胚上,影响实验的观察,导致结果差异。
六、注意事项1、选取种子的时候,要尽量选取未发芽的种子,避免影响测定。
2、添加染色液时,要是然也尽量没过种胚,使种胚和染液充分接触。
实验3 种子生活力的测定
实验3 种子生活力的测定目的要求用化学试剂测定种子生活力,可以在短时间内评定种子质量。
特别是对于有些树种种子的休眠期长,难于进行发芽测定,采用此法测定种子的生活力就具有明显的优越性。
通过实验要求了解测定种子生活力的基本原理,并学会其操作程序。
一、 氯化三苯基四氮唑(TTC )法【原理】凡有生活力的种子胚部在呼吸作用过程中都有氧化还原反应,而无生活力的种胚则无此反应。
当TTC 溶液渗入种胚的活细胞内,并作为氢受体被脱氢辅酶(NADH 或NADPH )还原时,可产生红色的三苯基甲 (TTF ),胚便染成红色。
当种胚生活力下降时,呼吸作用明显减弱,脱氢酶的活性亦大大下降,胚的颜色变化不明显,故可由染色的程度推知种子的生活力强弱。
TTC 还原反应如下:TTC(无色)TTF(红色)【仪器与用具】培养皿2套;镊子1把;单面刀片1片;垫板(切种子用)1块;烧杯1个;棕色试剂瓶;解剖针1把;搪瓷盘1个;pH 试纸。
【试剂】TTC 溶液的配制:取1g TTC 溶于1L 蒸馏水或冷开水中,配制成0.1%的TTC 溶液。
药液p H应在6.5~7.5,以pH 试纸试之(如不易溶解,可先加少量酒精,使其溶解后再加水)。
【方法】1.将玉米、小麦等作物的新种子、陈种子或死种子,用温水(30℃)浸泡2~6h ,使种子充分吸胀。
2.随机取种子2份,每份50粒,沿种胚中央准确切开,取每粒种子的一半备用。
3.把切好的种子分别放在培养皿中,加TTC 溶液,以浸没种子为度。
4.放入30~35℃的恒温箱内保温30min.也可在20℃左右的室温下放置40~60min.5.保温后,倾出药液,用自来水冲洗2~3次,立即观察种胚着色情况,判断种子有无生活力,把判断结果记入表32-1内。
表32-1 染色法测定种子生活力记载表+Cl+CN N NN +2HCN N NNHHCl【注意事项】1.TTC溶液最好现配现用,如需贮藏则应贮于棕色瓶中,放在阴凉黑暗处,如溶液变红则不可再用。
实验五、种子活力的快速测定

实验五、种子活力的快速测定一、实验目的熟悉种子活力快速测定的方法⏹TTC(氯化三苯基四氮唑)法⏹BTB(溴麝香草酚蓝)法⏹红墨水法⏹纸上荧光法二、实验原理⏹TTC(氯化三苯基四氮唑)法二、实验原理⏹红墨水法⏹活细胞的原生质膜具有选择透性,死亡的种胚细胞原生质膜无选择透性;⏹红墨水中的染色成分大红G不能通过选择透性膜,但能通过非选择透性膜。
三、实验材料、器材及试剂⏹材料:小麦种子⏹仪器及器皿:恒温箱,恒温水浴锅,镊子,刀片,培养皿,小烧杯⏹试剂:⏹0.5% TTC溶液(随配随用,若已变为红色则不能继续使用。
)⏹5%红墨水四、实验步骤⏹1、材料准备:将待测小麦种子用30-35℃温水浸种6~8h。
⏹2、切种子:随机取种子30粒以上,用刀片沿种子胚中心线切成两半。
⏹3、染色处理:取一半的种子放在培养皿中,加入染色溶液(刚好浸没种子),30-35℃恒温箱中保温0.5-1h。
⏹4、对照处理:另一半于沸水中煮死,染色同3。
⏹5、结果观察:倒出染色溶液,TTC处理种子用清水将种子冲洗1-2次,红墨水处理种子则用水冲洗至冲洗液无色为止。
观察种胚着色状况。
⏹6、结果验证:随机取种子30粒以上,25℃保温保湿培养,48h检测发芽率。
五、结果与讨论⏹1、计算两种测定法得到的种子发芽率。
统计分析两种测定方法的结果是否有差异。
⏹讨论两种方法有什么不同?你认为哪一种方法测定的结果较好,为什么?⏹2、统计分析种子活力快速测定结果与实际种子萌发结果的差异性。
⏹讨论可能原因。
比较分析种子活力快速测定与种子直接发芽率测定的优缺点。
注意事项⏹TTC处理染色结束后要立即进行鉴定。
凡种胚全部或大部分被染成红色的即为具有生活力的种子,种胚不被染色的为死种子。
如果种胚中非关键性部位(如子叶的一部分)被染色,而胚根或胚芽的尖端不能染色都属于不能正常发芽的种子。
⏹红墨水处理后要冲洗充分后观察。
凡种胚不着色或着色很浅的为活种子,凡种胚与胚乳着色程度相同的为死种子。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验 17 种子生活力的快速测定
种子生活力是指种子能够萌发的潜在能力或种胚具有的生命力。
它是决定种子品质和实用价值大小的主要依据,与播种时的用种量直接有关。
测定种子生活力常采用发芽实验,即在适宜条件下,让种子吸水萌发,在规定天数内统计发芽的种子占供试种子的百分数。
但是常规方法(直接发芽)测定种子生活力所需时间较长,特别是有时为了应急需要,没有足够的时间来测定发芽率,遇到休眠种子也无法知道。
而采用以下的化学方法,则能在较短时间内获得结果。
Ⅰ氯化三苯基四氮唑法( TTC 法)
一、原理
凡有生命活力的种子胚部,在呼吸作用过程中都有氧化还原反应,在呼吸代谢途径中由脱氢酶催化所脱下来的氢可以将无色的 TTC 还原为红色、不溶性三苯基甲( TTF ),而且种子的生活力越强,代谢活动越旺盛,被染成红色的程度越深。
死亡的种子由于没有呼吸作用,因而不会将 TTC 还原为红色。
种胚生活力衰退或部分丧失生活力,则染色较浅或局部被染色。
因此,可以根据种胚染色的部位以及染色的深浅程度来判定种子的生活力。
二、实验材料、试剂与仪器设备
(一)实验材料
玉米、小麦等种子。
(二)试剂
0.5% TTC 溶液:称取 0.5 gTTC 放在烧杯中,加入少许 95% 乙醇使其溶解,然后用蒸馏水稀释至 100 mL 。
溶液避光保存,若变红色,即不能再用。
(三)仪器设备
恒温箱,培养皿,刀片,烧杯,镊子,天平。
三、实验步骤
1. 浸种将待测种子在 30 ~ 35 ℃温水中浸种(大麦、小麦 6 小时,玉米 5 小时左右),以增强种胚的呼吸作用。
2. 显色取吸胀的种子 200 粒,用刀片沿种子胚的中心线纵切为两半,将其中的一半置于 2 只培养皿中,每皿 100 个半粒,加入适量的 0.5% TTC 溶液,以覆盖种子为度。
然后置于 30 ℃恒温箱中 1 h 。
观察结果,凡胚被染为红色的是活种子。
将另一半在沸水中煮 5 min 杀死胚,作同样染色处理,作为对照观察。
3. 计算活种子的百分率,如果可能的话与实际发芽率作一比较看是否相符?
Ⅱ溴麝香草酚蓝法( BTB 法)
一、原理
凡活细胞必有呼吸作用,吸收空气中的 O 2 放出 CO 2 。
CO 2 溶于水成为 H 2 CO 3 , H 2 CO 3 解离成 H + 和 HCO 3 ˉ,使得种胚周围环境的酸度增加,可用溴麝香草酚蓝( BTB )来测定酸度的改变。
BTB 的变色范围为 pH6.0 ~ 7.6 ,酸性呈黄色,碱性呈蓝色,中间经过绿色(变色点为 pH 7.1 )。
色泽差异显著,易于观察。
二、实验材料、试剂与仪器设备
玉米种子。
(二)试剂
0.1% BTB 溶液:称取 BTB 0.1 g ,溶解于煮沸过的自来水中(配制指示剂的水应为微碱性,使溶液呈蓝色或蓝绿色,蒸馏水为微酸性不宜用),然后用滤纸滤去残渣。
滤液若呈黄色,可加数滴稀氨水,使之变为蓝色或蓝绿色。
此液贮于棕色瓶中可长期保存。
(三)仪器设备
恒温箱,天平,刀片,烧杯,镊子,培养皿,滤纸,漏斗。
三、实验步骤
1. 浸种同上述 TTC 法。
2. BTB 琼脂凝胶的制备取 0.1% BTB 溶液 100 mL 置于烧杯中,将 1 g 琼脂剪碎后加入,用小火加热并不断搅拌。
待琼脂完全溶解后,趁热倒在 4 个干洁的培养皿中,使成一均匀的薄层,冷却后备用。
3. 显色取吸胀的种子 200 粒,整齐地埋于准备好的琼脂凝胶培养皿中,种子胚朝下平放,间隔距离至少 l cm 。
然后将培养皿置于 30 ~ 35 ℃下培养 1 ~ 2 小时,在蓝色背景下观察,如种胚附近呈现较深黄色晕圈是活种子,否则是死种子。
4. 计算活种子百分率。
用沸水杀死的种子作同样处理,进行对比观察。
Ⅲ红墨水染色法
一、原理
有生活力的种子其胚细胞的原生质具有半透性,有选择吸收外界物质能力,某些染料如红墨水中的大红 G 不能进入细胞内,胚部不着色。
而丧失生活力的种子其胚部细胞原生质膜丧失了选择吸收的能力,染料进入细胞内是胚部染色,所以可根据种子胚部是否染色来判断种子的生活力。
二、实验材料、试剂与仪器设备
(一)实验材料
玉米、小麦等种子。
(二)试剂
5% 红墨水。
(三)仪器设备
恒温箱,培养皿,刀片,烧杯,镊子。
三、实验步骤
1 .浸种同上述 TTC 法。
2 .染色取已吸胀的种子 200 粒,沿胚的中线切为两半,将一半置于培养皿中,加入 5% 红墨水(以淹没种子为度),染色 10 ~ 15 min (温度高时间可短些)。
3 .观察染色后倒去红墨水,用水冲洗多次,至冲洗液无色为止。
检查种子死活,凡种胚不着色或着色很浅的为活种子;凡种胚与胚乳着色程度相同的为死种子。
可用沸水杀死的种子作对照观察。
4 .计算有生活力种子的百分率。
Ⅳ纸上荧光法
一、原理
具有生活力的种子和已经死亡的种子,它们的种皮对物质的透性是不同的,而许多植物的种子中又都含有荧光物质。
利用对荧光物质的不同透性来区分种子的死活,方法简单,特别是对十字花科植物的种子,尤为适用。
二、实验材料与仪器设备
油菜、白菜等十字花科植物的种子。
(二)仪器设备
紫外荧光灯,镊子,培养皿,滤纸(无荧光)。
三、实验步骤
1. 将完整无损的种子(油菜、白菜等十字花科植物的种子) 100 粒,于 25 ~ 30 ℃水中浸泡 2 ~ 3 小时。
2. 把已吸胀的种子,以 3 ~ 5 mm 间隔整齐地排列在培养皿中的湿滤纸上,滤纸上水分不能过多,以免荧光物质流散彼此影响。
培养皿可以不必加盖,放置 1.5 ~ 2 小时,取去种子,将滤纸阴干。
取出的种子仍按原来顺序排列在另一培养皿中(以备验证)。
3. 将阴干的滤纸置于紫外荧光灯下进行观察,观察如能在暗室中进行,则效果更好。
在放过种子的位置上如见到荧光圈,则为死种子。
如要确证它们是死种子,可将排列在另一培养皿中的这些种子拣出来,集中在一只培养皿的湿滤纸上,而让不产生荧光圈的种子留在培养皿中,维持湿度,让其自然发芽。
4. 3 ~ 4 天后记录培养皿中发芽种子数。
此方法的成败,首先决定于种子中荧光物质的存在,其次决定于种皮的性质。
有些种子无论有无发芽能力,一经浸泡,即有荧光物质透出,大豆即属此类;也有些种子由于种皮的不透性,无论种子死活,都不产生荧光圈,许多植物的种子都会碰到这种个别现象,此时只要用机械方法擦伤种皮,可重复验证。
相反,有时由于收获时受潮,种皮已破裂,也会产生荧光圈,试验时都应该注意。
最好将浸泡液进行检查,没有荧光则适于作试验材料。
[ 思考题 ]
1. 试验结果与实际情况是否相符 ? 为什么 ?
2. 就你所知还有哪些快速方法,可以测定种子的发芽率 ?
3. 试比较 TTC 法、 BTB 法、红墨水法以及纸上荧光法,测定的结果是否相同 ? 为什么 ?。
