2006-2007年化工热力学A答案
《化工热力学》详细课后习题标准答案(陈新志)

- 1 - / 1052习题第1章 绪言一、是否题1. 孤立体系的热力学能和熵都是一定值。
(错。
和,如一体积等于2V 的绝热刚性容器,被一理想的隔板一分为二,左侧状态是T ,P 的理想气体,右侧是T 温度的真空。
当隔板抽去后,由于Q =W =0,,,,故体系将在T ,2V ,0.5P 状态下达到平衡,,,)2. 封闭体系的体积为一常数。
(错)3. 封闭体系中有两个相。
在尚未达到平衡时,两个相都是均相敞开体系;达到平衡时,则两个相都等价于均相封闭体系。
(对)4. 理想气体的焓和热容仅是温度的函数。
(对)5. 理想气体的熵和吉氏函数仅是温度的函数。
(错。
还与压力或摩尔体积有关。
)6. 要确定物质在单相区的状态需要指定两个强度性质,但是状态方程 P=P (T ,V )的自变量中只有一个强度性质,所以,这与相律有矛盾。
(错。
V 也是强度性质)7. 封闭体系的1mol 气体进行了某一过程,其体积总是变化着的,但是初态和终态的体积相等,初态和终态的温度分别为T 1和T 2,则该过程的;同样,对于初、终态压力相等的过程有。
(对。
状态函数的变化仅决定于初、终态与途径无关。
)8. 描述封闭体系中理想气体绝热可逆途径的方程是(其中),而一位学生认为这是状态函数间的关系,与途径无关,所以不需要可逆的条件。
(错。
) 9. 自变量与独立变量是一致的,从属变量与函数是一致的。
(错。
有时可能不一致)10. 自变量与独立变量是不可能相同的。
(错。
有时可以一致)三、填空题1. 状态函数的特点是:状态函数的变化与途径无关,仅决定于初、终态 。
2. 单相区的纯物质和定组成混合物的自由度数目分别是 2 和 2 。
3. 封闭体系中,温度是T 的1mol 理想气体从(P ,V )等温可逆地膨胀到(P ,V ),则所做的功为i i f f(以V 表示)或 (以P 表示)。
4. 封闭体系中的1mol 理想气体(已知),按下列途径由T 1、P 1和V 1可逆地变化至P,则mol ,温度为 和水 。
化工热力学课后习题答案

化工热力学课后习题答案化工热力学课后习题答案解析与实践化工热力学是化学工程专业中的重要课程,它涉及到热力学原理在化工过程中的应用。
课后习题是学生巩固知识、提高能力的重要途径。
本文将针对化工热力学课后习题答案进行解析,并结合实际工程案例进行讨论。
第一题:某化工过程中,液体从100°C冷却至30°C,求其冷却前后的焓变化。
解析:根据热力学知识,焓变化可以通过温度变化和相变潜热来计算。
在这个过程中,液体从100°C冷却至30°C,因此焓变化可以表示为:ΔH = mcΔT + mL其中,m为液体的质量,c为液体的比热容,ΔT为温度变化,L为相变潜热。
实际案例:在化工生产中,液体冷却过程常常会伴随着热量的释放。
比如在冷却塔中,热水经过冷却塔顶部的喷淋装置,通过与空气的接触,将热量传递给空气,使水的温度降低。
这个过程中,热水的焓发生了变化,而释放的热量则被转化为冷却塔底部的冷却水。
第二题:某反应器中,气体从1MPa膨胀至0.1MPa,求其膨胀过程中的焓变化。
解析:气体的膨胀过程可以看作是绝热膨胀,根据绝热过程的热力学关系,焓变化可以表示为:ΔH = C_pΔT其中,C_p为气体的定压比热容,ΔT为温度变化。
实际案例:在化工生产中,气体的膨胀过程常常会伴随着功的输出。
比如在天然气输送管道中,高压天然气经过减压阀膨胀至低压,释放出的能量可以用来驱动压缩机或者发电机,实现能量的转换和利用。
通过以上两个习题的解析和实际案例的讨论,我们可以看到化工热力学的知识在实际工程中的重要性。
掌握热力学原理和应用是化学工程师必备的基本能力,通过课后习题的答案解析和实践案例的讨论,可以帮助学生更好地理解和应用这些知识,提高工程实践能力,为将来的工程实践打下坚实的基础。
化学工程与工艺专业《化工热力学》模拟考试考题A(答案)

华东理工大学20 -20 学年第 学期《化工热力学》课程模拟考试试卷 A (答案)开课学院:化工学院,专业:化学工程与工艺 考试形式:闭卷,所需时间: 120分钟 考生姓名: 学号: 班级: 任课教师:1.当压力大于临界压力时,纯物质就以液态存在。
( × ) 2.纯物质的三相点随着所处压力的不同而改变。
( × ) 3.用一个相当精确的状态方程,就可以计算所有的均相热力学性质随着状态的变化。
( × )4.气体混合物的V irial 系数,如B ,C ,…,是温度和组成的函数。
( √ ) 5.在一定压力下,纯物质的泡点温度和露点温度是相同的,且等于沸点。
( √ ) 6.对于理想溶液,所有的混合过程性质变化均为零。
( × ) 7.在二元系统的汽液平衡中, 若组分1是轻组分,组分2是重组分,若温度一定,则系统的压力随着1x 的增大而增大。
( × )8.偏摩尔焓的定义可表示为()[][],,,,j i j i i i i T p n T p n nH H H n x ∂⎡⎤⎛⎫∂== ⎪⎢⎥∂∂⎝⎭⎣⎦。
( × ) 9.Gibbs-Duhem 方程可以用来检验热力学实验数据的一致性。
( √ ) 10.自然界一切实际过程总能量守恒,有效能无损失。
( × ) 11.能量衡算法用于过程的合理用能分析与熵分析法具有相同的功能。
( × ) 12.当化学反应达到平衡时,反应的Gibbs 自由焓变化值G ∆等于零。
( √ ) 二、单项选择题(共20分,每小题2分)1.指定温度下的纯物质,当压力低于该温度下的饱和蒸汽压时,则物质的状态为:( D )(A) 饱和蒸汽; (B) 超临界流体; (C) 压缩液体; (D) 过热蒸汽 2.单元操作的经济性分析中,功耗费用和下列哪个因素有关( C )。
(A) 理想功; (B) 有效能; (C) 损耗功; (D) 环境温度3.一流体从状态1分别经历可逆过程R 与不可逆过程NR 到达状态2,两个过 程的环境状态相同,则过程R 的理想功比过程NR 的理想功要:( A ) (A) 相等; (B) 大; (C) 小; (D) 不确定 4.由混合物的逸度的表达式ig ˆln i i i G G RT f =+知,ig i G 的状态为:( B ) (A) 系统温度,1=p 的纯组分i ;(B) 系统温度、1=p 的纯组分i 的理想气体状态; (C) 系统温度,系统压力的纯组分i 的理想气体状态; (D) 系统温度,系统压力,系统组成的温度的理想混合物。
化工热力学考试5套题库与答案
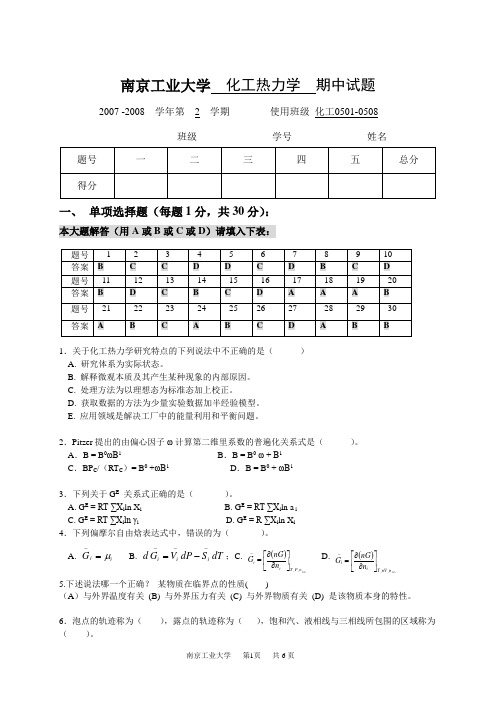
南京工业大学 化工热力学 期中试题2007 -2008 学年第__2__学期 使用班级_化工0501-0508_班级 学号 姓名一、 单项选择题(每题1分,共30分):本大题解答(用A 或B 或C 或D )请填入下表:1.关于化工热力学研究特点的下列说法中不正确的是( ) A. 研究体系为实际状态。
B. 解释微观本质及其产生某种现象的内部原因。
C. 处理方法为以理想态为标准态加上校正。
D. 获取数据的方法为少量实验数据加半经验模型。
E. 应用领域是解决工厂中的能量利用和平衡问题。
2.Pitzer 提出的由偏心因子ω计算第二维里系数的普遍化关系式是( )。
A .B = B 0ωB 1 B .B = B 0 ω + B 1 C .BP C /(RT C )= B 0 +ωB 1 D .B = B 0 + ωB 13.下列关于G E 关系式正确的是( )。
A. G E = RT ∑X i ln X iB. G E = RT ∑X i ln a iC. G E = RT ∑X i ln γiD. G E = R ∑X i ln X i 4.下列偏摩尔自由焓表达式中,错误的为( )。
A. i i G μ=-B. dT S dP V G d i i i ----=;C.()ij n P T i i n nG G ≠⎥⎦⎤⎢⎣⎡∂∂=-,, D.()ij n nV T i i n nG G ≠⎥⎦⎤⎢⎣⎡∂∂=-,,5.下述说法哪一个正确? 某物质在临界点的性质( )(A )与外界温度有关 (B) 与外界压力有关 (C) 与外界物质有关 (D) 是该物质本身的特性。
6.泡点的轨迹称为( ),露点的轨迹称为( ),饱和汽、液相线与三相线所包围的区域称为( )。
A. 饱和汽相线,饱和液相线,汽液共存区B.汽液共存线,饱和汽相线,饱和液相区C. 饱和液相线,饱和汽相线,汽液共存区7.关于逸度的下列说法中不正确的是 ( ) (A )逸度可称为―校正压力‖ 。
《化工热力学》通用型答案(一)

《化工热力学》通用型答案(一)《化工热力学》通用型答案作为化工热力学课程的重要组成部分,热力学题目的解答是学生们需要掌握的重点内容之一。
然而,由于热力学问题本身的复杂性和多变性,同样的问题可能有不同的解法。
因此,让学生们了解并正确掌握通用型答案,是提高他们热力学题目解答能力的必要途径之一。
所谓通用型答案,是指解答常见的热力学问题时所需的基本公式和方法。
以下是热力学学科中常见问题的通用型答案:一、热力学基础概念问题:1.熵表征了热力学系统的无序程度,是热力学基础概念之一。
2.焓表征了热力学系统的内能和对外界做功的综合影响。
3.内能是系统所有分子的动能和势能之和。
二、热力学题目解答问题:1.计算内能变化量的公式:ΔU=Q-W,其中Q为热量,W为做功量。
2.计算焓变的公式:ΔH=Qp+W,其中Qp为在宏观压强下的热量,W为在宏观压强下做功量。
3.计算熵变的公式:ΔS=Q/T,其中Q为热量,T为温度。
4.计算Gibbs自由能变化量的公式:ΔG=ΔH-TΔS,当ΔG<0时,化学反应是自发的。
5.计算化学反应热效率的公式:η=(∆H反应/∆H燃烧)*100%,其中∆H 反应为化学反应的焓变,∆H燃烧为化学反应的燃烧热。
以上就是化工热力学中常见问题的通用型答案。
当然,在实际解答问题时,根据不同的题目类型和条件,可能需要对这些公式和方法进行适当调整或组合。
因此,在掌握通用型答案的基础上,学生们仍需不断积累实践经验,以逐渐提高自己的热力学问题解答能力。
最后,提醒学生们注意热力学问题中量纲的统一和单位制的选择,以免在计算过程中产生错误。
另外,学生们还应当了解热力学问题的一些常见误区和典型错误,以免在解答问题中陷入这些误区。
通过对热力学问题的深入学习和实践掌握,相信学生们一定能够在未来的实际工作和研究中充分发挥热力学知识的价值。
化工热力学课后题答案

习题:2-1.为什么要研究流体的pVT 关系?答:在化工过程的分析、研究与设计中,流体的压力p 、体积V 和温度T 是流体最基本的性质之一,并且是可以通过实验直接测量的。
而许多其它的热力学性质如内能U 、熵S 、Gibbs 自由能G 等都不方便直接测量,它们需要利用流体的p –V –T 数据和热力学基本关系式进行推算;此外,还有一些概念如逸度等也通过p –V –T 数据和热力学基本关系式进行计算。
因此,流体的p –V –T 关系的研究是一项重要的基础工作。
2-2.理想气体的特征是什么?答:假定分子的大小如同几何点一样,分子间不存在相互作用力,由这样的分子组成的气体叫做理想气体。
严格地说,理想气体是不存在的,在极低的压力下,真实气体是非常接近理想气体的,可以当作理想气体处理,以便简化问题。
理想气体状态方程是最简单的状态方程:RT pV =2-3.偏心因子的概念是什么?为什么要提出这个概念?它可以直接测量吗?答:纯物质的偏心因子ω是根据物质的蒸气压来定义的。
实验发现,纯态流体对比饱和蒸气压的对数与对比温度的倒数呈近似直线关系,即符合:⎪⎪⎭⎫ ⎝⎛-=r sr Tp 11log α 其中,cs s r p p p = 对于不同的流体,α具有不同的值。
但Pitzer 发现,简单流体(氩、氪、氙)的所有蒸气压数据落在了同一条直线上,而且该直线通过r T =0.7,1log -=sr p 这一点。
对于给定流体对比蒸气压曲线的位置,能够用在r T =0.7的流体与氩、氪、氙(简单球形分子)的sr p log 值之差来表征。
Pitzer 把这一差值定义为偏心因子ω,即)7.0(00.1log =--=r s r T p ω任何流体的ω值都不是直接测量的,均由该流体的临界温度c T 、临界压力c p 值及r T =0.7时的饱和蒸气压s p 来确定。
2-4.纯物质的饱和液体的摩尔体积随着温度升高而增大,饱和蒸气的摩尔体积随着温度的升高而减小吗?答:正确。
化工热力学复习题大题答案

化工热力学复习题大题答案化工热力学复习题大题答案热力学是化工工程中一个重要的学科,它涉及到热量、能量和物质的转化与传递。
在化工工程中,热力学的应用十分广泛,因此掌握热力学的基本原理和计算方法对于化工工程师来说至关重要。
下面将给出一些化工热力学的复习题大题答案,希望能够帮助大家更好地理解和掌握热力学知识。
1. 一个封闭系统由两个子系统组成,它们之间通过一个绝热可逆壁隔开。
子系统1的体积为V1,温度为T1,子系统2的体积为V2,温度为T2。
求整个系统的熵变。
解答:根据热力学第二定律,一个绝热可逆过程中,熵不变。
因此,整个系统的熵变为0。
2. 一个理想气体从初始状态A经过一系列过程到达最终状态B。
过程1是等温过程,过程2是绝热过程,过程3是等容过程。
已知初始状态A的压力为P1,温度为T1,体积为V1,最终状态B的压力为P2,温度为T2,体积为V2。
求过程1、过程2和过程3的熵变。
解答:过程1是等温过程,根据理想气体的熵变公式,熵变为ΔS1 =nRln(V2/V1)。
过程2是绝热过程,根据理想气体的熵变公式,熵变为ΔS2 = 0。
过程3是等容过程,根据理想气体的熵变公式,熵变为ΔS3 = nCvln(T2/T1)。
3. 一个封闭系统由一个绝热可逆壁分成两个部分,每个部分包含1mol理想气体。
初始状态为A,温度为T1,体积为V1,最终状态为B,温度为T2,体积为V2。
求整个系统的熵变。
解答:根据热力学第二定律,一个绝热可逆过程中,熵不变。
因此,整个系统的熵变为0。
4. 一个理想气体从初始状态A经过一系列过程到达最终状态B。
过程1是等温过程,过程2是绝热过程,过程3是等压过程。
已知初始状态A的压力为P1,温度为T1,体积为V1,最终状态B的压力为P2,温度为T2,体积为V2。
求过程1、过程2和过程3的熵变。
解答:过程1是等温过程,根据理想气体的熵变公式,熵变为ΔS1 =nRln(V2/V1)。
过程2是绝热过程,根据理想气体的熵变公式,熵变为ΔS2 = 0。
化工热力学试题答案第一组

一、选择。
1.下列热力学基本关系式与Maxwell 公式中,错误的是( C ) A. dG=VdP-SdT B. dH=TdS+VdpC. ⎪⎭⎫⎝⎛∂∂⎪⎭⎫ ⎝⎛∂∂-=V S T P TVD.⎪⎭⎫⎝⎛∂∂⎪⎭⎫⎝⎛∂∂-=S P V T VS2.、气体经过稳流绝热膨胀,对外作功,如忽略宏观动能,位能变化,无摩擦损失,则此过程气体焓值 ( B ) 。
A. 增加 B. 减少 C. 不变 D.不确定3.关于制冷原理,以下说法不正确的是( D )。
A. 任何气体,经等熵膨胀后,温度都会下降 。
B. 只有当,经节流膨胀后,气体温度才会降低。
C. 在相同初态下,等熵膨胀温度降比节流膨胀温度降大。
D. 任何气体,经节流膨胀后,温度都会下降4.对于理想溶液,下列说法正确的是(D ) A.0,0>>E E H V B.0,0<>E E H V C.0,0≥≤E E H V D.0,0==E E H V5、混合物的逸度f 与组分逸度i f ∧之间的关系是 ( D ) A .f=ii f x ^∑B .f=if ^∑C .f=ii f x^ln ∑D .lnf i i i x f x /ln ^∑=二、填空1、等温线在两相区中的水平线段随温度升高而 缩短 最后再临界处 缩成一点 纯物质PV 图临界点处的斜率和曲率都等于 0 。
2、温-熵图是最有用的热力学性质图,其纵坐标是温度,横坐标是熵。
对于可逆过程TdS Q R =δ 。
在T-S 图上位于T-S 曲线下的面积等于 可逆过程吸收或放出的热量 。
3.一定状态下体系的火用指体系由该状态达到与 __环境基态完全平衡____ 时,此过程理想功。
4.对封闭体系,单位质量能量平衡方程式是__△U =Q +W_______,对稳定流动体系单位质量能量的平衡方程式是__△H +1/2△U2 +g △z=Q+Ws 或△H +△Ek +△Ep =Q +Ws _______.5.温度为T 的热源与温度为T0的环境之间进行变温热量传递,其等于热容为Cp ,则ExQ 的计算式为( )。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2006-2007年化工热力学A一.填空题(每题2分,共20分)1. 正丁烷的偏心因子ω=0.193,临界压力为p c =3.797MPa ,则在Tr =0.7时的蒸汽压为(0.2435 )MPa 。
2. 封闭系统中,温度为25℃的1mol 理想气体从10MPa ,0.3m3等温可逆膨胀到0.1MPa ,30 m3,则所做的功为(-11.4kJ,RTln (p 2/p 1))。
3. 节流膨胀的Joule-Thomson 效应系数的定义式为(HJP T ⎥⎦⎤⎢⎣⎡∂∂=μ)4. 等熵效率的定义是对膨胀做功过程,(不可逆绝热过程的做功量)与(可逆绝热过程的做功量)之比5. 温度为T 的恒温热源的热量Q ,其E xQ 的计算式为(E xQ =(1-T 0/T )Q )。
6. 对于理想气体,节流膨胀后温度( 不变 ),作外功的绝热膨胀时,温度(下降)。
7. 液态水常压下从25℃加热至50℃,其等压平均热容为75.31J/mol,则此过程的焓变为(1882.75)J/mol 。
8. 二元非理想溶液在极小浓度的条件下,其溶质组分遵守(Henry )规则,溶剂组分遵守( Lewis-Randll )规则。
9. 纯物质的临界等温线在临界点的斜率和曲率均为零,数学上可表示为( 0)/(=∂∂TV p )和( 0)/(22=∂∂T Vp )。
10. 对于孤立体系,熵增原理可采用( 0dS ≥ )表达式表示。
二、 简答题:(每题5分,共20分)1.分析改变蒸汽的参数如何改变Rankine 循环的效率。
2.写出稳流体系的熵平衡方程,并指出各项的含义。
答:i i j j Q m S m S S Tδ-++∆=∑∑⎰产生入出3.写出维里方程中维里系数B 、C 的物理意义,并写出舍项维里方程的混合规则。
答:第二维里系数B 代表两分子间的相互作用,第三维里系数C 代表三分子间相互作用,B 和C 的数值都仅仅与温度T 有关;舍项维里方程的混合规则为:∑∑===ni nj ijj i M B y y B 11,()10ijij ijcijcijij B Bp RTB ω+=,6.10422.0083.0prij T B -=,2.41172.0139.0prij T B -=,cijpr T T T =,()()5.01cjci ij cij T T k T ⋅-=,cijcijcij cij V RT Z p =,()[]331315.0Cjcicij V V V +=,()cjci cijZ Z Z +=5.0,()ji ijωωω+=5.04.写出理想溶液组分的偏摩尔性质(焓、熵、自由焓、体积、内能)与纯物质性质间的关系表达式。
答:ln ln i i i i i ii i i i i iV V U U H H S S R x G G R T x ====-=+三、苯(1)和环己烷(2)的二元液体混合物的超额自由焓与组成的关系可用如下式表示:21x x RTGEβ=β与温度和压力有关,与组成无关,在0.101MPa 时,β与温度的关系为:T004.071127.1-=β计算在40℃、0.101MPa 下,H E /RT 、 S E /R 、活度系数与组成的关系。
(15分)解:1.jn P T i Ein RT G n ,,ln ⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎣⎡∂⎪⎪⎭⎫ ⎝⎛∂=γ得:212221ln ,ln x x βγβγ==40℃、0.101Mpa 时,212221458.0ln ,458.0ln x x ==γγ2.由2,ln RTH TE i xp i-=⎪⎭⎫⎝⎛∂∂γ得∑⎪⎭⎫⎝⎛∂∂-=xp i i E T x RTH ,2ln γ21,222,1004.0ln ,004.0ln x T x T xp x p -=⎪⎭⎫ ⎝⎛∂∂-=⎪⎭⎫ ⎝⎛∂∂γγ,故得: 21212221253.115.313*004.015.313*004.0x x x x x x RT HE=+=由RTGRTHRSEEE-=得:=RSE1.25321x x -045821x x =0.79521x x四、某朗肯循环以水为工质,运行于14MPa 和0.007MPa 之间,循环最高温度为540℃,求:(1) 水泵消耗的理论功; (2) 汽轮机作出的理论功; (3) 循环的热效率。
3对水泵能量衡算:H 4-H 3=Wp H 4=168.79+14=182.79 kJ/kgQ 1=H 1-H 4=3448-182.79=3265.21 kJ/kg (2)求干度:S 2=S 1=S 3(1-x )+ S 4*x 6.5199=0.5764(1-x )+8.2515x 得:x =0.774H 2=H 3(1-x )+ H 4*x=168.79(1-0.774)+2574.8*0.774=2032 kJ/kg 对汽轮机能量衡算:Ws =H 2-H 1=2032-3448=-1416 kJ/kg (3)11416140.4293265.21s pTW W Q η---===五、某换热器完全保温,热流体流量为0.042kg/s ,进、出换热器的温度分别为150℃、35℃,等压热容为4.36kJ/kgK 。
冷流体进、出换热器的温度分别为25℃、110℃,等压热容为4.69kJ/kgK 。
计算冷热流体的有效能的变化、损失功和目的有效能效率。
环境温度为293k ,压力0.101MPa 。
(15分) 解:(1)计算冷流体的流量0.042 4.36(15035)0.0528/4.69(11025)ppc hc c h hc Q m C T m C T m kg S=∆=∆⨯⨯-==⨯-(2)求有效能的变化,02,01,ln1102730.0528 4.6911025293ln 252732.853/ppx c c c c c cc c c cE H T S T m C T T m C T kJ S∆=∆-∆=∆-+=⨯--⨯+()=同理可得热流体的有效能的变化:, 4.036/x h E kJ S∆=-(3) 损失功和目的有效能效率2,2,001,1,ln ln)2930.004 1.172/ppc c chl c h ccT T W T S T m C m C T T kJ S=∆+=⨯=总=(,( 2.8530.707( 4.036x E x x E E η∆=∆获得)==失去)六、使用R-K 状态方程计算从p 1=0.1013MPa ,t 1=0℃压缩到p 2=20.26MPa ,t 2=200℃时1mol 甲烷的焓变。
已知甲烷的*18.110.0602(/)p C T J m o l K =+∙。
R-K 方程为:(15分)。
1.522.51(),/,/,110.42748,0.0864, 4.6,190.6CC C C CCA hA B Z a bR TB bp R T h hB h BZR T R T a b p M P a T Kp p =-===-+====解:设计状态变化为:△HP 1,T 1(真实) P 2,T 2(真实)1RH - 2R H△H*P 1,T 1(理想) P 2,T 2(理想) (1)求V1,V2得到a =3.222(Pam 6K 0.5mol -2),b=2.985*10-5(m 3/mol) B=1.332*10-3,A/B=2.876 得叠代式:31 1.332102.876(),11h Zh hhZ-⨯=-=-+叠代得Z1=0.9975,V1=0.0224(m 3/mol)对于V2,同理得:B=0.1537,A/B=1.261,Z2=1.013,V1=1.97*10-4(m 3/mol)(2)求1R H ,2R H31ln (1)2RHA Z h R TB=--+得:1R H =-17.58J/mol, 2R H =-999.8 J/mol21***128114.7/7133/T p T R RHC d T J m o lH HH H J m o l∆==∆=∆-+=⎰。
