各种氨基酸理化性质-20101202综述
各种氨基酸理化性质-20101202

各种氨基酸性质
酸的酶进行水解,再利用游离氨基酸与酰化体的溶解度差进行分离。化学合成法生产 成本高,反应复杂,步骤多,且有许多副产物。
3.发酵法:利用微生物发酵法生产L-缬氨酸具有原料成本低、反应条件温和及易实 现大规模生产等优点,是一种非常经济的生产方法。 (1)添加前体物发酵法:又称微生物转化法。这种方法使用葡萄糖作为发酵碳源 ,再添加特异的前体物质即在氨基酸生物合成途径中的一些合适中间代谢产物,以避 免氨基酸生物合成途径中的反馈调节作用,经微生物作用将其有效转化为目的氨基酸 。由于其前体物质如丙酮酸等稀少或价格昂贵,目前已少采用此法生产L-缬氨酸。 (2)直接发酵法:是借助于微生物具有合成自身所需氨基酸的能力,通过对特定微 生物ide诱变处理,选育出营养缺陷型及氨基酸结构类似物抗性突变株,以解除代谢调 节中的反馈抑制和反馈阻遏作用,从而达到过量累积某种氨基酸的目的。目前,世界 上L-缬氨酸均采用直接发酵法生产。国外曾对发酵法所用L-缬氨酸优良生产菌株的诱 变育种和代谢调节作了一些研究,而国内尚处于研究与小规模生产阶段,菌株产酸水 平不高,生产水平和产量远不能满足市场需求。因此,以微生物发酵法生产L-缬氨酸 的研究具有重要的意义。
物理性质:本品为白色结晶或结晶性粉末;无臭,味微甜而后苦 ;在水中
溶解,在乙醇中几乎不溶;等电点6.00。
化学性质:具有氨基酸的通性。 生产工艺: 目前,L-缬氨酸的生产方法有提取法、合成法、发酵法等。
1.提取法:动物血粉、蚕蛹及毛发水解液中L-缬氨酸的含量较高,从动物血粉 和蚕蛹水解液中,应用离子交换技术从混合氨基酸中分离L-缬氨酸,分离的效率高 ,提取操作简单,生产周期短,但成本高,不适合现代化大工业生产猪血粉中提 取L-缬氨酸的回收率为14.7%;蚕蛹水解液中分离L-缬氨酸,回收率为23.68%
氨基酸基本的理化性质
R CH
N O O
+ H2O
6.1.2肽类物质 6.1.2.1活性肽的种类及功能 生物活性肽也称作功能肽,是近年来非常活跃的研究领域,其应用涉 及到生物学、医药学、化学等多种学科,在食品科学研究及功能食品开发 中也显示出美好的前景。 功能肽按照获得途径的差异可以分作两种类型,一类是由生物体特别 是动物体内获得的天然功能肽;另一类是利用动植物蛋白,通过水解或酶 解,再经过活性筛选而获得的外源性功能肽。 一、天然活性肽 目前,由自然界已经获得了种类多样、功能各异的生物活性肽,下页 列举了一些这方面的例证。 昆虫抗菌肽 :迄今为止,已有150多种昆虫抗菌肽被分离鉴定,许多 抗菌肽的cDNA已被克隆测序并进行了初步的基因定位和表达调控机制研 究。昆虫抗菌肽已成为当前研究的热点,某些抗菌肽正在通过基因工程技 术开始工业化生产并用于农业、工业和食品卫生等多个领域。
三、活性肽在食品中的应用
营养学研究证明,功能肽类在人体内的消化吸收明显优于蛋白质和单个氨基 酸,对人体内蛋白质的合成无任何不良影响,而且具有促进钙吸收、降血压、提高 免疫力等生理功能。此外,功能肽具有良好的水合性,使其溶解度增加,黏度降低、 胶凝程度减小,发泡性丧失,具有优良的加工性能。目前在食品中已经应用或出现 了应用苗头的功能肽主要有以下种类。
6.1.2.2肽的理化性质 一、肽的物理性质 A、肽的两性:与氨基酸相似,肽类物质也具有两性和等电点。例如 Gly-Asp pI3.63;Gly-Gly-Gly pI5.58;利用多肽的等电点,可以进行肽类 物质的分离。 B、黏度与溶解度 天然蛋白的水溶液当其浓度超过13%时就会形成凝胶,不利于蛋白溶液 的制备;而多肽即使在50%的高浓度下和在较宽的pH范围内仍能保持溶
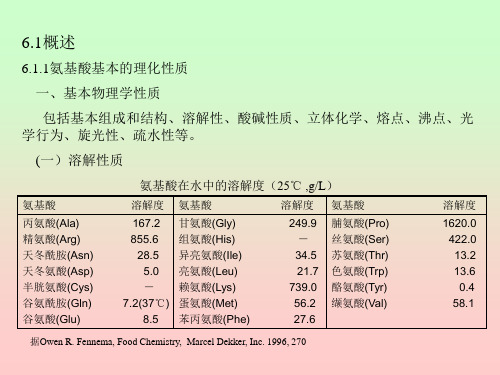
据Owen R. Fennema, Food Chemistry, Marcel Dekker, Inc. 1996, 270
常见的氨基酸的分类特点及理化性质

非极性氨基酸的理化性质
2
疏水性
非极性氨基酸具有很强的疏水性。
4
溶解性
非极性氨基酸在水中的溶解度较低,但在有机溶剂如酒精或丙酮中的溶解度较高。
8
热稳定性
非极性氨基酸的烷基或芳基结构使其具有较高的热稳定性,可以在较高温度下保持结构完整。 非极性氨基酸由于其疏水性,在蛋白质折叠过程中通常会聚集在蛋白质的内部,形成疏水性核心,使得蛋白质整体结 构更加紧密和稳定。
氨基酸的酸碱性
氨基酸中的氨基(-NH2)和羧基(-COOH)具有不同的酸碱性。氨基是弱碱性基 团,而羧基是弱酸性基团。在水溶液中,氨基和羧基会发生质子交换反应,形 成两性离子。这种两性离子的pH值称为氨基酸的等电点(pI)。
1-14
—
pH
pH 值范围
氨基酸在不同pH值下会呈现不同的 离子形式,从而影响其理化性质和
抗原-抗体反应、免 疫标记等
氨基酸的生物学功能
蛋白质合成
氨基酸是构建生物体内蛋白质 的基本单位,是决定蛋白质结构 和功能的关键要素。
能量来源
通过代谢氧化,某些氨基酸可以 向细胞提供ATP,满足机体的能 量需求。
细胞信号传导
部分氨基酸及其代谢产物可作 为细胞间信号传递的载体,调节 生理过程。
抗氧化防护
农业应用
氨基酸可用作生物农药和 叶面肥料,提高作物抗病虫 能力和产量。还可用于饲 料添加,改善动物营养和生 长。
工业生产
许多工业合成过程需要用 到氨基酸,如制药、化工、 材料等领域。它们可作为 原料、催化剂或中间体。
氨基酸的研究进展
持续创新
科学家们不断探索新的技术和方法来研 究氨基酸的结构、性质和功能,推动着这 一领域的持续创新。
常见的氨基酸的分类特点及理化性质

常见的氨基酸的分类特点及理化性质氨基酸是构成蛋白质的基本单位,是生物体内重要的有机化合物。
它们在生物体内发挥着多种功能,如参与蛋白质合成、信号传递、代谢调节等。
根据氨基酸的结构和性质,可以将它们分为不同的类别,并探讨其理化性质。
一、氨基酸的分类特点1. 根据侧链的结构,氨基酸可以分为非极性氨基酸、极性氨基酸、酸性氨基酸和碱性氨基酸。
(1)非极性氨基酸:侧链不含有极性基团,如甘氨酸、丙氨酸、缬氨酸等。
它们在蛋白质中主要起到结构支撑的作用。
(2)极性氨基酸:侧链含有极性基团,如丝氨酸、苏氨酸、天冬氨酸等。
它们在蛋白质中主要起到与水分子和其他极性分子相互作用的作用。
(3)酸性氨基酸:侧链含有羧基,如天冬氨酸、谷氨酸等。
它们在蛋白质中主要起到调节蛋白质电荷的作用。
(4)碱性氨基酸:侧链含有氨基,如赖氨酸、精氨酸等。
它们在蛋白质中主要起到与酸性氨基酸相互作用,维持蛋白质稳定性的作用。
2. 根据侧链的功能,氨基酸可以分为疏水性氨基酸、亲水性氨基酸、带电氨基酸和带负电氨基酸。
(1)疏水性氨基酸:侧链不含有极性基团,如甘氨酸、丙氨酸、缬氨酸等。
它们在蛋白质中主要起到结构支撑的作用。
(2)亲水性氨基酸:侧链含有极性基团,如丝氨酸、苏氨酸、天冬氨酸等。
它们在蛋白质中主要起到与水分子和其他极性分子相互作用的作用。
(3)带电氨基酸:侧链含有氨基或羧基,如赖氨酸、精氨酸、天冬氨酸等。
它们在蛋白质中主要起到调节蛋白质电荷的作用。
(4)带负电氨基酸:侧链含有羧基,如谷氨酸、天冬氨酸等。
它们在蛋白质中主要起到与带正电氨基酸相互作用,维持蛋白质稳定性的作用。
二、氨基酸的理化性质1. 溶解性:氨基酸的溶解性与其侧链的结构和性质有关。
非极性氨基酸在水中的溶解性较差,而极性氨基酸和带电氨基酸在水中的溶解性较好。
2. 等电点:氨基酸的等电点是指其在溶液中呈电中性的pH值。
不同氨基酸的等电点不同,与其侧链的结构和性质有关。
3. 水解反应:氨基酸在水中可以发生水解反应,相应的羧酸和胺。
氨基酸的分类特点和理化性质

氨基酸的分类特点和理化性质氨基酸是构成蛋白质的基本单位,具有多种功能和作用。
根据它们的理化性质和分类特点,氨基酸可以分为非极性氨基酸、极性氨基酸和特殊氨基酸。
1.非极性氨基酸:非极性氨基酸的中心原子由一个氨基基团(NH2)、一个羧基(COOH)、一个氢原子(H)和一个碳原子(C)组成。
这类氨基酸的侧链由多种有机基团组成,不带任何阳离子或阴离子功能性团。
它们通常不溶于水,但溶于有机溶剂。
在生物体内,非极性氨基酸主要负责蛋白质的折叠和稳定。
在非极性氨基酸中,最简单的是甘氨酸、丙氨酸和异亮氨酸等。
这些氨基酸的侧链中带有碳和氢原子,由于不带电荷,属于非极性,因此有亲水性较强。
2.极性氨基酸:这类氨基酸的侧链通常包含含氧或氮等具有强电负性的原子,可以形成氢键、离子键等。
大多数极性氨基酸具有亲水性,能与水进行相互作用,因此溶解度较高。
极性氨基酸可以进一步分为酸性和碱性氨基酸。
-酸性氨基酸:这类氨基酸的侧链含有羟基和羧基,具有负电荷。
代表性的酸性氨基酸有天冬氨酸和谷氨酸等。
这些氨基酸在水溶液中具有酸性,能够释放出负电荷的氢离子,与基性氨基酸发生中和反应。
-碱性氨基酸:这类氨基酸的侧链含有氨基和胺基等功能性团,在水溶液中带正电荷。
代表性的碱性氨基酸有赖氨酸和精氨酸等。
这些氨基酸能够接受负电荷的氢离子,与酸性氨基酸发生中和反应。
3.特殊氨基酸:这是一类在生物体中含量较少,具有特殊功能和结构的氨基酸。
代表性的特殊氨基酸有脯氨酸、半胱氨酸、甲硫氨酸等。
这些氨基酸的结构中具有额外的官能团,能够参与特殊的生化反应和代谢途径。
总的来说,氨基酸的分类特点主要根据其理化性质和功能特点来区分。
非极性氨基酸主要由碳和氢原子组成,溶解度较低,主要负责蛋白质的结构稳定;极性氨基酸具有亲水性,溶解度较高,包括酸性和碱性两种,具有酸碱中和的作用;特殊氨基酸则具有特殊的结构和功能,用于特定的生化反应和代谢途径。
这些特征使得氨基酸能够在生物体内进行多种功能的发挥,并形成复杂的蛋白质结构。
氨基酸的分类特点及理化性质详解演示文稿

(2)、氨基酸的pK值和氨基酸解离的关系
• 氨基酸在结晶形态或在水溶液中,并不是以游离的羧基或氨基 形式存在,而是离解成兼性离子。在兼性离子中,氨基是以质 子化(-NH3+)形式存在,羧基是以离解状态(-COO-)存在。
• 在不同的pH条件下,两性离子的状态也随之发生变化。
COOH -H+
含羟基氨基酸
O H2N CH C OH
CH OH CH3
第24页,共86页。
氨基酸的结构
天冬酰胺 Asnaragine
含酰胺氨基酸
O H2N CH C OH
CH2 CO NH2
第25页,共86页。
பைடு நூலகம்
氨基酸的结构
天冬酰胺 Asnaragine
谷氨酰胺 Glutamine
含酰胺氨基酸
O H2N CH C OH
• 在近紫外区(220-300nm) 只有酪氨酸、苯丙氨酸和 色氨酸有吸收光的能力。 可以通过测定280nm 处的 紫外吸收值的方法对蛋白溶 液进行定量。
• 苯丙氨酸的max=257nm,
257=2.0x102
• 酪氨酸的max=275nm, 275=1.4x103
• 色氨酸的max=280nm, 280=5.6x103
脂肪族氨基酸
O H2N CH C OH
CH CH3 CH3
第9页,共86页。
氨基酸的结构
甘氨酸
丙氨酸
缬氨酸
亮氨酸
Glycine
Alanine
Valine
Leucine
脂肪族氨基酸
O
H2N
CH C OH CH2 CH CH3
CH3
第10页,共86页。
氨基酸的分类特点及理化性质
1
2
氨基酸的结构
甘氨酸 Glycine 丙氨酸 Alanine 缬氨酸 Valine 亮氨酸 Leucine
脂肪族氨基酸
1
2
氨基酸的结构
甘氨酸 Glycine 丙氨酸 Alanine 缬氨酸 Valine 亮氨酸 Leucine 异亮氨酸 Ileucine
要求: 能倒背
不用的字母
JUZBOX
L-氨基酸的基本结构
C
H
H2N
COOH
R
α碳原子,不对称碳原子
侧链
二十种氨基酸除Gly外全是L-型。 Pro呢?
残基:在肽链中氨基酸之间脱去一个水分子,脱水后的残余部分叫残基(residue), 因此蛋白质肽链中的氨基酸统统是残基形式。
Chiral carbon
脂肪族氨基酸
亚氨基酸
氨基酸的结构
甘氨酸 Glycine
丙氨酸 Alanine
缬氨酸 Valine
亮氨酸 Leucine
异亮氨酸 Ileucine
脯氨酸 Proline
含硫氨基酸
氨基酸的结构
甘氨酸 Glycine
丙氨酸 Alanine
缬氨酸 Valine
亮氨酸 Leucine
异亮氨酸 Ileucine
脯氨酸 Proline
甲硫氨酸 Methionine
含硫氨基酸
氨基酸的结构
甘氨酸 Glycine
丙氨酸 Alanine
缬氨酸 Valine
亮氨酸 Leucine
异亮氨酸 Ileucine
脯氨酸 Proline
甲硫氨酸 Methionine
半胱氨酸 Cysteine
氨基酸的结构
苯丙氨酸 Phenylalanine
氨基酸的分类特点及理化性质..共93页文档
21、没有人陪你走一辈子,所以你要 适应孤 独,没 有人会 帮你一 辈子, 所以你 要奋斗 一生。 22、当眼泪流尽的时候,留下的应该 是坚强 。 23、要改变命运,首先改 证了所 有其余 的德性 。--温 斯顿. 丘吉尔 。 25、梯子的梯阶从来不是用来搁脚的 ,它只 是让人 们的脚 放上一 段时间 ,以便 让别一 只脚能 够再往 上登。
谢谢!
51、 天 下 之 事 常成 于困约 ,而败 于奢靡 。——陆 游 52、 生 命 不 等 于是呼 吸,生 命是活 动。——卢 梭
53、 伟 大 的 事 业,需 要决心 ,能力 ,组织 和责任 感。 ——易 卜 生 54、 唯 书 籍 不 朽。——乔 特
55、 为 中 华 之 崛起而 读书。 ——周 恩来
氨基酸的分类特点及理化性质 (2)
I
leucine
亮氨酸
Leu
L
lysine
赖氨酸
Lys
K
methionine
甲硫氨酸 Met
M
phenylalanine 苯丙氨酸
Phe
F
proline
脯氨酸
Pro
P
serine
丝氨酸
Ser
S
threonine
苏氨酸
Thr
T
tryptophan
色氨酸
Trp
W
tyrosine
酪氨酸
Tyr
Y
valine
Ile
Met
Trp
Asn His Thr
第三十二页,课件共有90页
二、氨基酸的理化性质
1、一般物理性质
无色晶体,熔点较高(200℃~300℃) 水中溶解度各不同,取决于侧链。氨基酸 能使水的介电常数增高。氨基酸的晶体是 离子晶体。氨基酸是离子化合物。
第三十三页,课件共有90页
2、氨基酸的旋光性和光吸收
第四十一页,课件共有90页
(2)、氨基酸的pK值和氨基酸解离的关系
• 氨基酸在结晶形态或在水溶液中,并不是以游离的羧基或氨基 形式存在,而是离解成兼性离子。在兼性离子中,氨基是以质 子化(-NH3+)形式存在,羧基是以离解状态(-COO-)存在。
• 在不同的pH条件下,两性离子的状态也随之发生变化。
氨基酸的分类特点及理化性质 (2)
第一页,课件共有90页
氨基酸是蛋白质的基本组成材料
蛋白质用强酸、强碱处理后,可以得到 各种各样的氨基酸。在动植物组织中可以分 离得到26~30种不同的氨基酸。第一个氨基 酸早在两个世纪前就已经被发现,而最后一 个氨基酸在1935年才发现。直到1965年才搞 清楚,只有20种氨基酸才是合成蛋白质的原
氨基酸的理化性质
氨基酸的理化性质生化1. 氨基酸的理化性质两性解离等电点紫外吸收核酸的紫外吸收最大值2. 蛋白质的分子结构一级顺序肽键二硫键二级主链氢键三级全部疏水作用离子键氢键范德华力四级亚基氢键离子键3. 蛋白质的变性空间构象破坏理化性质改变生物活性丧失4. DNA双螺旋结构反向平行互补双链==手螺旋横纵5. 转运RNA结构稀有碱基茎环结构二级三级6. DNA变性氢键断裂只改变二级不改变核苷酸排列增色效应解链吸光值增加融解温度Tm紫外吸收值达最大的%时的温度7. 酶结构结合酶酶蛋白辅助因子辅酶辅基必需集团活性中心结合集团催化集团£8. 值等于2005Y25, —个简单的酶促反应,当[S] Km A,反应速度最大B,反应速度太慢难以测出C,反应速度与底物浓度成正比D,增加底物浓度反应速1度不变E,增加底物浓度反应速度降低时9. 可逆性抑制竞争性非竞争性反竞争性Km丙二酸琥珀酸脱氢酶琥珀酸磺胺二氢叶酸合成酶对氨基苯甲酸210. 变构酶速度方程式米氏方程,呈型曲线多为多亚基构成,亚基,亚基:中心,中心: 11. 同工酶催化化学反应,分子结构理化性质免疫学性质乳酸脱氢LDH1 LDH2 LDH3 LDH5#肌酸激酶CK1 CK2 CK312. 糖酵解的调节6-磷酸果糖激酶-1激活AMP ADP 1,6-双磷酸果糖::、2,6-双磷酸果糖:: 抑制ATP、柠檬酸丙酮酸激酶激活1,6-双磷酸果糖抑制ATP、丙氨酸己糖激酶抑制长链脂酰CoA13. 底物水平磷酸化1,3-二磷酸甘油酸3-磷酸甘油酸磷酸甘油酸激酶磷酸烯醇式丙酮酸丙酮酸丙酮酸激酶琥珀酰CoA琥珀酸琥珀酰CoA合成酶脱氢琥珀酸延胡索酸琥珀酸脱氢酶14. 糖异生己糖激酶葡萄糖-6-磷酸酶6-磷酸果糖激酶-1果糖双磷酸酶-1丙酮酸激酶丙酮酸羧化酶磷酸烯醇式丙酮酸羧激酶乙酰CoA丙酮酸羧化酶丙酮酸脱氢酶15. 脂酸氧化限速酶肉碱脂酰转移酶I过程脱氢加水再脱氢硫解、NADH+乙酰CoA16. 能量计算17. 酮体生成关键酶羟甲基戊二酸单酰CoA合成酶肝内生成,肝外利用:肝脏没有318. 脂酸合成原料关键酶乙酰CoA羧化酶激活抑制19. 胆固醇原料分子乙酰CoA、分子ATP及分子NADPH+限速酶HMG CoA还原酶20. 胆固醇的转化Qal胆汁酸::类固醇激素7-脱氢胆固醇:维生素:21. 呼吸链递电子体不递氢递氢体也递电子2.细胞色素223. 抑制剂呼吸链抑制剂鱼藤酮粉蝶霉素A异戊巴比妥Cyt与Cyt抗霉素A二巯基丙醇CO解偶联剂与脱离二硝基苯酚24. 高能化合物磷酸肌酸磷酸烯醇式丙酮酸乙酰磷酸ATP GTP UTP CTP乙酰CoA25. 脱氨基作用转氨酶氧化脱氨基嘌呤核苷酸循环26. 氨的转运丙氨酸- 葡萄糖循环谷氨酰胺27. 鸟氨酸循环限速酶氨基甲酰磷酸合成酶CPS-I 变构激活剂生成一份子尿素需要消耗个高能磷酸键瓜氨酸精氨酸鸟氨酸28. 脱羧基作用氨基酸脱羧酶氨酸- 氨基丁酸氨酸牛磺酸氨酸组胺氨酸5- 羟色胺酸氨酸腐氨精脒精胺429. 一碳单位30. 苯丙氨酸和酪氨酸代谢苯丙氨酸酪氨酸多巴多巴胺去甲肾上腺素肾上腺素黑色素对羟本丙酮酸延胡索酸乙酰乙酸苯丙酮酸31. 核苷酸合成原料和分解产物嘌呤原料天冬氨酸谷氨酰胺C02 —碳单位甘氨酸嘧啶原料天冬氨酸谷氨酰胺C02嘌呤产物尿酸:,,,:嘧啶产物-丙氨酸:,:-氨基异丁酸::32. 脱氧核苷酸的生成在磷酸核苷:N P:上进行:N代表A、G U、C:dTMP由甲基化生成33. 抗代谢物嘌呤类似物6-巯基嘌呤::IMP AMP GMP氨基酸类似物氮杂丝氨酸::UTP CTP叶酸类似物氨碟令氨甲喋呤::dUMP dTMP嘧啶类似物5-氟尿嘧啶::dUMP dTMP次黄嘌呤类似物别嘌呤醇::IMP 尿酸阿糖胞苷CDP dCDP 34. DNA复制的酶学DNA聚合酶解螺旋酶弓I物酶单链DNA结合蛋白DNA拓扑异构酶DNA连接酶DNA聚合酶延长修复原核DNA-pol DNA-pol真核DNA-pol DNA-pol除了DNA-polIII 只有外切酶活性, 其余都有双向外切酶活性I拓扑酶II催化3,5 磷酸二酯键DNA聚合酶RNA聚合酶DNA连接酶DNA拓扑异构酶逆转录酶引物酶535. DNA 生物合成过程起始DnaA 辨别起始点DnaB: : 解螺旋SSB 稳定单链DnaG: : 合成短链RNA 引物:提供末端: 终止后冈崎片段的连接水解引物填补空隙连接缺口36. RNA 聚合酶亚基辨认起始点转录延长仅需要核心酶RNA聚合酶I II IIIS-rRNA S-rRNA,tRNA,snRNA37. 转录后修饰mRNA l子结构聚腺苷酸尾巴mRNA的剪接tRNA 剪切: : 剪接: :添加: : 化学修饰: :外显子内含子38. 遗传密码的特点起始密码终止密码39. 乳糖操纵子三个结构基因一个操纵序列阻遏蛋白一个启动序列RNA 聚合酶一个调节基因阻遏蛋白40. 顺式作用元件启动子启动子是的结合位点至少包括转录起始点和以上的功能组件TATA 盒是的结合位点41. 重组DNA 技术常用工具酶限制性核酸内切酶DNA 连接酶DNA 聚合酶I Klenow 片段反转录酶67。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
分子式:C2H5NO2 化学式:NH2CH2COOH 结构式
分子量:75.07
物化性质:甘氨酸是20个氨基酸中最简单的一个,是一个非极性的氨基酸。白
色单斜晶系 或六方晶系晶体,或白色结晶粉末,无臭,有特殊甜味; 相对密度1.16,熔点 248℃(分解),易溶于水;在水中的溶解度: 25℃ 时为 25g/100ml,50℃时为 39.1g/100ml,75℃时为 54.4g/100ml,100℃时为67.2g /100ml;极 难溶于乙醇,在100g无水 乙醇中约溶解 0.06 g,几乎不溶于丙酮 和乙醚;等电点6.06。
2.合成法:合成法很多,一种是由异丁酸与氨生成氨基异丁醇,再与氰化氢合 成氨基异丁腈,然后水解而成。一种是由异丁醛与氰化氢合成羟基异丁腈,水解 得DL-缬氨酸,经化学法或酶法拆分得L-缬氨酸。也可由异丁醛与氰化钠和氯化铵 直接合成氨基异丁腈,再水解而成。上述三种方法的得率为36%~40%。合成法 所得为外消旋体,须经外消旋拆开。旋光拆开的方法很多,如用酰基-DL-氨基
各种氨基酸性质
酸的酶进行水解,再利用游离氨基酸与酰化体的溶解度差进行分离。化学合成法生产 成本高,反应复杂,步骤多,且有许多副产物。
3.发酵法:利用微生物发酵法生产L-缬氨酸具有原料成本低、反应条件温和及易实 现大规模生产等优点,是一种非常经济的生产方法。 (1)添加前体物发酵法:又称微生物转化法。这种方法使用葡萄糖作为发酵碳源 ,再添加特异的前体物质即在氨基酸生物合成途径中的一些合适中间代谢产物,以避 免氨基酸生物合成途径中的反馈调节作用,经微生物作用将其有效转化为目的氨基酸 。由于其前体物质如丙酮酸等稀少或价格昂贵,目前已少采用此法生产L-缬氨酸。 (2)直接发酵法:是借助于微生物具有合成自身所需氨基酸的能力,通过对特定微 生物ide诱变处理,选育出营养缺陷型及氨基酸结构类似物抗性突变株,以解除代谢调 节中的反馈抑制和反馈阻遏作用,从而达到过量累积某种氨基酸的目的。目前,世界 上L-缬氨酸均采用直接发酵法生产。国外曾对发酵法所用L-缬氨酸优良生产菌株的诱 变育种和代谢调节作了一些研究,而国内尚处于研究与小规模生产阶段,菌株产酸水 平不高,生产水平和产量远不能满足市场需求。因此,以微生物发酵法生产L-缬氨酸 的研究具有重要的意义。
工艺培训 邬斌
2010年12月1日
目 录
氨基酸基础知识
各种氨基酸性质
氨基酸基础知识
一、氨基酸的定义
氨基酸:含有氨基(―NH2 )和羧基(―COOH),并且氨基和羧基都直 接连接在一个-CH-结构上的一类有机化合物的通称。生物功能大分子蛋白质的 基本组成单位,是构成动物营养所需蛋白质的基本物质。
二、氨基酸的分类
氨基酸基础知识
极性中性氨基酸:色氨酸、酪氨酸、丝氨酸、半胱氨酸、蛋氨酸(甲硫氨酸)
、天冬酰胺、谷氨酰胺、苏氨酸
酸性氨基酸:天冬氨酸、谷氨酸 碱性氨基酸:赖氨酸、精氨酸、组氨酸
其中:属于芳香族氨基酸的是:色氨酸、酪氨酸、苯丙氨酸 属于亚氨基酸的是:脯氨酸 含硫氨基酸包括:半胱氨酸、蛋氨酸(甲硫氨酸) 注意:在识记时可以只记第一个字,如碱性氨基酸包括:赖精组
三、氨基酸的理化性质
氨基酸通式是H2NCHRCOOH。根据氨基连结在羧酸中碳原子的位置,可分 为α、β、γ、δ……的氨基酸( C……C―C―C―C―COOH)。
由于结构相似,具有一些共同的性质。它们都是无色结晶;熔点约在230℃以 上,大多没有确切的熔点,熔融时分解并放出CO2;都能溶于强酸和强碱溶液 中,除胱氨酸、酪氨酸、二碘甲状腺素外,均溶于水;除脯氨酸和羟脯氨酸外 ,均难溶于乙醇和乙醚
长的紫外吸光度的测量可对蛋白质溶液进行定量分析。
3、茚三酮反应 氨基酸的氨基与茚三酮水合物反应可生成蓝紫色化合物,此化合物最大吸 收峰在570nm波长处。由于此吸收峰值的大小与氨基酸释放出的氨量成正比 ,因此可作为氨基酸定量分析方法。
各种氨基酸性质
一、缬氨酸
缬氨酸(Val )
结构式 分子式 : C5H11NO2 化学式 : CH3 - CH(CH3) - CH(NH2) - COOH 分子量 :75.07
各种氨基酸性质
此工艺路线较长,原料NaCN为剧毒物,反应的脱盐操作较复杂,操作条件比较 苛刻。其优点是易于精制,成本低,适用于大规模工业化生产。 3、氢氰酸法合成甘氨酸新工艺:该工艺以廉价的丙烯腈副产物氢氰酸代替氰 化钠,生产成本更低。美国、日本等普通采用此法生产甘氨酸,我国中科院大连 化物所于90年代初开发成功以HCN为原料合成甘氨酸的工艺。该工艺以氢氰酸为 主体原料,在生产过程中,可直接利用气态HCN或任意比例的HCN水溶液。醛类 可利用气体、溶液或高聚物,氨源可用氨加二氧化碳或碳酸铵、碳酸氢铵等,各 原料的投料量近于理论量,产品收率可达73%,产品含量大于95%。该工艺由于 反应步骤少,因此工艺过程缩短,操作步骤简化,设备投资减少,生产成本大大 降低。无三废处理,易于放大生产,所得甘氨酸产品质量明显优于氯乙酸法所得 的产品。 4、生物合成法:21世纪是生物合成的世纪,生物合成甘氨酸成为十分重要,潜 力巨大的合成路线,美国、日本、欧洲长期以来坚持开发生物合成甘氨酸的研究 。以前由于存在酶的活性低,合成甘氨酸的微生物菌需求量大,甘氨酸的产率低 等因素,使生物合成法的工业化受到限制。20世纪80年代后期,日本三菱公司把 经过筛选的好氧土壤杆菌属、短杆菌属、棒状杆菌属等微生物菌属加入到含有碳 源、氮源及无机营养液的介质中进行培植,然后将该类菌种在25~45℃,pH值在 4~9的情况下,使乙醇胺转化为甘氨酸,用浓缩中和离子交换处理得到甘氨酸。 进入20世纪90年代以后,国外合成甘氨酸的技术有了新的进展。日本Nitto化学
各种氨基酸性质
工业公司将培养的假细胞菌属,酪蛋白菌属、产碱杆菌属等菌属以0.5%(质量分数 ,干重)加入到含甘氨酸胺基质中,在30℃、pH值7.9~8.1情况下,反应45h,几 乎所有的甘氨酸胺水解生成甘氨酸,转化率达99%。尽管目前生物法尚处于研究 阶段,但是其具有高选择性,无污染,因此将是极具发展潜力的合成路线。 用途: 食品级甘氨酸:用做调味剂 、甜味剂、防腐剂;利用它本身的氨基和羧基, 对食盐和醋等味感起缓冲作用;用作饲料添加剂中的诱食剂(引诱剂);食品酿造 、肉食加工和清凉饮料的配方及糖精钠的去苦剂 ;用作奶油 、干酪、人造奶油 、速食面 、小麦粉和猪油等的稳定剂;在味精中有 10% 的成份为甘氨酸。 医药级甘氨酸:医学微生物和生物化学氨基酸代谢研究的用药;金霉素缓冲 剂\抗帕鑫森氏病药物L-多巴\ 维生素B6\ 以及苏氨酸等氨基酸的合成原料;氨基 酸营养输液;化妆品原料。 饲料级甘氨酸:主要作为家禽、畜禽特别是宠物等食用的饲料增加氨基酸的 添加剂与引诱剂。 工业级甘氨酸:作农药中间体;电镀液添加剂;PH 调节剂 。
1、两性解离及等电点
氨基酸基础知识
氨基酸分子中有游离的氨基和游离的羧基,能与酸或碱类物质结合成盐, 故它是一种两性电解质。在某一PH的溶液中,氨基酸解离成阳离子和阴离 子的趋势及程度相等,成为兼性离子,呈电中性,此时溶液的PH称为该氨 基酸的等电点。 2、氨基酸的紫外吸收性质 芳香族氨基酸在280nm波长附近有最大的紫外吸收峰,由于大多数蛋白质 含有这些氨基酸残基,氨基酸残基数与蛋白质含量成正比,故通过28多种生理功能,主要用于食品、调味剂、动物饲
料和化妆品的制造以及配制复合氨基酸输液、合成多肽药物和食品抗氧化剂等,尤其 是在医学研究和治疗中的作用日益受到重视。随着其研究的深入 ,应用范围也将进一 步扩大。因此,L-缬氨酸的生产具有非常广泛的前景。
各种氨基酸性质
二、甘氨酸
化学性质 :含有羧基,所以水溶液呈酸性,可以用PH试纸测出来,与盐酸反应
生成盐酸盐;又能与碱发生中和反应;甘氨酸可以与氧气发生燃烧 ,
生成氮气、二氧化碳、水;其中含有氮,可以从甘氨酸中提取氨气。
各种氨基酸性质
生产工艺:目前工业化和具有工业化前景的生产工艺主要有氯乙酸氨解法、施特
雷克法(cstercker法)、氢氰法合成甘氨酸及生物合成法等。 1、氯乙酸氨解法:该法根据原料不同,又可分以下几种工艺: (1)水相或醇相中以乌洛托品、氯乙酸、氨水(氨气或液氨均可)为原料合成; (2)水相中以碳酸铵或氨基甲酸胺、氯乙酸、氨水为原料合成。 目前国内的生产方法以前者为主,产率在70%左右,后者产率较低(约42%),故 很少用于工业化生产。由于水相合成甘氨酸中乌洛托品消耗较大,且乌洛托品价格 较高,无法回收,故成本较高,而以醇溶液代替水溶液则会大大降低乌洛托品的消 耗量,从而降低生产成本。因此,目前国内普遍采用醇相法合成甘氨酸。 氯乙酸氨解法的优点是原料易得,合成工艺简单,对设备要求不高,易操作,基 本无公害。缺点是反应时间较长,副产氯化铵等无机盐类物质难以除去,产品质量 差,精制成本高,作为催化剂的乌洛托品难以回收循环使用,造成原料的极大浪费 ,使生产成本增加。国内甘氨酸生产厂家及一些科研机构本着优化反应条件降低生 产成本,提高产品质量的原则,对氯乙酸法合成甘氨酸的工艺进行了大量的研究工 作,并取得一定的进展。 2、施特雷克法(cstercker法):是以甲醛、氰化钠、氯化铵为原料反应,在硫酸 存在下醇解,然后与氢氧化钡一起加水分解而得甘氨酸产品。将产物过滤,在硫酸 存在下加乙醇分解,得到氨基乙腈硫酸盐。将上述产物用氢氧化钡分解,得到氨基乙 酸钡,然后加入定量的硫酸,使钡沉淀,过滤液浓缩,放置冷却,析出甘氨酸结晶 。
各种氨基酸性质
三、丙氨酸
丙氨酸(Ala )
结构式 分子式:C3H7NO2 结构式: CH3(NH2)CHCOOH 相对分子质量:89.1 物理性质:丙氨酸分为α-丙氨酸和β-丙氨酸,它们是共分异构体。α-丙氨酸亦 称2-氨基丙酸,200℃以上升华,随加热速度不同约在264~296℃ 之间分解。β-丙氨酸亦称3-氨基丙酸,无色晶体,熔点198℃(分 解),溶于水,微溶于乙醇,不溶于乙醚;等电点 6.11。
