逐步聚合(2)方案
合集下载
逐步聚合实施方法

员工培训与参与
1 2
提供培训和支持
为员工提供必要的培训和支持,帮助他们掌握逐 步聚合实施所需的知识和技能。
鼓励员工参与
通过激励机制和奖励措施,鼓励员工积极参与逐 步聚合实施过程,提出改进建议和意见。
3
培养员工意识和能力
通过培训和宣传,提高员工对逐步聚合实施的认 识和理解,培养他们的创新意识和能力。
企业应对策略建议
加强技术创新
企业应注重技术创新,积极引 进和研发新技术,提高生产效
率和产品竞争力。
推动绿色发展
企业应积极响应环保政策,推 动绿色生产,降低能耗和排放 ,提高资源利用效率。
加强供应链管理
企业应优化供应链管理,提高 供应链透明度和协同效率,降 低运营成本和风险。
关注政策变化
企业应密切关注政策变化,及 时调整战略和业务模式,以适
应市场需求和政策要求。
感谢您的观看
THANKS
制定详细计划
分析现状
对现有系统或流程进行全面分析,了解存在的问题和瓶颈。
设计聚合方案
根据目标和原则,制定详细的聚合方案,包括技术选型、系统架 构、数据迁移等。
制定实施计划
将聚合方案细化为可执行的实施计划,明确时间节点、责任人、 所需资源等。
逐步实施与监控
按计划实施
按照实施计划逐步推进聚合工作,确保每一步都符合预期目 标和原则。
作提供参考。
03
关键成功因素
领导层的支持与推动
制定明确的愿景和战略
领导层需要明确公司的长期目标和短期目标,以及实现这些目标 所需的策略和行动计划。
提供资源和支持
领导层应确保逐步聚合实施所需的资源得到合理分配,包括人力、 物力、财力和时间等。
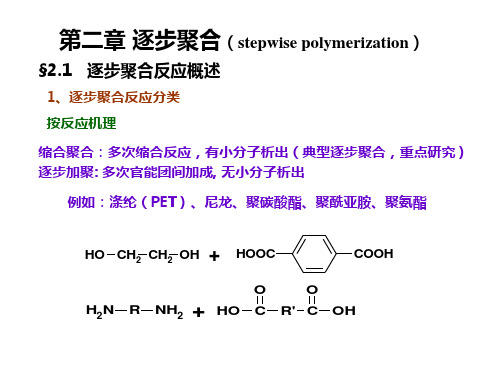
第二章逐步聚合(stepwisepolymerization)
反应程度
Xn = 1 /(1体系
Xn
KC0 Pnw
Xn K 1
(2)官能团不等摩尔比反应
一种官能团过量越多,聚合度越小。
分析: • 如何提高线形缩聚反应聚合物的聚合度
提高反应程度 除去小分子 官能团等摩尔比反应
• 如何控制线形缩聚反应聚合物的聚合度
第二章 逐步聚合(stepwise polymerization)
§2.1 逐步聚合反应概述
1、逐步聚合反应分类 按反应机理
缩合聚合:多次缩合反应,有小分子析出(典型逐步聚合,重点研究) 逐步加聚: 多次官能团间加成, 无小分子析出
例如:涤纶(PET)、尼龙、聚碳酸酯、聚酰亚胺、聚氨酯
+ HO CH2 CH2 OH
Rp k0[COOH][OH][H ]
[H ] [COOH ]
Rp ko[COOH]2[OH]
聚合速率
Rp
d[COOH ] dt
ko[COOH ]3
聚合度
( X n )2 1 2[COOH ]o2 kot
动力学曲线
(1) P=0.8-0.93,符合三级动力学关系 (2) P<0.8,偏离 (3) P>0.93,偏离
曲线偏离的原因:
低转化率时
反应体系的极性变化 反应物浓度和活度 催化机理的变化 体系体积的变化
自催化体系高转化率时
反应物的少量损失 体系粘度增加
(3)官能团不等活性体系 (P32)
2、平衡缩合聚合动力学(不排除小分子)
O C OH
起始
C0
t 时刻,未除水 C
k1 OH
k-1
C0 C
高分子材料合成聚合反应类型

CH2 CH n Cl
▪ 加聚物的组成与单体相同; 特点: ▪ 聚合物主链由碳链组成,不含官能基团;
▪ 加聚物的分子量是单体分子量的整数倍。
3
聚合反应类型
(2)缩聚反应:通常是由单体分子的官能团间发生反应,伴随
有水、醇等小分子副产物生成,其产物称为缩聚物。如:
nH2N(CH2)6NH2 + nHOOC(CH2)4COOH H NH(CH2)6NHCO(CH2)4CO n OH + (2n-1)H2O
聚合反应:通过单体 功能基之间的反应进 行,为逐步聚合反应。
9
(2)含多重键的单体
C=C双键:乙烯、丙烯、苯乙烯等 C≡C三键:乙炔及取代乙炔 C=O双键:甲醛等
聚合反应类型
聚合反应:多通 过单体中重键加 成反应进行,为 链式聚合反应。
(3)杂环单体
O
O
HO NC
O CO
聚合反应:开环 聚合,依条件不 同可为逐步或为 链式聚合反应。
10
内容回顾
聚合反应类型
1、按单体和聚合物在组成和结构上发生的变化分类
(1)加聚反应(addition polymerization) : (2)缩聚反应(polycondensation) :
这是早期分类方法。聚合反 应不断开发,这种分类方法 已不适应。
2、按聚合反应的反应机理和动力学分类
(1)连锁聚合反应
体活性中心,就能很快传递下去,瞬间形成高分子。平均每个大分子的生成时间很短 (零点几秒到几秒)
按聚合的 活性中心分:
▪ 自由基聚合 ▪ 阴离子聚合 ▪ 阳离子聚合 ▪ 配位聚合
现代合成高分子材料70%是 按连锁聚合反应合成的,如 PE、 PP、PVC、PTFE、 PMMA、PAN、ABS、SBS、 SBR、丁腈 橡胶和氯丁橡胶 等。
第二章 逐步聚合

m HO R COOH + n HO R' COOH H ORCO m OR'CO OH + (m+n-1)H2O n
(2)按聚合产物分子链形态可分为线形逐步聚合反应和非线形逐 聚合产物分子链形态可分为线形逐步聚合反应和 可分为线形逐步聚合反应 步聚合反应。 步聚合反应。 线形逐步聚合单体为双功能基单体, 线形逐步聚合单体为双功能基单体,聚合产物分子链只会向 两个方向增长,生成线形高分子。 两个方向增长,生成线形高分子。 非线形逐步聚合反应的聚合产物分子链不是线形的, 非线形逐步聚合反应的聚合产物分子链不是线形的,而是支 化或交联的。 聚合体系中必须加入含三个以上功能基的单体。 化或交联的。其聚合体系中必须加入含三个以上功能基的单体。 (3)按反应热力学性质分为平衡逐步聚合和不平衡逐步聚合。 反应热力学性质分为平衡逐步聚合和不平衡逐步聚合。 分为平衡逐步聚合 聚合反应是可逆平衡反应, 平衡逐步聚合 聚合反应是可逆平衡反应,生成的聚合物分子 可被反应伴生的小分子副产物降解成聚合度减小的聚合物分子。 可被反应伴生的小分子副产物降解成聚合度减小的聚合物分子。 聚合反应为不可逆反应。 不平衡逐步聚合 聚合反应为不可逆反应。或当平衡逐步聚合反 应的平衡常数足够高时( ),其降解逆反应相对于聚合反 应的平衡常数足够高时(K ≥104),其降解逆反应相对于聚合反 应可以忽略,也可看作是非平衡逐步聚合反应。 应可以忽略,也可看作是非平衡逐步聚合反应。
2.2 逐步聚合反应的分类 逐步聚合反应的分类可由多种角度: 逐步聚合反应的分类可由多种角度: 根据参与聚合反应的单体数目和种类 以缩聚反应为例, 参与聚合反应的单体数目和种类, (1) 根据参与聚合反应的单体数目和种类,以缩聚反应为例, 可分为均缩聚、混缩聚和共缩聚。 可分为均缩聚、混缩聚和共缩聚。 均缩聚 只有一种单体参与的缩聚反应,其重复结构单元只含 只有一种单体参与的缩聚反应 一种单体参与的缩聚反应, 一种单体单元。其单体结构可以是X-R-Y,聚合反应通过 和Y 一种单体单元。其单体结构可以是 ,聚合反应通过X和 的相互反应进行,也可以是 的相互反应进行,也可以是X-R-X,聚合反应通过 之间的相互 ,聚合反应通过X之间的相互 反应进行。 反应进行。如:
(2)按聚合产物分子链形态可分为线形逐步聚合反应和非线形逐 聚合产物分子链形态可分为线形逐步聚合反应和 可分为线形逐步聚合反应 步聚合反应。 步聚合反应。 线形逐步聚合单体为双功能基单体, 线形逐步聚合单体为双功能基单体,聚合产物分子链只会向 两个方向增长,生成线形高分子。 两个方向增长,生成线形高分子。 非线形逐步聚合反应的聚合产物分子链不是线形的, 非线形逐步聚合反应的聚合产物分子链不是线形的,而是支 化或交联的。 聚合体系中必须加入含三个以上功能基的单体。 化或交联的。其聚合体系中必须加入含三个以上功能基的单体。 (3)按反应热力学性质分为平衡逐步聚合和不平衡逐步聚合。 反应热力学性质分为平衡逐步聚合和不平衡逐步聚合。 分为平衡逐步聚合 聚合反应是可逆平衡反应, 平衡逐步聚合 聚合反应是可逆平衡反应,生成的聚合物分子 可被反应伴生的小分子副产物降解成聚合度减小的聚合物分子。 可被反应伴生的小分子副产物降解成聚合度减小的聚合物分子。 聚合反应为不可逆反应。 不平衡逐步聚合 聚合反应为不可逆反应。或当平衡逐步聚合反 应的平衡常数足够高时( ),其降解逆反应相对于聚合反 应的平衡常数足够高时(K ≥104),其降解逆反应相对于聚合反 应可以忽略,也可看作是非平衡逐步聚合反应。 应可以忽略,也可看作是非平衡逐步聚合反应。
2.2 逐步聚合反应的分类 逐步聚合反应的分类可由多种角度: 逐步聚合反应的分类可由多种角度: 根据参与聚合反应的单体数目和种类 以缩聚反应为例, 参与聚合反应的单体数目和种类, (1) 根据参与聚合反应的单体数目和种类,以缩聚反应为例, 可分为均缩聚、混缩聚和共缩聚。 可分为均缩聚、混缩聚和共缩聚。 均缩聚 只有一种单体参与的缩聚反应,其重复结构单元只含 只有一种单体参与的缩聚反应 一种单体参与的缩聚反应, 一种单体单元。其单体结构可以是X-R-Y,聚合反应通过 和Y 一种单体单元。其单体结构可以是 ,聚合反应通过X和 的相互反应进行,也可以是 的相互反应进行,也可以是X-R-X,聚合反应通过 之间的相互 ,聚合反应通过X之间的相互 反应进行。 反应进行。如:
第七章逐步聚合反应

2 HOOC-R-COO-R'-OH
HOOC-R-COO-R'-OOC-R-COO-R'-OH + H2O 四聚体
。 。 。
n HOOC-R-COOH + n HO-R'-OH
。 。 。
O O HO ( C R C OR'O ) H + (2n-1) H2O n
20
第七章 逐步聚合反应
例: 对苯二甲酸与乙二醇反应得到涤纶树脂; 己二胺与己二酸反应得到聚酰胺—6,6; 双酚A与光气反应得到聚碳酸酯; 氨基酸自身聚合得到聚酰胺。
14
体系中若有一种原料属单官能度,
缩合后只能得到低分子化合物。
15
第七章 逐步聚合反应
单官能度的丁醇和二官能度的邻苯二甲酸酐进行酯化反 应,产物为低分子邻苯二甲酸二丁酯,副产物为水。 单官能度的醋酸与三官能度的甘油进行酯化反应,产物 为低分子的三醋酸甘油酯,副产物为水。
只要反应体系中有一种原料是单官能度 物质,无论其他原料的官能度为多少,都只 能得到低分子产物。
7
第七章 逐步聚合反应
Diels-Alder加成聚合:单体含一对共轭双键,如:
+
与缩聚反应不同,逐步加成聚合反应没有小分 子副产物生成。
8
第七章 逐步聚合反应
逐步聚合还可以按以下方式分类: 平衡线形逐步聚合 线形逐步聚合
逐步聚合
非线形逐步聚合 (1)线形逐步聚合反应
不平衡线形逐步聚合
参与反应的每种单体只含两个功能基,聚合产物分子链 只会向两个方向增长,生成线形高分子。
9
第七章 逐步聚合反应
a. 两功能基相同并可相互反应:如二元醇聚合生成聚醚 n HO-R-OH H-(OR)n-OH + (n-1) H2O b. 两功能基相同, 但相互不能反应,聚合反应只能在不同单 体间进行:如二元胺和二元羧酸聚合生成聚酰胺 n H2N-R-NH2 + n HOOC-R’-COOH H-(HNRNH-OCR’CO)n-OH + (2n-1) H2O
《逐步聚合反应》课件

逐步聚合反应的热力学机理
逐步聚合反应的热力学机理涉及聚合 过程中自由能的变化。
自由能的变化与单体分子之间的相互 作用、聚合产物的分子结构和分子量 等因素有关。
在聚合过程中,自由能的变化决定了 聚合反应是否能够自发进行。当聚合 产物的自由能低于单体分子时,聚合 反应自发进行。
逐步聚合反应通常需要在一定的温度 下进行,以提供足够的能量使单体分 子活化并形成聚合物链。
逐步聚合反应
目录
• 逐步聚合反应概述 • 逐步聚合反应的机理 • 逐步聚合反应的条件与影响因素 • 逐步聚合反应的实例 • 逐步聚合反应的挑战与解决方案 • 逐步聚合反应的发展趋势与展望
01 逐步聚合反应概述
定义与特点
定义
逐步聚合反应是一种化学反应,涉及 低分子量单体或预聚物通过逐步增长 的方式形成高分子量聚合物。
逐步聚合反应的动力学机理
逐步聚合反应的动力学机理涉及 聚合速率的变化,通常表现为随 着聚合度的增加,聚合速率逐渐
降低。
在聚合初期,活性中心浓度较高, 聚合速率较快。随着聚合度的增 加,活性中心浓度降低,聚合速
率逐渐减缓。
聚合速率的快慢与单体分子的结 构、引发剂或催化剂的种类和浓
度、反应温度等因素有关。
高压可以促进某些单体的均聚反应, 而对共聚反应的影响较小。因此,压 力的选择应根据具体的聚合体系而定 。
溶剂的影响
溶剂的极性和介电常数对逐步聚合反应有重要影响。极性溶 剂有利于增加聚合物与单体之间的相互作用力,从而提高聚 合速率和产物分子量。
溶剂的纯度和残留杂质也可能影响聚合反应的进行,因此应 选择高质量的溶剂。
催化剂的影响
催化剂可以显著降低聚合活化能,提高聚合速率。不同类 型的催化剂对聚合反应的影响不同,选择合适的催化剂是 获得所需聚合物的重要因素。
逐步聚合的四种方法与特点
逐步聚合的四种方法与特点
在文库项目中,逐步聚合是一种重要的组织信息的方法,它可以帮助读者更好地理解复杂的概念和信息。
在这篇文章中,我们将介绍四种常见的逐步聚合方法以及它们的特点。
方法一:分类逐步聚合
分类逐步聚合是将信息按照不同的类别或属性进行分组,然后逐步展开每个类别或属性的细节。
这种方法适用于整合多方面的信息,并将其有条理地呈现给读者。
通过分类逐步聚合,读者可以逐步了解各个类别或属性的内容,有助于他们更好地理解整体信息。
方法二:时间逐步聚合
时间逐步聚合是按照时间顺序将信息逐步呈现给读者。
这种方法常用于介绍事件发展的过程或历史演变。
通过时间逐步聚合,读者可以清晰地了解事件发展的先后顺序,帮助他们建立起时间轴,更好地理解事件发生的背景和结果。
方法三:逻辑逐步聚合
逻辑逐步聚合是按照逻辑脉络将信息逐步展开,使读者能够按照一定的逻辑思考路径理解信息。
这种方法常用于引导读者理清概念之间的逻辑关系,帮助他们形成完整的认知结构。
通过逻辑逐步聚合,读者可以逐步理解各个环节之间的逻辑联系,更好地掌握信息的内在逻辑。
方法四:深度逐步聚合
深度逐步聚合是将信息从表层逐步深入,逐步揭示更深层次的意义和内涵。
这种方法适用于复杂概念或问题的解析,帮助读者逐步深入思考和理解信息。
通过深度逐步聚合,读者可以通过不断深入的层次逐步解析信息,领悟信息的深层含义,提升对信息的认知水平。
在文库项目中,不同的逐步聚合方法可以根据信息的特点和读者的需求灵活运用。
通过合理地运用逐步聚合方法,可以帮助读者更好地理解信息,提升信息传达的效果和价值。
2-逐步聚合
2 HOROOCR'COOH
四聚体
HOROOCR'COOROOCR'COOH + H2O
•
含羟基的任何聚体和含羧基的任何聚体都可以 相互缩聚,如此逐步反应下去就可以得到高分 子量的聚酯。
m 聚体 + n 聚体 (m + n) 聚体 + 水
• •
反应体系中无特定活性种,各步反应的活化能 和速率常数均相等。 缩聚早期,单体消失很快,因此转化率很高, 但实际意义不大,因为都转化成二、三、四聚 体等低聚物,以后是低聚物之间的缩聚,逐步 使分子量增大。
CH3COOCH2CH2OOCCH3
当反应体系中单体的官能度均等于 2 时,缩合 反应就可进一步发展到线性缩聚反应,如己二 酸与己二醇进行酯化时,就可以得到高分子量 的聚酯。
n HOOC(CH2)4COOH + n HOCH2(CH2)4CH2OH HO OC(CH2)4COO(CH2)6O H n
HOROH + HOOCR'COOH HOROOCR'COOH + H2O
1 mol 的二元醇与1 mol 的二元酸反应已经缩合 生成1 mol 的二聚体酯,此时: • 对单体而言转化率应该是100%
•
对羟基或羧基而言,均只反应了一半(因 为二聚体两端仍然带有能够继续进行反应 的一个羟基和一个羧基),即反应程度都 是50%
• 2.2 缩聚反应 缩合聚合反应:简称缩聚反应,是指带有两个或两 个以上官能团单体之间连续、重复进行的缩合反应。 缩合反应主要在有机官能团之间发生,除主产物外 往往还有小分子副产物,如:
CH3COOH
+
CH3CH2OH
H+
高分子化学第2章逐步聚合反应
d. 聚硅氧烷化反应:硅醇之间聚合 n HO-SiR1R2-OH + n HO-SiR1’R2’-OH
H-(OSiR1’R2’-OSiR1R2)n-OH + (2n-1) H2O
共同特点
在生成聚合物分子的同时,伴随有小分子副产物的生成, 如H2O, HCl, ROH等。 重键加成聚合: 含活泼氢官能团的亲核化合物与含亲电不饱和官能团的亲电化 合物之间的聚合。如: n O=C=N-R-N=C=O + n HO-R’-OH
12
2-2官能度体系:如二元酸和二元醇,生 成线形缩聚物。通式如下:
naAa nbBb a[ AB]n b (2n 1)ab
2官能度体系:单体有能相互反应的官能团 A、B(如氨基酸、羟基酸等),可经自身缩聚, 形成类似的线形缩聚物。通式如下:
naRb a[R]n b (n 1)ab
2-2或2官能度体系的单体进行缩聚形成线形 缩聚物。
0
1-C 1-C
1-C nw
令起始浓度为 1,时间 t 时浓度为C,若有一 部分水不排除,则其残留水的浓度为 nw。
35
封闭体系:
水部分排出时:
dC dt
k1C 2
k 1 (1
C)2
dC dt
k1C 2
k1(1 C)nw
用p表示,则得:
dp dt
k1[(1
p)2
p2 ]
K
dp dt
k1[(1
( C N R N C O R'O )n OH HO
聚氨基甲酸酯,简称聚氨酯
含活泼氢的官能团:-NH2, -NH, -OH, -SH, -SO2H, -COOH, -SiH等 亲电不饱和官能团:主要为连二双键和三键,
H-(OSiR1’R2’-OSiR1R2)n-OH + (2n-1) H2O
共同特点
在生成聚合物分子的同时,伴随有小分子副产物的生成, 如H2O, HCl, ROH等。 重键加成聚合: 含活泼氢官能团的亲核化合物与含亲电不饱和官能团的亲电化 合物之间的聚合。如: n O=C=N-R-N=C=O + n HO-R’-OH
12
2-2官能度体系:如二元酸和二元醇,生 成线形缩聚物。通式如下:
naAa nbBb a[ AB]n b (2n 1)ab
2官能度体系:单体有能相互反应的官能团 A、B(如氨基酸、羟基酸等),可经自身缩聚, 形成类似的线形缩聚物。通式如下:
naRb a[R]n b (n 1)ab
2-2或2官能度体系的单体进行缩聚形成线形 缩聚物。
0
1-C 1-C
1-C nw
令起始浓度为 1,时间 t 时浓度为C,若有一 部分水不排除,则其残留水的浓度为 nw。
35
封闭体系:
水部分排出时:
dC dt
k1C 2
k 1 (1
C)2
dC dt
k1C 2
k1(1 C)nw
用p表示,则得:
dp dt
k1[(1
p)2
p2 ]
K
dp dt
k1[(1
( C N R N C O R'O )n OH HO
聚氨基甲酸酯,简称聚氨酯
含活泼氢的官能团:-NH2, -NH, -OH, -SH, -SO2H, -COOH, -SiH等 亲电不饱和官能团:主要为连二双键和三键,
高分子化学第2章逐步聚合反应
p) 2
pnw ] K
K=k1/k-1
总反应速率与 p、低分子副产物含量及 K 有 关。 当 nw值很小或 K值很大时,上式右边第 二项可忽略,即与外加酸催化的聚酯动力学 相同(二级反应)。
36
小结:
p 1 N N0
不可逆:
自催化缩聚 dC kC3 dt
可逆:
封闭体系
dp dt
k1[(1
p)2
至少有一单体含两个以上的官能团,形成的大分子向 三个方向增长,得到体形结构缩聚物的反应。如酚醛 树脂、环氧树脂等。
17
3.2按参加反应的单体数分
均缩聚:只有一个单体参加的反应。 2官能度体系:aRb
杂缩聚:两种单体参加的反应。 2-2官能度体系:aAa+bBb
共缩聚:两种以上单体参加的反应。 aAa+bBb+aA’a(改性)
以聚酯反应为例,
~COOH + ~OH
k1 k-1
~ OCO ~ + H2O
聚酯化是酸催化反应。反应速率用羧基消失速率表示。
Rp
d[COOH] dt
k[COOH][OH][H ]
29
自催化缩聚
聚酯反应在无外加酸作催化剂时,二元酸的羧 基起催化作用,这称为自催化作用。
当醇和酸为等摩尔时,速率方程可表示为:
dC dt
(kC
ka[H
])C 2
一般, ka [H ] kC k ' ka [H ]
dC k 'C 2 dt
工业上总是采用外加酸。
二级反应
33
积分并引入p,得:
1 1 p
k 'C0t
1
X n k 'C0t 1
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2
官能团等活性理论是近似的,不是绝对的。 这一理论大大简化了研究处理,可用同一平衡 常数表示,整个缩聚过程可以用两种官能团之 间的反应来表征.
3
2. 线型缩聚动力学 1)不可逆条件下的缩聚动力学
在不断排出低分子副产物时符合不可逆条 件,以聚酯化反应为例,聚酯是酸催化反应。
4
ቤተ መጻሕፍቲ ባይዱ
k3是最慢的一步反应,k4由于不可逆,暂不考虑。 聚酯反应速率用羧基消失速率来表示:
15000 = 132.743 113
由 Xn =
1+r
= 132.743
1+r-2 0.995r
单体原料:r=0.995
37
设:己二酸过量,则己二酸(Nb)与己二胺(Na)的摩尔 投料比为1:0.995 (r=Na/Nb1).
端胺基数: Na-NaP=Na(1-p)=Nbr(1-p)
端羧基数: Nb-NaP=Nb-Nbrp=Nb(1-rp)
表明自催化的聚酯 反应呈三级反应。
7
积分:
由反应程度
羧基数用羧基浓度C代替
C=Co(1-p),代入上式
p~t关系式
8
代入上式
讨论:
Xn~t关系式
(a)表明(Xn)2与反应时间t呈线性关系。
(b)聚合度随反应时间缓慢增加,要获得高分子量, 需要较长的时间。
(c)以(Xn)2对t作图,直线的斜率可求得速率常数k。
两单体等当量比,小分子部分排出时:
平衡时
20
当P 1(>0.99)时
上式为 P=1 时的缩聚平衡方程, 近似表达了Xn、
K和nW三者之间的定量关系.
如果P≠1,需按缩聚平衡方程式推导!
21
在生产中,要使 Xn>100,不同反应允许的nw不同
聚酯 聚酰胺 可溶性酚醛
K值 nw (mol / L)
4
端胺基数 =
Nbr(1-p)
=
0.995(1-0.995)
1/2
端羧基数 Nb(1-rp) 1- 0.9950.995
如设:己二胺过量,同理可得:
端胺基数
端羧基数 2/1
38
2.5 分子量分布 由Flory 统计法及官能团等活性理论:
Xn = 1/(1-P) Xw = (1+P)/(1-P) Xw /Xn = 1+P 2
9
(b)外加酸催化缩聚反应 为了加速反应,常外加酸作为聚酯化反应的催化剂, 反应速率将由自催化和酸催化两项组成:
作为催化剂,[H+]不变,且 ka[H+]>>kC,kC略去, 并令k`= ka[H+]
外加酸催化为二级反应。
10
积分得:
将 C=Co(1-p) 代入上式 P~t关系式 Xn~t关系式
27
(2)aAa、bBb等当量比,另加少量单官能团物质Cb, Nc为单官能团物质Cb的分子数
摩尔系数和分子过量分率定义如下:
aAa单体的官能团a的残留数: Na-NaP bBb单体的官能团b的残留数: Nb-NaP = Na-NaP 两单体官能团(a+b)的残留数: 2(Na-NaP)
28
体系中的大分子总数 体系中的结构单元数(即单体数) Na+Nc
39
人有了知识,就会具备各种分析能力, 明辨是非的能力。
所以我们要勤恳读书,广泛阅读, 古人说“书中自有黄金屋。
”通过阅读科技书籍,我们能丰富知识, 培养逻辑思维能力;
通过阅读文学作品,我们能提高文学鉴赏水平, 培养文学情趣;
通过阅读报刊,我们能增长见识,扩大自己的知识面。 有许多书籍还能培养我们的道德情操, 给我们巨大的精神力量, 鼓舞我们前进。
第二章 逐步聚合
Step-growth Polymerization
1
2.3 线形缩聚反应动力学
1.官能团等活性理论 缩聚反应在形成大分子的过程中是逐步进行的。 原先认为,官能团的活性将随分子量增加而递减。 若每一步都有不同的速率常数,研究将无法进行。
官能团等活性理论:不同链长的端基官能团,具 有相同的反应能力和参加反应的机会,即官能团 的活性与分子的大小无关。
[C+(OH)2]是质子化羧基的浓度,难以确定,设法消去
5
考虑催化用酸HA的离解平衡
6
催化用酸HA 可以是二元酸本身,但反应较 慢,也可以是外加酸,如H2SO4,大大加速。 (a)自催化缩聚反应
无外加酸,二元酸单体作催化剂,[HA] = [COOH],羧基与羟基浓度相等,以C表示, 将③式中的所有常数及[A-]合并成 k
合度。
36
例题2:由己二胺和己二酸生产尼龙-66,分子量 Mn =15000,反应程度P = 0.995,计算两单体原料比, 并计算端胺基与端羧基的摩尔比.
解:
HO CO(CH2)4CONH(CH2)6NH H
n
112
114
结构单元平均分子量:
M0 =
112 + 114 2
= 113
平均聚合度: Xn =
残留的官能团总数分布在大分子的两端,每个 大分子有两个官能团。 体系中大分子总数是端基官能团数的一半:
25
体系中结构单元数等于单体分子数( Na+Nb)/2 表示了Xn与P、r或q之间的定量关系式
26
两种极限情况: A 当原料单体等当量比时,即 r=1或q=0 B 当P=1时,即官能团a完全反应
和前一种情况相同,只是r和q表达式不同 29
(3)aRb 加少量单官能团物质Cb反应, Nc为单官能团 物质Cb的分子数
摩尔系数和分子过量分率如下:
r=
1 q+1
Xn =
1+r 1+r-2rp
30
小结:
三种情况都说明,Xn与P、r(或q)密切 相关. 官能团的极少过量,对产物分子量就有 显著影响. 在线形缩聚中,要得到高分子量,必须 保持严格的等当量比.
< 4 ×10-4(高真空度)
400 < 4 ×10-2(稍低真空度)
103 可在水介质中反应
22
2. 线形缩聚物聚合度的控制 反应程度和平衡条件是影响线形缩聚物聚合 度的重要因素,但不能用作控制分子量的手 段,因为缩聚物的分子两端仍保留着可继续 反应的官能团。
控制方法: 端基封锁
在两官能团等当量的基础上,(a)使某官能团稍 过量或(b)加入少量单官能团物质.
分三种情况进行讨论:
23
(1)单体aAa和bBb反应,其中bBb稍过量,令Na,Nb分 别为官能团a、b的起始数
两单体的官能团数之比为:
称为摩尔系数
bBb单体的分子过量分率(是分子数之比)为:
r-q 关系式
24
设: 官能团a的反应程度为P 则: a官能团的反应数为NaP(也是b官能团的反应数)
a官能团的残留数为 Na-NaP b官能团的残留数为 Nb-NaP a、b官能团的残留总数为 Na+Nb-2NaP
起始
1
1
t时水未排出 C
C
水部分排出 C
C
0 1-C 1-C
0
1-C
nw
13
聚酯反应速率是正、逆反应速率之差(净速率): 水未排出时 水部分排出时 根据反应程度关系式
14
引入平衡常数,K=k1/k-1 ,k-1 =k1/K 代 入上两式,整理:
水未排出时
水部分排出时
总反应速率与反应程度、平衡常数、低分 子副产物含量有关。
r N A 2 0.987 N 0.013
35
NA 2N 2 2N
例:对苯二甲酸(NAmol)和乙二醇(NBmol) 反应得到聚酯,试求: (1) NA=NB=1mol,数均聚合度为100时的反应
程度p; (2) 当平衡常数K=4时,要求生成的数均聚合度
为100时,体系中的水量(mol); (3) 若NA=1.02,NB=1.00,求p=0.99时的数均聚
33
己二酸的分子过量分率:
34
例:由等物质的量的己二酸和己二胺合成聚酰胺,要求 分子量为10000,反应程度为99.5%,问需加多少苯甲酸?
解:本题计算线形缩聚物的聚合度,属于2-2官能度 体系加上少量的单官能团进行端基封锁的情况。
己二酸和己二胺生成尼龙-66的重复单元的平均分子量 为226,则分子量为10000的尼龙-66的结构单元数:
17
正、逆反应达到平衡时,总聚合速率为零,则:
整理 解方程
P > 1, 此根无意义
18
代入
在密闭体系: 聚酯化反应 K=4,P=0.67, Xn只能达到3. 聚酰胺反应 K=400,P=0.95,Xn只能达到21. 不可逆反应 K=104,P=0.99,Xn能达到101.
19
B 非密闭体系 在实际操作中,要采取措施排出小分子(减压;加热; 通 N2, CO2).
X n 10000 2 88.5 226
根据X n 1 r , 1 r 2rp
p 99.5%得:
X n 1 r 1 r 88.5 r 0.987 1 r 2rp 1 r 1.99r
假设己二酸和己二胺的起始物质的量为1mol,苯甲酸
的加入量为Nmol,则:
31
例题1:生产尼龙-66,想获得Mn = 13500的产品, 采用己二酸过量的办法, 若使反应程度P = 0.994, 求己二胺和己二酸的配料比和过量分率. 解:当己二酸过量时,尼龙-66的分子结构为
结构单元的平均分子量:
32
则平均聚合度 当反应程度P = 0.994时,求r值:
己二胺和己二酸的配料比: r=0.995
15
2.4 影响线形缩聚物聚合度的因素及控制方法 1. 影响聚合度的因素 1)反应程度对聚合度的影响 在任何情况下,缩聚物的聚合度均随反应程度 的增大而增大. 反应程度受到某些条件的限制 可逆反应
官能团等活性理论是近似的,不是绝对的。 这一理论大大简化了研究处理,可用同一平衡 常数表示,整个缩聚过程可以用两种官能团之 间的反应来表征.
3
2. 线型缩聚动力学 1)不可逆条件下的缩聚动力学
在不断排出低分子副产物时符合不可逆条 件,以聚酯化反应为例,聚酯是酸催化反应。
4
ቤተ መጻሕፍቲ ባይዱ
k3是最慢的一步反应,k4由于不可逆,暂不考虑。 聚酯反应速率用羧基消失速率来表示:
15000 = 132.743 113
由 Xn =
1+r
= 132.743
1+r-2 0.995r
单体原料:r=0.995
37
设:己二酸过量,则己二酸(Nb)与己二胺(Na)的摩尔 投料比为1:0.995 (r=Na/Nb1).
端胺基数: Na-NaP=Na(1-p)=Nbr(1-p)
端羧基数: Nb-NaP=Nb-Nbrp=Nb(1-rp)
表明自催化的聚酯 反应呈三级反应。
7
积分:
由反应程度
羧基数用羧基浓度C代替
C=Co(1-p),代入上式
p~t关系式
8
代入上式
讨论:
Xn~t关系式
(a)表明(Xn)2与反应时间t呈线性关系。
(b)聚合度随反应时间缓慢增加,要获得高分子量, 需要较长的时间。
(c)以(Xn)2对t作图,直线的斜率可求得速率常数k。
两单体等当量比,小分子部分排出时:
平衡时
20
当P 1(>0.99)时
上式为 P=1 时的缩聚平衡方程, 近似表达了Xn、
K和nW三者之间的定量关系.
如果P≠1,需按缩聚平衡方程式推导!
21
在生产中,要使 Xn>100,不同反应允许的nw不同
聚酯 聚酰胺 可溶性酚醛
K值 nw (mol / L)
4
端胺基数 =
Nbr(1-p)
=
0.995(1-0.995)
1/2
端羧基数 Nb(1-rp) 1- 0.9950.995
如设:己二胺过量,同理可得:
端胺基数
端羧基数 2/1
38
2.5 分子量分布 由Flory 统计法及官能团等活性理论:
Xn = 1/(1-P) Xw = (1+P)/(1-P) Xw /Xn = 1+P 2
9
(b)外加酸催化缩聚反应 为了加速反应,常外加酸作为聚酯化反应的催化剂, 反应速率将由自催化和酸催化两项组成:
作为催化剂,[H+]不变,且 ka[H+]>>kC,kC略去, 并令k`= ka[H+]
外加酸催化为二级反应。
10
积分得:
将 C=Co(1-p) 代入上式 P~t关系式 Xn~t关系式
27
(2)aAa、bBb等当量比,另加少量单官能团物质Cb, Nc为单官能团物质Cb的分子数
摩尔系数和分子过量分率定义如下:
aAa单体的官能团a的残留数: Na-NaP bBb单体的官能团b的残留数: Nb-NaP = Na-NaP 两单体官能团(a+b)的残留数: 2(Na-NaP)
28
体系中的大分子总数 体系中的结构单元数(即单体数) Na+Nc
39
人有了知识,就会具备各种分析能力, 明辨是非的能力。
所以我们要勤恳读书,广泛阅读, 古人说“书中自有黄金屋。
”通过阅读科技书籍,我们能丰富知识, 培养逻辑思维能力;
通过阅读文学作品,我们能提高文学鉴赏水平, 培养文学情趣;
通过阅读报刊,我们能增长见识,扩大自己的知识面。 有许多书籍还能培养我们的道德情操, 给我们巨大的精神力量, 鼓舞我们前进。
第二章 逐步聚合
Step-growth Polymerization
1
2.3 线形缩聚反应动力学
1.官能团等活性理论 缩聚反应在形成大分子的过程中是逐步进行的。 原先认为,官能团的活性将随分子量增加而递减。 若每一步都有不同的速率常数,研究将无法进行。
官能团等活性理论:不同链长的端基官能团,具 有相同的反应能力和参加反应的机会,即官能团 的活性与分子的大小无关。
[C+(OH)2]是质子化羧基的浓度,难以确定,设法消去
5
考虑催化用酸HA的离解平衡
6
催化用酸HA 可以是二元酸本身,但反应较 慢,也可以是外加酸,如H2SO4,大大加速。 (a)自催化缩聚反应
无外加酸,二元酸单体作催化剂,[HA] = [COOH],羧基与羟基浓度相等,以C表示, 将③式中的所有常数及[A-]合并成 k
合度。
36
例题2:由己二胺和己二酸生产尼龙-66,分子量 Mn =15000,反应程度P = 0.995,计算两单体原料比, 并计算端胺基与端羧基的摩尔比.
解:
HO CO(CH2)4CONH(CH2)6NH H
n
112
114
结构单元平均分子量:
M0 =
112 + 114 2
= 113
平均聚合度: Xn =
残留的官能团总数分布在大分子的两端,每个 大分子有两个官能团。 体系中大分子总数是端基官能团数的一半:
25
体系中结构单元数等于单体分子数( Na+Nb)/2 表示了Xn与P、r或q之间的定量关系式
26
两种极限情况: A 当原料单体等当量比时,即 r=1或q=0 B 当P=1时,即官能团a完全反应
和前一种情况相同,只是r和q表达式不同 29
(3)aRb 加少量单官能团物质Cb反应, Nc为单官能团 物质Cb的分子数
摩尔系数和分子过量分率如下:
r=
1 q+1
Xn =
1+r 1+r-2rp
30
小结:
三种情况都说明,Xn与P、r(或q)密切 相关. 官能团的极少过量,对产物分子量就有 显著影响. 在线形缩聚中,要得到高分子量,必须 保持严格的等当量比.
< 4 ×10-4(高真空度)
400 < 4 ×10-2(稍低真空度)
103 可在水介质中反应
22
2. 线形缩聚物聚合度的控制 反应程度和平衡条件是影响线形缩聚物聚合 度的重要因素,但不能用作控制分子量的手 段,因为缩聚物的分子两端仍保留着可继续 反应的官能团。
控制方法: 端基封锁
在两官能团等当量的基础上,(a)使某官能团稍 过量或(b)加入少量单官能团物质.
分三种情况进行讨论:
23
(1)单体aAa和bBb反应,其中bBb稍过量,令Na,Nb分 别为官能团a、b的起始数
两单体的官能团数之比为:
称为摩尔系数
bBb单体的分子过量分率(是分子数之比)为:
r-q 关系式
24
设: 官能团a的反应程度为P 则: a官能团的反应数为NaP(也是b官能团的反应数)
a官能团的残留数为 Na-NaP b官能团的残留数为 Nb-NaP a、b官能团的残留总数为 Na+Nb-2NaP
起始
1
1
t时水未排出 C
C
水部分排出 C
C
0 1-C 1-C
0
1-C
nw
13
聚酯反应速率是正、逆反应速率之差(净速率): 水未排出时 水部分排出时 根据反应程度关系式
14
引入平衡常数,K=k1/k-1 ,k-1 =k1/K 代 入上两式,整理:
水未排出时
水部分排出时
总反应速率与反应程度、平衡常数、低分 子副产物含量有关。
r N A 2 0.987 N 0.013
35
NA 2N 2 2N
例:对苯二甲酸(NAmol)和乙二醇(NBmol) 反应得到聚酯,试求: (1) NA=NB=1mol,数均聚合度为100时的反应
程度p; (2) 当平衡常数K=4时,要求生成的数均聚合度
为100时,体系中的水量(mol); (3) 若NA=1.02,NB=1.00,求p=0.99时的数均聚
33
己二酸的分子过量分率:
34
例:由等物质的量的己二酸和己二胺合成聚酰胺,要求 分子量为10000,反应程度为99.5%,问需加多少苯甲酸?
解:本题计算线形缩聚物的聚合度,属于2-2官能度 体系加上少量的单官能团进行端基封锁的情况。
己二酸和己二胺生成尼龙-66的重复单元的平均分子量 为226,则分子量为10000的尼龙-66的结构单元数:
17
正、逆反应达到平衡时,总聚合速率为零,则:
整理 解方程
P > 1, 此根无意义
18
代入
在密闭体系: 聚酯化反应 K=4,P=0.67, Xn只能达到3. 聚酰胺反应 K=400,P=0.95,Xn只能达到21. 不可逆反应 K=104,P=0.99,Xn能达到101.
19
B 非密闭体系 在实际操作中,要采取措施排出小分子(减压;加热; 通 N2, CO2).
X n 10000 2 88.5 226
根据X n 1 r , 1 r 2rp
p 99.5%得:
X n 1 r 1 r 88.5 r 0.987 1 r 2rp 1 r 1.99r
假设己二酸和己二胺的起始物质的量为1mol,苯甲酸
的加入量为Nmol,则:
31
例题1:生产尼龙-66,想获得Mn = 13500的产品, 采用己二酸过量的办法, 若使反应程度P = 0.994, 求己二胺和己二酸的配料比和过量分率. 解:当己二酸过量时,尼龙-66的分子结构为
结构单元的平均分子量:
32
则平均聚合度 当反应程度P = 0.994时,求r值:
己二胺和己二酸的配料比: r=0.995
15
2.4 影响线形缩聚物聚合度的因素及控制方法 1. 影响聚合度的因素 1)反应程度对聚合度的影响 在任何情况下,缩聚物的聚合度均随反应程度 的增大而增大. 反应程度受到某些条件的限制 可逆反应
