临床科室领用药品备案审批表
医疗机构炮制中药饮片备案申请表

用法用量
附 件
■《医疗机构执业许可证》复印件
■从事制备中药饮片工作的药学技术人员名册
■从事直接接触中药饮片工作人员的有效健康证明复印件
■制备场所布局图
■与制备及检验中药饮片相适应的设施设备目录
■质量标准和制备工艺
■市场上没有供应品种的证明文件
声 明
我们保证:①本申请遵守国家法律法规的规定;②申请表内容及所提交备案的资料均真实,未侵犯他人的权益,一并提交的电子文件与打印文件内容完全一致。
申请人:
法定代表人(签字):
日期: 年 月 日 (公 章)制备中药饮片备案表
备案日期 年 月 日 编号:
备
案
机
构
信
息
单位名称
(加盖公章)
《医疗机构执业许可证》编号
地址
联系人
联系电话
法定代表人
联系电话
中
药
饮
片
基
本
信
息
中药饮片
名 称
通用名称
汉语拼音
药材来源
(产 地)
饮片规格
主要制备工艺(含辅料)
辅料信息
名 称
生产企业
执行标准
包装材料信息
名 称
生产企业
执行标准
临床科室药事有关表格汇总

患者授权亲属签名与患者关系签名日期年月日
医生陈述:
我已经告知患者将要进行的治疗方式、此次治疗及治疗后可能发生的并发症和风险、可能存在的其它治疗方法并且解答了ห้องสมุดไป่ตู้者关于此次治疗的相关问题。
医生签名签名日期年月日
超说明书用药备案登记表
申请科室:
科主任:
超说明书范围
1、患者因个体差异等特殊情况对药物发生过敏、中毒等不良反应,导致休克、心跳呼吸骤停、脑死亡、严重多脏器功能损害等。
2、相关的药物不良反应。
3、其他难以预料的意外和并发症
4、自备药品为假药、劣药等。
上述情况医师均已讲明。经慎重考虑,本人对使用自备药品可能出现的风险表示充分的理解,本人相信医护人员将竭尽全力救治,并积极配合医师治疗,按规定缴纳一切费用。因使用自备药品引发的上述情况,本人放弃通过行政、司法等途径来主张权利。本人要求并授权医院使用自备药品,签字为证。
住院患者自备药品使用责任书
姓名
性别
年龄
科室
床号
住院号
诊断
自备药品
药名
规格
批号
数量
效期
使用理由
医师签名: 年 月 日
患者使用自备药品的责任与风险
本人从自身利益角度要求使用自备药品。但任何药物均具有风险,在根据病情,切实按用药操作技术规范使用自备药品的情况下,仍有可能发生以下难以避免的用药意外及并发症:
7)我理解我可能出现骨质疏松、各部位病理性骨折。
8)我理解我可能出现骨骼无菌性坏死。
9)我理解我可能出现月经失调或阳痿。
10)我理解我可能出现胰腺炎。
11)我理解我可能出现精神失常,诱发精神病。
厦门大学附属中山医院备案药品申请单
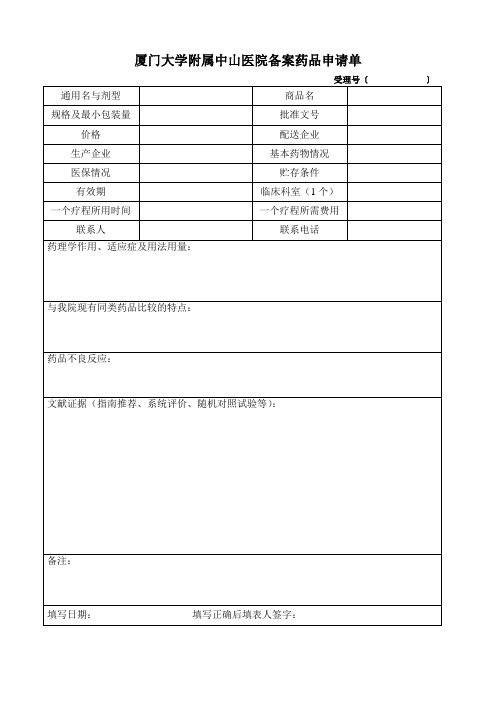
厦门大学附属中山医院备案药品申请单
新药申请表填写注意事项
1、受理号码由药学部审查合格后填写。
2、通用名与剂型请按照产品名称填写完整,一定要将剂型写上。
如注射用青霉素、阿莫西
林分散片等。
3、商品名称若没有,请注明“无”,无需再将通用名称重抄一遍。
4、基本药物需注明“国家基本药物”、“福建省基本药物”、“厦门市基本药物”或“非基本
药物”。
5、医保情况:医保药品请按照《福建省基本医疗保险和工伤保险药品目录》编号而非“国
家医保目录”填写,非医保药品注明“非医保”。
6、申请临床科室请填写将来使用该药品的主要科室,而且只能填写一个科室。
7、联系人可以是生产企业、配送企业或代理商,主要目的是在该产品发生疑问时可以及时
联系沟通。
8、规格及最小包装量填写药品规格和药品单包装数量,如0.25g×12片/盒或160万U×1支
/盒,不要填写中包装的量。
9、文献证据,包括指南推荐、系统评价、随机对照试验等。
如为已发表文献,请写文章题
目和文章出处(发表的期刊名称、卷、期、起止页码);如未发表,请注明试验单位,并提交试验报告。
10、如该药品以前在我院药库中有采购记录后退出的,需说明当时退出理由,并填写在备
注中。
11、填表日期按填写的当天日期为准。
如果以后有修改,请填写修改那天的日期,以便药
学部能够按照更新的表格进行存档。
12、所有情况填写完整,上交纸质资料时,确认无误后,请手写签字。
药物临床试验项目审批表

签字: 年月日
例
二. 申办方信息
公司名称
申办方
通讯地址 法人代表
联系人
联系电话
公司名称
CRO
通讯地址
(如有)
法人代表
联系人
联系电话
临床监查员姓名
联系电话
组长单位(如有)
组长单位主要研 究者(如有)
三. 附件材料(纸质版和电子版均需要)
□ NMPA 药物临床试验批件或通知书(上市药物应有药品注册证书)
□ 药物检验合格报告
GCP 机构办主任签字:
学科办主任签字:
年月日 伦理委员会审查意见:
年月日
盖章: 年月日
1.合同/协议 2.法律意见书: GCP 机构办审批意见: 学科办意见:
财务部意见:
机构副主任意见:
审计科意见:
总会计师意见:
机构主任意见:
签字: 年月日
签字: 年月日
签字: 年月日
签字: 年月日
签字: 年月日
加盖单位红章。
□ 项目经理的法人委托书原件,项目经理身份证或/和工作证复印件,GCP 证书,
并加盖单位红章。
□ 临床试验方案(需注明版本号)
□ 病例报告表样表(需注明版本号)
□ 知情同意书样本(需注明版本号) □ 研究者手册(需注明版本号) □ 受试者招募方案和广告(需注明版本号) □ 课题负责人简历、医师资格证、注册证、GCP 培训证书 □ 药物临床试验团队名单 □ 申办方公司/CRO 公司委托医院试验的委托函,加盖申办方公章。 □ 组长单位伦理批件(如有) □ 保险凭证(如有) □ 其他
申办方单位联系人签字(盖章):
年月日
经费预算情况(请罗列该项目涉及的所有经费情况,包括但不限于检验检测费、
科室备用药品申领表

序号
药品通用名称
规格
单位
数量
1
2
3
4
5
...
年月日
科主任护士长
领用备用药品审批表
申请科室
申ห้องสมุดไป่ตู้时间
药品种类
领用药品事由及明细
(本次申领药品详见附表内容,麻、精、高危药品须在此表填写明细)
申请科室护士长意见:
签名:年月日
申请科室主任意见:
签名:年月日
主管院长意见:
签名:年月日
补充必备药品审批表
申请科室
申请时间
药品种类
补充药品事由:
申请科室护士长意见:
签名:年月日
申请科室主任意见:
签名:年月日
主管院长意见:
签名:年月日
补充备用药品一览表
序号
通用名称
规格
单位
补充数量
补充理由
宝清县人民医院抗菌药物品规备案表

医疗机构购用抗菌药物品规备案表(新)填表单位:宝清县人民医院公章类别序号药品通用名剂型规格青霉素类青霉素类1 青霉素注射剂80万u400万u2 阿莫西林胶囊剂0.25*20粒3 青霉素V钾片片剂0.236*12片4 美洛西林钠注射剂 2.01.05 磺苄西林钠注射剂 1.0青霉素类复方制剂6 阿莫西林钠/克拉维酸钾注射剂 1.27 氨苄西林/丙磺舒胶囊剂0.25*18粒头孢菌素类一代头孢菌素8 头孢氨苄片剂0.25*30片9 五水头孢唑林钠注射剂1.00.510 头孢硫咪注射剂0.51.0二代头孢菌素11 头孢替安注射剂0.5三代头孢菌素12 头孢他啶注射剂 1.513 头孢曲松钠注射剂 1.014 头孢克肟片剂0.1*6片15 头孢哌酮钠/舒巴坦钠注射剂 1.5四代头孢菌素16 盐酸头孢吡肟注射剂0.51.0头霉素类氧头孢类β—内酰胺酶抑制剂其他ß---内酰胺类17 氨曲南注射剂0.51.0 18 头孢西丁钠注射剂 1.00.5 19 头孢美唑钠注射剂 1.00.5碳青霉烯类氨基糖苷类20 链霉素注射剂 1.0氨基糖苷类 21 硫酸庆大霉素 注射剂 8万u 22 硫酸阿米卡星 注射剂 0.2 酰胺醇类四环素类 23 土霉素 片剂 0.25*12片 大环内酯类 24 罗红霉素片剂75㎎*12片 0.15*6片林可胺类 25 盐酸克林霉素 注射剂 0.2*100ml 26 硫酸阿奇霉素 注射剂 0.25喹诺酮类27 诺氟沙星 胶囊0.1*24粒28 盐酸左氧氟沙星 注射剂 0.2*100ml 29门冬氨酸洛美沙星 注射剂 0.1 硝基呋喃类硝基咪唑类30 甲硝唑 片剂0.2*100片31 甲硝唑 注射剂 0.5*250ml 32奥硝唑氯化钠 注射剂 0.5*100ml0.25*100ml磺胺类 噁唑酮类 其他类抗真菌类 浅部抗真菌药 深部抗真菌药备案医疗机构及法人签章王志强年 月 日核发 << 医疗机构执业许可证 >>的卫生行政部门备案经办人; 审核人; 签发人年 月 日联系电话:5432563药事管理与药物治疗学委员会宝清县人民院医院人民医院爱婴医院。
医疗机构抗菌药物临床应用备案表

医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表本品为第二代注射用头孢菌素
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表
医疗机构抗菌药物临床应用备案表。
药物临床试验申请审批表

试验名称
CFDA批件号
药物名称
药物剂型
适应症
注册分类
化药类生物制剂类进口注册国际多中心其他
试验分期
Ⅰ期Ⅱ期Ⅲ期Ⅳ期生物等效性试验临床验证
项目立项类别
新启动项目增加中心项目
申请审查形式
快速审查会议审查
申办者
联系方式
CRO(如有)
联系方式
组长单位
主要研究者
本中心承担专业
主要研究者
试验计划完成总例数
本中心计划完成例数
申办者
代表人(签章):
日 期:
CRO
(如有)
代表人(签章):
日 期:
研究专业
审查意见
同意,进入机构审查程序
不同意,原因:
专业负责人:
年 月 日
机构办公不同意,原因:
机构办公室主任:
年 月 日
项目审查人员:
年 月 日
机构负责人
审批意见
同意,进入伦理审查程序
不同意,原因:
机构负责人:
年 月 日
