最新21盐酸吗啉胍片工艺规程汇总
盐酸二甲双胍片生产工艺设计方案

盐酸二甲双胍 250g
糊
精 5g
预胶化淀粉 35.7g
淀
粉 8.3g
Mg-St
1g
制成
1000 片
三、 生产工艺流程图及环境区划示意图
四、 工序质量控制要点
工序
质量控制
粉碎
点 原辅料
粉碎过筛
配料
投料
制粒
颗粒
2
质量控制项目 异物 细度、异物 品种、数量、批号 粘合剂温度、浓度
频次 每批 每批 1 次/批 1 次/批
4
查其相应片子的完整外观。 (4)压片制作完毕后将成品片子用一个塑料周转桶对其进行密封加盖并待密封好后再存放到片
子贴上的成品物料回收卡之后再进行递交递送中间站,在递交中间站门口进行成品称量,填写一份关 于半成品的称量请求检验单,质监工作人员根据成品规定时间进行检验取样。
(5)边现场操作边严格认真填写操作记录,生产工作完成后,按照中国压片机产品清洗处理标准 工艺操作处理规程和有关清洁处理工艺操作规程的相关要求对其内部进行了产品清场,由公司质监 工作人员现场检验产品合格后为其发放了产品清场处理合格证。
3
称量指示凭证书所描述规定的称量要求对其进行限期定额配料称量、记录、签字,并由双人共同进行 资格复核。配好的批量原辅料制粒安装在洁净的成型不锈钢辅料周转桶中严密封闭,挂好批量混合食 品物料称量卡(内外各一个),注明批量商品的辅料名称、批号、规格、数量、称量者、复核员、日期 等,转入到其他批量混合食品成型辅料制粒的操作过程中。
筛网及目数
烘干 整粒、总混
沸腾床干
温度、滤袋材料是否完好情况、清洁
燥 粒度
度 筛网目数、总混时间、含量、水份
随时/批 1 次/批
原811-2盐酸吗啉胍检验标准操作程序

目的:规范原辅料检验方法和操作程序。
范围:盐酸吗啉胍责任:质检员规定:1性状1.1取本品5g,置洁净的白瓷盘中,检查其颜色和状态。
1.2依法检查(凡例),观察本品在水、氯仿中溶解情况。
1.3吸收系数取本品,精密称定,加水溶解并定量称稀制成每1ml中含盐酸吗啉胍5ug的溶液,照分光光度法测定,在237nm波长处测定吸收度。
2鉴别2.1取本品约10mg,加水1ml溶解后,加碘试液数滴,观察现象。
2.2取本品约10mg,加水1ml溶解后,加硫酸铜试液1滴,氢氧化钠试液1ml,观察现象。
2.3依法检查(附录III)氯化物鉴别反应:①取供试品溶液,加稀硝酸使成酸性后,滴加硝酸银试液,即观察反应现象;分离沉淀,沉淀加氨试液,即观察反应现象,再加稀硝酸酸化后,观察反应现象。
②取供试品少量,置试管中,加等量的二氧化锰,混匀,加硫酸湿润,缓缓加热,观察反应现象,并用水湿润的碘化钾淀粉试纸放置试管口,观察试纸的颜色变化。
3检查3.1澄清度取本品1g,加水100ml溶解后,检查溶液澄清度。
3.2酸碱度取本品0.1g,加新沸过的冷水10ml溶解,按“pH测定标准操作程序”检测。
3.4有关物质照高效液相色谱法(附录V D)测定3.4.1色谱条件与系统适用性试验填充剂:氨基硅烷键合硅胶流动相:0.03mol/L磷酸二氢钾缓冲液(PH4.5)检测波长:237nm理论板数:≥2500(按吗啉胍峰计算)3.4.2供试品溶液与对照溶液的制备取本品适量,加0.03mol/L磷酸二氢钾缓冲液(PH4.5)制成每1ml中含1.0mg的溶液,作为供试品溶液;精密量取适量,加0.03mol/L磷酸二氢钾缓冲液(PH4.5)制成每1ml中含10ug的溶液,作为对照溶液。
3.4.3测定法取对照溶液20ul,注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的45~55%;再量取对照溶液和供试品溶液各20ul,分别注入液相色谱仪,记录色谱图至主成分峰保留时间的2.5倍。
01二甲工艺规程(2006.2.28修改)

北京嘉德制药有限公司编号:GY-TMS-GP-001-01盐酸二甲双胍片生产工艺规程目录一、产品概述-----------------------------------------------------------------------------------3二、生产工艺流程图及环境区域划分-----------------------------------------------------4三、处方1. 处方依据----------------------------------------------------------------------------------52. 处方----------------------------------------------------------------------------------------5四、生产、包装工艺1. 原辅料质量标准------------------------------------------------------------------------52. 工艺用水质量标准---------------------------------------------------------------------123. 瓶装包装规格---------------------------------------------------------------------------164. 板装包装规格---------------------------------------------------------------------------165. 主要设备及生产能力-----------------------------------------------------------------166. 操作过程及工艺条件-----------------------------------------------------------------167. 质量控制点-----------------------------------------------------------------------------208. 技术安全、劳动保护及工艺卫生--------------------------------------------------209. 物料平衡--------------------------------------------------------------------------------2210. 原辅料及包装材料消耗定额------------------------------------------------------2411. 劳动组织及岗位定员---------------------------------------------------------------2512. 中间产品贮存------------------------------------------------------------------------2613.盐酸二甲双胍片半成品质量标准------------------------------------------------2614. 盐酸二甲双胍片成品质量标准---------------------------------------------------26一、产品概述1.1产品名称:盐酸二甲双胍片1.2汉语拼音:Yansuan Erjiashuanggua Pian1.3英文名:Metformin Hydrochloride Tablets2规格:0.25g3.性状:本品为薄膜衣片,除去包衣后显白色。
吗啉恶酮片车间工艺设计

摘要车间工艺设计是在毕业实习的基础上,认真观察实习厂家的厂房布局,设备布置并收集相关数据及资料,在老师的指导下进行的。
应用所学的专业知识和各方面信息进行本次设计。
旨在理论联系实际,培养分析和解决实际工程问题的能力,从而达到更进一步巩固基础知识,提高工艺设计能力,应用计算机AUTOCAD绘图的能力。
本次设计任务为年产40亿片吗啉噁酮片的车间工艺设计,根据年生产总量计算每天的工作量,以此为基础结合工艺流程进行设备选型。
根据设备尺寸和台数设计厂房的平面布置,并布置净化系统。
本设计说明书综述了吗啉噁酮的药理作用,片剂的生产工艺设计和车间设计,并较为详细的介绍了片剂车间的组成、布置、生产设备、工艺管道、净化系统及生产管理等。
本次设计为初步工艺设计,为施工设计及投资规划提供了基本依据。
最后设计结果为:车间总面积为2808m2,共选用粉碎机1台,筛分机2台,混合机2台,沸腾制粒干燥机2台,整粒机3台,压片机3台,包衣机5台,铝塑包装机4台等。
绘制了6幅图,撰写了1.5万字以上的初步设计说明书,并翻译了约3500字的专业文献。
关键词:片剂;吗啉噁酮片;车间工艺设计AbstractWorkshop process design is designed on the basis of the graduation practice,carefully observing plane layout,equipment layout of internship factory and collecting related data and information,and finished under the guidance of e the application of the specialized knowledge studied and information on other aspects,it aimed at linking theory with reality and training us the ability of analyzing and solving practical problems.So as to achieve further consolidate and improve the ability of process design,computer AutoCAD drawing.The design mandate is the design of an annual output of 4 billion linezolid tablets workshop, according to the annual production,calculate the daily output combined with integration process,provide the basis of selection of equipment.According to equipment size and number,design plant layout and purification system. The design specification summarize the pharmacological effects of linezolid tablets,the production process design and plant design of tablets or a more detailed introduction of a workshop of the tablets form, layout, production equipment,pipeline technology, production management and purification system and so on. The design process for the preliminary design provide basis for the construction design and investment plan. The results for the final design: Workshop total area of 2808 m2, has chosen one set of crusher , two set sof screen, two sets of mixer , two sets of Granulating machine,two sets of whole grain of machine,three sets of compressor machine,five sets of coating machine,four sets of aluminum-plastic packaging machine and so on. Finish six plans,write more than 15,000 words preliminary design of brochures,and translated the word about the professional literature 3500.Key words:tablets;Linezolid tablets;the process design of workshop目录摘要 (I)Abstract (II)第一章概述 (1)1.1 产品简介 (1)1.2 处方分析 (3)1.3 设计依据 (4)1.3.1 设计内容 (4)1.3.2 设计原则 (5)第二章工艺流程 (6)2.1 粉碎与过筛 (6)2.2 混合与制粒 (9)2.3 干燥 (10)2.4 整粒与总混 (11)2.5 压片 (11)2.6 包衣 (12)2.7 包装 (13)第三章物料衡算与热量衡算 (16)3.1 物料衡算概述 (16)3.2 原辅料的物料衡算 (17)3.3 包装材料的消耗 (19)3.3.1 铝塑包装用量 (19)3.3.2 中包装及外包装用量 (20)3.4 热量衡算 (21)3.4.1计算条件 (21)3.4.2计算过程 (21)第四章设备计算与选型 (23)4.1 粉碎设备 (23)4.2 筛分设备 (24)4.3 混合设备 (26)4.4 制粒和干燥设备 (28)4.5 整粒设备 (30)4.6 压片设备 (31)4.7 包衣设备 (33)4.8 包装设备 (35)第五章车间布置设计及管道设计 (37)5.1 车间布置设计的任务 (37)5.2 车间布置设计的内容 (38)5.3 车间布置设计的依据 (38)5.4 工厂布置 (40)5.5 车间布置设计 (41)5.6 各工序布局 (45)5.7 车间管道设计 (45)5.7.1 车间管道设计的基本资料 (46)5.7.2 管道设计的内容 (46)5.7.3 用水管道及管件材质要求 (47)5.7.4 车间管道安装要求 (47)5.7.5 车间管道的计算 (48)5.8 车间设备布置 (50)5.8.1 设备的吊装和运输 (50)5.8.2 设备的安装 (50)5.8.3 设备及钢结构油漆及其它要求 (50)5.9 车间人员配置 (50)第六章公用体统消耗 (52)6.1设计说明 (52)6.1.1 设计依据 (52)6.1.2 设计原则和设计范围 (52)6.2 公用工程设计概况 (53)6.2.1 给排水 (53)6.2.2 电气 (56)6.3 节能 (62)第七章结论与建议 (64)7.1 结论 (64)7.2 建议 (64)参考文献 (65)致谢 (67)附录 (68)第一章概述1.1 产品简介噁唑烷酮类(oxazolidinone)抗菌药是继磺胺类和喹诺酮类抗菌药后上市的又一类全合成的抗菌药物,其对G+菌的抗菌谱非常广,对耐甲氧西林葡萄球菌(MRSA)、耐万古霉素葡萄球菌、耐万古霉素肠球菌(VRE)、耐青霉素肺炎球菌和厌氧菌均有抗菌活性。
年产500吨盐酸二甲双胍的工艺工段设计

目录设计总说明 I1 概要 I1.1任务依据 I1.2设计标准 I1.3设计资料主要来源 I2设计内容 I2.1生产工艺流程 I2.2设计结构 IIIThe total designed to show that III 1前言 11.1 盐酸二甲双胍的性质 11.1.1 理化性质 11.1.2 临床上用途 21.2 发展简史 21.3 国内外市场现状及生产现状 41.4 选题的意义 52生产工艺 62.1 设计任务及内容 62.2 生产工艺 62.3 生产工艺流程确定 72.3.1 生产工艺流程 72.3.2 工艺流程图 72.4 工艺过程说明 72.4.1 粗制阶段 72.4.2 精制阶段 83 物料衡算 93.1 缩合罐的物料衡算 93.2 离心机的物料衡算 103.3 脱色罐的物料衡算 113.4 结晶罐的物料衡算 113.5 精制离心罐的物料衡算 123.6 干燥机的物料衡算 124 能量衡算 144.1 反应罐能量衡算 144.1.1 比热容的计算 144.1.2 能量衡算 155 主要工艺设备计算 205.1 工艺设备选型原则 205.2 工艺设备计算 205.2.1 结晶反应釜 205.2.2 夹套的计算 215.2.3 筒体的材料和壁厚 235.2.4 选择釜体法兰 245.2.5 选用手孔、视镜、温度计、和工艺接管 245.2.6 搅拌器的设计计算 255.2.7 容器支座的选用计算 255.3 离心机 255.4 脱色罐 265.5 精制结晶罐 265.5.1结晶釜尺寸计算 265.5.2夹套尺寸计算 275.5.3 强度计算(按内压计算强度) 285.6 精制离心机 315.7干燥机 316 管道设计 326.1 管道计算 326.1.1 环己醇的进料管道的计算 326.1.2 乙醇的进料管道的计算 336.1.3 反应釜的出料管道计算 337 泵的计算选型 347.1 输送环己醇用泵的计算 357.2 输送乙醇用泵的计算 367.3 输送母液用泵的计算 378 车间布置设计 398.1 概述 398.2 车间布置设计的依据 398.3 车间布置设计应考虑的因素 408.4 车间布置设计的程序 408.5 车间设计的成果 419 公用工程 429.1 排水系统 429.2 电气和照明 439.2.1 电气设计和安装 439.2.2 照明设计和安装 449.3 环境消毒 459.3.1 灭菌与消毒 459.3.2消毒剂的选择和配制 469.3.3主要消毒和灭菌方法 4710 结论 49附录1 50参考文献 51设计总说明1 概要1.1任务依据毕业设计任务书1.2设计标准(1)盐酸二甲双胍工艺质量标准(2)盐酸二甲双胍设计参数(3)结晶釜设计参数1.3设计资料主要来源(1)药厂反应设备及车间工艺设计(2)结晶化工艺手则(3)石油化工设备设计手则(4)压力容器设计手则2设计内容本设计要求是采用以盐酸二甲胺和双氰胺为原料,产量为500吨盐酸二甲双胍工艺初步设计。
78种常见固体片剂处方工艺
**药业有限公司**药业有限公司**药业有限公司编号:片剂产品标准技术操作卡年11月2日**药业有限公司编号:片剂产品标准技术操作卡2010 年4月18 日**药业有限公司编号:片剂产品标准技术操作卡年11月2日**药业有限公司编号:片剂产品标准技术操作卡2010年11月2日**药业有限公司编号:片剂产品标准技术操作卡--年7月10日**药业有限公司编号:片剂产品标准技术操作卡--年6月16日**药业有限公司编号:片剂产品标准技术操作卡2010年11月1日**药业有限公司编号:片剂产品标准技术操作卡2010年11月2日**药业有限公司编号:片剂产品标准技术操作卡2010 年11 月2 日**药业有限公司编号:片剂产品标准技术操作卡年月日石家庄制药集团欧意药业编号:片剂产品标准技术操作卡--年6月15日**药业有限公司编号:片剂产品标准技术操作卡--年3月20日石药集团欧意药业编号:片剂产品标准技术操作卡2010年11月10日石药集团欧意药业编号:片剂产品标准技术操作卡--年7月8日**药业有限公司编号:片剂产品标准技术操作卡年月日**药业有限公司编号:片剂产品标准技术操作卡年月日**药业有限公司编号:片剂产品标准技术操作卡--年5月19日**药业有限公司编号:片剂产品标准技术操作卡--年5月19日**药业有限公司编号:片剂产品标准技术操作卡2010年11月2日**药业有限公司编号:片剂产品标准技术操作卡--年月日**药业有限公司编号:片剂产品标准技术操作卡-- 年月日**药业有限公司编号:片剂产品标准技术操作卡--年5月19日。
GMP文件总目录

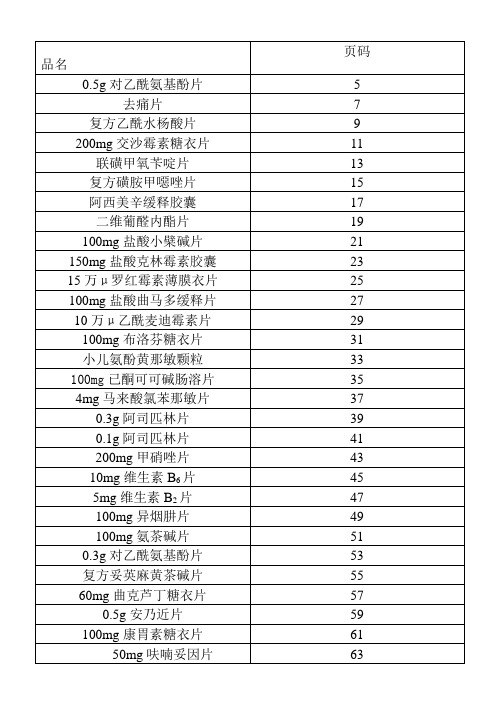
文件编码1技术标准1.1工艺规程1.1.1片剂工艺规程1去痛片工艺规程J-GY-10012土霉素片工艺规程J-GY-10023维生素C 片工艺规程J-GY-10034盐酸小檗碱片工艺规程J-GY-10045异烟肼片工艺规程J-GY-10056吡哌酸片工艺规程J-GY-10067阿普唑仑片工艺规程J-GY-10078阿司匹林片工艺规程J-GY-10089氨茶碱片工艺规程J-GY-100910安乃近片工艺规程J-GY-101011对乙酰氨基酚片工艺规程J-GY-101112复方磺胺甲噁唑片工艺规程J-GY-101213复方乙酰水杨酸片工艺规程J-GY-101314甲硝唑片工艺规程J-GY-101415曲克芦丁片工艺规程J-GY-101516曲克芦丁羟丙茶碱片工艺规程J-GY-101617盐酸吗啉胍片工艺规程J-GY-101718氧氟沙星片工艺规程J-GY-101819乙酰螺旋霉素片工艺规程J-GY-101920醋酸泼尼松片工艺规程J-GY-10201.1.2胶囊剂工艺规程1盐酸雷尼替丁胶囊工艺规程J-GY-20012氯霉素胶囊工艺规程J-GY-20023诺氟沙星胶囊工艺规程J-GY-20034阿莫西林胶囊工艺规程J-GY-20045利福平胶囊工艺规程J-GY-20056氨咖黄敏胶囊工艺规程J-GY-20067氨苄西林胶囊工艺规程J-GY-20078头孢氨苄胶囊工艺规程J-GY-20081.1.3颗粒剂工艺规程1复方氨酚那敏颗粒工艺规程J-GY-30011.1.4注射剂工艺规程J-GY-40011.2原料质量标准1氨基比林质量标准J-YL-00012苯巴比妥质量标准J-YL-00023非那西丁质量标准J-YL-0003广生制药GMP文件总目录文件名称4咖啡因质量标准J-YL-0004 5土霉素质量标准J-YL-0005 6维生素C质量标准J-YL-0006 7盐酸小檗碱质量标准J-YL-0007 8异烟肼质量标准J-YL-0008 9吡哌酸质量标准J-YL-0009 10阿普唑仑质量标准J-YL-0010 11阿司匹林质量标准J-YL-0011 12氨茶碱质量标准J-YL-0012 13安乃近质量标准J-YL-0013 14对乙酰氨基酚质量标准J-YL-0014 15磺胺甲噁唑质量标准J-YL-0015 16甲氧苄啶质量标准J-YL-0016 17乙酰水杨酸质量标准J-YL-0017 18非那西丁质量标准J-YL-0018 19甲硝唑质量标准J-YL-0019 20曲克芦丁质量标准J-YL-0020 21二羟丙茶碱质量标准J-YL-0021 22香豆素质量标准J-YL-0022 23盐酸吗啉胍质量标准J-YL-0023 24氧氟沙星质量标准J-YL-0024 25乙酰螺旋霉素质量标准J-YL-0025 26醋酸泼尼松质量标准J-YL-0026 27人工牛黄质量标准J-YL-0027 28马来酸氯苯那敏质量标准J-YL-0028 29盐酸雷尼替丁质量标准J-YL-0029 30氯霉素质量标准J-YL-0030 31诺氟沙星质量标准J-YL-0031 32阿莫西林质量标准J-YL-0032 33利福平质量标准J-YL-0033 34氨苄西林质量标准J-YL-0034 35头孢氨苄质量标准J-YL-00351.3辅料质量标准1饮用水质量标准J-FL-0001 2纯化水质量标准J-FL-0002 3注射用水质量标准J-FL-0003 4羟丙甲纤维素质量标准J-FL-0004 5聚山梨脂80质量标准J-FL-0005 6淀粉质量标准J-FL-0006 7羧甲淀粉钠质量标准J-FL-0007 8糊精质量标准J-FL-0008 9硬脂酸镁质量标准J-FL-0009 10乙基纤维素质量标准J-FL-0010 11硬脂酸质量标准J-FL-0011 12预胶化淀粉质量标准J-FL-001213枸橼酸质量标准J-FL-0013 14微粉硅胶质量标准J-FL-0014 15乙醇质量标准J-FL-0015 16蔗糖质量标准J-FL-0016 17滑石粉质量标准J-FL-0017 18食用色素质量标准J-FL-0018 19硅油质量标准J-FL-0019 20虫白蜡质量标准J-FL-0020 21明胶质量标准J-FL-0021 22空心胶囊质量标准J-FL-0022 23红氧化铁质量标准J-FL-0023 24活性炭质量标准J-FL-00241.4中间产品质量标准1.4.1片剂中间产品质量标准1去痛片中间产品质量标准J-ZC-1001 2土霉素片中间产品质量标准J-ZC-1002 3维生素C片中间产品质量标准J-ZC-1003 4盐酸小檗碱片中间产品质量标准J-ZC-1004 5异烟肼片中间产品质量标准J-ZC-1005 6吡哌酸片中间产品质量标准J-ZC-1006 7阿普唑仑片中间产品质量标准J-ZC-1007 8阿司匹林片中间产品质量标准J-ZC-1008 9氨茶碱片中间产品质量标准J-ZC-1009 10安乃近片中间产品质量标准J-ZC-1010 11对乙酰氨基酚片中间产品质量标准J-ZC-1011 12复方磺胺甲噁唑片中间产品质量标准J-ZC-1012 13复方乙酰水杨酸片中间产品质量标准J-ZC-1013 14甲硝唑片中间产品质量标准J-ZC-1014 15曲克芦丁片中间产品质量标准J-ZC-1015 16曲克芦丁羟丙茶碱片中间产品质量标准J-ZC-1016 17盐酸吗啉胍片中间产品质量标准J-ZC-1017 18氧氟沙星片中间产品质量标准J-ZC-1018 19乙酰螺旋霉素片中间产品质量标准J-ZC-1019 20醋酸泼尼松片中间产品质量标准J-ZC-10201.4.2胶囊剂中间产品质量标准1盐酸雷尼替丁胶囊中间产品质量标准J-ZC-2001 2氯霉素胶囊中间产品质量标准J-ZC-2002 3诺氟沙星胶囊中间产品质量标准J-ZC-2003 4阿莫西林胶囊中间产品质量标准J-ZC-2004 5利福平胶囊中间产品质量标准J-ZC-2005 6氨咖黄敏胶囊中间产品质量标准J-ZC-2006 7氨苄西林胶囊中间产品质量标准J-ZC-2007 8头孢氨苄胶囊中间产品质量标准J-ZC-20081.4.3颗粒剂中间产品质量标准1复方氨酚那敏颗粒中间产品质量标准J-ZC-30011.4.4注射剂中间产品质量标准J-ZC-40011.5成品质量标准1.5.1片剂成品质量标准1去痛片质量标准J-CP-1001 2土霉素片质量标准J-CP-1002 3维生素C片质量标准J-CP-1003 4盐酸小檗碱片质量标准J-CP-1004 5异烟肼片质量标准J-CP-1005 6吡哌酸片质量标准J-CP-1006 7阿普唑仑片质量标准J-CP-1007 8阿司匹林片质量标准J-CP-1008 9氨茶碱片质量标准J-CP-1009 10安乃近片质量标准J-CP-1010 11对乙酰氨基酚片质量标准J-CP-1011 12复方磺胺甲噁唑片质量标准J-CP-1012 13复方乙酰水杨酸片质量标准J-CP-1013 14甲硝唑片质量标准J-CP-1014 15曲克芦丁片质量标准J-CP-1015 16曲克芦丁羟丙茶碱片质量标准J-CP-1016 17盐酸吗啉胍片质量标准J-CP-1017 18氧氟沙星片质量标准J-CP-1018 19乙酰螺旋霉素片质量标准J-CP-1019 20醋酸泼尼松片质量标准J-CP-10201.5.2胶囊剂成品质量标准1盐酸雷尼替丁胶囊质量标准J-CP-2001 2氯霉素胶囊质量标准J-CP-2002 3诺氟沙星胶囊质量标准J-CP-2003 4阿莫西林胶囊质量标准J-CP-2004 5利福平胶囊质量标准J-CP-2005 6氨咖黄敏胶囊质量标准J-CP-2006 7氨苄西林胶囊质量标准J-CP-2007 8头孢氨苄胶囊质量标准J-CP-20081.5.3颗粒剂成品质量标准1复方氨酚那敏颗粒质量标准J-CP-30011.5.4注射剂成品质量标准J-CP-40011.6包装材料质量标准1标签质量标准J-BC-0001 2说明书质量标准J-BC-0002 3塞纸质量标准J-BC-00034铝箔(PTP)质量标准J-BC-0004 5聚氯乙烯(PVC)硬片质量标准J-BC-0005 6纸盒质量标准J-BC-0006 7封口签质量标准J-BC-0007 8热合收缩膜质量标准J-BC-0008 9药用塑料瓶质量标准J-BC-0009 10纸箱垫片质量标准J-BC-0010 11纸箱质量标准J-BC-0011 12打包带质量标准J-BC-0012 13封口胶带质量标准J-BC-00131.7质量检验1.7.1原料质量检验1氨基比林检验标准操作规程J-ZJ-1001 2苯巴比妥检验标准操作规程J-ZJ-1002 3非那西丁检验标准操作规程J-ZJ-1003 4咖啡因检验标准操作规程J-ZJ-1004 5土霉素检验标准操作规程J-ZJ-1005 6维生素C检验标准操作规程J-ZJ-1006 7盐酸小檗碱检验标准操作规程J-ZJ-1007 8异烟肼检验标准操作规程J-ZJ-1008 9吡哌酸检验标准操作规程J-ZJ-1009 10阿普唑仑检验标准操作规程J-ZJ-1010 11阿司匹林检验标准操作规程J-ZJ-1011 12氨茶碱检验标准操作规程J-ZJ-1012 13安乃近检验标准操作规程J-ZJ-1013 14对乙酰氨基酚检验标准操作规程J-ZJ-1014 15磺胺甲噁唑检验标准操作规程J-ZJ-1015 16甲氧苄啶检验标准操作规程J-ZJ-1016 17乙酰水杨酸检验标准操作规程J-ZJ-1017 18非那西丁检验标准操作规程J-ZJ-1018 19甲硝唑检验标准操作规程J-ZJ-1019 20曲克芦丁检验标准操作规程J-ZJ-1020 21二羟丙茶碱检验标准操作规程J-ZJ-1021 22香豆素检验标准操作规程J-ZJ-1022 23盐酸吗啉胍检验标准操作规程J-ZJ-1023 24氧氟沙星检验标准操作规程J-ZJ-1024 25乙酰螺旋霉素检验标准操作规程J-ZJ-1025 26醋酸泼尼松检验标准操作规程J-ZJ-1026 27人工牛黄检验标准操作规程J-ZJ-1027 28马来酸氯苯那敏检验标准操作规程J-ZJ-1028 29盐酸雷尼替丁检验标准操作规程J-ZJ-1029 30氯霉素检验标准操作规程J-ZJ-1030 31诺氟沙星检验标准操作规程J-ZJ-1031 32阿莫西林检验标准操作规程J-ZJ-103233利福平检验标准操作规程J-ZJ-1033 34氨苄西林检验标准操作规程J-ZJ-1034 35头孢氨苄检验标准操作规程J-ZJ-10351.7.2辅料质量检验1饮用水检验标准操作规程J-ZJ-2001 2纯化水检验标准操作规程J-ZJ-2002 3注射用水检验标准操作规程J-ZJ-2003 4羟丙甲纤维素检验标准操作规程J-ZJ-2004 5淀粉检验标准操作规程J-ZJ-2005 6羧甲淀粉钠检验标准操作规程J-ZJ-2006 7糊精检验标准操作规程J-ZJ-2007 8硬脂酸镁检验标准操作规程J-ZJ-2008 9乙基纤维素检验标准操作规程J-ZJ-2009 10硬脂酸检验标准操作规程J-ZJ-2010 11预胶化淀粉检验标准操作规程J-ZJ-2011 12枸橼酸检验标准操作规程J-ZJ-2012 13微粉硅胶检验标准操作规程J-ZJ-2013 14乙醇检验标准操作规程J-ZJ-2014 15蔗糖检验标准操作规程J-ZJ-2015 16滑石粉检验标准操作规程J-ZJ-2016 17硅油检验标准操作规程J-ZJ-2017 18食用色素检验标准操作规程J-ZJ-2018 19虫白蜡检验标准操作规程J-ZJ-2019 20明胶检验标准操作规程J-ZJ-2020 21空心胶囊检验标准操作规程J-ZJ-2021 22聚山梨脂80检验标准操作规程J-ZJ-2022 23红氧化铁检验标准操作规程J-ZJ-20231.7.3包装材料质量检验1标签检验标准操作规程J-ZJ-3001 2说明书检验标准操作规程J-ZJ-3002 3复合膜检验标准操作规程J-ZJ-3003 4铝箔(PTP)检验标准操作规程J-ZJ-3004 5聚氯乙烯(PVC)硬片检验标准操作规程J-ZJ-3005 6药用塑料瓶检验标准操作规程J-ZJ-3006 7小盒检验标准操作规程J-ZJ-3007 8中盒检验标准操作规程J-ZJ-3008 9防伪签检验标准操作规程J-ZJ-3009 10热收缩膜检验标准操作规程J-ZJ-3010 11纸箱检验标准操作规程J-ZJ-3011 12打包带检验标准操作规程J-ZJ-3012 13封口胶带检验标准操作规程J-ZJ-30131.7.4中间产品质量检验1去痛片中间产品检验标准操作规程J-ZJ-4001 2土霉素片中间产品检验标准操作规程J-ZJ-40023维生素C片中间产品检验标准操作规程J-ZJ-40034盐酸小檗碱片中间产品检验标准操作规程J-ZJ-40045异烟肼片中间产品检验标准操作规程J-ZJ-40056吡哌酸片中间产品检验标准操作规程J-ZJ-40067阿普唑仑片中间产品检验标准操作规程J-ZJ-40078阿司匹林片中间产品检验标准操作规程J-ZJ-40089氨茶碱片中间产品检验标准操作规程J-ZJ-4009 10安乃近片中间产品检验标准操作规程J-ZJ-4010 11对乙酰氨基酚片中间产品检验标准操作规程J-ZJ-4011 12复方磺胺甲噁唑片中间产品检验标准操作规程J-ZJ-4012 13复方乙酰水杨酸片中间产品检验标准操作规程J-ZJ-4013 14甲硝唑片中间产品检验标准操作规程J-ZJ-4014 15曲克芦丁片中间产品检验标准操作规程J-ZJ-4015 16曲克芦丁羟丙茶碱片中间产品检验标准操作规程J-ZJ-4016 17盐酸吗啉胍片中间产品检验标准操作规程J-ZJ-4017 18氧氟沙星片中间产品检验标准操作规程J-ZJ-4018 19乙酰螺旋霉素片中间产品检验标准操作规程J-ZJ-4019 20醋酸泼尼松片中间产品检验标准操作规程J-ZJ-4020 21盐酸雷尼替丁胶囊中间产品检验标准操作规程J-ZJ-4021 22氯霉素胶囊中间产品检验标准操作规程J-ZJ-4022 23诺氟沙星胶囊中间产品检验标准操作规程J-ZJ-4023 24阿莫西林胶囊中间产品检验标准操作规程J-ZJ-4024 25利福平胶囊中间产品检验标准操作规程J-ZJ-4025 26氨咖黄敏胶囊中间产品检验标准操作规程J-ZJ-4026 27氨苄西林胶囊中间产品检验标准操作规程J-ZJ-4027 28头孢氨苄胶囊中间产品检验标准操作规程J-ZJ-4028 29复方氨酚那敏颗粒中间产品检验标准操作规程J-ZJ-40291.7.5成品质量检验1.7.5.1片剂成品质量检验1去痛片检验标准操作规程J-ZJ-50012土霉素片检验标准操作规程J-ZJ-50023维生素C片检验标准操作规程J-ZJ-50034盐酸小檗碱片检验标准操作规程J-ZJ-50045异烟肼片检验标准操作规程J-ZJ-50056吡哌酸片检验标准操作规程J-ZJ-50067阿普唑仑片检验标准操作规程J-ZJ-50078阿司匹林片检验标准操作规程J-ZJ-50089氨茶碱片检验标准操作规程J-ZJ-5009 10安乃近片检验标准操作规程J-ZJ-5010 11对乙酰氨基酚片检验标准操作规程J-ZJ-5011 12复方磺胺甲噁唑片检验标准操作规程J-ZJ-5012 13复方乙酰水杨酸片检验标准操作规程J-ZJ-5013 14甲硝唑片检验标准操作规程J-ZJ-501415曲克芦丁片检验标准操作规程J-ZJ-5015 16曲克芦丁羟丙茶碱片检验标准操作规程J-ZJ-5016 17盐酸吗啉胍片检验标准操作规程J-ZJ-5017 18氧氟沙星片检验标准操作规程J-ZJ-5018 19乙酰螺旋霉素片检验标准操作规程J-ZJ-5019 20醋酸泼尼松片检验标准操作规程J-ZJ-50201.7.4.2胶囊剂成品质量检验1盐酸雷尼替丁胶囊检验标准操作规程J-ZJ-60012氯霉素胶囊检验标准操作规程J-ZJ-60023诺氟沙星胶囊检验标准操作规程J-ZJ-60034阿莫西林胶囊检验标准操作规程J-ZJ-60045利福平胶囊检验标准操作规程J-ZJ-60056氨咖黄敏胶囊检验标准操作规程J-ZJ-60067氨苄西林胶囊检验标准操作规程J-ZJ-60078头孢氨苄胶囊检验标准操作规程J-ZJ-60081.7.4.3颗粒剂成品质量检验1复方氨酚那敏颗粒检验标准操作规程J-ZJ-70011.7.4.4注射剂成品质量检验J-ZJ-80011.8通用检查法1洁净区沉降菌测试标准操作规程J-ZJ-90012洁净区尘粒数测试标准操作规程J-ZJ-90023装量差异检查法J-ZJ-90034含量均匀度检查法J-ZJ-90045黏度检查法J-ZJ-90056红外分光光度法J-ZJ-90067紫外分光光度法J-ZJ-90078高效液相色谱法J-ZJ-90089旋光度测定法J-ZJ-9009 10PH值测定法J-ZJ-9010 11电位滴定法J-ZJ-9011 12乙醇量测定法J-ZJ-9012 13氯化物检查法J-ZJ-9013 14硫酸盐检查法J-ZJ-9014 15铁盐检查法J-ZJ-9015 16重金属检查法J-ZJ-9016 17砷盐检查法J-ZJ-9017 18干燥失重测定法J-ZJ-9018 19炽灼残渣检查法J-ZJ-9019 20易碳化物检查法J-ZJ-9020 21溶液颜色检查法J-ZJ-9021 22澄清度检查法J-ZJ-9022 23粒度测定法J-ZJ-9023 24崩解时限检查法J-ZJ-902425溶出度测定法J-ZJ-9025 26片剂脆碎度检查法J-ZJ-9026 27抗生素微生物检定法J-ZJ-9027 28微生物限度检查法J-ZJ-9028 29薄层色谱法J-ZJ-9029 30熔点测定法J-ZJ-9030 31钠盐鉴别法J-ZJ-9031 32水分测定法J-ZJ-9032 33镁盐检查法J-ZJ-90331.9验证1.9.1工艺验证阿莫西林胶囊工艺验证方案J-YZ-1001头孢氨苄胶囊工艺验证方案J-YZ-10021.9.2设备验证HV-200型V型混合机验证方案J-YZ-2001NJP-400型全自动胶囊填充机验证方案J-YZ-2002DPB-140型多功能自动泡罩机验证方案J-YZ-2003PG-7000A型抛光机(青霉素车间)验证方案J-YZ-2004HV-100型V型混合机验证方案J-YZ-2005NJP-1200型全自动胶囊填充机验证方案J-YZ-2006DPT-140型自动铝塑包装机验证方案J-YZ-2007PG-7000A型抛光机(头孢氨苄车间)验证方案J-YZ-2008 1.9.3清洁验证HV-200型V型混合机清洁验证方案J-YZ-3001NJP-400型全自动胶囊填充机清洁验证方案J-YZ-3002DPB-140型多功能自动泡罩机清洁验证方案J-YZ-3003PG-7000A型抛光机(青霉素车间)清洁验证方案J-YZ-3004HV-100型V型混合机清洁验证方案J-YZ-3005NJP-1200型全自动胶囊填充机清洁验证方案J-YZ-3006DPT-140型自动铝塑包装机清洁验证方案J-YZ-3007PG-7000A型抛光机(头孢氨苄车间)清洁验证方案J-YZ-3008 1.9.4公用系统验证组合式空气处理机组验证方案J-YZ-4001纯化水系统验证方案J-YZ-4002压缩空气系统验证方案J-YZ-4003储水罐、管道清洗及消毒验证方案J-YZ-4004 2管理标准2.1人员管理1组织机构定岗定编管理规程G-RY-0001 2人员考核聘用管理规程G-RY-0002 3人员定期体检管理规程G-RY-0003 4人员培训教育管理规程G-RY-00045人事劳资管理规程G-RY-0005 6档案管理规程G-RY-0006 7员工主动报告管理规程G-RY-0007 2.2厂房设施管理1厂房设计管理规程G-CF-0001 2厂房施工管理规程G-CF-0002 3厂房验收管理规程G-CF-0003 4洁净厂房管理规程G-CF-0004 5厂房保养、维修管理规程G-CF-0005 6洁净厂房灭菌管理规程G-CF-0006 7一般生产区防火安全管理规程G-CF-0007 8洁净区防火安全管理规程G-CF-0008 9行政管理区防火管理规程G-CF-0009 2.3设备管理1设备选型验收管理规程G-SB-0001 2设备安装运行管理规程G-SB-0002 3设备维护保养管理规程G-SB-0003 4设备计划检修管理规程G-SB-0004 5设备封存管理规程G-SB-0005 6设备更新报废管理规程G-SB-0006 7设备调拨管理规程G-SB-0007 8设备事故管理规程G-SB-0008 9五金工具与备品备件管理规程G-SB-0009 10计量器具管理规程G-SB-0010 11设备使用管理规程G-SB-0011 12设备润滑管理规程G-SB-0012 13压力容器管理规程G-SB-0013 14锅炉管理规程G-SB-0014 15动火管理规程G-SB-0015 16照明设施管理规程G-SB-0016 17动力管理规程G-SB-0017 18设备管理规程G-SB-0018 19设备日常巡回检查管理规程G-SB-0019 20设备档案管理规程G-SB-0020 21灭火器材存放及使用管理规程G-SB-0021 22设备编号管理规程G-SB-0022 23设备管道状态标志管理规程G-SB-0023 24电器设备管理规程G-SB-0024 25计量器具周期检定管理规程G-SB-0025 26计量器具抽检管理规程G-SB-0026 27计量器具使用维护保养管理规程G-SB-0027 28计量单位管理规程G-SB-0028 29计量器具分类编码管理规程G-SB-0029 30计量器具分类管理规程G-SB-00302.4物料管理1物料验收管理规程G-WL-0001 2物料分类编码管理规程G-WL-0002 3包装破损物料管理规程G-WL-0003 4物料入库前清洁管理规程G-WL-0004 5物料入库管理规程G-WL-0005 6标签及类标签管理规程G-WL-0006 7仓储物料状态标志管理规程G-WL-0007 8物料贮存管理规程G-WL-0008 9拆零物料管理规程G-WL-0009 10空心胶囊贮存管理规程G-WL-0010 11物料发放管理规程G-WL-0011 12物料超额发放管理规程G-WL-0012 13退料管理规程G-WL-0013 14物料采购管理规程G-WL-0014 15仓库定置管理规程G-WL-0015 16不合格物料贮存管理规程G-WL-0016 17原辅料称量管理规程G-WL-0017 18仓库安全防火管理规程G-WL-0018 19库存物料盘存管理规程G-WL-0019 20仓库取样室管理规程G-WL-0020 21成品出入库管理规程G-WL-0021 22易燃易爆及危险品管理规程G-WL-0022 23仓库啮齿类、昆虫类动物控制管理规程G-WL-0023 24退回产品接收管理规程G-WL-0024 25库区清洁管理规程G-WL-0025 26特殊药品管理规程G-WL-0026 2.5卫生管理1人员健康管理规程G-WS-0001 2卫生管理规程G-WS-0002 3厂区环境卫生管理规程G-WS-0003 4生产区环境卫生管理规程G-WS-0004 5个人卫生管理规程G-WS-0005 6洁净区工艺卫生管理规程G-WS-0006 7一般生产区工艺卫生管理规程G-WS-0007 8工作服管理规程G-WS-0008 9清洁工具管理规程G-WS-0009 10容器清洁管理规程G-WS-0010 11卫生状态标志管理规程G-WS-0011 12特殊清洁管理规程G-WS-0012 13洁净区管理规程G-WS-0013 2.6文件管理1文件编制标准化管理规程G-WJ-0001 2文件起草审核印制保管管理规程G-WJ-00023标准文件颁布与回收管理规程G-WJ-0003 4质量标准编制管理规程G-WJ-0004 5工艺规程编制管理规程G-WJ-0005 6标准操作规程编制管理规程G-WJ-0006 7管理标准编制管理规程G-WJ-0007 8岗位责任制编制管理规程G-WJ-0008 9批记录编制管理规程G-WJ-0009 10状态标志编制管理规程G-WJ-0010 11记录凭证编制管理规程G-WJ-0011 12技术标准编制管理规程G-WJ-0012 2.7生产管理1生产过程管理规程G-SC-0001 2生产、包装指令流转管理规程G-SC-0002 3领料管理规程G-SC-0003 4配料管理规程G-SC-0004 5批号管理规程G-SC-0005 6物料平衡管理规程G-SC-0006 7生产试验管理规程G-SC-0007 8生产过程偏差处理管理规程G-SC-0008 9灭菌管理规程G-SC-0009 10工艺用水管理规程G-SC-0010 11生产车间结料、退料管理规程G-SC-0011 12产品重新加工管理规程G-SC-0012 13包装材料退库或销毁管理规程G-SC-0013 14批记录管理规程G-SC-0014 15工具柜及工具管理规程G-SC-0015 16工序残料管理规程G-SC-0016 17生产交接班管理规程G-SC-0017 18紧急情况处理管理规程G-SC-0018 19现场试验管理规程G-SC-0019 20中间站管理规程G-SC-0020 21模具管理规程G-SC-0021 22清场管理规程G-SC-0022 23物料进出生产区管理规程G-SC-0023 24工艺查证管理规程G-SC-0024 25车间不合格品管理规程G-SC-0025 26车间包材与类标签管理规程G-SC-0026 27清洁剂、消毒剂管理规程G-SC-0027 28区域状态标志管理规程G-SC-0028 29人员进出一般生产区管理规程G-SC-0029 30人员进出洁净区管理规程G-SC-0030 31生产事故管理规程G-SC-0031 32安全生产管理规程G-SC-0032 33生产废弃物管理规程G-SC-0033 34生产统计报表管理规程G-SC-003435生产分析会管理规程G-SC-0035 36包装过程管理规程G-SC-0036 37合箱管理规程G-SC-0037 38周转容器管理规程G-SC-0038 39生产原始记录填写管理规程G-SC-0039 40生产用乙醇管理规程G-SC-0040 41生产过程复核管理规程G-SC-0041 42生产定额管理规程G-SC-0042 43精神药品生产复核管理规程G-SC-0043 2.8质量管理1原辅料取样管理规程G-ZL-0001 2包装材料取样管理规程G-ZL-0002 3中间产品取样管理规程G-ZL-0003 4成品取样管理规程G-ZL-0004 5工艺用水取样管理规程G-ZL-0005 6精神药品取样管理规程G-ZL-0006 7产品质量台帐管理规程G-ZL-0007 8包装材料样板管理规程G-ZL-0008 9原辅料、内包装材料超期复验管理规程G-ZL-0009 10物料检验合格放行管理规程G-ZL-0010 11成品放行管理规程G-ZL-0011 12质量责任制管理规程G-ZL-0012 13质量否决权管理规程G-ZL-0013 14质量事故管理规程G-ZL-0014 15产品质量档案管理规程G-ZL-0015 16质量统计月报管理规程G-ZL-0016 17不合格品管理规程G-ZL-0017 18销毁工作管理规程G-ZL-0018 19精神药品销毁管理规程G-ZL-0019 20质量分析会管理规程G-ZL-0020 21成品有效期管理规程G-ZL-0021 22退货管理规程G-ZL-0022 23检验室管理规程G-ZL-0023 24仪器室管理规程G-ZL-0024 25微生物检查室管理规程G-ZL-0025 26取样室、移动取样车管理规程G-ZL-0026 27质量控制点管理规程G-ZL-0027 28留样观察室管理规程G-ZL-0028 29玻璃仪器与器具管理规程G-ZL-0029 30化验室废弃物管理规程G-ZL-0030 31检验管理规程G-ZL-0031 32留样管理规程G-ZL-0032 33检验原始记录和报告单复核管理规程G-ZL-0033 34检品复检管理规程G-ZL-0034 35检验文件管理规程G-ZL-003536标准品与对照品管理规程G-ZL-0036 37标准溶液(滴定液)管理规程G-ZL-0037 38检定菌管理规程G-ZL-0038 39培养基管理规程G-ZL-0039 40菌检室卫生管理规程G-ZL-0040 41化验试剂配制管理规程G-ZL-0041 42化学试剂使用管理规程G-ZL-0042 43化学试剂贮存发放管理规程G-ZL-0043 44化验室易燃易爆品管理规程G-ZL-0044 45剧毒物品管理规程G-ZL-0045 46检测仪器、设备管理规程G-ZL-0046 47化验室安全管理规程G-ZL-0047 48化验室防火防爆管理规程G-ZL-0048 49取样用具管理规程G-ZL-0049 50稳定性试验管理规程G-ZL-0050 51原辅料、包装材料部分项目免检管理规程G-ZL-0051 52玻璃仪器清洁管理规程G-ZL-0052 53玻璃量器校正管理规程G-ZL-0053 54生产过程监控管理规程G-ZL-0054 55仓库监控管理规程G-ZL-0055 56清场检查管理规程G-ZL-0056 57有效数字修约管理规程G-ZL-0057 58检验记录管理规程G-ZL-0058 59合格证发放粘贴管理规程G-ZL-0059 60物料供应商确认管理规程G-ZL-0060 61验证管理规程G-ZL-0061 62再验证管理规程G-ZL-0062 63验证文件管理规程G-ZL-0063 64《GMP规范》自检管理规程G-ZL-0064 65A类用户投诉处理标准工作程序G-ZL-0065 66B类用户投诉处理标准工作程序G-ZL-0066 67C类用户投诉处理标准工作程序G-ZL-0067 68用户投诉管理规程G-ZL-0068 69药品不良反应监察管理规程G-ZL-0069 70向药监机构报告公司质量情况管理规程G-ZL-0070 2.9销售管理1销售记录管理规程G-XS-0001 2产品销售管理规程G-XS-0002 3用户意见报告管理规程G-XS-0003 4产品召回管理规程G-XS-0004 5经济合同管理规程G-XS-0005 6产品退货管理规程G-XS-0006 7精神药品销售商审核管理规程G-XS-0007 8精神药品销售管理规程G-XS-00083工作标准3.1岗位责任制1总经理岗位责任制Z-GW-0001 2生产副总经理岗位责任制Z-GW-0002 3总工程师岗位责任制Z-GW-0003 4办公室职责Z-GW-0004 5办公室主任岗位责任制Z-GW-0005 6人事劳资管理员岗位责任制Z-GW-0006 7档案管理员岗位责任制Z-GW-0007 8保安负责人岗位责任制Z-GW-0008 9保卫人员岗位责任制Z-GW-0009 10厂区清洁工岗位责任制Z-GW-0010 11炊事员岗位责任制Z-GW-0011 12质量保证部职责Z-GW-0012 13质量保证部部长岗位责任制Z-GW-0013 14生产质量监督员岗位责任制Z-GW-0014 15物料质量监督员岗位责任制Z-GW-0015 16用户投诉管理员岗位责任制Z-GW-0016 17GMP文件管理员岗位责任制Z-GW-0017 18销售质量监督员岗位责任制Z-GW-0018 19中心化验室职责Z-GW-0019 20中心化验室主任岗位责任制Z-GW-0020 21质量检验员岗位责任制Z-GW-0021 22微生物测定员岗位责任制Z-GW-0022 23仪器管理员岗位责任制Z-GW-0023 24留样观察员岗位责任制Z-GW-0024 25标化员岗位责任制Z-GW-0025 26试剂管理员岗位责任制Z-GW-0026 27计划财务部职责Z-GW-0027 28计划财务部部长岗位责任制Z-GW-0028 29主办会计岗位责任制Z-GW-0029 30财务出纳岗位责任制Z-GW-0030 31材料会计岗位责任制Z-GW-0031 32营销副总经理岗位责任制Z-GW-0032 33供应销售部职责Z-GW-0033 34供应销售部部长岗位责任制Z-GW-0034 35销售员岗位责任制Z-GW-0035 36销售内勤员岗位责任制Z-GW-0036 37采购员岗位责任制Z-GW-0037 38库房管理员岗位责任制Z-GW-0038 39设备动力部职责Z-GW-0039 40设备动力部部长岗位责任制Z-GW-0040 41设备管理员岗位责任制Z-GW-0041 42设备维修员岗位责任制Z-GW-0042。
盐酸吗啉呱残留溶剂方法确认方案

盐酸吗啉呱残留溶剂方法确认方案文件编号:RSH6105-1起草人:日期:审核人:日期:日期:批准人:日期:目录一、概述二、验证目的三、验证范围四、验证人员五、验证依据六、验证内容七、附色谱图八、验证结论九、批准一、概述药物中的残留溶剂系指在原料药或辅料的生产中以及制剂的制备过程中使用的,但在工艺过程中未能完全除去的有机溶剂,我司在盐酸吗啉呱生产过程中使用了有机溶剂乙醇,因残留溶剂会影响产品的安全性,故需对盐酸吗啉呱的残留溶剂方法进行确认。
二、验证目的对盐酸吗啉呱残留溶剂分析方法的专属性、精密度、定量限、检测限进行确认,确保方法的可行性,以便为有效控制盐酸吗啉呱的质量提供依据。
三、验证范围针对盐酸吗啉呱残留溶剂测定方法的可靠性及可行性。
四、验证人员验证依据5.1 国家食品药品监督管理局标准WS-10001(HD-0649)-20025.2 中国药典2010版二部附录VIII P 残留溶剂测定法5.3中国药典2010版二部附录XIX A药品质量标准分析方法验证指导原则六、验证内容6.1、验证用仪器、试剂、对照品6.2、验证方法6.2.1色谱条件:6.2.1色谱条件:仪器:Agilent 7890A 检测器:FID色谱柱:ZB-WAX 30m*0.32mm*0.25um 进样口温度:200℃检测器温度:240℃柱温:起温度始120℃,维持3分钟,以每分钟40℃的速度升温到200℃,维持10分钟。
流速:3.0ml/min 分流比:15:1 进样量:1ul载气:氮气空气:400ml/min 氢气:30ml/min6.2.1.1溶液的配制6.2.1.1.1供试品溶液:精密称取盐酸吗啉呱500mg至10ml量瓶中,加二甲基亚砜溶解并稀释至刻度,摇匀,作为供试品溶液。
6.2.1.1.2对照品储备溶液:精密称取乙醇375mg于100mL量瓶中,加二甲基亚砜溶解并稀释至刻度,摇匀,作为对照品储备液。
6.2.1.1.3对照品溶液:精密量取上述乙醇贮备液2.0ml置50ml量瓶中,加二甲基亚砜溶解并稀释至刻度,摇匀,作为对照品溶液。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
21盐酸吗啉胍片工艺规程盐酸吗啉胍片工艺规程山西●上海信谊制药有限公司质量保证部二O O二年目录1、产品概况2、处方和依据3、生产工艺流程图4、操作过程及工艺条件5、设备一览表及主要设备生产能力6、工艺(环境)卫生、技术安全及劳动保护7、原辅料消耗定额、技经指标及计算方法8、包装要求、说明书、贮藏方法9、原辅料、中间产品及成品的质量标准和技术参数10、劳动组织与岗位定员11、支持文件12、附页盐酸吗啉胍片工艺规程1.产品概况:1.1产品名称:盐酸吗啉胍片汉语拼音:Yansuan Malin Gua Pian英文名称: Tablets1.2执行标准:山西省药品标准一九九O年版二部。
剂型:片剂1.3 规格:0.1g。
1.4 含量限度: 含盐酸吗啉胍应为标示量的93.0-107.0%。
1.5 性状: 本品为白色片1.6 有效期:二年2.处方和依据:2.1 处方: 原辅料名称用量原辅料处理盐酸吗啉胍 1000.0g 过100目筛淀粉 300.0g 过100目筛5%淀粉浆 280.0g 含淀粉42g 硬脂酸镁 13.0g 过40目筛淀粉(外加) 30.0g 过100目制成 10000片2.2每片成份及含量:2.3制粒处方:2.4 依据: 山西省药品标准一九九O年版二部。
3、生产工艺流程图:3.1 生产工艺流程总图:(另附)3.2 制粒生产工艺流程图(50万片/锅):4.操作过程及工艺条件:4.1 原辅料处理:4.1.1 按前处理的SOP执行。
4.1.2 盐酸吗啉胍、淀粉过100目筛,硬脂酸镁过40目筛后使用。
4.1.3淀粉浆配成15.0%使用。
4.1.4分锅配料4.2 混合制粒(搅拌制粒、沸腾干燥工艺):4.2.1 按制粒SOP执行。
4.2.2 制粒准备:4.2.2.1 按工艺处方将50.0 kg盐酸吗啉胍、15.0kg淀粉加入高效湿法混合制粒机中,搅拌干混10分钟。
4.2.2.2 加入14.0kg15%淀粉浆,搅拌湿混8分钟,即做好软材。
4.2.3 到制粒:4.2.3.1起动制粒器(慢档),将软材粉碎成粒状,然后制粒器开快档,同时搅拌器也开快档,功率达12.0-14.0kw,维时约10-15分钟,停机放料。
4.2.3.2 干燥:将湿颗粒放入沸腾干燥器内进行干燥,控制进风温度在85℃±,待物料温度达50℃±即可出料。
4.2.4 制粒工艺参数及注意事项:4.2.4.1 工艺参数:4.2.4.2 注意事项:本品生产时应避免与碱性药物接触。
4.2.5整粒:干颗粒往装有14目尼龙筛网的摇摆颗粒机进行干颗粒整粒。
4.2.6 总混:将整粒后的干颗粒,0.65kg的硬脂酸镁、1.5kg的淀粉全部吸入三维运动混合机中,进行充分混合时间不少于30分钟,方可放料,QA抽样送验。
4.2.7颗粒的质量标准:含量:70.0-74.0%水分: 4.0-5.0%外观:白色颗粒4.3 压片(工艺参数及工艺要求):4.3.1 根据颗粒含量和批颗粒总重量,计算出应压片重和应压万片数。
4.3.2冲头规格:直径为7.0mm,浅凹石园冲。
4.3.3 脆碎度:符合药典规定。
4.3.4 片子外观:白色4.3.5崩解时间:≤15分钟4.3.6 平均片重:0.138g±5%4.3.7片重差异:±6%(n=20)4.3.8含量限度:盐酸吗啉胍应为标示量的94.0-106.0%。
4.3.9片子要求符合片剂外观质量标准通则要求(见附件)。
4.3.10 并机试压,按规定进行片重、片重差、外观等检查。
4.3.11 符合要求后,正式开机生产,每30分钟检查一次片重及外观4.4 包装:4.4.1 包装材料见包材卡。
4.4.2 按包装SOP执行。
4.4.3 按塑料瓶包装机操作规程操作。
4.4.4 包装规格:100片/瓶(20ml)。
4.4.5 包装质量要求:应符合片剂外观包装质量等级标准通则要求(见附件)。
5.设备一览表及主要设备生产能力:6.工艺(环境)卫生、技术安全及劳动保护:6.1 工艺(环境)卫生:6.1.1 生产车间内除拆包间、除尘间、外包材料存放间、大包间、一更外,均为三十万级洁净区。
6.1.2 生产环境、设施根据GMP要求,房顶、墙壁清洁无颗粒状剥落,通风良好。
6.1.3 操作人员进入洁净区,必须执行“洁净制度”和“人流SOP”。
6.1.4前处理:场地四壁无尘、干燥,用吸尘吸墙壁、地面顶之尘。
6.1.5 制粒:料车的使用和清洗,按其SOP进行。
6.1.6 压片:生产场地不应有与生产无关的物品。
做好定置安放工作,保持工作台等的整洁。
使用冲模,按其管理制度执行。
6.1.7 包装:进入生产车间的包装材料必须整洁,采取除尘措施,任何废弃物必须及时投入废弃袋中。
包装线发生故障及时清理,整洁后开车生产。
6.1.8中间站:保持中间区域,公共通道清洁。
保持每个货位堆放整齐。
周转桶必须按定位要求堆放,清洗干净后备用,定好状态标志牌,注明日期,在时限内按先进出和程序使用。
6.1.9 包装材料仓库:必须保持整洁。
6.1.10 生产设备、生产容器、生产工具的使用和清洁,按工艺装务操作SOP、工艺装备清场SOP、生产容器清洁SOP执行。
6.1.11 操作前生产场地必须符合清洁标准,并持有QA签证的清场合格证。
6.1.12交班前必须做好地面、机器、工具的清洁工作,并擦净周围门窗、玻璃,保持下水管道畅通。
6.1.13前处理:制粒、压片包装、辅助工段的工艺卫生操作按各工序的岗位SOP执行。
6.1.14 调换品种按设备、场地的清洁SOP进行(品种暂停时,须及时清场,不得超过24小时)。
6.1.15 清洁时用真空吸尘系统或真空吸尘器除尘后,再用抹布、拖布清洁。
6.1.16 清场标准:6.1.16.1 无上一品种的任何遗留物。
6.1.16.2 场地四壁整洁无尘,装备无尘。
6.1.16.3 先由组长检查后,再由QA检查,确认达到标准后,签发清场合格证。
6.1.17 定期做好技术走廊的清洁除尘工作。
6.1.18 运货车、垫仓板的使用与清洁根据装备SOP进行。
6.1.19 衡器使用按衡器使用SOP进行。
6.1.20操作人员要定期进行身体检查,符合健康标准者才能上岗。
6.1.21非操作人员不得擅自进入工作室。
6.2 技术安全、劳动保护:6.2.1 操作人员必须经技术培训、安全教育后,方能上岗。
6.2.2 各工序所有设备,在运转时均勿将手伸入,以免发生伤亡事故。
6.2.3 生产中使用的乙醇、汽油、机油、纸张、包材等易燃易爆品要安全存放,及时清理。
6.2.4 车间岗位严禁烟火,需动火时必须事先办理动炎手续,以防发生火灾。
6.2.5各工序所有设备,按工艺装备操作SOP,工艺装备清场SOP执行。
加、点油量要到位,做好生产过程中各设备的保养防护工作。
6.2.6加强对电器设备的管理,安全用电, 严禁用水冲或湿布擦抹电气开关。
7.原辅料消耗定额、技经指标及其计算方法:7.1 原辅料消耗定额:7.2 技经指标及其计片算方法:8.包装要求、说明书,贮藏方法:8.1 包装要求:8.1.1 用塑瓶包装机包装,100片/瓶(20ml)。
8.1.2 片子装瓶、塞纸、旋盖、盖子旋紧、不松动。
8.1.3 标签贴正。
8.1.4 每10瓶装一中盒,并放入相应数量的说明书。
8.1.5 每30个中盒装入一个纸箱,并放产品合格证。
8.1.6包装箱用印有商标和厂名的封箱带封口。
8.2 包装材料规格、尺寸、型号,参照包装材料卡。
8.3 说明书等内容应与国家药监局统一下发的一致。
8.4 贮藏方法:密封干燥处保存。
8.5 有效期:二年。
9.原辅料、中间产品及成品的质量标准和技术参数:9.1 原辅料的质量标准:9.1.1 辅料控制项目:9.2 中间产品质量标准:9.2.1 前处理的质量标准:9.2.2 制粒质量标准:片芯的质量标准:9.2.39.3.1 前处理9.3.1.1 QA在抽取原辅料的样品时,目测鉴定原辅料外观质量应符合质量标准:无异物、杂点符标。
9.3.1.2平板法:称取样品20g,置白色背景下,铺成10cm²,用清净的玻璃板压平,在光亮处观察,如有杂黑点就拣出,然后翻动样品再压平,如此检查三次,累计拣出的杂黑点数≤6个点。
9.3.1.3 检查原辅料的细度,符合标准。
9.3.2 颗粒:9.3.2.1 目测:粒径分布均匀,松密度、色泽合适。
9.3.2.2 QC分析:含量、水份、理论片重、压片片重,应符合标准。
9.3.3 片芯的检查方法:9.3.3.1 随机抽取正常运转中的压片机左右路轨各20片。
9.3.3.2 用已核对“O”点的“扭力天平”称量,检查片芯的重量是否在标准范围内。
9.3.3.3 目测片芯的外观(参照附件:片剂外观包装等级标准通则)。
9.3.3.4 控制片芯的脆碎度应符合药典规定;控制片芯的崩介时限≤20分钟。
9.4 过程控制(附技术标准、质量标准),QA根据盐酸吗啉胍片的技术标准、质量标准及每道工序SOP的检查,负责生产全过程的监控。
9.4.1 前处理:9.4.1.1 检查清仓SOP的执行情况。
9.4.1.2 检查清场SOP的执行情况。
9.4.1.3 检查筛圈、筛目是否符合要求。
9.4.2 配料:9.4.2.1 检查岗位SOP执行情况。
9.4.2.2 检查清场SOP执行情况。
9.4.2.3 检查计量器具的有效期、校零工作。
9.4.2.4 检查原辅料的称量、配比等的准确性。
9.4.2.5 检查批生产记录,要求完整、正确、整洁。
9.4.3 制粒:9.4.3.1 检查岗位SOP执行情况。
9.4.3.2 检查清场SOP执行。
9.4.3.3 检查工艺装备SOP执行情况。
9.4.3.4 检查工艺装备清场SOP执行情况。
9.4.3.5 检查批生产记录、复核制度执行情况。
9.4.3.6 检查分锅配料、混合、糖浆等的配制情况。
9.4.3.7 检查工艺参数是否符合要求。
9.4.3.8 检查房间的状态标志是否与批生产记录一致。
9.4.3.9 混合后,抽样送检。
9.4.4 压片:9.4.4.1 以QC化验结果合格为依据,黄牌翻绿牌。
9.4.4.2 检查岗位SOP执行情况。
9.4.4.3 检查清场SOP执行情况。
9.4.4.4 检查工艺装备SOP执行情况。
9.4.4.5 检查工艺装备清场SOP执行情况。
9.4.4.6 检查复核制度、状态标志及批生产记录填写情况。
9.4.4.7 开车检查:9.4.4.7.1 确认片重、硬度、溶出度。
9.4.4.7.2 确认外观标准(附件:片剂外观包装等级标准通则)。
9.4.4.7.3 确认车速。
9.4.4.8 正常生产中的检查:9.4.4.8.1 检查开车时的各项内容。
9.4.4.8.2 QA每班循回检查二次(不稳定时不定时抽查)。
