卡托普利片一致性评价项目报价及评价方案(网站)讲解
药物一致性评价介绍

确定参比制剂遴选原则
参比制剂原则上首选原研药品,也可以选用国际公认的同种药品。 仿制药是指与被仿制药具有相同的活性成分、剂型、给药途径和治疗作
用的药品。
参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常为被
仿制的对象,如原研药品或国际公认的同种药物。参比制剂应为处方工 艺合理、质量稳定、疗效确切的药品。
化学药品新注册分类实施前批准上市的其他仿制药,自首家品种通过 一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致 性评价;逾期未完成的,不予再注册。
8 | Presentation Title | Presenter Name | Date | Subject | Business Use Only
各国对于生物等效性的评价标准不同主要国家/地区 对于药代动力学参数的规定
国家/地区 90% CI
AUC0-t % Cmax%
加拿大 90-112
美国
80-125
欧盟90-1Leabharlann 1 澳大利亚 80-125
日本
80-125
中国
80-125
80-125 80-125 90-111 80-125 80-125 70-143
同品种药品通过一致性评价的生产企业达到3家以上的,在药品集中采
购等方面不再选用未通过一致性评价的品种。
通过一致性评价药品生产企业的技术改造,在符合有关条件的情况下,
可以申请中央基建投资、产业基金等资金支持。
7 | Presentation Title | Presenter Name | Date | Subject | Business Use Only
在相似的试验条件下单次或多次 给予相同剂量的试验药物后,受 试制剂中药物的吸收速度和吸收 程度与参比制剂的差异在可接受 范围内。生物等效性研究方法按 照研究方法评价效力,其优先顺 序为药代动力学研究、药效动力 学研究、临床研究和体外研究。
仿制药质量和疗效一致性评价工作介绍

阿托伐他汀钙片 阿莫西林胶囊
苯磺酸氨氯地平片 蒙脱石散
阿法骨化醇片 阿奇霉素片 奥氮平片
厄贝沙坦氢氯噻嗪片 恩替卡韦分散片
富马酸替诺福韦二吡呋酯片 卡托普利片 赖诺普利片
硫酸氢氯吡格雷片 氯沙坦钾片
马来酸依那普利片 恩替卡韦胶囊 福辛普利钠片
富马酸比索洛尔片 格列美脲片 吉非替尼片
BE 试验
受理 立卷审查
基于审 评需要 检查
技术 审评
基于审 评需要 检验
综合 审评
纳入 橙皮书
研究
审评
信息公开
工作程序1——药学研究
工作程序2——BE试验
伦理审查
BE试验合同
BE试验备案
信息登记
开展BE试验
719家药物 临床试验 机构
工作程序3-受理
2016年第105号公告
2017年第100号公告
17
《关于阿莫西林胶囊等7个品种规格
通过仿制药质量和疗效一致性评价的 7
公告(第三批)》(2018年第6号)
《关于蒙脱石散等16个品种通过仿制
药质量和疗效一致性评价的公告(第 五批)》(2018年第49号)
16
《关于瑞舒伐他汀钙片等5个品种通过仿制
5 药质量和疗效一致性评价的公告(第二
批)》(2018年第20号)
关于仿制药质量和疗效一 致性评价工作有关事项的 公告(2017年第100号)
关于规范使用“通过一致 性评价”标识的通知
关于阿托伐他汀钙片等12 个品种规格通过仿制药质 量和疗效一致性评价的公 告(第四批)(2018年第 24号) 附件2关于“通过一致性评 价”标识使用有关事宜的 说明
工作成效——推动供给侧结构性改革
卡托普利片市场分析报告

卡托普利片市场分析报告1.引言1.1 概述卡托普利片是一种常用的降压药物,市场需求量巨大,是全球医药市场的重要组成部分。
本篇报告将对卡托普利片市场进行深入分析,包括市场现状、竞争分析以及未来趋势。
通过对市场进行全面了解,可以更好地指导相关企业制定市场策略,把握市场机遇。
1.2 文章结构文章结构部分内容如下:文章结构分为引言、正文和结论三部分。
在引言部分,我们将概述文章的内容和目的,并对整篇报告进行总结。
在正文部分,将详细分析卡托普利片市场的现状、竞争情况和未来趋势。
最后,在结论部分,将对市场分析报告进行总结,提出建议和展望,并以结语结束整篇文章。
1.3 目的目的部分的内容应该涵盖撰写此报告的原因和目的。
在这一部分,可以阐述为何进行对卡托普利片市场的分析,以及预期的目标和效果。
可以提及对市场趋势、竞争环境和未来预测的研究,以及为读者提供有关卡托普利片市场的全面和准确的信息。
同时,也可以指出本报告的目的是帮助读者更好地了解当前市场情况,并为相关利益相关者提供决策参考。
1.4 总结总结部分:本报告对卡托普利片市场进行了全面的分析,包括市场现状、竞争分析和未来趋势。
通过对市场的深入研究,我们发现卡托普利片市场存在着潜在的增长机会,但同时也面临着激烈的竞争挑战。
随着消费者对健康和生活质量的关注日益增强,卡托普利片市场仍然具有较大的潜力和发展空间。
在未来,我们建议相关企业要加强产品创新和品牌建设,不断提高产品质量和服务水平,以满足消费者的不断增长的需求。
同时,企业需要注重市场营销和宣传,提升品牌知名度和竞争力。
通过持续的努力和创新,可以更好地抓住市场机遇,实现长期稳定的发展。
总的来说,卡托普利片市场具有广阔的发展前景,但也需要企业不断努力和创新来应对激烈的市场竞争。
希望本报告能为相关企业在市场决策和战略规划上提供一定的参考和指导,促进行业的健康发展。
2.正文2.1 卡托普利片市场现状卡托普利片(Captopril)是一种被广泛使用的降压药物,属于血管紧张素转化酶抑制剂。
2023年卡托普利片行业市场分析现状

2023年卡托普利片行业市场分析现状卡托普利(Captopril)片是一种常用的抗高血压药物,属于血管紧张素转化酶抑制剂(ACEI)。
它通过抑制血管紧张素转化酶的活性,降低血管紧张素Ⅱ的生成,从而扩张血管,降低血压。
卡托普利片是世界卫生组织基本药物之一,是高血压患者的常用药物之一。
卡托普利片的市场需求主要来自两个方面:一方面是高血压患者的治疗需求,另一方面是心血管疾病患者的辅助治疗需求。
根据世界卫生组织的统计数据,全球高血压患者数量不断增长,特别是在发展中国家,高血压患者的比例不断上升。
同时,心血管疾病患者的数量也在逐年增加。
这两个因素使得卡托普利片的市场需求持续增长。
然而,卡托普利片市场也面临一些挑战。
首先,卡托普利片已经面临了很多仿制药的竞争。
由于卡托普利片是过去几十年来的老药物,许多制药公司都能生产仿制品。
这使得市场上出现了许多价格低廉的仿制药,给品牌卡托普利片带来了竞争压力。
其次,卡托普利片的潜在副作用也是市场发展的限制因素之一。
卡托普利片可能引起低血压、咳嗽、头晕等副作用,严重时还会引起肝功能损害和血液问题。
这使得一些患者在使用卡托普利片时产生抵触情绪,选择其他药物。
此外,卡托普利片市场还面临着管理政策的改变和医疗体系的差异等因素的影响。
不同国家和地区的药品监管机构对药物的准入要求和管理政策各不相同,这给跨国制药公司的进入带来了一定的障碍。
尽管面临这些挑战,卡托普利片市场仍然具有较大的潜力。
随着人们对高血压和心血管疾病的认识不断提高,卡托普利片作为一种有效的药物治疗手段将继续受到关注。
而且,新技术的应用也为卡托普利片的发展带来了机遇,比如微型化技术的发展可以提高制药过程的效率和药物的可控性。
综上所述,卡托普利片市场虽然面临着一些挑战,但仍然具有较大的潜力。
随着高血压和心血管疾病患者数量的增加,卡托普利片的市场需求将持续增长。
但制药公司需要面对竞争的挑战,拓展市场份额,同时还要关注药物的安全性和患者的需求,以提高产品竞争力。
2024年卡托普利片市场分析现状

2024年卡托普利片市场分析现状引言卡托普利片是一种常用的降压药物,主要用于治疗高血压疾病。
随着人们对健康意识的提高和生活水平的改善,高血压患者的数量不断增加,进而推动了卡托普利片市场的发展。
本文将对卡托普利片市场的现状进行分析,并对未来的发展趋势进行展望。
市场规模目前,卡托普利片市场规模已经达到了一个较高的水平。
据统计数据显示,卡托普利片市场的年销售额超过了XX亿元,预计未来还会继续增长。
市场需求的增加主要源于以下几个方面的因素:•高血压患者数量的增加:随着人口老龄化趋势的加剧以及生活方式的不健康,高血压患者的数量不断增加,进而带动了卡托普利片市场的发展。
•医疗水平提高:随着医疗技术的不断进步和医疗条件的改善,越来越多的患者被准确诊断为高血压,并开始接受符合规范的治疗,其中卡托普利片作为一种常用的降压药物得到了广泛应用。
•药物疗效优势:卡托普利片具有良好的降压效果,且副作用较小,这使得它成为许多医生和患者的首选药物之一。
市场竞争态势卡托普利片市场竞争激烈,主要有以下几个方面的原因:1.市场参与者众多:目前已经有多个厂家生产和销售卡托普利片,市场上的竞争非常激烈。
这些厂家不仅来自国内,还有一些外资企业也加入了竞争。
2.品牌竞争:由于市场需求旺盛,许多品牌卡托普利片涌入市场。
各大药企通过品牌推广、广告宣传等手段来提高产品知名度和市场份额。
3.价格竞争:由于市场竞争激烈,一些药企通过降低产品价格来争夺市场份额。
这种价格竞争对于一些规模较小的企业来说,往往是一种压力和挑战。
市场发展趋势在未来,卡托普利片市场有望继续保持稳定增长。
以下是未来发展趋势的几个方面:1.市场规模扩大:随着高血压患者数量的不断增加和医疗水平的提高,卡托普利片市场的规模将进一步扩大。
2.技术创新:在卡托普利片的研发领域,技术创新是推动市场发展的重要因素。
未来,随着科技的进步和医学研究的深入,有望出现更加安全、有效的卡托普利片产品。
2024年卡托普利片市场调查报告

卡托普利片市场调查报告1. 引言本文档是针对卡托普利片市场进行的调查报告。
卡托普利片是一种常用的高血压治疗药物,市场需求量大。
本调查报告旨在对卡托普利片市场进行深入的分析和评估,以提供相关决策的依据。
2. 调查方法为了获得准确的市场信息,我们采用了多种调查方法。
首先,我们进行了一系列的市场调研,包括问卷调查、访谈和观察等。
此外,我们还收集了相关的市场数据和资料,对市场趋势进行了分析和预测。
3. 市场概况卡托普利片市场是一个庞大的市场,具有广阔的发展前景。
目前,卡托普利片在高血压患者中的应用非常广泛,且市场需求量稳定增长。
随着人们健康意识的提高和高血压患病率的增加,预计卡托普利片市场将继续保持良好的发展态势。
4. 市场竞争分析卡托普利片市场存在较强的竞争压力。
现有市场上已有多个品牌的卡托普利片产品,竞争激烈。
不同品牌的产品在价格、质量、品牌知名度等方面存在差异,消费者对产品的选择有较大的自由度。
此外,一些药企还通过广告和促销活动来提升产品的市场占有率。
5. 市场机会和挑战卡托普利片市场具有很好的发展机会。
随着高血压患病率的增加,卡托普利片的需求量将继续增加。
此外,随着人们健康意识的提高,对高血压治疗药物的需求也将增加。
市场需求的增长为卡托普利片的销售提供了良好的机会。
然而,市场上也存在一些挑战。
首先,卡托普利片市场竞争激烈,产品同质化现象比较突出,价格战也比较频繁。
此外,一些新型治疗药物的出现可能对卡托普利片市场造成冲击。
药企需要加强研发创新,提高产品的竞争力。
6. 市场推广策略在市场推广方面,药企可以采取以下策略来提高卡托普利片的市场占有率。
首先,注重产品的品质和疗效,提高产品的竞争力。
其次,加大市场宣传和广告投入,提高品牌知名度和产品曝光度。
此外,与医疗机构合作,开展宣传推广活动,提高医生和患者对产品的认可度。
7. 结论通过对卡托普利片市场的调查,我们可以得出以下结论: - 卡托普利片市场具有良好的发展前景,市场需求量稳定增长; - 市场竞争激烈,药企需要加强研发创新,提高产品竞争力; - 各种市场机会存在,药企可以通过提高产品品质和加大市场推广力度来提高市场占有率。
空腹条件下卡托普利片生物等效性研究

•临床药学窑中国当代医药2021年3月第28卷第9期空腹条件下卡托普利片生物等效性研究聂昌盛1赵翔2崔靖2陈仁燕21.仁和堂药业有限公司,山东临沂276600;2.翔宇药业股份有限公司,山东临沂276023[摘要]目的评价仁和堂药业有限公司生产的卡托普利片受试制剂与Bristol-Myers Squibb S.r.l.生产的参比制剂的生物等效性,旨在为临床合理用药提供依据。
方法2019年9~11月纳入24名中国成年健康受试者于郑州市中心医院进行卡托普利片受试制剂和参比制剂的生物等效性研究。
采用随机、单剂量、两制剂、两周期、交叉试验设计,按照随机数字表法分为R-T组和T-R组,每组各12名°于空腹状态下,R-T组口服单剂量卡托普利片受试制剂、参比制剂,T-R组口服单剂量卡托普利片参比制剂、受试制剂,两周期交叉用药,制得受试制剂、参比制剂样本各24份。
所有数据均采用SAS9.4软件进行分析,并对两种制剂进行生物等效性评价。
结果受试制剂和参比制剂的CgAUCg和AUC0-肄个体内变异(CV%・)均<30%、受试制剂的CgAUC。
-,和AUC。
-”几何均值与参比制剂的比值90%CI分别为87.82%~100.74%、91.37%~101.35%・和91.47%~101.33%、均在80.00%~125.00%・范围内,符合生物等效性的判断标准。
结论卡托普利片的受试制剂和参比制剂具有生物等效性。
[关键词]卡托普利片;生物等效性;空腹条件[中图分类号]R971.9[文献标识码]A[文章编号]1674-4721(2021)3(C)-0128-03Study on bioequivalence of Captopril Tablets under fasting conditionNIE Chang-sheng ZHAO Xiang CUI Jing2CHEN Ren-yan21.Renhetang Pharmaceutical Co.,Ltd.,Shandong Province,Linyi276600,China;2.Xiangyu Pharmaceutical Co.,Ltd.,Shandong Province,Linyi276023,China[Abstract]Objective To evaluate the bioequivalence between the test preparation of Captopril Tablets produced by Renhetang Pharmaceutical Co.,Ltd.and the reference preparation produced by Bristol-Myers Squibb S.r.l.To provide basis for rational drug use in clinic.Methods A total of24healthy adult Chinese subjects enrolled in Zhengzhou Central Hospital from September to November2019to study the bioequivalence of the test preparation and reference preparation of Captopril Tablets.A randomized,single-dose,two-preparation,two-period,crossover experiment design was used,and they were divided into the R-T group and T-R group according to random number table method,with12 subjects in each group.Under fasting condition,R-T group was given single dose of test preparation and reference preparation of Captopril Tablets orally,and T-R group was given single dose of reference preparation and test preparation of Captopril Tablets orally.Two cycles of cross-medication were conducted to obtain24samples of test preparation and reference preparation respectively.The test preparation and reference preparation of single dose Captopril Tablets were taken orally under fasting condition.All the data were analyzed by SAS9.4software,and the bioequivalence of the two preparations was evaluated.Results The intraspecific variation(CV%J for C mx,AUC°_t and AUC0-肄of test preparation and reference preparation were below30%、90%'CI of geometric mean point estimate for C mx,AUC°_t and AUC0-肄of test preparation and reference preparation were87.82%-100.74%',91.37%—101.35%,and91.47%—101.33%,, respectively.All of them were in the range of80.00%—125.00%、which met the criteria of bioequivalence.Conclusion The test preparation and reference preparation of Captopril Tablets are bioequivalent.[Key words]Captopril Tablets;Bioequivalence;Fasting condition高血压为临床上常见的慢性疾病,多选用药物进行血压控制,卡托普利吸收迅速,吸收率在75%以上,大部分经肾脏排泄,其中约50%以原形排出[1],剩余为代谢物,血液透析时可将其清除,在体内很少蓄积,广泛用于治疗高血压。
一致性评价品种名单
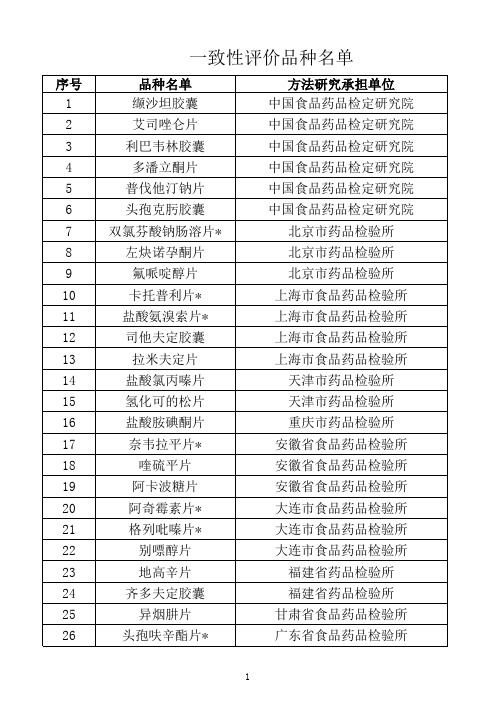
厦门市药品检验所 山东省食品药品检验所 山东省食品药品检验所 四川省食品药品检验所 四川省食品药品检验所 山西省食品药品检验所 山西省食品药品检验所 山西省食品药品检验所 山西省食品药品检验所 陕西省食品药品检验所 陕西省食品药品检验所 深圳市药品检验所 武汉市食品药品监督检验所 新疆维吾尔自治区食品药品检验所 云南省食品药品检验所 浙江省食品药品检验所 浙江省食品药品检验所 浙江省食品药品检验所 浙江省食品药品检验所 浙江省食品药品检验所 浙江省食品药品检验所
27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54
阿莫西林胶囊 法莫替丁片 硫酸茚地那韦胶囊 盐酸二甲双胍片 阿立哌唑片 氨茶碱片 马来酸依那普利片* 盐酸克林霉素胶囊 苯磺酸氨氯地平片 白消安片 盐酸维拉帕米片 地西泮片 尼莫地平片* 醋酸泼尼松片 吡嗪酰胺片 硝酸异山梨酯片 酒石酸美托洛尔* 利福平片 利福平胶囊 奥美拉唑肠溶胶囊 盐酸异丙嗪片 奋乃静片 吲达帕胺片* 氟康唑片 地塞米松片 呋塞米片 阿苯达唑片 乙酰唑胺片
1
方法研究承担单位 中国食品药品检定研究院 中国食品药品检定研究院 中国食品药品检定研究院 中国食品药品检定研究院 中国食品药品检定研究院 中国食品药品检定研究院 北京市药品检验所 北京市药品检验所 北京市药品检验所 上海市食品药品检验所 上海市食品药品检验所 上海市食品药品检验所 上海市食品药品检验所 天津市药品检验所 天津市药品检验所 重庆市药品检验所 安徽省食品药品检验所 安徽省食品药品检验所 安徽省食品药品检验所 大连市食品药品检验所 大连市食品药品检验所 大连市食品药品检验所 福建省药品检验所 福建省药品检验所 甘肃省食品药品检验所 广东省食品药品检验所
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
卡托普利片一致性评价方案
一致性评价方案如下:
我单位负责一致性评价过程中,全面贯彻国家局质量源于设计(QbD)理念,首先进行原研药国家局备案,购买国家局认可的原研药,对原研药进行质量剖析,建立原研药产品质量概况(QTPP),作为自制样品的研发目标,并根据本品种确定关键质量属性(CQAs),充分理解的基础上,对于关键工艺参数及其与CQAs间的关联以及潜在的高风险变量进行充分研究和筛选,对自制样品与原研药进行全面质量对比,如自制原处方样品体外释放与原研药不一致,按照原研处方工艺进行改进,处方工艺确定后进行小试三批及中试三批的工艺交接,按照国外药典标准或进口标准与原研药进行质量一致性的质量研究工作,做到体外释放及杂质与原研药一致,新建立的标准按照国家要求进行方法学研究,自制样品与原研药进行稳定性研究比较,按照《生物等效豁免指导原则》对本品的溶解性及渗透性进行研究,提供BE 豁免资料,整理申报资料上报,获得一致性评价许可。
一致性评价研究路线图如下:
项目调研资料如下:
一、原研药:
卡托普利(开博通)于1981年由百时美施贵宝公司首先开发上市。
百时美施贵宝公司为原研单位,在美国因其安全性和有效性原因被召回停止生产,不能作为参比制剂,参比制剂厂家为美兰实验室有限公司,在美国该公司产品为RLD药物,规格为100mg。
但百时美施贵宝公司在中国生产的卡托普利片仍在销售,商品名为开博通,规格为12.5mg,日本PMDA 确定的参比制剂为第一三共株式会社生产的产品,规格为12.5mg。
建议将三种药物都购买后进行质量比较后确定参比药物。
开博通在美国已退市
二、主药理化性质及BCS分类:
通用名称卡托普利
汉语拼音Captopril
英文名称Katuopuli
BCS分类Ⅲ类
CAS号62571-86-2
化学名称1-[(2S)-2-甲基-3-巯基-1-氧代丙基]-L-脯氨酸
分子式C9H15NO3S
分子量217.28
性状本品为白色或类白色结晶性粉末;有类似蒜的特臭。
熔点:104 〜110℃。
易溶于水,易溶于甲醇和二甲基氯化铵。
它溶解于稀碱金属氢氧化物溶
液。
结构式
三、对照品
卡托普利对照品:
杂质对照品:
加拿大TLC公司杂质对照品供应:
四、质量标准及处方工艺质量标准见附件
1
1
处方工艺
开博通处方:
Captopril is a white to off-white crystalline powder that may have a slight sulfurous odor; it is soluble in water (approx. 160 mg/mL), methanol, and ethanol and sparingly soluble in chloroform and ethyl acetate.
CAPOTEN is available in potencies of 12.5 mg, 25 mg, 50 mg, and 100 mg as scored tablets for oral administration.
Inactive ingredients: microcrystalline cellulose, corn starch, lactose, and stearic acid.
辅料为:微晶纤维素,玉米淀粉,乳糖和硬脂酸
根据辅料,推测本品片剂生产工艺为湿法制粒工艺。
1
济南永康医药科技有限公司一致性评价项目资料五、日本橙皮书资料
主药理化性质:
溶出曲线:
方法:
六、BE实验方案
因为本品主药为BCSⅢ类,因此本品可申请生物等效性实验的豁免。
参照《人体生物等效性试验豁免指导原则》,需提供以下资料支持豁免:
1.药物具有高溶解性;
2.仿制和参比制剂均具有非常快速的溶出;
3.仿制制剂和参比制剂应处方完全相同,各组成用量相似。
