第3讲元素及元素周期表
高中化学元素周期表

b.位于过渡元素右侧的主族元素,即ⅢA~ⅦA族,同 主族、邻周期元素原子序数之差为下一周期元素所 在周期所含元素种数.例如,氯和溴的原子序数之差 为:三五-一七=一八[溴所在第四周期所含元素的 种数].
原子核外电子排布规律
基础回归 一.电子层的表示方法及能量变化
电子层数
由内向外
数字表 示法
一二三四五六七
正价,Na、Mg、Al等无负价.
二.元素、核素、同位素
三.元素的相对原子质量 [一]目前已发现的一一0多种元素中,大多数都有同 位素. [二]一种天然存在的元素的各种核素分占的比例不 一定相同,但所占的百分比组成不变. [三]元素的相对原子质量是按各种天然同位素原子 所占的一定百分比算出来的平均值.元素周期表和 相对原子质量表中的数值就是元素的相对原子质量, 而非核素[或原子]的相对原子质量.
字母表 示法
K L MNO P Q
离核远近
由近到 远
电子能量
由低 到 高
二.原子核外电子排布规律
[一]能量最低原理:核外电子总是尽可能先排布在
能量 最低的[离原子核
]的电最子近层里.
[二]每层最多容纳的电子数为: 个
[三]最外层电子数最多不超过 个[二k层n二为最外层
时不超过 个]
八
[四]次外层电子数二最多不超过 个.
[二]性质与位置互推是解题的关键 熟悉元素周期表中同周期、同主族元素性质的递变规 律,主要包括: 一元素的金属性、非金属性. 二气态氢化物的稳定性. 三最高价氧化物对应水化物的酸碱性. [三]结构和性质的互推是解题的要素 一电子层数和最外层电子数决定元素原子的氧化性和 还原性. 二同主族元素最外层电子数相同,性质相似. 三正确推断原子半径和离子半径的大小及结构特点. 四判断元素金属性和非金属性的方法.
最新人教版九年级全一册化学第三单元课题3 元素 课时2 元素符号和元素周期表

(6)五个氧分子:___5_O_2___。
返回目录
思路点拨 (1)金属、稀有气体、部分固态非金属(如碳、硫、磷等)的 元素符号还表示这种元素代表的物质。(2)当在元素符号前加 上数字时,仅表示微观意义;如3Fe仅表示3个铁原子。
返回目录
课堂练习 4. 下列图示属于第二周期元素的是( D )
返回目录
5. 如图3-3-2是钾元素在元素周期表中的部分信息和原子的结 构示意图,下列判断不正确的是( B ) A.钾的相对原子质量是39.10 B.钾元素和钾离子的电子层数相同 C.钾元素在元素周期表中应该排在 第四周期 D.钾元素的原子在化学反应中容易 失去电子
九年级 全一册 配人教版
第三单元 物质构成的奥秘
课题3 元素
课时2 元素符号和元素周期表
目录
01 课程要求 02 课前预习 03 知识点精讲 04 课堂检测
课程要求
1.了解元素符号所表示的意义,学会元素符号的正确写法,记 住并能书写一些常见元素的名称和符号。 2. 初步认识元素周期表,能根据原子序数在元素周期表中找到 指定的元素。 3. 初步认识元素性质与原子核外电子的排布,特别是最外层电 子数的密切关系。
返回目录
课前预习
下图是元素周期表中的一种元素,其上的数字、字母、文字分 别表示什么意思?
该元素的原子序数是5 该元素的名称是硼
该元素的元素符号是B 该原子的相对原子质量是10.81
Hale Waihona Puke 返回目录知识点精讲
知识点1 元素符号 1. 元素符号的书写方法:由一个字母表示的元素符号要 __大__写____;由两个字母表示的元素符号,第一个字母要 __大__写____,第二个字母要___小__写___。 2. 元素符号的含义:(1)表示__一__种__元__素_______;(2)表示 ____这__种__元__素__的__一__个__原__子________。
人教版化学九年级上册第三单元3.3《元素》ppt课件 ( 共21张PPT)

•
10、阅读一切好书如同和过去最杰出 的人谈 话。2021/8/112021/8/112021/8/118/11/2021 12:02:08 AM
•
11、一个好的教师,是一个懂得心理 学和教 育学的 人。2021/8/112021/8/112021/8/11Aug-2111- Aug-21
•
12、要记住,你不仅是教课的教师, 也是学 生的教 育者, 生活的 导师和 道德的 引路人 。2021/8/112021/8/112021/8/11Wednesday, August 11, 2021
4、地壳中各种元素的质量分数 氧>硅>铝>铁
(1)地壳中含量最多的元素是: 氧元素 (2)地壳中含量最多的金属元素:铝元素 (3)生物细胞中含量最多的元素:氧元素
5、元素与原子的区别与联系
原子
元素
1、粒子;
1、是粒子的总称;
区 2、既讲种类,又讲个数; 2、只讲种类,不讲个 别 3、微观角度描述分子的 数;
18 Ar 氩 40
图A
+6 2 4 图B
(1)原子序数为14的元素名称为
;
(2)图B是某元素的原子结构示意图,该元素在图A中的位
置是(填①或②或③) ;
(3)每周期中从左到右存在着的变化规律(写一条)__
_
____________。
一、元素 1.定义:具有相同的核电荷数(质子数)的一类原子的总称 2、决定元素种类的是:核电荷数(质子数) 3.分类:金属元素、非金属元素和稀有气体元素 4.地壳中元素含量:氧、硅、铝、铁 二、元素符号 1、书写 2、符号表示意义 三、元素周期表 1、元素周期表的构成(周期、族) 2、原子序数=核电荷数=核内质子数=核外电子数 3、元素周期表中各符号含义
第3讲原子结构与元素周期表 2022-2023学年高二化学同步精品讲义(人教2019选择性必修2 )

知识点一:一、构造原理与元素周期表1.核外电子排布与周期的划分 (1)电子排布与周期划分的本质联系周期价层电子排布各周期增加的能级元素种数 ⅠA 族 0族 最外层最多容纳电子数 一 1s 1 1s 2 2 1s 2 二 2s 1 2s 22p 6 8 2s 、2p 8 三 3s 1 3s 23p 6 8 3s 、3p 8 四 4s 1 4s 24p 6 8 4s 、3d 、4p 18 五 5s 1 5s 25p 6 8 5s 、4d 、5p 18 六 6s 1 6s 26p 6 8 6s 、4f 、5d 、6p 32 七7s 17s 27p 687s 、5f 、 6d 、7p 32(2)规律:①周期序数= 。
②本周期包含的元素种数= 的2倍=对应能级组最多容纳的电子数。
【答案】电子层数 对应能级组所含原子轨道数 2.核外电子排布与族的划分知识精讲考点导航第03讲 原子结构与元素周期表(1)划分依据:取决于原子的价层电子数目和价层电子排布。
(2)特点:同族元素的价层电子数目和价层电子排布相同。
(3)规律①对主族元素,同主族元素原子的价层电子排布完全相同,价层电子全部排布在n s或n s、n p轨道上(见下表)。
价层电子数与族序数相同。
族序数ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA价层电n s1n s2n s2n p1n s2n p3n s2n p4n s2n p5子排布③稀有气体元素:价层电子排布为(He除外)。
【答案】n s2n p2 n s2n p6【即学即练1】1.原子核外的某一能层最多能容纳的电子数目为18,则该能层是A.K能层B.L能层C.O能层D.M能层【答案】D【解析】根据鲍利不相容原理可知,每一能层最多能容纳的电子数目为22n,所以最多能容纳的电子数目为18的能层是第三能层即M层,故答案为:D。
2.关于价电子排布式为523d4s的元素的说法不正确的是A.原子序数为25 B.价电子数为7C.位于第四周期ⅦB族D.位于第四周期VB族【答案】D【解析】该元素的最大电子层数为4,应位于元素周期表第四周期,3d和4s能级电子数之和为7,应在第7列,位于ⅦB族,价电子数为7,原子序数为25,故D错误。
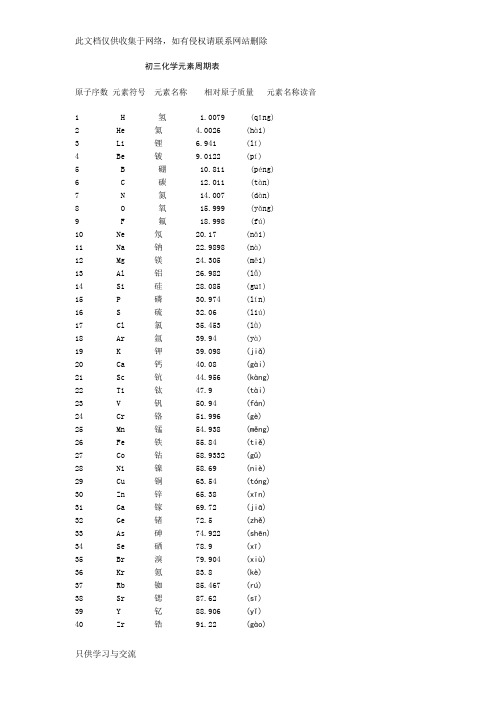
初三化学元素周期表(完整版)讲解学习
初三化学元素周期表原子序数元素符号元素名称相对原子质量元素名称读音1 H 氢 1.0079 (qīng)2 He 氦 4.0026 (hài)3 Li 锂 6.941 (lǐ)4 Be 铍 9.0122 (pí)5 B 硼 10.811 (péng)6 C 碳 12.011 (tàn)7 N 氮 14.007 (dàn)8 O 氧 15.999 (yǎng)9 F 氟 18.998 (fú)10 Ne 氖 20.17 (nǎi)11 Na 钠 22.9898 (nà)12 Mg 镁 24.305 (měi)13 Al 铝 26.982 (lǚ)14 Si 硅 28.085 (guī)15 P 磷 30.974 (lín)16 S 硫 32.06 (liú)17 Cl 氯 35.453 (lǜ)18 Ar 氩 39.94 (yà)19 K 钾 39.098 (jiǎ)20 Ca 钙 40.08 (gài)21 Sc 钪 44.956 (kàng)22 Ti 钛 47.9 (tài)23 V 钒 50.94 (fán)24 Cr 铬 51.996 (gè)25 Mn 锰 54.938 (měng)26 Fe 铁 55.84 (tiě)27 Co 钴 58.9332 (gǔ)28 Ni 镍 58.69 (niè)29 Cu 铜 63.54 (tóng)30 Zn 锌 65.38 (xīn)31 Ga 镓 69.72 (jiā)32 Ge 锗 72.5 (zhě)33 As 砷 74.922 (shēn)34 Se 硒 78.9 (xī)35 Br 溴 79.904 (xiù)36 Kr 氪 83.8 (kè)37 Rb 铷 85.467 (rú)38 Sr 锶 87.62 (sī)39 Y 钇 88.906 (yǐ)40 Zr 锆 91.22 (gào)42 Mo 钼 95.94 (mù)43 Tc 锝 (99) (dé)44 Ru 钌 161.0 (liǎo)45 Rh 铑 102.906 (lǎo)46 Pd 钯 106.42 (bǎ)47 Ag 银 107.868 (yín)48 Cd 镉 112.41 (gé)49 In 铟 114.82 (yīn)50 Sn 锡 118.6 (xī)51 Sb 锑 121.7 (tī)52 Te 碲 127.6 (dì)53 I 碘 126.905 (diǎn)54 Xe 氙 131.3 (xiān)55 Cs 铯 132.905 (sè)56 Ba 钡 137.33 (bèi) 57-71 La-Lu 镧系57 La 镧 138.9 (lán)58 Ce 铈 140.1 (shì)59 Pr 镨 140.9 (pǔ)60 Nd 钕 144.2 (nǚ)61 Pm 钷 (147) (pǒ)62 Sm 钐 150.3 (shān)63 Eu 铕 151.96 (yǒu)64 Gd 钆 157.25 (gá)65 Tb 铽 158.9 (tè)66 Dy 镝 162.5 (dī)67 Ho 钬 164.9 (huǒ)68 Er 铒 167.2 (ěr)69 Tm 铥 168.9 (diū)70 Yb 镱 173.04 (yì)71 Lu 镥 174.967 (lǔ)72 Hf 铪 178.4 (hā)73 Ta 钽 180.947 (tǎn)74 W 钨 183.8 (wū)75 Re 铼 186.207 (lái)76 Os 锇 190.2 (é)77 Ir 铱 192.2 (yī)78 Pt 铂 195.08 (bó)79 Au 金 196.967 (jīn)80 Hg 汞 200.5 (gǒng)81 Tl 铊 204.3 (tā)82 Pb 铅 207.2 (qiān)83 Bi 铋 208.98 (bì)85 At 砹 (201) (ài)86 Rn 氡 (222) (dōng)87 Fr 钫 (223) (fāng)88 Ra 镭 226.03 (léi)89-103 Ac-Lr 锕系89 Ac 锕 (227) (ā)90 Th 钍 232.0 (tǔ)91 Pa 镤 231.0 (pú)92 U 铀 238.0 (yóu)93 Np 镎 (237) (ná)94 Pu 钚 (244) (bù)95 Am 镅 (243) (méi)96 Cm 锔 (247) (jú)97 Bk 锫 (247) (péi)98 Cf 锎 (251) (kāi)99 Es 锿 (252) (āi)100 Fm 镄 (257) (fèi)101 Md 钔 (258) (mén)102 No 锘 (259) (nuò)103 Lr 铹 (262) (láo)104 Rf 钅卢 (257) (lú)105 Db 钅杜 (261) (dù)106 Sg 钅喜 (262) (xǐ)107 Bh 钅波 (263) (bō)108 Hs 钅黑 (262) (hēi)109 Mt 钅麦 (265) (mài)110 Uun (281)111 Uuu (272)112 Uub (285)114 Uuq (289)(加括号的数据为该放射性元素半衰期最长同位素的质量数。
元素及元素周期表

针对训练3 右图是铝的结构示意图和在周期表 中的位置图,下列说法错误的是(C ) A.铝原子的核电荷数是13 B.铝元素的相对原子质量是26.98 C.铝离子核外有3个电子层 D.铝原子最外层有3个电子
【火眼金睛】 易错点1 对元素概念的理解不清晰 例 下列有关元素的说法正确的是( D ) A.质子数相同的粒子属于同一种元素 B.相同元素组成的化合物一定是同种物质 C.一种元素只能组成一种单质 D.水是由氢、氧两种元素组成的
(3)元素周期表中氟元素的有关信息如下图所示, 下列说法正确的是 B (填字母)。 氟属于金属元素 氟的原子序数是9 氟的相对原子质量是19.00g (4)氟原子结构示意图为 ,氟原子在化学 反应中易 得到 (填“得到”或“失去”)电子, 由钠元素和氟元素组成的化合物氟化钠的化学式 为 NaF 。
例3 (2016·枣庄)如图是元素周期表的一部分,请 回答
:
(1)①处元素和②处元素形成常见化合物的化学 式为 ,该化合物中②处元素的化合价为 ( 2) 表示如表中 (填表中序号) 的原子结构示意图,该原子易 (填“得”或 “失”)电子,形成的离子符号为 .
【解析】(1)①是氧元素,在化合物中常 显﹣2价,②是铝元素,常显+3价;二者组成 的化合物氧化铝的化学式为Al2O3;故填: Al2O3;+3; (2)由原子结构示意图可知,这是17号元 素氯原子的结构示意图,元素位于元素周期 表的④位置;其最外层有7个电子,在化学反 应中易得到1个电子,而形成带一个单位负电 荷的氯离子;故填:④;得;Cl﹣.
(6)主族元素原子的最外层电子数等于主族序数;
(7)主族元素原子的最外层电子数等于其最高正化合价。
3.元素周期表中的信息 原子序数 (核电荷数) 1H 元素符号 元素名称
结构化学《结构化学》第2章 第3讲(2.5)2.1 《结构化学》第2章第3讲

4
4. 电负性 1)定义 用以量度原子对成键电子吸引能力的相对大小。 2)元素电负性的影响因素 a. 氧化态影响:Fe3+比Fe2+的电负性大; b. 轨道杂化影响:C2H2中C原子的电负性比CH4 中C原子的电负性大; c. 周围环境影响:F3CI中,由于F原子诱导效应, 使得C原子的电负性比I原子还强。
14
又如,人们制备了零价的Ni、Pd化合物:Ni(CO)4、 K4Ni(CN)4、K4Pd(CN)4等。
15
2.5 元素周期表与元素周期性质
1. 元素周期表
现在使用最多的长周期表共分7个周期,18个族,
如表2.5.1(下一页)所示。
根据价电子组态,周期表可分为5区:
s区
1~2族
ns1(碱金属)和ns2(碱土金属)
p区
13~18族 ns2np1~6
d区
3~10族 (n-1)d1~10ns0~2
ds区 11~12族 (n-1)d10ns1~2
11
Au、Hg 性质差异:
Hg
Au
密度/g cm-3
13.53
19.32
熔点/ºC
-39
1064
熔化热/kJ mol-1 2.30
12.8
电导率/kS cm-1 10.4
426
Hg22+
Au2
(4)对金属熔点的影响
第六周期金属元素熔点从Cs开始一直到W,金属
熔点逐渐升高;而从W到Hg,金属熔点逐渐降低。
对 于 W(5d46s2) , 6 个 价 电 子 全 部 进 入 成 键 轨 道 , 原子间结合力最强,熔点最高。
2020届人教版高一化学必修2讲义:第一章 第二节 第三课时 元素周期表和元素周期律的应用含答案

第三课时元素周期表和元素周期律的应用——————————————————————————————————————[课标要求]1.了解元素周期表中金属元素、非金属元素的分区。
2.体会元素周期表和元素周期律在科学研究和工农业生产中的指导意义。
1.对于主族元素(1)周期序数=电子层数(2)主族序数=最外层电子数=最高正价=8-|最低负价|(其中,F无正价,O无最高正价)。
2.金属与非金属分界线处的元素(1)Al Ge Sb Po; B Si As Te At(2)在金属和非金属分界线附近的元素既有金属性,又有非金属性。
3.金属与非金属分界处半导体材料过渡元素催化剂、合金材料周期表右上角制取农药的元素元素周期表和元素周期律的应用)1.金属元素与非金属元素的分区及性质递变规律位于周期表中金属和非金属元素分界线两侧的元素(如Al、Si等)既能表现金属性,又能表现非金属性。
2.元素化合价与其在周期表中位置的关系3.元素周期表和元素周期律的应用(1)科学预测:为新元素的发现和预测它们的原子结构和性质提供线索。
(2)指导其他与化学相关的科学技术研究①在金属与非金属分界线附近的元素中寻找半导体材料。
②在周期表中的非金属区域探索研制农药的材料。
③在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。
[特别提醒]元素既具有金属性,又具有非金属性,不能称为元素具有两性,两性指的是酸、碱两性,而不是指金属性和非金属性。
1.结合元素周期律分析,在现有元素中金属性和非金属性最强的分别是什么元素?提示:由元素周期律可知,同一周期从左到右,金属性逐渐减弱,非金属性逐渐增强;同一主族自上而下,金属性逐渐增强,非金属性逐渐减弱。
所以金属性最强的元素位于元素周期表的左下角,非金属性最强的元素位于元素周期表的右上角,即金属性最强的应该为钫元素,但由于钫是放射性元素,在自然界中不能稳定存在,所以一般认为铯的金属性最强,氟的非金属性最强。
2.从第ⅢA族的硼到第ⅦA族的砹连成一条斜线,即为金属元素和非金属元素的分界线,分界线附近元素的性质有何特点?这些元素可制取什么材料?提示:分界线附近的元素既有一定的金属性,又有一定的非金属性,这些元素可以制取半导体材料。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
A.氢是金属元素
B.钠离子核外有三个电子层
C.第二、三周期元素的原子从左至右最外层电子数逐渐增多
D.在化学变化中镁元素容易失去最外层2个电子形成镁离子,其离子符号是Mg+2
11.(2011年福建福州)根据图X1-3-4有关信息判断,下列说法错误的是( D)
图X1-3-4
A.氯原子的核电荷数为17
A.肌酸含有四个元素
B.肌酸由四种元素组成
C.肌酸总共含有18个原子
D.肌酸中含有一个氧气分子
考点2元素周期表及其应用
8.图X1-3-1是元素周期表中的硫元素及其原子结构示意图,下列说法正确的是( B)
图X1-3-1
A.硫元素属于金属元素
B.硫原子核内有16个质子
C.硫的相对原子质量为16
D.硫原子在化学反应中容易失去电子
图X1-3-6
A.碘的相对原子质量为126.9,原子核内质子数为53
8.请写出下列符号所表示的意义(只写一种即可):
(1)H表示氢元素(或表示一个氢原子)。
(2)2C表示两个碳原子。
(3)Cu表示铜元素(或表示一个铜原子,也表示铜这种物质)。
9.下表是元素周期表的一部分:
(1)12号元素的元素名称为镁;Be元素的相对原子质量为9.012。
(2)相对原子质量为22.99的元素属于金属(填“金属”或“非金属”);Ne的化学性质不活泼;F元素最外层电子数为7。
14.钾是维持人体生命和植物生长所必需的元素。图X1-3-5是从元素周期表中得出的部分信息。下列关于钾元素的叙述错误的是( B )
图X1-3-5
A.钾元素的原子序数为19
B.钾元素在人体及植物体内以单质形式存在
C.钾元素的相对原子质量为39.10
D.施用草木灰,可给农作物补充钾元素
15.(2011年陕西)随着日本福岛核电站放射性碘泄漏,碘这种元素被人们所认知。图X1-3-6是元素周期表中提供的碘元素的部分信息及碘原子的结构示意图。下列说法错误的是( D)
9.(2011年广西桂林)锶元素的粒子结构示意图和在元素周期表中显示的信息如图X1-3-2所示:
图X1-3-2
(1)锶属于金属元素(填“金属”或“非金属”)。
(2)锶元素的原子序数为38,相对原子质量为87.62。
(3)图B所表示的粒子的化学符号是Sr2+。
10.(2011年山东烟台)根据图X1-3-3提供的信息,下列判断正确的是(C)
B.钠的原子结构示意图中x=8
C.氯原子的相对原子质量为35.45
D.在化学反应中,钠原子容易得到1个电子
12.填写下列空白:
(1)N所表示的意义:一个氮原子或氮元素。
(2)酒精中含3种元素。
(3)食盐水中含有Na、Cl、H、O元素。
(4)地壳中含量最高的金属元素:Al。
13.2011年5月,台湾传出“毒饮料事件”,一些厂商在饮料中违法添加了“塑化剂”。塑化剂的主要成分为邻苯二甲酸二辛酯,其化学式为C24H38O4。下列说法中正确的是(D)
A.最外层电子数B.中子数ﻩ
C.相对原子质量ﻩD.质子数
3.以下符号书写正确的是(C )
A.一个水分子:2HOﻩ
B.氧元素:O2
C.两个钠离子:2Na+ﻩ
D.正三价的铝元素:Al3+
4.有四种原子或离子,其质子数、中子数和核外电子数如下表所示:
粒子
质子
数
中子
数
核外
电子数
粒子
质子
数
中子
数
核外
电子数
甲
6
(3)表中不同种元素最本质的区别是A(填字母)。
A.质子数不同B.相对原子质量不同C.中子数不同
考点1ห้องสมุดไป่ตู้素
1.地壳中含量最多的元素是( C)
A.铝B.铁C.氧D.硅
2.老年人缺钙易发生骨折,这里的钙是指( C)
A.钙单质B.钙原子
C.钙元素D.钙离子
3.下列描述Fe所表示的意义错误的是( D)
A.表示铁原子B.表示铁元素
C.表示铁这种物质D.表示铁分子
4.下列元素名称与其对应的元素符号完全正确的是( C )
A.氯cLB.氖Na
C.镁 MgD.铜Ca
5.(2010年浙江湖州)2010年4月5日,科学家成功合成了第117号新元素,填补了第116号和118号元素之间的空缺。推测该元素为117号元素的依据是( B)
A.中子数B.质子数
A.该元素在地壳中的含量为52.00%
B.该元素属于非金属元素
C.该元素的原子核外有24个电子
D.该元素的原子序数为52
7.(2010年广东调研)由地壳中含量最多的金属元素和非金属元素以及空气中含量最多的元素组成的一种化合物的化学式为( C)
A.Al2O3B.Al2(SO4)3
C.Al(NO3)3D.Fe(NO3)3
第3讲元素及元素周期表
———————————————————————————————— 作者:
———————————————————————————————— 日期:
ﻩ
第3讲元素及元素周期表
1.分别分解氯酸钾和过氧化氢,都可以制得氧气。则两种物质中都含有(D)
A.纯氧B.钾元素
C.氦元素D.氧元素
2.元素的种类决定于原子的( D )
6
6
乙
6
7
6
丙
12
12
10
丁
11
12
10
则属于同种元素粒子的是(A)
A.甲和乙ﻩB.丁和丙ﻩC.乙和丙ﻩD.甲和丙
5.下列化学用语既能表示一种元素,又能表示一个原子,还能表示一种物质的是(B )
A.NB.HeC.N2D.SO2
6.(2011年广东揭阳)元素周期表是学习化学的重要工具,下图是元素周期表中的一格,下面从该图获取的信息中,正确的是(C)
C.电子数D.中子数和质子数
6.物质分为混合物和纯净物。物质种类繁多,而组成物质的元素种类并不多,目前已发现一百余种。下列说法正确的是(D)
A.混合物由两种或两种以上元素组成
B.纯净物由一种元素组成
C.元素是组成物质的最小微粒
D.化学变化中元素的种类不变
7.2011年爆出的“牛肉膏”事件引起了社会的广泛关注。牛肉膏中含有多种物质,其中一种物质称为肌酸,其化学式为C4H9N3O2,下列有关肌酸的说法正确的是( B)
A.邻苯二甲酸二辛酯是碳、氢、氧原子构成的
B.邻苯二甲酸二辛酯由四种元素组成
C.邻苯二甲酸二辛酯含有24个碳元素
D.邻苯二甲酸二辛酯含有氢元素
解析:物质宏观上是由元素组成的,微观上是由分子、原子或离子构成,A项,邻苯二甲酸二辛酯是由碳、氢、氧三种元素组成或者说是由邻苯二甲酸二辛酯分子构成,而邻苯二甲酸二辛酯分子才由碳、氢、氧原子构成;C项,元素只讲种类不讲个数。
