定点生产申请表-药品生产企业申报麻醉药品、精神药品定点生产申请表
麻醉药品、第一类精神药品申请资料

麻醉药品、第一类精神药品申请材料
一、《印鉴卡》申请表
二、医疗机构执业许可证(无需提供,医疗机构网查询)
三、麻醉药品和第一来精神药品安全储存设施情况及管理制度
四、采购人员身份证及其药学专业技术资格证书原件及复印件和麻醉药品、精神药品使用知识培训考核合格证明。
培训和考核对象为医疗机构执业医师。
培训单位也可以结合当地实际情况,将相关药学专业技术人员纳入培训对象。
培训和考核内容包括:
(一)《药品管理法》、《执业医师法》、《麻醉药品和精神药品管理条例》、《处方管理办法(试行)》、《<麻醉药品、第一类精神药品购用印鉴卡>管理规定》、《麻醉药品、精神药品处方管理规定》和《医疗机构麻醉药品、第一类精神药品管理规定》等相关法律、法规、规定;
(二)医疗机构内麻醉药品和精神药品使用及管理制度;
(三)麻醉药品、精神药品临床应用指导原则;
(四)癌痛、急性疼痛和重度慢性疼痛的规范化治疗
(五)医源性药物依赖的防范与报告;
(六)麻醉药品和第一类精神药品不良反应的防治。
五、药学部门负责人的药学专业证明及药学专业技术资格证书原件及复印件和麻醉药品、精神药品使用知识的培训考核合格证明(此药学部门负责人应具有本科以上学历及本专业高级技术职务任职资格)
六、从事调配麻醉药品、第一类精神药品药学专业人员花名册≥2人,及麻醉药品和精神药品使用知识培训考核证明,应提供专业技术任职资格证书原件、核对退回。
七、有麻醉药品和第一类精神药品处方权的执业医师花名册。
应提供执业证书原件核对后退回及麻醉药品和精神药品使用知识培训考核证明。
八、委托他人办理的还应提供授权委托书及代理人身份证原件及复印件。
申请麻醉药品、第一类精神药品以及第二类精神药品原料药

申请麻醉药品、第一类精神药品以及第二类精神药品原料药定点
生产资格需提交材料
一、材料目录:
(1)、《药品生产企业申报麻醉药品、精神药品定点生产申请表》;
(2)、加盖企业公章的《药品生产许可证》、《企业法人营业执照》复印件;
(3)、加盖企业公章的麻醉药品和精神药品实验研究立项批件或研究成果转让批件复印件;
(4)、加盖企业公章的药品注册申请受理通知单复印件;
(5)、企业麻醉药品和精神药品管理的组织机构图(注明各部门职责以及相互关系、部门负责人);
(6)、企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图(注明麻醉药品和精神药品所在相应位置);
(7)、麻醉药品和精神生产工艺布局平面图、工艺设备平面布置图(注明相应安全管理措施);
(8)、麻醉药品和精神药品安全管理制度文件目录。
(9)、经办人的法人授权书和身份证复印件复印件(经办人在复印件上签名);
(10)、申请人对申请材料真实性地自我保证声明。
全部申请材料应以纸质形式报送2份,同时(1)、(5)、(6)、(7)、(8)项以电子文档形式报送;
二、资料要求
1、所提交的材料均应为A4纸大小;
2、复印件均应加盖申请单位红色印章。
麻醉药品第一类精神药品及第二类精神药品原料药定点生产批准

麻醉药品第一类精神药品及第二类精神药品原料药定点生产批准2006年02月22日发布一、项目名称:麻醉药品和精神药品定点生产企业批准二、许可内容:麻醉药品、第一类精神药品及第二类精神药品原料药定点生产批准三、设定和实施许可的法律依据:《麻醉药品和精神药品管理条例》第十六条四、收费:不收费五、数量限制:本许可事项有总量限制。
根据《麻醉药品和精神药品管理条例》第十四条规定,国务院药品监督管理部门应当根据麻醉药品和精神药品的需求总量,确定麻醉药品和精神药品定点生产企业的数量和布局。
六、申请人提交材料目录:(一)《药品生产企业申报麻醉药品、精神药品定点生产申请表》。
(二)加盖企业公章的《药品生产许可证》复印件。
(三)加盖企业公章的麻醉药品和精神药品实验研究立项批件或研究成果转让批件复印件。
(四)加盖企业公章的药品注册申请受理通知单复印件。
(五)企业麻醉药品和精神药品管理的组织机构图(注明各部门职责以及相互关系、部门负责人)。
(六)企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图(注明麻醉药品和精神药品所在相应位置)。
(七)麻醉药品和精神药品生产工艺布局平面图、工艺设备平面布置图(注明相应安全管理措施)。
(八)麻醉药品和精神药品安全管理制度文件目录。
七、对申请资料的要求:申报资料的一般要求:1、申请项目及内容准确,申请材料完整、清晰,使用A4规格纸单面打印或复印。
中文不得小于宋体小4号字,英文不得小于12号字,内容应完整、清楚,不得涂改。
2、申请人提交的资质证书必须有效。
3、申报资料所附图片必须清晰易辨。
(二)申报资料的具体要求:《药品生产企业申报麻醉药品、精神药品定点生产申请表》该表是申请人提出麻醉药品和精神药品定点生产申请的基本文件,同时也是药监部门对该申请进行审批的依据,是药品监督管理部门对定点生产申请进行形式审查的重点,其填写必须准确、规范,需加盖单位公章。
八、申办流程示意图:九、许可程序:(一)受理:申请人向申请人所在地的省级食品药品监督管理部门提出申请,按照本《须知》第六条所列目录提交申请材料,省级食品药品监督管理部门对申报材料进行形式审查,对于申报资料不齐全或者不符合形式审查要求的,应当在5日内一次告知申请人需要补正的全部内容,逾期未告知的,自收到申报资料之日起即为受理。
申请报告麻醉药品和精神药品标准品、对照品申请表【模板】

XX市食品药品监督管理局:
我单位生产盐酸地芬诺酯等品种是国药准字xxx号药品。根据质量标准规定,xxx等品种其检验需用到xxx标准品(对照品),现向你局申请购买,请批准。
XX市××××(单位)(盖章)
××××年××月××日
麻醉药品和精神药品标准品、对照品申请表
购用单位名称
广西***制药有限公司
单位地址
广西XX市**路*号
经办人
黄**
电话
0775-********
经办人身份证号码
****************
药品名称
规格
计量单位
申请用量
药品监督部门核定用量(大写)
吗啡
200mg
支
壹支
壹支
盐酸麻黄碱
100mg
支
壹支
壹支
申购单位(公章)
填报人:
年 日
批准单位(公章)
年 月 日
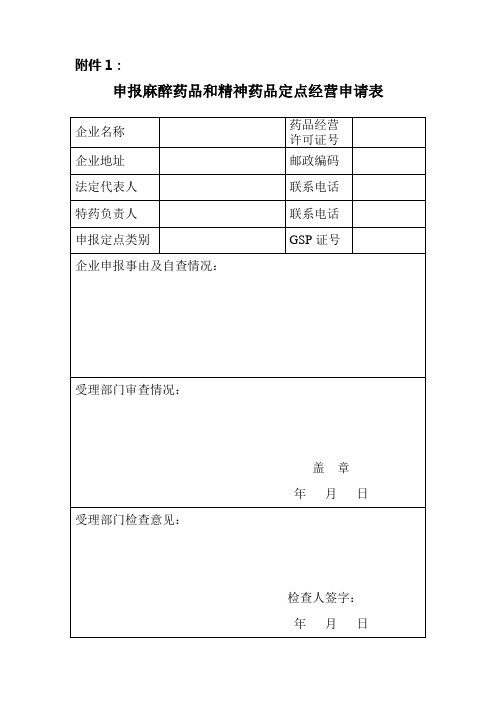
特殊药品定点经营申请表

特殊药品定点经营申请表
填报企业:(盖章)联系人:
联系电话:
申请时间:年月日
河北省药品监督管理局
填报说明
一、本表填写一式四份,必须使用钢笔、签字笔填写或打印,
字迹清晰,涂改无效。
二、企业基本情况
经营方式:批发或零售。
申报定点类别:麻醉药品、第一类精神药品
第二类精神药品制剂批发
第二类精神药品制剂零售
第二类精神药品原料药批发
第一类药品类易制毒化学品批发
罂粟壳批发
罂粟壳零售
医疗用毒性药品批发
医疗用毒性药品零售
销售额及利税:填报前三年情况
企业基本情况
特殊药品经营管理人员一览表
特殊药品管理文件、制度目录
所提交的文件、证件、资料
审批意见。
《麻醉药品第一类精神药品购用印鉴卡》申请表
法定代表人(负责人)签章
批准单位意见
审核人签字:(公章)
年 月 日
注:口腔医疗机构在“床位数栏需同时填写床位数和牙椅数,如无病床,只填写牙椅数。
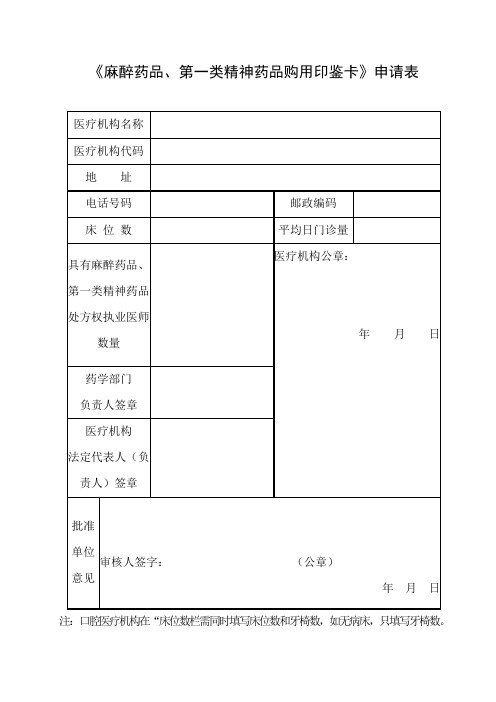
《麻醉药品、第一类精神药品购用印鉴卡》申请表
医疗机构名称
××××医院
医疗机构代码
PDY×××××-×××××××××××
地 址
柳州市×××路
电话号码
1234567
邮政编码
床位数
××张
平均日门诊量
×××人次
具有麻醉药品、第一类精神药品处方权执业医日
药学部门
负责人签章
《麻醉药品、第一类精神药品购用印鉴卡》申请表
医疗机构名称
医疗机构代码
地 址
电话号码
邮政编码
床位数
平均日门诊量
具有麻醉药品、第一类精神药品处方权执业医师数量
医疗机构公章:
年 月 日
药学部门
负责人签章
医疗机构
法定代表人(负责人)签章
批准单位意见
审核人签字:(公章)
年 月 日
注:口腔医疗机构在“床位数栏需同时填写床位数和牙椅数,如无病床,只填写牙椅数。
麻醉药品、第一类精神药品及第二类精神药品原料药定点生产批准

麻醉药品、第一类精神药品及第二类精神药品原料药定点生产批准2006年02月22日发布一、项目名称:麻醉药品和精神药品定点生产企业批准二、许可内容:麻醉药品、第一类精神药品及第二类精神药品原料药定点生产批准三、设定和实施许可的法律依据:《麻醉药品和精神药品管理条例》第十六条四、收费:不收费五、数量限制:本许可事项有总量限制。
根据《麻醉药品和精神药品管理条例》第十四条规定,国务院药品监督管理部门应当根据麻醉药品和精神药品的需求总量,确定麻醉药品和精神药品定点生产企业的数量和布局。
六、申请人提交材料目录:(一)《药品生产企业申报麻醉药品、精神药品定点生产申请表》。
(二)加盖企业公章的《药品生产许可证》复印件。
(三)加盖企业公章的麻醉药品和精神药品实验研究立项批件或研究成果转让批件复印件。
(四)加盖企业公章的药品注册申请受理通知单复印件。
(五)企业麻醉药品和精神药品管理的组织机构图(注明各部门职责以及相互关系、部门负责人)。
(六)企业周边环境图、总平面布置图、仓储平面布置图、质量检验场所平面布置图(注明麻醉药品和精神药品所在相应位置)。
(七)麻醉药品和精神药品生产工艺布局平面图、工艺设备平面布置图(注明相应安全管理措施)。
(八)麻醉药品和精神药品安全管理制度文件目录。
七、对申请资料的要求:申报资料的一般要求:1、申请项目及内容准确,申请材料完整、清晰,使用A4规格纸单面打印或复印。
中文不得小于宋体小4号字,英文不得小于12号字,内容应完整、清楚,不得涂改。
2、申请人提交的资质证书必须有效。
3、申报资料所附图片必须清晰易辨。
(二)申报资料的具体要求:《药品生产企业申报麻醉药品、精神药品定点生产申请表》该表是申请人提出麻醉药品和精神药品定点生产申请的基本文件,同时也是药监部门对该申请进行审批的依据,是药品监督管理部门对定点生产申请进行形式审查的重点,其填写必须准确、规范,需加盖单位公章。
八、申办流程示意图:九、许可程序:(一)受理:申请人向申请人所在地的省级食品药品监督管理部门提出申请,按照本《须知》第六条所列目录提交申请材料,省级食品药品监督管理部门对申报材料进行形式审查,对于申报资料不齐全或者不符合形式审查要求的,应当在5日内一次告知申请人需要补正的全部内容,逾期未告知的,自收到申报资料之日起即为受理。
申报麻醉药品和精神药品定点经营申请表.
*206
企业最近2年内是否有违反有关禁毒法律、行政法规规定的行为。
207
企业工作人员最近2年内是否有违反有关禁毒法律、行政法规规定的行为。
*208
1、区域性批发企业验收检查项目共34项,其中关键项目9项(条款号前加“*”),一般项目25项。
关键项目如不合格则称为严重缺陷,一般项目如不合格则称为一般缺陷。
2、结果评定
项目
结果
严重缺陷
一般缺陷
通过验收
0
≤6
0
6—10
限期整改后,追踪验收
≤2
≤6
≤2
>6
不通过验收
>2
0
>10
3、验收检查条款
一、资质
5
按《条例》、《办法》、《验收标准》进行自查的自查报告。
6
经营规模、效益等综合指标评价在本地区药品经营行业中位居前列的证明材料。(批发企业提供)
7
具有药品配送能力,普通药品的销售已基本形成全国性(本地区)经营网络的说明材料,已初步建立现代物流体系说明材料。(批发企业提供)
8
企业第二类精神药品管理组织机构图(注明机构设置、各部门的职责及相互关系、部门负责人)。
211
从事麻醉药品和第一类精神药品的管理人员和直接业务人员是否熟悉麻醉药品和第一类精神药品相关法律法规的规定和管理知识。
212
从事麻醉药品和第一类精神药品的管理人员和直接业务人员是否每年按计划接受麻醉药品和第一类精神药品管理培训。
三、仓储与安全管理
*313
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
检查人签字:
年 月 日
受理部门审查意见:
药品监督管理部门盖章
年 月 日
药品生产企业申报麻醉药品、精神药品定点生产申请表
企业名称
注册地址
邮 编
企业法定代表人
电 话
联 系 人
电 话
药品生产
许可证编号
GMP证书编号
申
报
定
点
生
产
药
品
药品名称
管制类别
境Байду номын сангаас
外
委
托
加
工
生
产
境外委托企业名称
地 址
委托生产药品名称
管制类别
药品质量标准
每年拟生产数量
进口国允许进口的准许证号码
备注:本表加盖单位公章有效。
