医用敷贴标准
2-医用冷敷贴产品技术要求

医疗器械产品技术要求编号:医用冷敷贴1.产品型号/规格及其划分说明1.1产品描述预期用途:用于人体物理退热、体表面特定部位的降温。
仅用于闭合性软组织。
主要组成成分:蚕丝或无纺布背衬层、凝胶层、聚乙烯薄膜覆盖层制成。
1.2产品规格2.性能指标2.1外观产品外观表面应平整,厚度均匀,无缺胶现象。
2.2尺寸应符合1.2的规定2.3 PH值为3.00—8.002.4 初黏力能黏住8号或9号钢球。
2.5 剥离强度悬挂150克的砝码,1分钟内产品应能脱落。
2.6 耐热性在40℃±2℃时,凝胶不流淌。
2.7 耐寒性在0℃±1℃时,凝胶不结冰。
2.8 残留物产品从塑料板上揭下时,不应有明显残留胶体物质。
2.9 密封性包装应密封,按3.9的方法试验,无气泡溢出。
3.试验方法3.1 外观用目力检查,应符合 2.1 的规定3.2 规格尺寸用带表卡尺检测符合 2.2 的规定。
3.3 PH 值试验取样品 1 片,用刀片刮取凝胶 5 克,置入锥形瓶中注入 500ml 蒸馏水,用橡皮塞密封,放入恒温水浴中恒温 60℃±2℃中震动五次,溶胀 10min 后,冷却至室温,按照《中华人民共和国药典》 2015 年版四部,附录 PH 值测定法检验,应符合 2.3 的规定。
3.4 初黏力试验根据《中国药典》 2015 版四部中贴膏剂黏附力测定法(初黏力的测定),取供试品 3片,置于倾斜角为 15 度倾斜板中央,膏面向上,斜面上部 10mm 及下部 15mm 用 0. 025mm厚的涤纶薄膜覆盖,中间留出 5mm 膏面,将各品种项下规定的钢球,自斜面顶端自由滚下。
供试品中, 3 片应有 2 片或 2 片以上能在测试段上粘住 9 号钢球,如有一片不能粘住,再用较小的 8 号钢球试验,应能粘住。
如只有一片能粘住 9 号钢球,而另两片只能粘住较小的 8 号钢球,则应另取 3 片复试, 3 片应能粘住 8 号的钢球为符合 2.4 的规定。
医用输液贴产品技术标准2023年
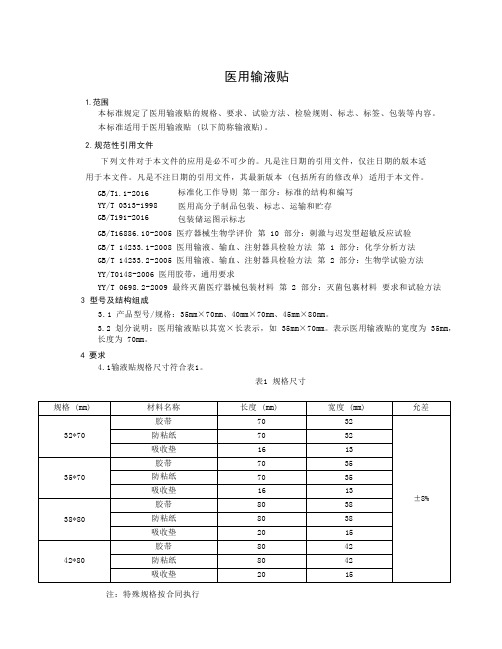
医用输液贴1.范围本标准规定了医用输液贴的规格、要求、试验方法、检验规则、标志、标签、包装等内容。
本标准适用于医用输液贴 (以下简称输液贴)。
2.规范性引用文件下列文件对于本文件的应用是必不可少的。
凡是注日期的引用文件,仅注日期的版本适用于本文件。
凡是不注日期的引用文件,其最新版本 (包括所有的修改单) 适用于本文件。
GB/T1.1-2016 YY/T 0313-1998 GB/T191-2016 标准化工作导则第一部分:标准的结构和编写医用高分子制品包装、标志、运输和贮存包装储运图示标志GB/T16886.10-2005 医疗器械生物学评价第 10 部分:刺激与迟发型超敏反应试验GB/T 14233.1-2008 医用输液、输血、注射器具检验方法第 1 部分:化学分析方法GB/T 14233.2-2005 医用输液、输血、注射器具检验方法第 2 部分:生物学试验方法YY/T0148-2006 医用胶带,通用要求YY/T 0698.2-2009 最终灭菌医疗器械包装材料第 2 部分:灭菌包裹材料要求和试验方法3 型号及结构组成3.1 产品型号/规格:35mm×70mm、40mm×70mm、45mm×80mm。
3.2 划分说明:医用输液贴以其宽×长表示,如 35mm×70mm。
表示医用输液贴的宽度为 35mm,长度为 70mm。
4 要求4.1输液贴规格尺寸符合表1。
表1 规格尺寸注:特殊规格按合同执行4.2 输液贴外观应洁净、无污渍、不起毛、无破洞,胶带无脱胶、漏胶,涂布均匀、切割整齐,吸收垫应洁净、无污渍。
4.3 胶带剥离强度按 YY/T0148-2006 附录 B 试验时,每 1cm 宽度所需的平均力应不小于 1.0N。
4.4 胶带持粘性按 YY/T0148-2006 附录 B 试验时,在烘箱内试验期间,贴于不锈钢板上水胶体的顶端下滑应不超过 2.5mm。
穴位贴敷诊疗操作标准

穴位贴敷穴位贴敷是指在夏日三伏天,通过将药物敷贴到人体必然穴位,医治和预防疾病的一种外治方式,故又称“三伏灸”、“三伏贴”。
一、适应病症要紧用于在秋冬春之际容易反复发作或加重的慢性、顽固性肺系疾病。
重点推荐:1.慢性咳嗽、慢性支气管炎、支气管哮喘、慢性阻塞性肺病;2.变应性鼻炎、慢性鼻窦炎、慢性咽喉炎;3.小儿体虚易感冒者,反复呼吸道感染者;近年也有专家探索将其用于骨关节炎等疾病。
二、操作标准1施术前预备1)药物:药物组成①以白芥子、延胡索、甘遂、细辛、生姜作为大体处方,可结合既往的临床体会和地域特点等进行加减。
②药材炮制白芥子、延胡索、甘遂和细辛采用道地药材,白芥子可以通过炒制或者调整其配伍比例控制对皮肤的刺激程度,其余药物均采用生药。
③药物制备药物制备过程要求在无菌、清洁、常温环境下进行,或者在当地医疗机构的专用制剂室完成。
药物的制备方法:采用洁净药材,将药物烘干,粉碎,过80~120目筛,备用。
姜汁的制备方法:采用生姜,洗净,粉碎,三层无菌纱布挤压取汁而成。
姜汁的浓度各地医院可以根据原有的经验和地域的特点在50%~100%之间适当调整,浓度调整可以通过加适量蒸馏水调配而成。
生药粉和生姜汁的比例为10克:10毫升,可以根据各地气候因素和经验予以适当调整。
贴敷时取生药粉用姜汁调成较干稠膏状,药物应在使用的当日制备,或者置冰箱冷藏室备用。
2)部位:依照患者病情,按规定选择相应的穴位。
3)体位:以患者舒适、医者便于操作的医治体位为宜。
4)环境:应选择清洁卫生的环境。
5)消毒:①部位:用75%乙醇或%~l%碘伏棉球或棉签在施术部位消毒。
②术者:医者双手应用香皂水清洗干净。
二、施术方式1)贴法:将已制备好的药物直接贴压于穴位上,然后外覆医用胶布固定;或先将药物置于医用胶布粘面正中,再对准穴位粘贝占。
硬膏剂可直接或温化后将硬膏剂中心对准穴位贴牢。
2)敷法:将已制备好的药物直接涂搽于穴位上,外覆医用防渗水敷料贴,再以医用胶布固定。
医用退热贴执行标准

医用退热贴执行标准
医用退热贴是一种用于缓解发热症状的医疗器械产品,其执行标准为《医用退热贴》YY/T 0499-2015。
该标准规定了医用退热贴的技术要求、试验方法、标志、包装、运输和贮存等方面的内容。
具体而言,该标准规定了医用退热贴的产品性能要求,包括产品的物理性能、化学性能、生物学性能等方面的要求。
同时,该标准还规定了产品的试验方法,包括外观检查、尺寸测量、粘度测定、pH值测定、水分含量测定、热传导率测定、生物相容性试验等方面的要求。
此外,该标准还规定了产品的标志、包装、运输和贮存等方面的要求,以确保产品在生产、销售和使用过程中的质量和安全。
需要注意的是,医用退热贴仅适用于缓解轻度发热症状,不能替代药物治疗,且不适用于高热、中暑、热射病等疾病的治疗。
在使用医用退热贴时,应按照产品说明书的要求正确使用,并注意产品的有效期限和保质期。
第1页/ 共1页。
一次性使用无菌敷贴技术要求

产品型号/规格及其划分说明1.1 产品组成:一次性使用无菌敷贴按配套的导管不同可分为A、B、C、D、L、K共六种型号,本产品主要应用于伤口护创及医用导管固定用。
1.2 组成材质:A、B、C、D型由涂胶皮肤贴片、尼龙粘扣、涂胶泡棉片、离型纸(膜)组成;L型由涂胶皮肤贴片和离型纸(膜)组成;K型由C型和D型组合而成。
涂胶皮肤贴片材质为医用压敏胶(聚氨酯树脂)和水刺无纺布(聚氨酯)。
尼龙粘扣材质为尼龙。
涂胶泡棉片材质为医用压敏胶(聚氨酯树脂)和EVA泡棉。
1.3 产品型号:型号命名示例:HK-GDT-B(M)B型无菌敷贴,规格中号。
HK-GDT-K K型无菌敷贴(C型和D型组合)套装。
1.4 型号规格尺寸:表1性能指标: 2.1 外观本品呈平面形状,应洁净平整,无裂缝,无污渍。
2.2 尺寸本品尺寸应符合表1规定。
2.3.拉伸强度本品的拉伸强度(横向、纵向)≥9.8N/25mm。
2.4 持粘性在烘箱内试验期间,贴于不锈钢板上试样的顶端下滑应不超过2.5mm。
2.5 剥离强度本品剥离强度每lcm宽度胶带所需的平均力不小于1.0N。
2.6 水蒸气透过性每24h的水蒸气渗透应不少于500g·m-2。
2.7 灭菌状态:采用环氧乙烷灭菌后,应无菌。
2.8 环氧乙烷残留量采用环氧乙烷灭菌,环氧乙烷残留量应不大于10μg/g。
2.9 胶粘剂残留量产品在温度为37℃条件下放置30min后应无残留粘性物质。
2.10 粘扣固定力将粘扣粘接,粘接应饱满,应能承受2.5N的静拉力,持续15s无脱落。
2.11 水中溶出物按YY/T0472.1-2004附录D试验时,水中溶出物的总量应不大于4.0%。
医用退热贴的技术标准要求

医用退热贴的技术标准要求1. 范围本文件规定了医用退热贴的技术标准要求,适用于医用退热贴的生产和检验。
2. 引用标准以下标准对于本文件的应用是必不可少的,凡是引用本文件的标准,均应被视为等效。
- GB/T 16886.1-2011 医疗器械生物学评价第1部分:评价和试验- YY/T 0148-2006 医用脱脂纱布- YY/T 0466.1-2016 医疗器械标签、标记和提供信息第1部分:通用要求3. 技术要求3.1 产品外观医用退热贴应为平整、无折痕、无气泡、无污渍、无变形。
颜色、大小、厚度应符合规定。
3.2 材质要求医用退热贴的基材、粘合剂、离型纸等材料应无毒、无刺激性、具有良好的生物相容性,不引起过敏反应。
3.3 退热效果医用退热贴应具有明显的退热效果,退热速率应符合规定。
退热效果应通过临床试验验证。
3.4 粘贴性能医用退热贴应具有良好的粘贴性能,能够牢固地粘贴在皮肤上,不易脱落。
3.5 透气性医用退热贴应具有良好的透气性,以保证皮肤的正常呼吸。
3.6 防水性医用退热贴应具有一定的防水性,能够在洗澡、洗手等潮湿环境下使用。
3.7 稳定性医用退热贴应具有良好的稳定性,在储存和使用过程中,性能不应发生明显变化。
3.8 有效期医用退热贴的有效期应符合规定,过期后应不能再使用。
4. 检验方法按照附录A的规定进行检验。
5. 检验规则医用退热贴的检验规则应符合GB/T 16886.1-2011、YY/T 0148-2006、YY/T 0466.1-2016等标准的规定。
6. 包装、标志、储存和运输医用退热贴的包装、标志、储存和运输应符合YY/T 0466.1-2016的规定。
7. 质量承诺生产商应对医用退热贴的质量承担责任,如用户在使用过程中发现产品质量问题,生产商应负责处理。
附录A(检验方法)参考文献[1] GB/T 16886.1-2011 医疗器械生物学评价第1部分:评价和试验[2] YY/T 0148-2006 医用脱脂纱布[3] YY/T 0466.1-2016 医疗器械标签、标记和提供信息第1部分:通用要求。
贴敷疗法操作评分标准

保持患者衣裤、床单整洁
弄脏一处-1
观察 观察局部皮肤反应,询问患者有无不适
未观察局部反应-2 未询问-2
未整理衣裤-2
患者卧位舒适,衣裤、床单整齐
未安置合适体位-2
未整理床单位-2
操作 整理 清理用物,归还原处
后 用物消毒处理,洗手
未清理用物-2 未归还原处-2 未洗手或洗手方法不 正确-2
记录 按要求记录、签名
贴敷疗法操作评分标准
科室:
项目
姓名:
要
求
得分:
扣分标准
标准分
仪表大方,举止端庄,态度和蔼 素质要求
服装、鞋帽整齐
一项不合要求-2 一项不合要求-2
对患者评估正确,全面 护士
一项未评估-1 评估一项不正确-1
洗手、戴口罩
一项不合要求-1
治疗盘,治疗卡,敷贴,治疗碗,镊子,生理盐
操作 物品
缺一项-0.5
记录不全一项-1
评价
心理素质好,动作稳重、轻巧,操作正确、熟练 一项达不到-2
体现人性化关怀,目标达到的程度
理论提问 回答全面、正确
总计:100
48 4 5 2
20 4 2 4
3
4 2 1 8 35
8
6 2 4
6
4 17 2 5 10 10 10 10
水棉球,弯盘,配,部位,方法 备
一项未核对-0.5
解释耐心、细致 患者
解释目的不清-2 未告知注意事项-2
体位合理,能充分暴露;注意保暖
未协助病人取合理体 位-2,暴露过多-1
清洁 清洁彻底,无污迹、药迹
皮肤
一处清洁不彻底-2
观察 局部皮肤无红肿、无炎症
医用退热贴:产品技术要求详解

医用退热贴:产品技术要求详解简介医用退热贴是一种用于降低体温的医疗产品,通常以贴剂的形式附着在人体皮肤上。
本文将详细解释医用退热贴的产品技术要求,以帮助企业生产符合相关标准的产品。
产品要求1. 温度控制医用退热贴应能有效地控制附着部位的温度,以达到退热的效果。
贴剂应具备以下特点:- 温度范围:医用退热贴的温度范围应在医学上被证明为有效的退热温度范围内,通常为36°C至40°C之间。
- 温度稳定性:贴剂在附着期间应能保持稳定的温度,不受外界环境影响。
- 温度调节:产品应具备温度可调节的功能,以满足不同患者的退热需求。
2. 安全性医用退热贴作为医疗产品,安全性是至关重要的。
产品应符合以下安全要求:- 无刺激性:贴剂应对人体皮肤无刺激性,不引起过敏反应。
- 无毒性:产品材料应无毒,不对人体产生有害影响。
- 无细菌感染:贴剂应具备抗菌功能,以防止细菌感染。
3. 使用便捷性医用退热贴的使用应简单便捷,方便患者和医护人员操作。
产品应具备以下特点:- 粘性:贴剂应具备良好的粘性,能够牢固附着在皮肤上。
- 操作简单:产品使用方法应简单易懂,患者和医护人员能够迅速上手操作。
- 不残留:贴剂在撕除后不留下残留物,不对肌肤造成损害。
4. 生产标准医用退热贴的生产应符合相关的标准和法规要求,以确保产品的质量和安全性。
生产标准应包括以下内容:- 材料选择:选用符合医用标准的材料进行生产,确保产品的安全性和有效性。
- 工艺控制:严格控制生产工艺,确保产品符合设计要求。
- 质量检测:在生产过程中进行质量检测,确保产品的质量稳定。
结论医用退热贴作为一种降温产品,其产品技术要求对于产品的质量和安全性至关重要。
在生产过程中,应严格遵守相关标准和法规要求,确保产品能够有效地降低体温、安全可靠地使用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
YZB 医疗器械注册产品标准
YZB/鲁青 0009-2007
医用敷贴
2007-06-08发布2007-06-20实施青岛海诺生物工程有限公司发布
前言
根据《医疗器械监督管理条例》、《医疗器械标准管理办法》特制订本注册产品标准作为该产品生产、检验、销售的质量依据。
本标准性能指标根据YY0148-2006与GB15980—1995制订。
本标准编写格式遵循了《医疗器械标准编写规范》和GB/T 1.1-2000《标准化工作导则第1部分:标准的结构和编写规则》。
本注册标准由青岛海诺生物工程有限公司提出并负责起草。
本注册标准主要起草人:刘宝玉、麻兆晖。
本注册标准首次发布于2007年06月。
II
医用敷贴
1 范围
本注册标准规定了医用敷贴的产品分类与标记、要求,试验方法,检验规则,标志。
本注册标准适用于医用敷贴(以下简称敷贴)。
2 规范性引用文件
下列文件中的条款通过本标准的引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T2828.1-2003计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T2829—2002 周期检验计数抽样程序及表适用于对过程稳定性的检验。
GB15980—1995 一次性使用医疗用品卫生标准
YY0148-2006医用胶带通用要求
YY0466-2003医疗器械用于医疗器械标签、标记和提供信息的符号
3 分类
3.1 组成
本产品由医用胶带、吸水垫、隔离膜、包装袋组成。
其中医用胶带由表面涂布医用胶粘剂的医用无纺布或医用PV从、PE膜或医用PU膜或其他医用材料构成。
3.2 材料
3.2.1 医用胶带符合应符合YY0148-2006的要求。
3.2.2 隔离膜采用60g~110g/ m2表面涂硅油的底纸。
3.2.3 吸水垫采用200g~350g/ m2单面复膜水刺无纺布。
3.3 尺寸
产品尺寸应不小于标称值的97%。
4要求
4.1 外观
敷贴表面应平整、洁净、无破损,医用胶带、吸水垫和隔离膜不得有脱离现象。
4.2 尺寸
敷贴尺寸应符合3.3规定。
4.3 无菌
敷贴的微生物指标应符合GB15980-1995中4.3.2要求。
4.4 医用胶带剥离强度、持粘性.
剥离强度应符合YY0148-2006中5.2.1要求;
持粘性应符合YY0148-2006中5.5.2要求;
4.5 吸水垫的吸水率
1
吸水垫的吸水率不小于150%。
4.6 环氧乙烷残留量
若采用环氧乙烷灭菌,环氧乙烷残留量应符合GB15980-1995中4.3.2要求
5 试验方法
5.1 外观
以目测及触摸检测并应符合4.1的要求。
5.2 尺寸
以通用量具或专用量具测量,应符合第4.2条规定。
5.3 无菌
按照GB15980—1995中附录D中规定方法进行。
5.4医用胶带的剥离强度、持粘性
剥离强度:按YY0148-2006附录B中第B.2章规定进行;
持粘性:按YY0148-2006附录B中第B.2章规定进行;
5.5 吸水垫的吸水率:
5.5.1试验器材及样品
a)天平。
分度值为0.01g。
b)镊子。
长度为10cm。
c)陶瓷托盘.尺寸为20cm×40cm×1.5cm。
d)吸水垫。
尺寸5cm×6cm ,三块。
5.5.2试验步骤
a)将陶瓷托盘盛上水,水面不低于1cm。
b)用天平称量吸水垫的重量,记为M1,
c)使敷料层面向下,平放在室温的水面上,5min后用镊子轻轻夹住一角,提出水面,停留10s(停
留期间不得抖动)。
然后称其重量,记为M2。
d)用同样的方法测定3块吸水垫。
5.5.3结果与计算
按下公式(1)计算吸水率X(%),取三次平均值。
M2-M1
X =──────× 100% ```````````` (1)
M1
式中:M1为干燥吸水垫的重量,g;
M2为吸水后吸水垫的重量,g;
X为吸水垫的吸水率;%。
5.6 环氧乙烷残留量
按照GB15980—1995中附录G中规定方法进行。
6 检验规则
6.1检验分类
敷贴必须成批提交检验,检验分逐批检验(出厂检验)和周期检验。
6.2 逐批检验
6.2.1敷贴的逐批检验按GB/T2828.1-2003的要求进行。
6.2.2 敷贴抽样方案采用一次抽样方案,其缺陷分类、检验项目、检验水平和接收质量限按表1的规定。
2
表1
缺陷分类A类B类
检验项目 4.3 4.1 4.2 4.4 4.5
检验水平ⅡⅡ
接收质量限 2.5 2.5
6.3 周期检验
6.3.1在下列情况之一时,一般应进行周期检验:
a)新产品投产前或产品注册时;
b)连续生产中每年不少于一次;
c)停产半年以上恢复生产时;
d)在设计、工艺或材料有重大改变时;
e)国家监督机构对产品质量进行监督检验时。
6.3.2周期检验按GB2829-2002规定进行,从逐批检验合格批中按规定抽取一定数量进行全性能检测。
采用一次抽样方案,其缺陷分类、检查项目、抽样方案和不合格质量水平(RQL)按表2的规定。
表2
缺陷分类A类B类
检查项目 4.3 4.6 4.1 4.2 4.4 4.5 RQL 15 40
抽样方案10[0,1] 12[3,4]
7标志、标签、包装
7.1标志
7.1.1小包装上应有下列标志:
a)产品名称;
b)生产单位名称;
c)使用说明。
7.1.2中包装上应有下列标志:
a)产品名称和型号;
b)生产单位名称;
c)产品注册号和本标准号;
d)生产批号和生产日期;
e)使用说明;
f)包装破损禁止使用说明或标识。
7.1.3外包装上应有下列标志:
a)产品名称,内装数量;
b)生产单位名称;
c)产品注册号和本标准号;
d)生产批号、有效期和灭菌日期;
f)箱体外型尺寸(长×宽×高cm);
g)“保持干燥、一次性使用、灭菌”等字样应符合YY0466-2003的规定。
7.2 标签
产品大包装中应附有产品质量检验合格证,合格证应有下列标志:
3
a)制造厂名称;
b)产品名称;
c)规格型号;
d)生产批号;
e)检验员代号;
f)生产日期。
7.3 包装
7.3.1 产品小包装为塑料袋或复合纸袋。
7.3.2 产品中包装为纸盒或塑料盒。
7.3.3产品外包装为瓦楞纸箱。
7.3.4外包装中放有产品质量合格证。
4
编制说明
一、产品概述
医用敷贴系由医用胶带、吸水垫、隔离膜、包装袋组成一体的医用敷料,国、内外已有多家企业生产,主要应用于伤口护创及医用导管固定等用。
该产品携带、使用方便,安全有效。
因没有统一的行业标准或国标,特制订本注册产品标准作为该产品生产、检验、销售的质量依据。
按国家食品药品监督管理局《医疗器械分类目录》规定。
医用敷贴为一类医疗器械。
二、主要指标确定依据
1、产品尺寸主要依据实际应用并参照其它同类产品而定,主要性能指标依据YY0148-2006、GB15980—1995制定。
2、因产品直接与创面接触,所以规定产品为无菌。
三、引用标准
GB/T2828.1-2003计数抽样检验程序第1部分:按接收质量限(AQL)检索的逐批检验抽样计划GB/T2829—2002 周期检验计数抽样程序及表适用于对过程稳定性的检验。
GB15980—1995 一次性使用医疗用品卫生标准
YY0148-2006医用胶带通用要求
YY0466-2003 医疗器械用于医疗器械标签、标记和提供信息的符号
5。
