类胡萝卜素的检验方法(中国螺旋藻联盟)
鉴定胡萝卜素的方法

鉴定胡萝卜素的方法
首先,最常见的鉴定胡萝卜素的方法之一就是紫外-可见分光光度法。
这种方
法是利用不同波长下胡萝卜素的吸收特性来进行鉴定。
通过测定样品在特定波长下的吸光度,可以得到胡萝卜素的含量。
这种方法简单、快速,且准确度较高,因此被广泛应用于食品加工和质量监控领域。
其次,色谱法也是一种常用的鉴定胡萝卜素的方法。
色谱法是利用样品在色谱
柱中的分离和吸附特性来进行鉴定。
通过比较待测样品与标准物质在色谱图谱上的保留时间和峰面积,可以准确地确定胡萝卜素的含量和种类。
这种方法需要专业的设备和操作技能,但其分析结果准确可靠,因此在科研领域得到了广泛应用。
另外,光谱法也是一种常见的鉴定胡萝卜素的方法。
光谱法是利用样品在特定
波长下的吸收、发射或散射特性来进行鉴定。
通过测定样品在紫外、可见、红外等光谱范围内的吸收特性,可以得到胡萝卜素的含量和结构信息。
这种方法操作简单,且对样品的要求较低,因此在食品行业得到了广泛应用。
最后,生化分析法也是一种重要的鉴定胡萝卜素的方法。
生化分析法是利用生
物学试剂和生化技术来进行鉴定。
通过测定样品在特定生化反应条件下的变化,可以准确地确定胡萝卜素的含量和种类。
这种方法需要专业的实验室设备和操作技能,但其分析结果准确可靠,因此在科研领域得到了广泛应用。
综上所述,鉴定胡萝卜素的方法有很多种,每种方法都有其特点和适用范围。
在实际应用中,可以根据具体的需求和条件选择合适的方法进行鉴定。
希望本文介绍的内容能够对相关领域的科研工作者和食品从业人员有所帮助。
类胡萝卜素的分析测定

『 肠
/ Q /
!l .. , p ( , .
L +pn y, e e () b
产
构有关, 是其分子结构特征。 同时各吸收峰的相对 峰高比率也能反映类胡萝 卜 累的结构和纯度。因 此. 紫外一 可见光吸收图谱也是鉴定类胡萝 卜 素种
1 类胡萝 卜 素的光化学特点
11类胡萝卜 . 素的基本结构
类胡萝 卜 素是由 8 个异戊二烯基本单位( 图
类胡萝 卜 素的光吸收主要取决于分子内的吸 光色素基团, 结构上的其它差异对光吸收的影响 相对较小。类胡萝 卜 素分子中的主要吸光色素基
2) a组合成的多烯链, 通过共I双键构成的一类化 f E 合物或其氧化衍生物[。 [ 可以认为, I ] 所有的类胡萝 卜 素是由 番茄红素(a ,见图2 ) Co s H, ()通过系列 b 酶促反应过程形成的, 主要的生物化学反应包括 加氢反应、 去氢反应、 环化反应、 加氧反应、 双键漂 移、 基位移、 甲 链延长或链缩短等U ]
构的类胡萝 卜 素有 6。 0 种之多, 如常常提到的虾 青素、 角黄素.一 n胡萝 卜 R胡萝 卜 叶黄素、 素、一 素、 多甲藻素、 八氢番茄红素、 王米黄质等都是类胡萝 卜 a 1如果包括异构体在内, 素fa -。 类胡萝 卜 素的家 族数量则更加庞大, R胡萝 卜 单就 一 素而言, 分子 式为Ca , 在结构上含 9 , e H , 个共扼双键组成的大二 键, 理论上有 23 7 种异构体, 由于甲基的存在和阻
Sp 20 e . 1 0
类 胡 萝 卜素 的 分 析 测 定
黄 健, ,刘建国“
(. 1 青岛教育学院生化系。山东 青而 267: 601
2 中国科学院海洋研究所生物技术研究发展中心,山东 青岛 267) 601
植物叶绿素类胡萝卜素测定方法

叶绿素、类胡萝卜素含量的测定一、原理根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。
根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL式中:α比例常数。
当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数.各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。
如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。
这就是吸光度的加和性。
今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。
在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。
二、材料、仪器设备及试剂(一)材料:新鲜(或烘干)的植物叶片。
(二)仪器设备:1)分光光度计;2)电子顶载天平(感量0.01g);3)研钵;4)棕色容量瓶; 5)小漏斗;6)定量滤纸;7)吸水纸;8)擦境纸;9)滴管.(三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉.暗中2h,0.5g,25ml三、实验步骤1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀.2)将取好的样品放入25ml容量瓶中,加混合浸提液(无水乙醇:丙酮=5:5)20ml,放在黑暗条件下,浸泡至叶片发白,用浸提试剂定容至25ml,摇匀备用。
3)把叶绿体色素提取液倒入1cm光径的比色皿内,以浸提试剂为空白测定吸光度。
选择波长663 646 和470nm.四、实验结果计算叶绿素a的浓度 = 12.21 ⨯ OD633 – 2。
81 ⨯ OD646叶绿素b的浓度 = 20.13 ⨯ OD646– 5。
植物类胡萝卜素含量检测试剂盒说明书 可见分光光度法

植物类胡萝卜素含量检测试剂盒说明书可见分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC4330规格:50T/48S产品简介:类胡萝卜素(carotenoid)是一类重要的天然色素的总称,普遍存在于动物、高等植物、真菌、藻类的黄色、橙红色或红色的色素之中。
类胡萝卜素是体内维生素A的前体,同时还具有抗氧化、免疫调节、抗癌、减轻心血管疾病及着色剂等作用。
植物的类胡萝卜素存在于各种黄色质体或有色质体内;如黄叶,黄色花卉,黄色和红色的果实和黄色块根等组织,样本通过溶剂萃取,分离提取类胡萝卜素,在440±10nm处有特殊吸收峰。
大部分高等植物和藻类微生物的叶绿体内也含有类胡萝卜素,类胡萝卜素主要吸收蓝紫光,而叶绿素a 和叶绿素b既吸收红光又可吸收蓝紫光。
所以针对含叶绿体的组织,为排除叶绿素a和叶绿素b对类胡萝卜素的干扰,根据经验公式先计算出叶绿素a和叶绿素b的含量,再进一步得出类胡萝卜素的含量;针对不含叶绿素的组织可以直接根据类胡萝卜素的经验消光系数进行计算试验中所需的仪器和试剂:可见分光光度计、台式离心机、1mL玻璃比色皿、天平、可调式移液枪、研钵/匀浆器、10mL离心管/试管、蒸馏水和丙酮。
产品内容:提取液:自备,80%丙酮,即将丙酮:蒸馏水(V:V)=4:1混合待用。
试剂一:粉剂×1瓶,4℃保存。
操作步骤:一、样本制备:1、新鲜植物叶片(去掉中脉)或其他组织用蒸馏水洗干净,然后吸干表面水分,称取约0.1g,剪碎放入研钵或匀浆器中。
2、加入1mL蒸馏水,少量试剂一(约10mg),在黑暗或弱光条件下充分研磨,转入10mL离心管或试管中。
3、用提取液冲洗研钵或匀浆器,将所有冲洗液转入10mL 离心管或试管中,用提取液定容至10mL,置于黑暗条件或者包上锡箔纸浸提3h (期间可以颠倒混合2次),观察底部组织残渣接近于白色则提取完全,若组织残渣未完全变白,继续浸提至组织残渣颜色接近于白色。
类胡萝卜素的测定方法

类胡萝卜素的测定方法(高效液相色谱法)本方法适用于各类食品中以羟基类胡萝卜素为主的多种类胡萝卜素的测定。
本方法最低检出量为:α-胡萝卜素为5ng/mL,β-胡萝卜素为 4.3ng/mL,γ-胡萝卜素为3.5ng/mL,番茄红素为2.7ng/mL,斑蝥黄素为1.0ng/mL。
1. 方法提要样品以丙酮-石油醚(1+1体积比)混合溶剂反复萃取使类胡萝卜素与其他成分分离,在450nm 波长条件下进行HPLC分析检测,通过外标法计算各种类胡萝卜素的含量。
2. 仪器(1)高效液相色谱仪。
(2)冷凝回流皂化装置。
(3)旋转蒸发仪。
(4)离心机(5000r/min)。
3. 试剂本方法所使用试剂除特殊注明外,均为分析纯;所用水为重蒸馏水。
(1)丙酮-石油醚(1+1体积比)混合溶剂:取相同体积的丙酮、石油醚混匀。
(2)50% KOH甲醇-水溶液:称取250g氢氧化钾,用50mL适量水溶解后,用甲醇定容至500mL容量瓶,备用。
(3)无水硫酸钠(Na-2SO4)。
(4)二丁基羟基甲苯(BHT)。
(5)无水乙醇(C2H5OH)。
(6)流动相使用液:按乙腈+二氯甲烷+甲醇(85+10+5)比例准确量取各溶剂,并充分混匀,经.45μm微孔膜过滤后使用。
(7)类胡萝卜素标样:α-胡萝卜素、β-胡萝卜素、γ-胡萝卜素、番茄红素、斑蝥黄素。
(8)标准溶液:准确称取α-胡萝卜素、β-胡萝卜素、γ-胡萝卜素、番茄红素、斑蝥黄素一定量,先分别用少量的乙酸乙酯溶解,再用甲醇配制成60~80ng/L的标准储备液(于-30℃冻箱保存),使用时再配成3.5~16.5mg/L的标准使用液。
4. 测定步骤(1)样品处理:a. 皂化提取法(如牛奶等脂肪含量较高的样品):取250L鲜牛奶于2℃、5000r/min冷冻离心30min,取上层油脂于250mL皂化瓶中,加入50mL乙醇、40mL 50% KOH甲醇溶液、0.1g BHT,65~75℃回流皂化30min,用石油醚反复提取皂化液,多次水洗至中性后用无水硫酸钠脱水,定容至25mL容量瓶中,备用。
类胡萝卜素的检验方法(中国螺旋藻联盟)

类胡萝卜素的检验方法(中国螺旋藻联盟)类胡萝卜素(以β-胡萝卜素计)的测定A.1.1 原理根据在碱性条件下,样品中其它色素及酯类可被皂化,可用水除去。
不被皂化的总类胡萝卜素,可溶于乙醚中,通过测定其特征吸光度计算含量。
A.1.2 试剂所用试剂均为分析纯试剂。
a)混合溶剂:正己烷、丙酮、乙醇、甲苯体积比为10:7:6:7。
b)乙醚c) 40%KOH甲醇溶液:20克KOH溶于少量水中,用甲醇定容于50ml。
d)无水硫酸钠A.1.3 仪器分光光度计、恒温水浴锅。
A.1.4 操作方法A.1.4.1 样品处理称取0.03g至0.05g(精确至0.0001g)样品于50ml的比色管中,加35ml混合溶剂(a)和1ml40%KOH溶液(c),35℃恒温水浴并避光超声2小时,将浸泡提取液倒入250ml的分液漏斗中;在浸泡过的样品中加入25ml蒸馏水,轻轻摇荡、静置,合并以上提取液,加入乙醚(b)50ml萃取,并于萃取液中加入100ml蒸馏水,轻轻摇荡、静置,弃去下层溶液,重复洗涤至少两次,萃取液经过10g的无水硫酸钠(d),收集于100ml容量瓶中,用乙醚(b)定容至刻度线。
A.1.4.2 测定以乙醚(b)作空白,用带塞的1cm玻璃比色皿在453.0nm处测定吸光度。
A.1.5 计算类胡萝卜素含量(g/kg)=A453.0×V×10G×E式中:A:波长为453.0nm处的吸光度;V:定容萃取溶液的体积,ml;G:样品重量(g);E:总类胡萝卜素的吸光系数(2500)。
A.1.6 检验结果报告保留两位有效数字。
本方法来源于《中国螺旋藻战略联盟食用螺旋藻行业标准》。
胡萝卜素检验标准
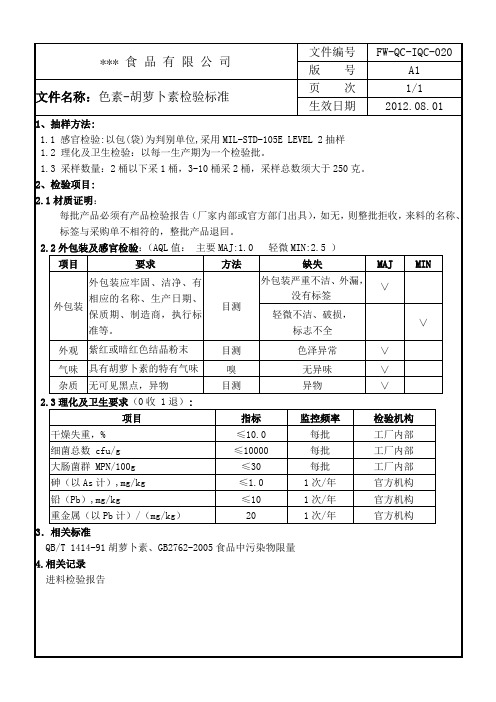
外包装严重不洁、外漏,没有标签
∨
轻微不洁、破损,
标志不全
∨
外观
紫红或暗红色结晶粉末
目测
色泽异常
∨
气味
具有胡萝卜素的特有气味
嗅
无异味
∨
杂质
无可见黑点,异物
目测
异物
∨
2.3理化及卫生要求(0收1退):
项目
指标
监控频率
检验机构
干燥失重,%
≤10.0
每批
工厂内部
细菌总数cfu/g
≤10000
每批
工厂内部
***食品有限公司
文件编号
FW-QC-IQC-020
版号
A1
文件名称:色素-胡萝卜素检验标准
页次
ห้องสมุดไป่ตู้1/1
生效日期
2012.08.01
1、抽样方法:
1.1感官检验:以包(袋)为判别单位,采用MIL-STD-105E LEVEL 2抽样
1.2理化及卫生检验:以每一生产期为一个检验批。
1.3采样数量:2桶以下采1桶,3-10桶采2桶,采样总数须大于250克。
2、检验项目:
2.1材质证明:
每批产品必须有产品检验报告(厂家内部或官方部门出具),如无,则整批拒收,来料的名称、标签与采购单不相符的,整批产品退回。
2.2外包装及感官检验:(AQL值:主要MAJ:1.0轻微MIN:2.5)
项目
要求
方法
缺失
MAJ
MIN
外包装
外包装应牢固、洁净、有相应的名称、生产日期、保质期、制造商,执行标准等。
大肠菌群MPN/100g
≤30
每批
工厂内部
砷(以As计),mg/kg
螺旋藻粉胡萝卜素含量测定方法的优化

文章编号:1673—2103(201205— 0030— 05螺旋藻粉B-胡萝卜素含量测定方法的优化*赵楠1,李勇勇1,邵明飞2,郁章玉1,3,秦松4(1 •曲阜师范大学化学与化工学院,山东曲阜273165;2 •南京农业大学资源与环境科学学院江苏省海洋生物学重点实验室,江苏南京210095;3 •菏泽学院化学与化工系,山东菏泽274015;4•中国科学院烟台海岸带研究所生物资源实验室,山东烟台264003摘要:采用可见分光光度法测定螺旋藻藻粉中B-胡萝卜素含量,并对测定过程中有关B—胡萝卜素的提取工艺进行了优化,确定了最佳工艺参数为:提取剂为v (正庚烷?V(丙酮?(无水乙醇?V (甲苯=10?7?6?7,提取剂体积为30mL ,浸提时间为12h,浸提温度为35?.在该工艺下测得螺旋藻藻粉的B—胡萝卜素含量为134. 15mg /100g.关键词:螺旋藻粉;阡胡萝卜素;含量;测定中图分类号:Q562文献标识码:A螺旋藻是丝状的多细胞蓝藻,具有很高的药用及营养价值,被联合国粮油组织推荐为“21 世纪最优秀的食品”.螺旋藻中B—胡萝卜素的含量非常丰富,所含的B—胡萝卜素达1700mg /kg (干重[1]•B-胡萝卜素是维生素A的前体物质,大量研究证实B-胡萝卜素是有效的抗氧化剂,能消除人体中的活性氧,消除自由基,在防癌[2]抗癌[3]、预防心血管疾病,增强免疫功能[4]等方面有明显作用[5]•螺旋藻粉中的B—胡萝卜素含量为所有食物之冠,比胡萝卜中的B—胡萝卜素含量还要高出10倍⑹•B—胡萝卜素作为螺旋藻综合开发利用的一种功能因子,有很大的商业化前景•因此,有关螺旋藻中B—胡萝卜素成分的研究和测定方法倍受重视•目前常用的测定p-胡萝卜素含量的方法有纸层析法、分光光度法和高效液相色谱法[7,8]•由于高效液相色谱法样品的前处理较为麻烦且所需仪器昂贵,所以还未能广泛普及•而纸层析法步骤比较繁琐,故本文采用分光光度法进行螺旋藻粉B-胡萝卜素含量的测定,并对该方法操作条件进行优化•1材料与方法材料螺旋藻粉,2011年12月份购于广西,置于阴凉抽屉中避光保存.1. 2试剂与仪器仪器:恒温水浴锅,上海福玛试验设备有限公司产品;电子分析天平,上海舜宇恒平科学仪器有限公司产品;TU - 1901紫外可见分光光度计,北京普析通用有限责任公司产品;50mL具塞比色管,分液漏斗等.试剂:标准B—胡萝卜素(Sigma公司产品,质量分数〉97%,无水硫酸钠、正庚烷、丙酮、无水乙醇、甲苯、乙酸乙酯、氯仿、甲醇、石油醚均为国产分析纯.1. 3B-胡萝卜素最大吸收波长的测定及标准曲线的绘制[5]取一定量的胡萝卜素标准品,溶解在石油醚中,在波长300 600nm范围内,用紫外可见分光3第34卷第5期Vol . 34No. 5菏泽学院学报Journal of Heze University 2012年10 月Oct. 2012*收稿日期:2012- 10- 09基金项目:国家海洋公益性行业科研专项经费项目(201205027国家海洋公益性行业科研专项经费项目(200905021—3;山东省自然科学基金资助项目(JQ200914山东省自然科学基金资助项目(ZR2012DQ015作者简介:赵楠(1987—,女,山东临沂人,在读硕士研究生,研究方向:分析化学.有障玉(I960—,男,山东临沂人教授,博士生导师,研究方向:生命电分析化学•秦松(1968—,男,山东莱州人,研究员,博士生导师,研究方向:海岸带生物技术.光度计进行波谱扫描,得到B-胡萝卜素的特征吸收峰,作为B-胡萝卜素的测定波长.准确称取2. 50mg3—胡萝卜素标准品,溶于石油醚,并定容于100mL棕色容量瓶中,配制成25ug/mL的B—胡萝卜素标准溶液,分别吸取0. 2,0. 4,0. 6,0. 8,1. 0mL于5个10mL棕色容量瓶中,用石油醚定容,以石油醚为参比溶液,在450nm处测定各样品的吸光度,并绘制标准曲线.1. 4样品的测定准确称取0. 2g左右的螺旋藻藻粉于50mL的比色管中加入30mL提取剂和1mL 质量浓度为400g/L的KOH溶液,混合均匀;比色管放于35?恒温水浴中浸泡12h后,将浸泡液过滤,滤液倒入内盛50mL的20g/L硫酸钠溶液的250mL分液漏斗中,用10mL提取剂冲洗滤渣,重复两次,将洗液、过滤液收集到分液漏斗中.向分液漏斗中加入30mL乙醚及100mL蒸馏水,振摇后静置分层,弃去下层溶液,上层溶液再重复萃取两次.萃取所得上层溶液通过一装有10g无水硫酸钠的小漏斗滤入100mL棕色容量瓶中,用少量石油醚洗涤分液漏斗,并洗去无水硫酸钠表面的色素,定容至刻度线,摇匀,用分光光度计测定其在450nm处的吸光度.1. 5提取剂在50mL具塞比色管中加入0. 2g螺旋藻粉后再分别加入30mL下列溶液:V(正庚烷?V(丙酮?V(无水乙醇?V(甲苯=10?7?6?7;V (石油醚?V(丙酮=1?1;V(甲醇?V(石油醚=2?1;乙酸乙酯;V(石油醚?V(丙酮=4?1;V (丙酮?V(氯仿=1?2;V(丙酮?V(甲醇=7?2;石油醚.其余步骤按1. 4所述步骤进行操作.1. 6浸提温度在50mL具塞比色管中加入0. 2g螺旋藻粉、30mL最佳提取剂后,分别于25,35,45,55,65, 75?恒温水浴中浸泡12h,其余步骤按1. 4所述步骤进行操作.1. 7提取剂体积在50mL具塞比色管中加入0. 2g螺旋藻粉后,再分别加入15,20,25,30,35,40mL 最佳提取剂,于最佳浸提温度恒温水浴中浸泡12h其余步骤按1. 4所述步骤进行操作.1. 8浸提时间在50mL具塞比色管中加入0. 2g螺旋藻粉、最佳提取剂体积的提取剂后,于最佳温度恒温水浴中,分别密封避光浸泡2,4,6,8,10,12h其余步骤按1. 4所述步骤进行操作.1. 9正交试验设计采用L9(33正交试验表,以V(正庚烷?V(丙酮?V(无水乙醇?V(甲苯=10?7?6?7为提取剂,选取浸提温度、提取剂体积、浸提时间3个因素,每个因素取3个水平,其因素水平见表1.表1L9(33正交试验的因素水平水平A浸提温度/?B提取剂体积/mL C浸提时间/h 125258235301034540122结果与分析2. 1 p-胡萝卜素的吸收光谱及标准曲线图B—胡萝卜素的吸收光谱,如图1所示•从图1可见,—胡萝卜素在波长300 600nm范围内有两处较大的吸收峰,其中在450nm处吸收峰值最大,是B—胡萝卜素的特征吸收峰,本试验选择450nm作为阡胡萝卜素的测定波长Alflgbhblip-.1 'Hww ■didLLiMlMtdf 耳Imui E图1 B—胡萝卜素光谱扫描曲线B—胡萝卜素的质量浓度(p在0 2. 5ug/mL范围内与吸光度值(A呈现很好的线性关系,如图2所示.其标准曲线公式为:A=0 . 3089p—0. 0088, r2=0. 999ChhnAllMhiriwt I low.■.J FWW jeribLnil1*4-101 Tl lMWtniN' Iwni* fJiKWnwfl:-Hr(4*n-■fl.t5.图2 B—胡萝卜素的标准曲线132012年赵楠,等:螺旋藻粉B-胡萝卜素含量测定方法的优化第5期2. 2提取剂对B-胡萝卜素含量测定的影响各提取剂对胡萝卜素含量测定的影响见表2.由表2知,V(正庚烷?V(丙酮?V (无水乙醇?V(甲苯=10?7?6?7为最佳提取剂,其提取到的胡萝卜素含量测定最高,以下实验中均以此为提取剂.表2提取剂对B-胡萝卜素含量测定的影响提取剂B—胡萝卜素测定含量/(mg/100g标准偏差V(正庚烷?V(丙酮?V(无水乙V(甲苯=10?7?6?7134. 51?). 869 V(石油醚?V(丙酮=1?198. 75?). 800 V(甲醇?V(石油醚=2?178. 97?1. 640乙酸乙酯119. 7?1. 253 V(石油醚?V(丙酮=4?185. 85?1. 523 V(丙酮?V(氯仿=1?294. 42?1. 406 V(丙酮?V(甲醇=7?291. 69?2. 193 石油醚125. 83?3. 1872. 3浸提温度对胡萝卜素含量测定的影响随着浸提温度的升高,,胡萝卜素的测定含量呈先增大后减小的趋势,见表3.当恒温水浴温度为35?时,卜胡萝卜素测定的含量最大,为134. 15mg/100g.此后随着恒温水浴温度的升高,,胡萝卜素的测定含量开始平缓地减小.这表明适当地提高浸提温度可提高胡萝卜素的测定含量,过高的温度可能会影响B-胡萝卜素的稳定性,可能会使阡胡萝卜素发生降解而被破坏,使得阡胡萝卜素的测定含量较低.表3浸提温度对B-胡萝卜素含量测定的影响浸提温度/?旷胡萝卜素测定含量/(mg/100g标准偏差25125. 79?3. 463 35134. 15?0. 869 45127. 59?0. 723 55118. 36?1. 562 65121. 56?2. 785 75109. 89?1. 2602. 4提取剂体积对B—胡萝卜素含量测定的影响当提取剂体积为30mL时提取效果较好,此时提取物中的f—胡萝卜素的测定含量达到最高值,见表4.试验表明,提取剂的体积过大或过小,都不利于f—胡萝卜素的提取,因此30mL为最佳提取剂体积.表4提取剂体积对f—胡萝卜素含量测定的影响提取剂体积/mL f-胡萝卜素测定含量/(mg/100g标准偏差15113. 88辺.10920118. 34?3. 06925118. 78?5. 21230134. 5170. 86935116.517. 65440121. 8772. 698232012年菏泽学院学报第5期2. 5浸提时间对胡萝卜素含量测定的影响当浸提时间为12h时,浸提效果最好,此时提取物中的3-胡萝卜素测定含量达到最高值为134. 15mg/100g见表5.浸提时间过短,不利于3-胡萝卜素的充分溶出.随着浸提时间的延长,-胡萝卜素测定含量逐渐增大.表5浸提时间对3—胡萝卜素含量测定的影响浸提时间/h —胡萝卜素测定含量/(mg/100g标准偏差2109. 17?2. 3274111. 85辺.613 6115. 11?2. 023 8117. 04?2. 544 10126. 4271. 732 12134. 5170. 8692. 6正交设计优化提取工艺3—胡萝卜素含量测定的正交试验结果见表6.由表6可知,影响3—胡萝卜素含量测定的因素依次为:浸提温度〉提取剂体积〉浸提时间,最佳提取工艺为A2B2C3,即以V(正庚烷?V(丙酮?V(无水乙醇?V(甲苯=10777677为提取剂,提取剂体积为30mL,浸提时间为12h,浸提温度为357.表6L(33正交试验结果与分析试验号A浸提温度/?B提取剂体积/mL C浸提时间/h阡胡萝卜素含量/(mg/100g 111199. 20212297.773133103.284212105.675223126.42623112187.731397.458321108.03933295.82K1100. 08100. 77109. 70K2117. 99110. 7499. 75K100. 43106. 99109. 05R17. 919. 979. 95优水平A2B2C3主次因素A > B >C3讨论与结论1 3-胡萝卜素易被氧化,见光易分解,故本试验须在遮光条件下进行.样品在提取过程中,遮光条件下浸泡12h,在一定程度上减少了3-胡萝卜素的损失,从而提高了3—胡萝卜素的测定含量.2通过正交试验得出,提取3-胡萝卜素的最佳工艺条件为:V(正庚烷?V(丙酮?V(无水乙332012年赵楠,等:螺旋藻粉3-胡萝卜素含量测定方法的优化第5期醇?V(甲苯=10?7?6?7为提取剂,提取剂体积为30mL,35?下浸提12h;在最佳工艺条件下3—胡萝卜素的测定含量为134. 5mg/100g.3本试验方法简单,实验所需仪器均较为普通,便于企业生产过程对3-胡萝卜素进行快速检测及监控.参考文献:[1] 王文博.螺旋藻的生物活性成分分析及其免疫特性研究[D].呼和浩特:内蒙古农业大学,2009.[2] 赵文恩,韩雅珊,苏震,等.类胡萝卜素对H202—NaCIO体系生成的102的淬灭作用[J].生物物理学报,1997,13(1:137—142.[3] Gregory G K,Chen T S,Philip T. Quantitative analysis of lutein esters in marigold flowers(Tagetes erectaby high performanee liquid chromatography[J]. Food Sci,1986,51(4:1093—1095.[4] 房明.螺旋藻p-胡萝卜素的提取及生物活性研究进展[J].现代农村科技,2012,(1:70- 71.⑸李新,安鑫南,刘震.胡萝卜素原料筛选及其超临界二氧化碳萃取[J].南京林业大学学报,1999,23(3: 37—40.[6] 郑静.螺旋藻化学成分及其生物活性研究[J].科技信息,2009,(7:25—27.[7] 赵厚民,徐慧,周小平.螺旋藻中B—胡萝卜素高效液相色谱测定方法的研究[J].中国野生植物资源,2005,24(3:43 —45.[8] 卢红梅,梁逸曾.高效液相色谱法测定食物中的类胡萝卜素[J].色谱,2005,23(1:57—62.The Optimizati on of Method for Determ in ati onof 3- carotene from Spirulina PowderZHAO Nan 1丄I Yong —yong1,SHAO Ming —fei2,YU Zhang —yu1,3,QIN Song4(1. College of Chemistry and Chemical Engineering,Qufu Normal University,Qufu Sha ndo ng273165,Chi na;2. Key Laboratory of Marine Biology in Jiangsu,College of Resources andEn vir onmen tal Scie nces,Nanjing Agricultural University,Nanjing Jangsu210095,China;3. Department of Chemistry and Chemical Engineering,Heze University,Heze Sha ndon g274015,Chi na;4. Biological Resources Laboratory,Yantai Institute of Coastal Zone Research,Chi nese Academy of Scie nces,Ya ntai Sha ndo ng264003,Chi naAbstract:I n this paper,the beta- carote ne of Spiruli na Powder was determ ined by UV —visible spectropho-tometry. The process for the extraction of bet—carotene was optimized as followed:n —hepta ne?acet on e?etha-nol ?toluene=10?7?6?7as extracti on age nt,extracti on solve nt volume30mL,the extract ion time12h,extrac-ti on temperature35?Key words:Spiruli na Powder;Beta— carote ne;c onten t;determ ine2012年菏泽学院学报第5期。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
类胡萝卜素(以β-胡萝卜素计)的测定
A.1.1 原理
根据在碱性条件下,样品中其它色素及酯类可被皂化,可用水除去。
不被皂化的总类胡萝卜素,可溶于乙醚中,通过测定其特征吸光度计算含量。
A.1.2 试剂
所用试剂均为分析纯试剂。
a)混合溶剂:正己烷、丙酮、乙醇、甲苯体积比为10:7:6:7。
b)乙醚
c) 40%KOH甲醇溶液:20克KOH溶于少量水中,用甲醇定容于50ml。
d)无水硫酸钠
A.1.3 仪器
分光光度计、恒温水浴锅。
A.1.4 操作方法
A.1.4.1 样品处理
称取0.03g至0.05g(精确至0.0001g)样品于50ml的比色管中,加35ml混合溶剂(a)和1ml40%KOH溶液(c),35℃恒温水浴并避光超声2小时,将浸泡提取液倒入250ml的分液漏斗中;在浸泡过的样品中加入25ml蒸馏水,轻轻摇荡、静置,合并以上提取液,加入乙醚(b)50ml萃取,并于萃取液中加入100ml蒸馏水,轻轻摇荡、静置,弃去下层溶液,重复洗涤至少两次,萃取液经过10g的无水硫酸钠(d),收集于100ml容量瓶中,用乙醚(b)定容至刻度线。
A.1.4.2 测定
以乙醚(b)作空白,用带塞的1cm玻璃比色皿在453.0nm处测定吸光度。
A.1.5 计算
类胡萝卜素含量(g/kg)=A453.0×V×10
G×E
式中:A:波长为453.0nm处的吸光度;
V:定容萃取溶液的体积,ml;
G:样品重量(g);
E:总类胡萝卜素的吸光系数(2500)。
A.1.6 检验结果报告
保留两位有效数字。
本方法来源于《中国螺旋藻战略联盟食用螺旋藻行业标准》。
