有机化学第2章 烷烃和环烷烃
合集下载
第二章烷烃和环烷烃
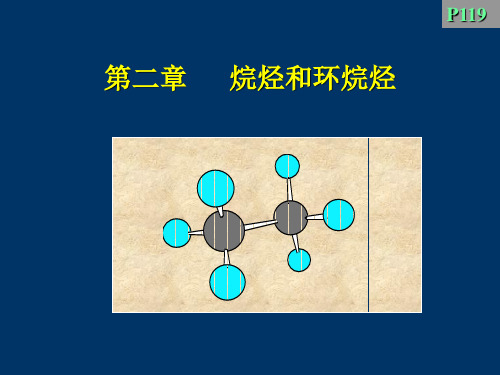
致分子中原子或基团在空间的排列方式不同而产 生的立体异构现象——构象异构。这种空间排列 方式——构象 conformation
(1)乙烷的构象
H3C CH 3
当C-C键旋转时, 可产生无数个构象
有两种典型conformation:
乙烷的两种典型构象的表示方法
优势构象
交叉式 staggered
H
重叠式 eclipsed
作业:P130 /1, 6, 7 ,8; P105 / 8(3) (4) *C2-C3键旋转 阅读Section 1. Alkanes and Cycloalkanes 全文
翻译 1.1第一段,1.2.2第一段,1.2.3 第四段
CH3 CH3 CH C Br
CH3 CH3
四、环烷烃的异构现象
1. 顺反异构 cis-trans isomer (P84) 环烷烃环中C-C单键受环约束不能自由旋转,导致产生顺反异构
HH
H
CH 3
CH 3 CH 3
顺-1,2-二甲基环丙烷
CH 3 H
反-1,2-二甲基环丙烷
练习:写答出案: 1-甲基-3-乙H基环己烷的顺反异构体CH 3
伯碳(1°):一级碳原子,只与1个其他碳原子直接相连
仲碳(2°):二级碳原子,只与2个其他碳原子直接相连
叔碳(3°):三级碳原子,只与3个其他碳原子直接相连
季碳(4°):四级碳原子,只与4个其他碳原子直接相连
CH3
CH3
H3C
C CH2
3° 2°
H
伯氢(1°H):伯碳上的H
仲氢(2°H):仲碳上的H
练习:预测2-甲基丁烷在室温下进行氯代反应所得的一氯代物
Cl
答 案 : C3 C H H C2C H H 3 +C 2l 光 C3 C H C2 C H H 3
(1)乙烷的构象
H3C CH 3
当C-C键旋转时, 可产生无数个构象
有两种典型conformation:
乙烷的两种典型构象的表示方法
优势构象
交叉式 staggered
H
重叠式 eclipsed
作业:P130 /1, 6, 7 ,8; P105 / 8(3) (4) *C2-C3键旋转 阅读Section 1. Alkanes and Cycloalkanes 全文
翻译 1.1第一段,1.2.2第一段,1.2.3 第四段
CH3 CH3 CH C Br
CH3 CH3
四、环烷烃的异构现象
1. 顺反异构 cis-trans isomer (P84) 环烷烃环中C-C单键受环约束不能自由旋转,导致产生顺反异构
HH
H
CH 3
CH 3 CH 3
顺-1,2-二甲基环丙烷
CH 3 H
反-1,2-二甲基环丙烷
练习:写答出案: 1-甲基-3-乙H基环己烷的顺反异构体CH 3
伯碳(1°):一级碳原子,只与1个其他碳原子直接相连
仲碳(2°):二级碳原子,只与2个其他碳原子直接相连
叔碳(3°):三级碳原子,只与3个其他碳原子直接相连
季碳(4°):四级碳原子,只与4个其他碳原子直接相连
CH3
CH3
H3C
C CH2
3° 2°
H
伯氢(1°H):伯碳上的H
仲氢(2°H):仲碳上的H
练习:预测2-甲基丁烷在室温下进行氯代反应所得的一氯代物
Cl
答 案 : C3 C H H C2C H H 3 +C 2l 光 C3 C H C2 C H H 3
有机化学第章烷烃和环烷烃

脂环烃:碳原子之间相互连成环,其性质类似链烃 的碳氢化合物。
脂环烃
饱和脂环烃,又称环烷烃,通式:CnH2n
不饱和脂环烃
环烯烃 环炔烃
单环脂环烃:分子中只有1个碳环。 环丙烷
环丁烷
分子中含有两个或两个以上碳环结构的脂环烃称为双环或 多环脂环烃。
两个碳环共用一个碳原子的脂环烃,称为螺环烃(spiro hydrocarbon)。“螺”字表示两个碳环只共用一个碳原子,此 碳原子称为螺原子。
Alkyl group names are obtained by removing the –ane from the alkane name , and replacing it with -yl
中文名 英文名 中文名 英文名 甲烷 methane 甲基 methyl 乙烷 ethane 乙基 ethyl 丙烷 propane 丙基 propyl 丁烷 butane 丁基 butyl
2. 编号:从第一桥头(共用碳原子)开始,沿最长桥路到第二桥 头,再沿次长桥路回到第二桥头,然后编最短的桥路。(先编大 桥,再编小桥)。取代基的位置最小。
3.命名: 某基二环[n.m.p]某烷。 n.m.p---指各桥路上碳原子数。
2 1
3
7
4
6
5
8 6
4 5
7 1
2
3
1-甲基二环[4.1.0]庚烷
Homolog
同系物: 同系列中各化合物互称同系物。
同系列差:相邻两个同系物在组成上的不变差数 CH2。
烷烃中的伯、仲、叔、季碳原子。
伯碳原子:只与1个碳原子直接相连的碳原子。 (primary) 也称一级碳原子,以1° 表示。 仲碳原子:只与2 个碳原子直接相连的碳原子。 (secondary) 也称二级碳原子,以2 ° 表示。 叔碳原子:只与3 个碳原子直接相连的碳原子。 (tertiary) 也称三级碳原子,以3 ° 表示。 季碳原子:与4个 碳原子直接相连的碳原子。 (quaternary) 是四级碳原子,以4 ° 表示。
第二章 烷烃和环烷烃

第二节 同系列和同分异构现象
一、同系列和同系物 • 烷 烃 的 分 子 通 式 为 CnH2n+2 , 环 烷 烃 的 分 子 通 式 为 CnH2n。 • 凡是具有同一分子通式和相同结构特征的一系列化合 物称为同系列(homologous series)。 • 同系列中的化合物互称同系物(homolog)。 • 同系物具有相似的化学性质,物理性质也随着碳链的 增长而表现出有规律的变化。
第 二 章 烷烃 环烷烃
exit
烃(hydrocarbons):
只含有C、H 两种元素的化合物 —— 碳氢化合物
碳原子之间均以C-C单键相连,其 余的价键均为H原子所饱和。 (saturated 烷烃 (alkanes) :甲烷、乙烷等; hydrocarbons) 环烷烃(cycloalkanes):
三级戊基 (Tert or t )
三级丁基 叔丁基
新戊基 (neo)
*3 有机化合物系统命名的基本格式
构型 +
R, S; D, L; Z, E; 顺,反
取代基
+
母体
官能团位置号 +名称
取代基位置号 + 个数 + 名称
(有多个取代基时,中文按顺 (没有官能团时 序规则确定次序,较优的在后。 不涉及位置号) 英文按英文字母顺序排列)
(1) 直链烷烃的命名: 含10个碳原子以内的直链烷烃, 从1-10依次用 天干名称甲、乙、丙、丁、戊、己、庚、辛、壬、 癸加上烷来命名; 而含碳原子10个以上的直链烷烃, 用数目加上烷来命名(P27) 。
(2) 支链烷烃的命名 *1 碳原子的级
CH3 H3C C CH3 CH2 CH3 CH
1oH 2oH 3oH
有机化学课件第-二-章烷烃和环烷烃_图文

熔点高低取决于分子间的作用力 和晶格堆积的密集度。
烷烃熔点的特点 (1) 随相对分子质量增大
而增大。 (2) 偶数碳烷烃比奇数碳
烷烃的熔点升高值 大 (如右图)。 (3)相对分子质量相同的烷 烃,叉链增多,熔点 下降。
偶数碳 奇数碳
(二) 沸点
沸点大小取决于分子间的作用力
烷烃沸点的特点
(1)沸点一般很低。 (非极性,只有色散力)
H2O2 + Fe2+
RCOO-
-e-
电解
HO• + HO- + Fe3+ RCOO •
自由基的稳定性
均裂 H=359.8kJ/mol (88kcal/mol) 共价键均裂时所需的能量称为键解离能。 键解离能越小,形成的自由基越稳定。
苯甲基自由基
稀丙基自由基 三级丁基自由基 异丙基自由基
乙基自由基 甲基自由基 苯基自由基
Hammond假设:过渡态总是与能量相近 的分子的结构相近似。
甲烷氯代反应势能图
甲烷氯代反应势能图的分析
1、第一步反应的活化能比较大,是速控步骤。 2、第二步反应利于平衡的移动。 3、反应 1 吸热,反应 2 放热,总反应放热,所以反应 只需开始时供热。 4、过渡态的结构与中间体(中间体是自由基)相似, 所以过渡态的稳定性顺序与自由基稳定性顺序一致。 推论:3oH最易被取代,2oH次之,1oH最难被取代。
甲烷氯代反应的适用范围
1、 该反应只适宜工业生产而不适宜实验室制备。 2 、该反应可以用来制备一氯甲烷或四氯化碳,不适 宜制备二氯甲烷和三氯甲烷。 3、无取代基的环烷烃的一氯代反应也可以用相应方法 制备,C(CH3)4的一氯代反应也能用此方法制备。
(2) 甲烷卤代反应活性的比较
烷烃熔点的特点 (1) 随相对分子质量增大
而增大。 (2) 偶数碳烷烃比奇数碳
烷烃的熔点升高值 大 (如右图)。 (3)相对分子质量相同的烷 烃,叉链增多,熔点 下降。
偶数碳 奇数碳
(二) 沸点
沸点大小取决于分子间的作用力
烷烃沸点的特点
(1)沸点一般很低。 (非极性,只有色散力)
H2O2 + Fe2+
RCOO-
-e-
电解
HO• + HO- + Fe3+ RCOO •
自由基的稳定性
均裂 H=359.8kJ/mol (88kcal/mol) 共价键均裂时所需的能量称为键解离能。 键解离能越小,形成的自由基越稳定。
苯甲基自由基
稀丙基自由基 三级丁基自由基 异丙基自由基
乙基自由基 甲基自由基 苯基自由基
Hammond假设:过渡态总是与能量相近 的分子的结构相近似。
甲烷氯代反应势能图
甲烷氯代反应势能图的分析
1、第一步反应的活化能比较大,是速控步骤。 2、第二步反应利于平衡的移动。 3、反应 1 吸热,反应 2 放热,总反应放热,所以反应 只需开始时供热。 4、过渡态的结构与中间体(中间体是自由基)相似, 所以过渡态的稳定性顺序与自由基稳定性顺序一致。 推论:3oH最易被取代,2oH次之,1oH最难被取代。
甲烷氯代反应的适用范围
1、 该反应只适宜工业生产而不适宜实验室制备。 2 、该反应可以用来制备一氯甲烷或四氯化碳,不适 宜制备二氯甲烷和三氯甲烷。 3、无取代基的环烷烃的一氯代反应也可以用相应方法 制备,C(CH3)4的一氯代反应也能用此方法制备。
(2) 甲烷卤代反应活性的比较
第二章 饱和烃:烷烃和环烷烃

3
5
CH
3
HC CH
4
CH
烷烃:饱和开链烃。 特征:C与C以单键相连,其余价键都为氢原子饱和。 通式为:CnH2n+2
环烷烃:饱和环烃。 特征:C与C以单键相连成环,其余价键都为氢 原子饱和。 通式为:CnH2n (单环烷烃)
烷烃和环烷烃统称为饱和烃
烷烃和环烷烃主要存在于石油和天然气中, 天然气主要由甲烷以及少量的乙烷、丙烷和丁烷 组成。石油是一种复杂混和物,主要是含1到40个 碳原子的烃,通过精馏可以将石油分离成沸点不 同的有用馏分。 天然气: 汽油: 煤油: 柴油: 沥青: CH4~C4H10 C5H12~C12H26 C12H26~16H34 C15H32~C18H38 C20以上
烷基自由基
伯
仲
叔
烷基自由基的类型
烷基自由基的结构
烷基自由基的稳定性:叔〉仲〉伯
烷基自由基的稳定性与C-H的均裂能有关:
CH3CH2CH2-H
离解能 (kJ/mol) 410
(CH3)2CH-H (CH3)3C-H
397 381
在烷烃氯化反应中,产生烷基自由基的步骤 是整个反应中最困难的一步。是控制反应速度的 步骤。生成的烷基自由基越稳定,所需的活化能 越小,反应越容易。
CH3CH2CH2CH2CH2CH3
正己烷
(CH3)2CHCH2CH2CH3
异己烷
(CH3)3CCH2CH3
新己烷
• 系统命名法:
采用IUPAC(International Union of Pure and Applied Chenistry)国际纯粹与应用化学联合会的命 名原则,结合我国文字特点制定的。
键旋转引起的位能变化曲线
第二章 烷烃和环烷烃
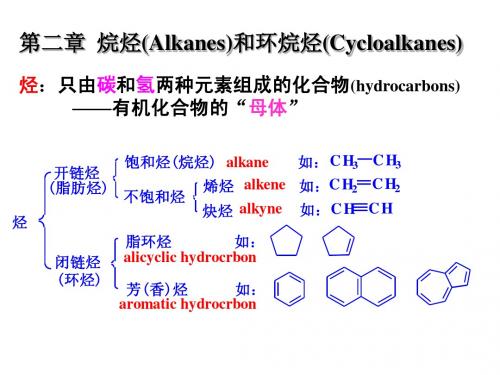
CH3 甲基 Me (正)丙基 Pr C H3C H2 乙基 Et i -Pr C H3C HC H 异丙基 3
C H3C H2C H2 C H3C H2C H2C H2 C H3C HC H 2 C H3
(正)丁基 Bu 异丁基 i -Bu
C H3C HC H C H3 仲丁基 2 s-Bu C H3 C H3 C C H3 叔丁基 t-Bu
在生理状况下,机体自由基一方面不断产 生,另一方面又不断清除,活性氧处于产生与清 除平衡状态。一旦活性氧的产生和清除失去平衡 ,过多的自由基就会造成对机体的损害,从而引 起多种疾病,并可诱发癌症和导致衰老。 天然抗氧化酶系统:超氧化物歧化酶(SOD) 、 过 氧 化 氢 酶 ( CAT)、 谷 胱 甘 肽 过 氧 化 物 酶 (GSH-Px)
构象异构
(一) 烷烃的构造异构(constitutional isomerism)
戊烷有3种碳链异构体
CH3 CH3CH2CH2CH2CH3 CH3CHCH2CH3
正戊烷 异戊烷
CH3 CH3-C-CH3 CH3
新戊烷
碳原子数 异构体数 4 5 6 7 2 3 5 9
碳原子数 8 9 10 20
异构体数 18 35 75 366 319
天然抗氧剂(自由基清除剂):VE、 Vc、 2巯基乙胺、谷胱甘肽、辅酶Qn(泛醌)、-硫辛酸 等
第二节 环 烷 烃
一、脂环烃的分类和命名
(一) 分类 C3-C4
根 据 环 数 多 少 分
小环 普通环
单脂环烃
C5-C6
C7-C12
中环
C13以上 大环 多脂环烃 桥环 螺环
(二) 命名
1. 单脂环烃: 在相应的烃名前加“环”字;英文名加词头cyclo
C H3C H2C H2 C H3C H2C H2C H2 C H3C HC H 2 C H3
(正)丁基 Bu 异丁基 i -Bu
C H3C HC H C H3 仲丁基 2 s-Bu C H3 C H3 C C H3 叔丁基 t-Bu
在生理状况下,机体自由基一方面不断产 生,另一方面又不断清除,活性氧处于产生与清 除平衡状态。一旦活性氧的产生和清除失去平衡 ,过多的自由基就会造成对机体的损害,从而引 起多种疾病,并可诱发癌症和导致衰老。 天然抗氧化酶系统:超氧化物歧化酶(SOD) 、 过 氧 化 氢 酶 ( CAT)、 谷 胱 甘 肽 过 氧 化 物 酶 (GSH-Px)
构象异构
(一) 烷烃的构造异构(constitutional isomerism)
戊烷有3种碳链异构体
CH3 CH3CH2CH2CH2CH3 CH3CHCH2CH3
正戊烷 异戊烷
CH3 CH3-C-CH3 CH3
新戊烷
碳原子数 异构体数 4 5 6 7 2 3 5 9
碳原子数 8 9 10 20
异构体数 18 35 75 366 319
天然抗氧剂(自由基清除剂):VE、 Vc、 2巯基乙胺、谷胱甘肽、辅酶Qn(泛醌)、-硫辛酸 等
第二节 环 烷 烃
一、脂环烃的分类和命名
(一) 分类 C3-C4
根 据 环 数 多 少 分
小环 普通环
单脂环烃
C5-C6
C7-C12
中环
C13以上 大环 多脂环烃 桥环 螺环
(二) 命名
1. 单脂环烃: 在相应的烃名前加“环”字;英文名加词头cyclo
第2章 烷烃、环烷烃

第二章 烷烃、环烷烃
2.2.2 烷烃、环烷烃的同分异构现象 二、环烷烃的异构现象 2.顺反异构 1,2-二甲基环丁烷、1,4-二甲基环己烷的顺反异构如下:
顺-1,2-二甲基环丁烷
反-1,2-二甲基环丁烷
顺- 1,4-二甲基环己烷
反-1,4-二甲基环己烷
当环上的取代基增多时,顺反异构体的数目也相应增加。
CH2 CH3
CH2
CH3
正丁烷 ( b.p. -0.5℃)
CH3 CH CH3
异丁烷 (b.p. –10.2℃)
CH3 CH3 CH2 CH2 CH2 CH3
正戊烷(b.p. 36.1℃)
CH3 CH3 C CH3 CH3
CH3 CH CH2 CH3
新戊烷(b.p. 9.5℃)
异戊烷(b.p. 28℃)
(a)交叉式构象
(b)重叠式构象
透视式好像锯木架,故也叫锯架式。纽曼式投影式是从C—Cσ键的延长线上 观察,两个碳原子在投影式中处于重叠位置,用 近的碳原子及其三个键,用 表示距离观察者较
表示距离观察者较远的碳原子及其上的
三个键。每一个碳原子上的三个键,在投影式中互呈120°角。
第二章 烷烃、环烷烃
第二章 烷烃、环烷烃
2.2 烷烃、环烷烃同分异构现象和命名
2.2.1 烷烃、环烷烃的通式
甲 烷 分 子 式 CH4 H 结构式 H C H 碳 数 氢 数 H H 乙 烷 C2H6 H C H H C H H H H C H 丙 烷 C3H8 H H C C H H H C H 丁 烷 C4H10 H H C C H C H H
` `
` `
... ... )
CH3
... ... )
第二章饱和烃:烷烃和环烷烃

7CH 1 2
2
CH
8CH
CH2
3CH2
7
1
2
6CH2
CH
5
CH2
4
式中两环共用的叔碳原子(1,5)称为“桥头”
从一个桥头到另外一个桥头的链或键称为“桥”或―桥路‖
此例中有三个桥,即碳链2-3-4,碳链6-7和碳链8
29
命名原则
确定母体名称:按成环碳原子的总数称为“某烷”。 注明环数:以“二环”作词头,放在母体名称前面。 注明桥的结构:将各桥所含碳原子数按由多到少的次 序用数字表示,放在词头和母体之间的方括号中,在数 字之间的右下角用小圆点“.”隔开。 编号:从一个桥头开始循环最长的桥编到另一桥头, 然后再循余下的最长的桥编回到起始桥头。最短的桥最 后编号,且仍从起始桥头一端的碳原子开始编号。
18
例如
CH3 CH CH3 CH2 CH3
二甲基乙基甲烷
CH2CH3 CH3 C CH CH3
二甲基乙基异丙基甲烷
CH3 CH3
该命名法虽能清楚地表示分子的结构,但是不能 适用于结构较复杂的烷烃的命名。目前文献中已 很少使用。
19
(3)系统命名法(重点)
系统命名法是我国根据1892年日内瓦国际化学会议首次拟定
饱和脂肪烃(烷烃):是指分子中的碳原子以单 键相连,其余的价键都与氢结合而成的化合物。
H H C H H H H C H H C H H H H C H H C H H C H H H H C H H C H H C H H C H H
甲烷(CH4) 乙烷(C2H6) 丙烷(C3H8) 丁烷(C4H10)
H H
H C
CH3 CH3 C H C CH3
C
2
CH
8CH
CH2
3CH2
7
1
2
6CH2
CH
5
CH2
4
式中两环共用的叔碳原子(1,5)称为“桥头”
从一个桥头到另外一个桥头的链或键称为“桥”或―桥路‖
此例中有三个桥,即碳链2-3-4,碳链6-7和碳链8
29
命名原则
确定母体名称:按成环碳原子的总数称为“某烷”。 注明环数:以“二环”作词头,放在母体名称前面。 注明桥的结构:将各桥所含碳原子数按由多到少的次 序用数字表示,放在词头和母体之间的方括号中,在数 字之间的右下角用小圆点“.”隔开。 编号:从一个桥头开始循环最长的桥编到另一桥头, 然后再循余下的最长的桥编回到起始桥头。最短的桥最 后编号,且仍从起始桥头一端的碳原子开始编号。
18
例如
CH3 CH CH3 CH2 CH3
二甲基乙基甲烷
CH2CH3 CH3 C CH CH3
二甲基乙基异丙基甲烷
CH3 CH3
该命名法虽能清楚地表示分子的结构,但是不能 适用于结构较复杂的烷烃的命名。目前文献中已 很少使用。
19
(3)系统命名法(重点)
系统命名法是我国根据1892年日内瓦国际化学会议首次拟定
饱和脂肪烃(烷烃):是指分子中的碳原子以单 键相连,其余的价键都与氢结合而成的化合物。
H H C H H H H C H H C H H H H C H H C H H C H H H H C H H C H H C H H C H H
甲烷(CH4) 乙烷(C2H6) 丙烷(C3H8) 丁烷(C4H10)
H H
H C
CH3 CH3 C H C CH3
C
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
5 4 3
H OH
2 1
C (O O O)
2) R、S 构型标记法
R、S 构型标记法广泛用于各种类型的手 性化合物构型的命名。 R、S 构型标记法: (1) 按照顺序规则,排列手性碳原子相连的四个原子 或基 团的优先次序。如果优先次序a > b > c >d 。 (2) 将手性碳原子所连的优先性最低的原子或基团 (如 d )置于远离视线的位置,然后观察朝向自己的另 外三个原子或基团,如a→b→c为顺时针方向,则为R构 型;如a→b→c为逆时针方向,则为S 构型。
H3C
CH2COOH
CH2COOH
CH3
H3C CH3
H3C CH3
4,5位中的取代基的 影响,不能共平面。
(-)-[6 ]- 螺 苯 (-)-[6 ]-h e x a h e lic e n e
首尾两个苯环不 在同一平面
(+ )-[6 ]- 螺 苯 (+ )-[6 ]-h e x a h e lic e n e
2)含有2个相同手性碳原子的分子 相同手性碳原子: 手性碳原子上所连的四个基团或原子与另一个手性碳 原子上所连的四个基团或原子完全相同。
一对对映体 a-b
酒石酸
非对映体 a-c,b-c
因为有两个相同的C*,只有3(< 22=4)个对映异构体。
内消旋体(meso):含有手性碳原子但分子整体是非手性 的化合物(an achiral compound with chirality centers)。 上面的分子,虽有两个手性碳原子,不具光学活 性,是一个内消旋体。 原因:分子内部具有对称面,分子的上、下两部分 对偏振光的影响互相抵消。
旋光角:偏振面被旋光性物质所旋转的角度, 用“α”表示。 对着光看: 顺时针(clockwise),右旋,符号(+)表示。 逆时针(counterclockwise),左旋,符号(-)表示。 (anticlockwise) 所有旋光性的物质,不是左旋,就是右旋。 目前在科研中还广泛使用自动旋光仪对被测化 合物的旋光角和旋光方向进行直接显示测定。
问题解释
如何分析环状化合物的C *?
N CH3
HO
* * * * * OH O 吗啡
理论上对映异构体数目: 2 = 32 个
5
6
Fischer投影式
COOH
Fischer投影式书写规则
1) 十字交叉代表C*
乳 2)碳链竖直,编号小的C在上方, 酸
HO
H CH3
COOH H HO OH H COOH
H HO OH CHO H CH2OH HO H H OH
OHC CH2OH
Newman投影式
H H H3C OH OH CH2OH H H
Fischer投影式
H OH OH H H3CCH2OH OH CH3 OH CH2OH
综上所述:有三种方法判断一个化合物分子是否是 手性分子(即是否存在对映异构体)。
(1)分子与其镜象 两者不重合,是手性分子, 有对映异构体。
(2)有无对称面和 对称中心
分子中无对称面、又无对称中心,是手 性分子,有对映异构体。
(3)有无手性碳原子
分子中只有一个手性碳原子,一定是手 性分子,有对映异构体。 有多个手性碳原子,另论。
一对对映体具有以下特性: (1) 物理性质相同;化学性质相同(除与
手性试剂反应外)。
(2) 对偏振光的偏振面的作用不同;生 物活性不同。
2) 手性与对称性 对称元素:通过某种对称操作后,和原来的立体形象完 全重合时,称为该分子具有某种对称元素。 对称轴Cn(symmetric axis):在分子内可以找到一个轴, 当分子沿着这个轴转动2π/n,得到的分子形象与原来的 完全重合,此轴称为n重对称轴。 对称面 σ (symmetric plane) :能将分子结构剖成互为镜像 的两半的面。 对称中心 i (symmetric center):当分子的任一个原子 (基团)到某一假想点( i)的连线,再延长到等距离 处,遇到一个相同的原子时,这个假想的点就称为对称 中心。
3
比旋光度
比旋光度:在一定温度下,旋光管的长度为 1dm 。旋光物质 B 的质量浓度为 1g.ml-1 ,光源波 长为589nm(钠光)时的旋光角。
[α ]Dt = α / l . ρB
公式中: [α ]Dt 旋光性物质的比旋光度, 常用单位 ° . ml . g-1.dm-1。 α l 旋光性物质的旋光角 常用单位 ° 旋光管长度 常用单位 dm
第三章 对映异构(Enantiomerism)
1 对映异构现象
立体异构:在分子构造相同的情况下,由于组成分子 的原子或基团的空间排列状态不同引起的异构现象。 构造异构
顺反异构 同分异构 构型异构
立体异构
构象异构
对映异构
手性chirality (手征性):互为实物与镜象关系, 彼 此不能重合的现象。 (如图左右手) 产生对映异构现象的结构依据是手性.
酒 石 酸
编号大的碳在下方。
3)“横前竖后”横键连接的原子或 基团在纸平面前方,竖键连接 的原子或基团在纸平面的后方。
7 构型的标记
1) D、L 标记法 D、L 标记法又称相对构型的标记法。 费歇尔( Fischer) 人为的选定( + ) - 甘油醛为标准 物,并规定 C2上的羟基处于右侧的为D-构型,其对映 体(-)-甘油醛为L构型。 它们的结构式分别如下:
定义:与四个不相同的原 子或基团相连的碳原子。
( a carbon bonded to
four different groups ) 通常用星花标示C*
H3C
* CH OH
COOH
乳酸分子中的 C2 所连的四个基团(COOH, OH,CH3,H)均不相同, 故C2是手性碳原子。
对映异构体:由于分子的不对称性,产生彼此互为 镜象关系,就象我们的左手和右手一样,相似而不 能重合的一对立体异构体,称为对映异构体,简称 为对映体(enantiomer)。
1.395 -13.9
4
外消旋体 · 肌肉组织中分离的具右旋性。
乳 酸 · 左旋乳酸杆菌使葡萄糖发酵的具左旋性。 · 化学反应合成的是外消旋体,不具有光学活性 α=0 。 外消旋体(racemic 合物。 mixture)定义:一对对映体的等量混
特点:无旋光性;物理性质与纯的单一对映体有差异。 常用(±)或者 dl表示。
5 具有两个或两个以上手性中心的分子 1) 含有2个不相同手性碳原子的分子
有 一个手性碳原子的化合物有( 21=2 )两
个对映异构体(一对对映体) 有多个手性碳原子的化合物有两个以上的 对映体,最大数=2n。 (n为手性碳原子的个数)
不相同手性碳原子: 手性碳原子上所连的四个基团或原子与另一个手性碳 原子上所连的四个基团或原子不完全相同。
Fischer投影式、Newman投影式、锯架式、透 视式如何转换?
透视式
OH H C COOH CH3
Fischer投影式
OH H COOH CH3
Fischer投影式表示两个以上的手性碳原子 时,显示了立体结构的重叠式。
Fischer投影式
CHO H OH HO H CH2OH
Newman投影式、锯架式
ρB 旋光性物质B的质量溶度 常用单位g . ml-1
一对对映体
比旋光度绝对值相等,符号相反。 其它物理性质相同。 一对对映体的物理性质
物理性质 沸点/℃ 密度/g.cm-3 折射率 比旋光度/°·mL·g-1·dm-1
(+)-2-丁醇
(-)-2-丁醇 99.5
0.8080
99.5
0.8080
1.395 +13.9
以甘油醛为标准,合成其它旋光性化合物,只要 在反应过程中不断裂与手性中心直接相连的化学键, 所得化合物的构型与原甘油醛的构型相同。
D、L标记法的使用有一定的局限性,一般用于糖 类和氨基酸的构型标记,我们重点介绍R、S标记法:
原子和基团优先性顺序规则判断方法:
(1) 比较原子序数,原子序数大的优先于原子序 数小的;同位素,质量重的优先于质量轻的。 -I >-Br >- Cl>-SH>-OH>-NH2>-CH3>-D>-H (2)原子序数相同时,外推再比较其后面的原子的 原子序数,直至比出大小为止。 CH3 2 CH3 1 3 4 5 CH2CH2CH3 CH2CH3 CH3 C CH3 CH CH3 CH
CH3 Br Cl Br
末优基团在横方向 Br→Cl→CH3,顺时针,S
H
8 无手性碳原子的对映异构体
1) 6,6/-二硝基-2,2/-联苯二甲酸
2) 丙二烯型对映异构
丙二烯类化合物(C=C=C)的结构特点是与中 心碳原子相连的两个π键所处的平面,彼此相互垂 直(中心碳原子为sp 杂化)。
3)螺旋型结构化合物—分子无对称面和对称中心,有手性。
手性关系 图: a 左、右手 互为镜象与 实物关系 b 左、右手 不能重合
2 具有一个手性中心的分子 1)手性分子和对映体
乳酸 a, b 互为镜像和实物,不能重合。 手性分子:不能与其镜像重合的分子,称为手性分子。
手性碳原子(chiral carbon atom) 又称 手性中心(chiral center) 又称不对称碳原子
2
COOH
3
HOOC H
2 1
H
C OH
H
1 R-乳酸
CH3
C
OH
H C 3 3
S-乳酸
H 3 CH 2 C F
S
Cl
C Br
Cl Br
C
R
H
3) R 、S 标记法用于Fischer投影式
