帕瑞昔布钠杂质整套系列
帕瑞昔布杂质合成工艺

帕瑞昔布杂质列表及杂质合成工艺N OSON OONaChemical Formula:C 19H 17N 2NaO 4SMolecular Weight:392.40帕瑞昔布序号名称结构备注1 杂质A (B )NO SOHNOO光降解杂质2 杂质C工艺杂质3 杂质D工艺杂质4 杂质E工艺杂质5 杂质FONSSO ON HO O HN OO工艺杂质6 杂质G工艺杂质7 杂质H工艺杂质8 杂质I工艺杂质9 杂质J 工艺杂质10 杂质K ONSOO N HON SOO工艺杂质11 杂质LNOSO NOOO工艺杂质12 杂质M 氧化降解杂质合成路线及合成工艺1. 杂质A (B )合成路线及合成操作:N OS OHNO O N OS OHNO O NOSO 2O+光降解杂质A杂质B依次将10g 帕瑞昔布,加入100ml 无水乙醇加入到250ml 三口瓶中,40-50℃条件下,用365nm 紫外灯连续照射5天,HPLC 监控反应过程,反应结束后,将反应液浓缩,浓缩液拌硅胶进行柱层析(体积比:乙酸乙酯:正己烷=1:1),分别得到光降解产物1及光降解产物2;杂质B 氢谱杂质B 碳谱2.杂质C 合成路线及合成操作:N OS O HNO O n-BnLi杂质CN OS NO合成操作:依次将2.5g 帕瑞昔布,30ml 无水四氢呋喃加入到圆底烧瓶中,氮气保护条件下、-78℃条件下,将11ml 正丁基锂(1.6M )缓慢加入到反应液中,加入完毕后,继续搅拌反应2h ;将反应液缓慢升温至20~30℃。
向反应液中加入饱和氯化铵溶液淬灭反应,乙酸乙酯萃取三次,每次100ml ,合并乙酸乙酯相,无水硫酸钠干燥;浓缩,浓缩物柱层析分析纯化,得到杂质C 粗品,使用乙醇重结晶,得到白色固体0.50g ;3.杂质D 合成路线及合成操作:ON ClSO3HCH2Cl2ONS SOOClO OCl ONS SOOHOO OOH 杂质D中间体5-甲基-3,4-二苯基异恶唑乙腈、H2O取30g5-甲基-3,4-二苯基异恶唑,60ml 二氯甲烷,84g 氯磺酸加入到250ml 三口瓶中,加热升温至35~40℃,保温反应20h ,液相监控,反应结束后,将反应液滴加至100ml 水中,20-30℃搅拌60min ,静置分液,水相用二氯甲烷萃取两次,每次100ml ,合并二氯甲烷相干燥,过滤、滤液浓缩至干,加入乙酸乙酯重结晶,得到中间体40.0g ,收率74.0%;将上述中间体(30g )加入至250ml 单口瓶中,加入50ml 水及50ml 乙腈,加热升温至回流,保持回流条件下,反应5-6小时;70℃减压浓缩至干,得到浓缩物用无水乙醇重结晶得到白色固体25g ,即为杂质D4. 杂质E 合成路线及合成操作ON ClSO3HCH2Cl2ON S S OOClO OCl ONS SOOH 2NO ONH 2杂质E中间体5-甲基-3,4-二苯基异恶唑二氯甲烷NH 3取30g5-甲基-3,4-二苯基异恶唑,60ml 二氯甲烷,84g 氯磺酸加入到250ml 三口瓶中,加热升温至35~40℃,保温反应20h ,液相监控,反应结束后,将反应液滴加至100ml 水中,20-30℃搅拌60min ,静置分液,水相用二氯甲烷萃取两次,每次100ml ,合并二氯甲烷相干燥,过滤、滤液浓缩至干,加入乙酸乙酯重结晶,得到中间体40.0g,收率74.0%;将上述中间体(30g)加入至250ml单口瓶中,加入200ml二氯甲烷及30ml三乙胺溶解,20~30℃条件下,通入氨气,TLC监控至中间体基本转化为目标产物为止,反应结束后,将反应液浓缩至干,浓缩物用异丙醇重结晶;得到白色固体15g,即为杂质E;杂质F合成路线及合成操作取30g5-甲基-3,4-二苯基异恶唑,60ml二氯甲烷,84g氯磺酸加入到250ml三口瓶中,加热升温至35~40℃,保温反应20h,液相监控,反应结束后,将反应液滴加至100ml水中,20-30℃搅拌60min,静置分液,水相用二氯甲烷萃取两次,每次100ml,合并二氯甲烷相干燥,过滤、滤液浓缩至干,加入乙酸乙酯重结晶,得到中间体40.0g,收率74.0%;将上述中间体(30g)加入至250ml单口瓶中,加入200ml二氯甲烷及30ml三乙胺溶解,20~30℃条件下,通入氨气,TLC监控至中间体基本转化为目标产物为止,反应结束后,将反应液浓缩至干,浓缩物用异丙醇重结晶;得到白色固体15g,即为杂质E;室温条件下,取10g杂质E加入100ml二氯甲烷,5gDMAP搅拌是完全溶解,加入丙酸酐,30-40℃反应20小时,TLC监控至原料消耗完全,反应结束后,将二氯甲烷浓缩干,加入无水乙醇重结晶得到杂质F;杂质G和杂质H合成路线及合成操作室温条件下,向100ml单口瓶中分别加入3-(3-溴苯基)-5-甲基-3-苯基异恶唑(10g)、4,5-双(二苯基磷)-9,9-二甲基氧杂蒽、二异丙基乙胺和二氧六环,搅拌下分别加入钯催化剂和苄硫醇,氩气保护条件下,升温至120℃反应5-6小时。
注射用帕瑞昔布钠药物安全性相关的影响因素的探讨

注射用帕瑞昔布钠药物安全性相关的影响因素的探讨【摘要】本文以注射用帕瑞昔布钠为例,主要结合《化学药品注射剂仿制药质量和疗效一致性评价技术要求》等指导原则,回顾了与注射用帕瑞昔布钠相关的前期研究。
从原辅料控制、生产工艺、制剂质量研究与控制、稳定性、非临床研究及上市后临床安全性监控方面,分析探讨了与药品安全性相关的影响因素,以期在药品整个生命周期中对药品安全风险进行科学合理地控制。
【关键词】注射用帕瑞昔布钠;安全性;影响因素当前药物安全性问题已经成为全社会关注的焦点,而药物安全性风险存在于从前体化合物筛选、杂质限量控制、临床试验、新药审批、上市后监控直至撤出市场的整个生命周期,贯穿于药品整个生命周期中。
帕瑞昔布钠(parecoxib sodium),化学名N-{[4-(5-甲基-3-苯基-4-异噁唑基)苯基]磺酰基}丙酰胺钠盐钠,分子式为C19H17N2O4SNa,分子量为392.40。
已上市的帕瑞昔布钠冻干粉针剂是由瑞典的法玛西亚普强公司(Pharmacia and Upjohn Company)联合美国辉瑞公司研制的新型非甾体抗炎药[1],是高选择性的第二代COX-2抑制剂。
这种高选择性使其能在不影响胃黏膜、肾脏及血小板的功能的同时,发挥镇痛消炎作用[2-4]。
帕瑞昔布钠作为全球第一个可同时静脉、肌肉注射用的COX-2抑制剂,主要用于治疗中、重度手术后急性疼痛[5]。
本文旨在以注射用帕瑞昔布钠为例,从研发到临床使用,系统性对注射用帕瑞昔布钠药物安全性相关的影响因素的前期研究进行回顾和讨论。
1 原辅包控制1.1 原料药《化学药品注射剂仿制药质量和疗效一致性评价技术要求》对注射剂原料、辅料和包材的质量控制提出了较为严格的要求,文件明确指出制剂生产商需结合原料药生产工艺,对原料药的质量进行充分研究与评估同时需关注对元素杂质和致突变杂质的研究和评估。
经检索,目前国内对帕瑞昔布钠原料药的质量研究多关注帕瑞昔布钠理化性质[6]、含量[6]、有关物质[7-8]、异构体[9]和溶剂残留[10-12]检测。
帕瑞昔布钠有关物质合成研究

帕瑞昔布钠有关物质合成研究发布时间:2023-02-28T01:33:56.920Z 来源:《中国医学人文》2022年33期作者:杜彬彬卢毅楷蒋鹏[导读] 本文对帕瑞昔布钠的合成技术进行研究,重点阐述4个有关物质的合成方式杜彬彬卢毅楷蒋鹏浙江海森药业股份有限公司 322104摘要:本文对帕瑞昔布钠的合成技术进行研究,重点阐述4个有关物质的合成方式,分别为4-(3-甲基异恶唑-4-基)苯磺酰胺、4-(5-溴-3-甲基异恶唑-4-基)苯磺酰胺、N-[[4-(3-甲基-5-苯基异恶唑-4-基)苯基]-磺酰基]丙酰胺、3,3’-(5-甲基异恶唑-3,4-二基)二苯磺酰胺,使此类抑制剂质量得到保障,并采用HPLC法对帕瑞昔布钠中相关物质进行实验测定,方法灵敏度高,且结果准确可靠。
关键词:帕瑞昔布钠;物质合成;HPLC测定;技术研究引言:帕瑞昔布钠作为水溶性前体药物,是首个可用于注射的选择性环氧合酶抑制剂,适用于胃肠外给药,临床作用在于术后疼痛治疗。
有关物质以合成期间残留的中间体、降解杂质为主,经过多年研究,许多杂质已经明确,在合成分析方法上也取得了一定成果,最为常用的是以二苯乙酮为原料,与乙酸乙酯环合脱水配置关键中间体,再经过氨解、磺化等方式反应合成,最终制成。
1帕瑞昔布钠的合成技术1.14-(3-甲基异恶唑-4-基)苯磺酰胺在氩气保护情况下,将双(三苯磷)氯化钯与二甲亚砜相混合,前者剂量为3.0mmol,后者为180ml,经过充分搅拌后,再将乙酸钾纯化溶液倒入,剂量为25ml,在温度为100—105℃环境下持续反应4h后,过滤处理,将过滤液与1L水混合,再用乙酸乙酯萃取。
待有机相合并后,利用无水硫酸钠进行干燥,经过过滤得到滤液,将其压缩成干燥状态,得到白色固体,无需纯化便可直接使用。
1.2 4-(5-溴-3-甲基异恶唑-4-基)苯磺酰胺在室内温度下,将4-(3-甲基异恶唑-4-基)苯磺酰胺与二氯甲烷混合,前者剂量为94.40mmol,后者为250ml,经过充分搅拌后,将温度降低到0—5℃,再将0.10mol的NBS倒入,调高温度为10—15℃,持续反应40min后,过滤处理,将滤出液体用1.0mol/L亚硫酸钠溶液洗涤,无水硫酸钠干燥处理后,压缩成白色固体,无需纯化,可直接应用到后续反应中。
注射用帕瑞昔布钠说明书20120925(特耐)

核准日期:2008年5月23日修改日期:2008年11月14日;2010年11月5日;2011年12月19日;2012年9月25日注射用帕瑞昔布钠说明书请仔细阅读说明书并在医师指导下使用。
[药品名称]通用名称: 注射用帕瑞昔布钠商品名称: 特耐®/Dynastat®英文名称: Parecoxib Sodium for Injection汉语拼音: Zhusheyong Paruixibuna[成份]帕瑞昔布钠化学名称:N-[[4-(5-甲基-3-苯基-4-异恶唑基)苯基]磺酰基]丙酰胺钠盐化学结构式:3CH3CH-Na+分子式:C19H17N2O4SNa分子量:392.41辅料:磷酸氢二钠无水合物,磷酸和/或氢氧化钠(用于调节pH值)[性状]本品为白色或类白色冻干块状物。
[适应症]用于手术后疼痛的短期治疗。
在决定使用选择性环氧化酶-2(COX-2)抑制剂前,应评估患者的整体风险。
[规格](1)20mg;(2)40mg (以帕瑞昔布计)[用法用量]推荐剂量为40mg静脉注射(IV)或肌内注射(IM)给药,随后视需要间隔6~12小时给予20mg或40mg,每天总剂量不超过80mg。
可直接进行快速静脉推注,或通过已有静脉通路给药。
肌内注射应选择深部肌肉缓慢推注。
使用本品超过三天的临床经验有限。
与阿片类镇痛药联合用药:阿片类镇痛药可以与帕瑞昔布同时应用,本品使用剂量参见上文。
在所有的临床评估中,帕瑞昔布是固定间隔时间给药,而阿片类药物则是按需给药。
由于选择性COX-2抑制剂的心血管事件发生风险随着剂量及暴露时间增加而增加,因此,应尽可能使用最短疗程及最低每日有效剂量。
由于帕瑞昔布与其它药物在溶液中混合可出现沉淀,因此不论在溶解或是注射过程中,帕瑞昔布严禁与其它药物混合。
如帕瑞昔布与其它药物使用同一条静脉通路,帕瑞昔布溶液注射前后须采用相容溶液充分冲洗静脉通路。
静脉通路溶液的相容性采用适用溶液配制后,帕瑞昔布溶液只能以静脉注射、肌内注射、或加入下列液体的静脉通路给药:氯化钠溶液9mg/ml(0.9%)葡萄糖注射液50g/L(5%)氯化钠4.5mg/ml(0.45%)和葡萄糖50g/L(5%)注射液乳酸林格氏液由于可以导致帕瑞昔布在溶液中沉淀,故不推荐向含50g/L(5%)葡萄糖的乳酸林格氏液或其它未列出溶液的静脉通路中加入帕瑞昔布。
帕瑞昔布杂质整理清单
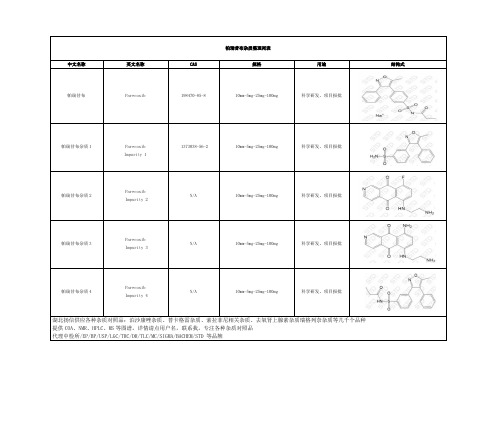
帕瑞昔布杂质 2
Parecoxib Impurity 2
N/A
10mm-5mg-25mg-100mg
科学研发,项目报批
帕瑞昔布杂质 3
Parecoxib Impurity 3
N/A
10mm-5mg-25mg-100mg
科学研发,项目报批
帕瑞昔布杂质 4
Parecoxib Impurity 4
N/A
10mm-5mg-25mg-100mg
科学研发,项目报批
湖北扬信供应各种杂质对照品:泊沙康唑杂质、替卡格雷杂质、索拉菲尼相关杂质、去氧肾上腺素杂质瑞格列奈杂质等几千个品种 提供 COA、NMR、HPLC、MS 等图谱。详情请点用户名,联系我。专注各种杂质对照品 代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/STD 等品牌
中文名称 帕瑞昔布
英文名称 Parecoxib
帕瑞昔布杂质整理列表
CAS
பைடு நூலகம்
规格
用途
198470-85-8
10mm-5mg-25mg-100mg
科学研发,项目报批
结构式
帕瑞昔布杂质 1
Parecoxib Impurity 1
1373038-56-2
10mm-5mg-25mg-100mg
科学研发,项目报批
