不同介质溶出曲线比较-2012-09-27
No.5_——_溶出曲线的测定与比较

上海市药品检验所 谢沐风 撰写
3
上海市药品检验所 谢沐风 撰写
b. 原制剂平均溶出率在结束时间内达 50%以上但未达 85%时,ƒ2因子大于 55。 c. 原制剂平均溶出率在结束时间内未达 50%时,ƒ2因子大于 61。
¾ 调释制剂 【用于仿制药研发时】 (1)参比制剂在结束时间内平均溶出率达 80%以上,ƒ2因子大于 50。 (2)参比制剂在结束时间内平均溶出率达 50%以上但未达到 80%,ƒ2因子大于 55。 (3)参比制剂在结束时间内平均溶出率未达 50%,ƒ2因子大于 61。 【用于其他各事项时】
公式(1)
t1:溶出率为dA%前的时间点 t2:溶出率为dA%后的时间点
d1:时间点为t1时的溶出率
d2:时间点为t2时的溶出率
表 1 参比制剂每一样品原始测定时间-溶出率数据汇总表
测定时间(分钟)
制剂
0 5 10 15 20 25 30 35 40 45 52.5 60 67.5 75 90
(1)
应如何进行校正的实例。
A-1 参比制剂平均溶出率在规定时间内达到 85%的实例
假设参比制剂的 12 个单位(片)溶出度试验测定结果如下表 1 所示。
第一步:延迟滞后时间的求算
针对每一溶出曲线,按照下列公式分别求出溶出率为dA%时的tA时间点。
tA
=
t1
+
dA d2
− d1 − d1
× (t2
− t1)
+ ⋅⋅⋅⋅⋅⋅ + A2 V2
+
A1) ×V1
其中 An为各时间点测得释放量
【注:本子版给出了该种方式的累积计算模板,请参阅!】
(2)不补液时:
各时间点校正后的累积溶出量(%) = Cn ×[V2 − (n −1)V1] + (Cn−1 + ⋅⋅⋅⋅⋅⋅ +C2 + C1) ×V1 ×100% L
溶出曲线 比较

溶出曲线比较溶出曲线比较是一种常见的物溶出方法,通过观察物在不同条件下的溶出情况,来其释放性能和效。
在物研发和生产过程中,溶出曲线比较是非常重要的一项,可以帮助科研人员和企者了解物的溶出特性,物的设计和质量控制。
在溶出曲线比较中,我们通常会选取不同的溶出介质、溶出速度和温度来模拟不同的生理环境。
通过测定物在这些不同条件下的溶出量和时间,我们可以得到一组溶出曲线。
这些曲线反映了物在不同条件下的溶出行为,可以用来进行比较和分析。
通过对不同物的溶出曲线进行比较,我们可以得出几个方面的信息:1.物性能比较:不同物的溶出曲线形状和溶出速度可以直观地反映出其溶出性能的差异。
对于同一类型的物,我们可以通过比较其溶出曲线,评估其在体内的释放速度和稳定性,从而最适合的物种类和剂型。
2.物质量控制:溶出曲线比较也可以用来评估同一物的不同批次之间的质量差异。
通过比较曲线的形状和溶出率,我们可以检验物在生产过程中是否存在工艺上的差异,并且及时调整制造工艺,以确保物质量的一致性和稳定性。
3.物设计改进:通过对溶出曲线的比较,我们可以了解物在不同环境下的溶出行为,并进一步优化物的和制备工艺。
通过调整物组分和制备方法,可以改变物的溶出速度和稳定性,以适应不同的临床需求。
溶出曲线比较的结果对物的研发和生产具有重要的意义。
在实际操作中,我们需要严格遵守溶出的相关规定和标准,确保比较结果的准确性和可比性。
我们也需要结合其他方法和实验数据,综合评估物的性能和效果。
溶出曲线比较是一种有效的物方法,可以帮助我们了解物的溶出性能和释放行为,物的设计和质量控制。
通过比较不同物的溶出曲线,我们可以评估物的性能差异,优化物的制备工艺,高物的疗效和治疗效果。
溶出曲线比较在物研发和生产中具有重要的应用前景,值得我们进一步深入研究和应用。
不同pH介质下呋喃妥因肠溶片溶出曲线对比
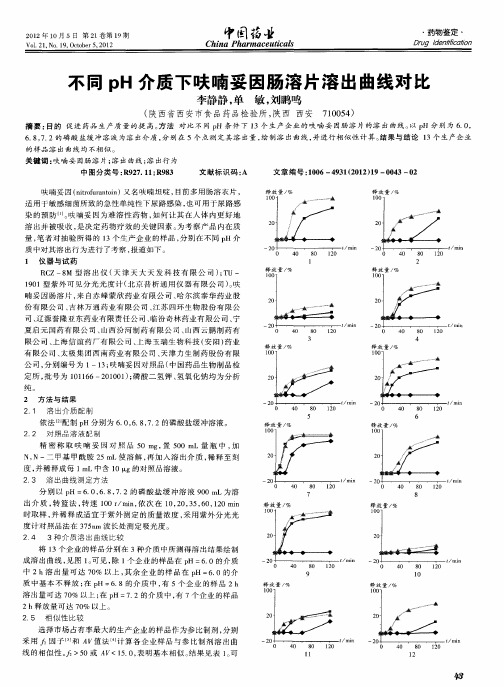
不同 p H介 质 下 呋 喃 妥 因肠 溶 片 溶 出 曲ห้องสมุดไป่ตู้对 比
李静静 , 单 敏, 刘鹏鸣
( 陕西省 西安 市食 品药品检 验所 , 西 西 安 7 0 5 ) 陕 10 4
摘要 : 目的 促 进 药 品 生产 质 量 的提 高 。 法 对 比 不 同 p 条 件 下 l 方 H 3个 生 产 企 业 的 呋 喃 妥 因肠 溶 片 的溶 出 曲线 。 p 分 别 为 6 0 以 H .,
中 2h溶 出 量 可 达 7 % 以上 , 余 企 业 的 样 品 在 p =60的 介 0 其 H .
质 中基本不 释放 ; p 在 H=6 8的介 质 中 , 5个 企 业 的样 品 2h . 有 溶 出量 可 达 7 % 以上 ; p 7 2的介 质 中 , 7个 企 业 的 样 品 0 在 H= . 有
6 8 7 2的 磷 酸 盐 缓 冲溶 液 为 溶 出介 质 , 别在 5个 点 测 定 其 溶 出量 , 制 溶 出 曲线 , . ,. 分 绘 并进 行 相 似 性 计 算 。 果 与 结 论 1 生 产 企 业 结 3个
的样 品 溶 出 曲线 均 不 相 似 。
关 键 词 : 喃妥 因肠 溶 片 ; 出曲 线 ; 出行 为 呋 溶 溶 中 图分 类 号 : 9 7 1 ; 9 3 R 2.1R 8 文 献 标 识 码 : A 文 章 编 号 :0 6 9 12 1 )9— 0 3— 2 10 —4 3 (02 1 0 4 0
10 9 1型 紫 外 可 见 分 光 光 度 计 ( 京 普 析 通 用 仪 器 有 限 公 司 ) 呋 北 。
喃妥 因肠溶片 , 自赤峰蒙欣 药业 有限公 司、 来 哈尔滨 泰华药业股
溶出曲线的测定与比较

上海市药品检验所 谢沐风撰写 xiemufeng@ 本文版权归作者所有,任何个人或团体使用本文内容,请与作者联系。
【No.5 —— 溶出曲线的测定】1. 关于测定时间点和结束时间点的设定 对于测定时间点,普通制剂与肠溶制剂可为 5、10、15、20、30、45、60、90、120 分钟,此后每隔 1 小时直至 6 小时止;缓控释制剂可为 15、30、45、60、90、120 分钟,3、 4、5、6、8、10、12、24 小时。
当连续两点溶出率均达 90%(调释制剂为 85%)以上、且 差值在 5%以内时,试验则可提前结束。
对于结束时间点,在酸性介质中(如 pH 值 1.0)最长测定时间为 2 小时,在其他各 pH 值介质中普通制剂为 6 小时,缓控释制剂为 24 小时。
2. 其他事项 (1) 试验样品 用于比较的两种制剂含量差值应在 5%以内;每个品种各取 12 个单位。
取三个批号样品,在最终溶出率均可达 90%以上的溶出介质(2) 参比制剂标准批号的选择中,取溶出率在约 70%处、位于中间批号的样品进行试验。
在进行仿制药研发时,考虑到原研品批间差异与耐受性,建议从市场流通渠道获得有效 期内不同时间段的 3~5 批样品,分别测定后,取结果均值用于比较;并同时确定参比制剂在 各 pH 值溶出曲线的波动范围,以更为有效地评估原研制剂内在质量和自身仿制制剂的研发 深入程度。
如果主成分是在溶解状态下进行溶出度试验的(如一些散剂、颗粒剂) ,则适当选择某一 批号,即可。
(3) 试验样品的生产规模 由于固体制剂生物利用度与生产规模密切相关, 故一般情况下应不少于今后工业化最大生产规模的 1/10 或不少于 10 万个单位。
1上海市药品检验所 谢沐风撰写 xiemufeng@ 本文版权归作者所有,任何个人或团体使用本文内容,请与作者联系。
3. 累积释放度校正计算公式 在多次取样时、可采取及时补充相同体积同温度溶出介质亦可采取不补液两种方式,但 必须保证每次抽取体积的固定性。
溶出曲线与溶出介质

溶出曲线与溶出介质研发过程中遇到的问题解答问题1.请问我们做的一个复方制剂是一个硬胶囊里包含有一个片子和一个软胶囊但是FDA各自推荐了溶出方法片子用的磷缓软胶囊用的盐酸转速和介质体积取样时间点均不一致但是要整粒硬胶囊投药测A-片溶出就按照片A溶出条件取样只检测A溶出曲线这样B软胶囊等于只是考察到了对A的影响但是不会有B的任何数据等于浪费掉了这样原研就要买很多了呀而且A片子用的900ml磷缓浓度也是不常规的0.07M的而B软胶囊用的推荐介质是盐酸0.01M的那我做A片子剩余的三个介质溶出曲线是按照指导原则0.1N盐酸还是与-B软胶囊盐酸浓度保持一致也用0.01M盐酸呢反之B软胶囊其它介质比如磷缓是用指导原则0.05M的磷缓还是用A所用浓度0.07M呢如果A 是难溶药物介质中还加入了0.5%SDS又该怎么做?由于原研知己非常昂贵因此谨慎起见想咨询下专家的意见答:很好很现实的问题。
如果可能,你可以开发一个新的溶出方法同时适用于两个APIs。
当然如果A是低溶解度药,B是高溶解度药,一个介质适用两个APIs有一定难度。
如果你是申请美国审批,不管你最终用什么方法,你都必须要提交FDA推荐的方法(n=12),这是硬规定。
对于不同pH介质,如果你证明0.1 N HCl 和0.01 N HCl 的pH 差别对于药物(两个API)的溶解度和药剂的溶出度都影响很小,你可以使用0.01N HCl。
FDA不般不会计较,欧洲有可能计较,CFDA我不太理解。
如果0.07 M磷酸介质pH 6.8是推荐介质, 你不需要再重复0.05 M pH 6.8. 对于pH 4.5, 你仍可以适用0.05M 的离子强度。
A是低溶解度药,你需要SDS以确保A的完全释放,但你不需要一定在0.01 NHCl 或pH 4.5的条件下加SDS (见问题3的回答)。
你可以用自己的配方寻找条件,以节省原研药。
问题2.韩博士,我们有个复方制剂的品种,与原研对比4种pH曲线时,在水和pH6.8中15分钟就达到85%以上了,但是在0.1N盐酸和pH4.0时用2小时和8小时才能达到85%,4种曲线的取样点和取样时间不一致,这样做可以吗?答:可以不一致,但在同一介质中,原研药和仿制药的取点要一致。
多介质溶出曲线的比较 溶出仪机械校验结果

多介质溶出曲线的比较溶出仪机械校验结果
多介质溶出曲线的比较可以用于判断同一批药品在不同溶出条件下的溶出特性是否一致。
一般来说,多介质溶出曲线分析是通过使用不同介质对药品进行溶解试验,然后记录溶解药物的浓度变化情况,最终比较不同溶出条件下的药物释放速率和时间等参数的差异。
而溶出仪机械校验结果则主要是为了保证溶出仪的稳定性和准确性,以确保药物溶解实验的可靠性。
机械校验通常包括检查样品架、转子、马达、电子装置等方面的功能是否正常,并且根据实验室所使用的标准进行检查并记录结果。
常见的机械校验标准包括美国药典(USP)以及欧洲药典(EP)等。
因此,多介质溶出曲线比较和溶出仪机械校验结果都是评估药物溶解实验可靠性和质量的重要指标,可以协同使用来确保实验结果的准确性和可靠性。
溶出度对比研究四种溶出介质的比较样本

001【求助】溶出度对比研究-四种溶出介质的比较作者: wangjianglin332(站内联系TA)发布: -10-21 Sample Text溶出度作为工艺筛选和质量研究的重要评价指标, 按当前的审评要求必须做详尽的研究, 现今一上市品种的仿制, 溶出度研究碰到比较棘手的问题, 望园中的前辈不吝赐教。
1.主药易溶于水, 溶解度为0.1g/ml, 一剂量( 240mg) 的主药在250ml四种溶出介质( 酸(0.1mol/L盐酸溶液)、 pH=4.5(醋酸-醋酸钠缓冲液)、 pH=6.8(磷酸盐缓冲液)、水) 能完全溶解。
胶囊剂崩解时限为3分钟, 胶囊崩解药物即可溶出, 实验结果也表明在水中, 10分钟药物的溶出量即可达到90%以上, 此种情况还是否需要经过溶出曲线的相似性来判定自制样品和市售品溶出行为的一致性? 园中有帖子谈到用ICH指导原则的三步法进行考察, 那么最后一步证明崩解和溶出具有相关性如何考察?2.溶出度的比较研究一般需考察自制品和市售品在四种溶出介质( 酸(0.1mol/L 盐酸溶液)、 pH=4.5(醋酸-醋酸钠缓冲液)、 pH=6.8(磷酸盐缓冲液)、水) 中的溶出行为, 溶出量的测定方法也一般采用UV法进行测定。
本品取样后, 需进行衍生化反应后才有紫外吸收(一般情况紫外最大吸收波长为195nm, 衍生化后为525nm), 但在实验研究过程中我们发现, 介质酸中样品1小时后吸光值在0. 1至0.2的范围, 不符合紫外吸收值的误差范围; 介质pH=4.5(醋酸-醋酸钠缓冲液)中1小时后样品吸光值为0, 推断无衍生化反应发生; 介质pH=6.8(磷酸盐缓冲液)中1小时后样品吸光值也在0.1至0.2的范围内, 不符合紫外吸收值的误差范围。
综合推断, 除水以外, 另外三种介质对衍生化反应均有不同程度影响, 溶出量无法准确测定, 此种情况下能否以水一种介质进行溶出度的对比研究?举报删除此信息caoyuan521(站内联系TA)问题一: 在国内一般有溶出检测项目的制剂都不再检测崩解项目了。
溶出曲线的测定与比较

上海市药品检验所 谢沐风撰写 xiemufeng@ 本文版权归作者所有,任何个人或团体使用本文内容,请与作者联系。
【No.5 —— 溶出曲线的测定】1. 关于测定时间点和结束时间点的设定 对于测定时间点,普通制剂与肠溶制剂可为 5、10、15、20、30、45、60、90、120 分钟,此后每隔 1 小时直至 6 小时止;缓控释制剂可为 15、30、45、60、90、120 分钟,3、 4、5、6、8、10、12、24 小时。
当连续两点溶出率均达 90%(调释制剂为 85%)以上、且 差值在 5%以内时,试验则可提前结束。
对于结束时间点,在酸性介质中(如 pH 值 1.0)最长测定时间为 2 小时,在其他各 pH 值介质中普通制剂为 6 小时,缓控释制剂为 24 小时。
2. 其他事项 (1) 试验样品 用于比较的两种制剂含量差值应在 5%以内;每个品种各取 12 个单位。
取三个批号样品,在最终溶出率均可达 90%以上的溶出介质(2) 参比制剂标准批号的选择中,取溶出率在约 70%处、位于中间批号的样品进行试验。
在进行仿制药研发时,考虑到原研品批间差异与耐受性,建议从市场流通渠道获得有效 期内不同时间段的 3~5 批样品,分别测定后,取结果均值用于比较;并同时确定参比制剂在 各 pH 值溶出曲线的波动范围,以更为有效地评估原研制剂内在质量和自身仿制制剂的研发 深入程度。
如果主成分是在溶解状态下进行溶出度试验的(如一些散剂、颗粒剂) ,则适当选择某一 批号,即可。
(3) 试验样品的生产规模 由于固体制剂生物利用度与生产规模密切相关, 故一般情况下应不少于今后工业化最大生产规模的 1/10 或不少于 10 万个单位。
1上海市药品检验所 谢沐风撰写 xiemufeng@ 本文版权归作者所有,任何个人或团体使用本文内容,请与作者联系。
3. 累积释放度校正计算公式 在多次取样时、可采取及时补充相同体积同温度溶出介质亦可采取不补液两种方式,但 必须保证每次抽取体积的固定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
如何准确、快捷、高效地测定大批量溶出度样品
(7) HPLC法测定时取样量1~2ml即可。对于小规格难溶性
药物,可考虑取出后无需过滤,直接臵于液相小瓶、放臵 0.5小时后进样即可。 因为在取样点位臵处,吸取这么小体积携带出辅料的可 能性极小,即便有少量存在,静臵后使其沉淀,就不会影响 到测定,更不会堵塞色谱柱。
若直接观察,各时间点差异均在10%以内,则可断定ƒ2 因子大于50。
卡马西平片的四条溶出曲线
公布标准批号的意义
尼群地平片的四条溶出曲线
法莫替丁片的四条溶出曲线
阐述仿制 药意义!
“错落有致”与 “溶解度”相一致
如何准确、快捷、高效地测定大批量溶出度样品
(1-1) 投样方式(桨板法) 采用每间隔固定时间(如30秒)投样。
(2) 尽可能采用HPLC法。一者可排除辅料/薄膜衣/ 肠溶衣/胶囊壳等易对紫外测定产生干扰的情况; 二者,由于线性范围宽,样品均可直接进样测定, 省略了紫外测定要求吸收度值在0.20~0.80间、样 品需稀释的繁琐步骤,大大提高了工作效率。
如何准确、快捷、高效地测定大批量溶出度样品
(3-1) 采用短色谱柱 市售有2~5cm长、粒径5~10μm的短分
对于f2因子计算时间点数据精密度的规定
精密度的优劣说明均值是否具有代表性: (注意非测定时间点、而是计算时间点)
<对于原研制剂> 以上所选用的第一时间点溶出结果变异系数(RSD)应不得过 20%,自第二时间点至最后时间点溶出结果变异系数(RSD)均应 不得过10%。
若不符合,应从仪器适用性予以考虑解决,如增加转速。
析柱、
(3-2) 提高流动相中有机相比例。如此,虽然有杂质与主成
分未能分离的担忧,但考虑到样品已被稀释1000倍(溶出
介质体积通常为900~1000ml),在此条件下,存在的微量
杂质响应值已微乎其微,即便有所表现,其影响对于结果而
言亦是完全在误差范围之内,可忽略不计。
如何准确、快捷、高效地测定大批量溶出度样品
时间点的选择以溶出量尽可能等分为原则。
加入最终溶出量为89%
1、四等分,在原研制剂的溶出曲线上寻找 22.25%、
44.5%、66.75%的最相近的溶出时间点。 2、三等分,在原研制剂的溶出曲线上寻找 29.66%、 59.33%的最相近的溶出时间点。 采用以上时间点以及89%溶出的时间点比较因子。
(1-2) 滤头/针筒的取用
建议采用“1个滤头/1个取样针筒方式”进行多样品抽取。
第1份样品抽取10~20ml后,过滤使滤膜吸附饱和,并将滤
液沿溶出杯壁缓慢注回,再抽取所需体积(如HPLC法、 1~2ml即可)即可,其后所有样品无需再弃去初滤液,直接 收集。
如何准确、快捷、高效地测定大批量溶出度样品
差异比较大,在排除测定误差之后,调整溶出条件,分别是
转速以及介质,如果无论如何调整都不起效的情况下,可测 定关键点的溶出区间,自制样品相关点溶出只要落在此区间 内即可。操作起来可能存在问题,具体问题具体分析。
(4) 柱温升高至40~50℃。色谱柱最高承受温度为80℃,在
60℃以下操作没有问题。
(5) 流速亦可根据柱压提高至1.5~2.0ml/min。
(6) 进样量可依据对照品溶液的精密度予以灵活调节。 100μl~500μl皆可。且对于小规格制剂,为提高精密度,缩 短保留时间,使色谱峰“变细变尖(锐)”更为重要。采用 10%溶出量验证精密度。
有机溶剂:对比剖析时可加入,但最终拟定质量标准时 决不允许添加。 <表面活性剂种类> 阐述最常用的十二烷基硫酸钠和吐温-80的优缺点
放宽溶出试验参数的“最极端条件”
装臵:桨板法 转速:100转 加入表面活性剂:3.0%浓度
引申至创新药:在以上条件下,如仍难以有任何一个介质
达85%以上溶出量,则建议慎重考虑,放弃研发!(说明
仿制药研发的必由之路 → “殊途同归”
生物利用度 相同
90%
生物利用度
体外多条溶出曲线
相同
体外多条溶出曲线
不同 处方/辅料/制剂工艺 相同 原研药 处方/辅料/制剂工艺
仿制药
仿制药研发是否成功的评价
● 首先测定原研品的多条溶出曲线 ● 仿制药研发进程:小试 → 中试 → 放大 以上每一步骤样品的多条曲线均应与原研 品一致,直至放大生产到一定规模、连续三 批(每批10万片或今后最大生产规模的 1/10),即宣告“仿制成功”!
这是比石头还坚硬的药物!)
体外溶出曲线比较的具体操作
原研制剂曲线类型
<参比制剂15分钟溶出量达85%以上时(前提50转)> ★ 无需采用f1和f2因子比较。 ★ 仿制制剂在15分钟内平均溶出率也达85%以上。
★ 强调:无需关注5、10分钟、20/30分钟溶出量,但需测定。
体外溶出曲线比较的具体操作
对于本身变异性较大的品种,n应增至12~18。 <对于仿制制剂>
如各时间点变异系数超出规定,说明制剂工艺/处方筛选尚待 优化、工艺尚未稳定。
体外溶出曲线比较的具体操作
<f1因子和f2因子的判定标准> f1因子应介于0~15;f2因子应至少大于50。 <f2因子数值与溶出量差值的关系>
比较时间点溶出量平均差异 ƒ2因子临界值 2% 83 5% 65 10% 50 15% 41 20% 36
如果药物在某中介质中溶出太低,无法达到85%的情况,
谢沐风的理论是,需要调整溶出条件,使其达到85%以上再
进行比较。 我的想法是,只要此介质中溶出稳定,rsd合格,只要 自制溶出和参比制剂溶出匹配即可,无需调整。
特殊事项
对于某一介质中参比制剂溶出不稳定
如果参比制剂在某种介质中溶出不稳定,批内以及批间
【缓/控释制剂】
pH值分别为1.2、3.0~5.0、6.8~7.5和水。 #与美国作法有所不同:美国统一采用1.0、4.5、6.8和水。
如何运用溶出曲线剖析原研品的实施步骤
溶出介质配制方法:
(1)各国不尽相同、建议根据原研制剂生产厂商的国别而定。 各国药典对缓冲盐溶液的浓度有特殊的要求。 (2) 表面活性剂加入时,一定采用煮沸法配制,绝对不要采
用超声法(盐的溶解方式亦如此)。
(3) 试验前应首先进行原料药在各pH值溶出介质中的稳定性 考察,以确保试验数据的准确测定。
如何运用溶出曲线剖析原研品的实施步骤
对原研制剂的剖析:
<对于测定时间点> 普通制剂与肠溶制剂可为5、10、15、20、30、45、60、 90、120分钟,此后每隔1小时直至6小时止;缓控释制剂可 为15、30、45、60、90、120分钟,3、4、5、6、8、10、 12、24小时。当连续两点溶出率均达90%(缓控释制剂为 85%)以上、且差值在5%以内时,试验则可提前结束。 <对于结束时间点> 在酸性介质中最长测定时间为2小时,在其他各pH值介质 中普通制剂为6小时,缓控释制剂为24小时。
如何运用溶出曲线剖析原研品的实施步骤
对原研制剂的剖析:
<装臵与转速> 片剂:桨板法/50转起始。
胶囊剂:转篮法/50转或桨板法/50转(加沉降蓝)起始。
<溶出介质> 不建议采用小杯法,一律采用900ml或1000ml。 如样品浓度过低,可采用加大进样量至50~500μl。
如何运用溶出曲线剖析原研品的实施步骤
对原研制剂的剖析: <试验参数的放宽>
在某溶出介质中最终溶出量未达要求、无法进行比较时, 首选加表面活性剂方式:浓度以0.01%(w/v)为起点、按照1、 2、5级别逐步增加,不建议采用3.0%以上浓度。
但当精密度差、必须提高精密度才能使溶出均值更具代 表性时,采用提高转速至75~100转方式。
采用f1和f2因子比较法。
F1 因 子 计 算 公 式
f 1
R T
t 1 t
n
t
R
t 1
n
100
t
Rt和Tt分别表示两制剂在第n个取样点的平均累积溶出率。
F2 因 子 计 算 公 式
f 50l og 2 1 100 n 2 ( R T ) t t i 1 n
原研制剂曲线类型
<参比制剂在15~30分钟内溶出量达85%以上时>
☺ 采用f2因子比较时,比较5或10、15、30分钟三个时 间点。(根据溶出量等分原则选择5或10min) ☺ 对应于参比制剂平均溶出率分别为60%和85%两个时 间点,两者平均溶出量差均在〒15%范围内;
< 参比制剂在30分钟后达85%以上时>
Rt和Tt分别表示两制剂在第n个取样点的平均累积溶出率。
n对于计算结果的贡献尤甚!
f2因子计算时间点的选择
(1) 溶出量在85%(缓控释制剂80%)以上的时间
点仅能选取一个。 (2) 普通速释制剂选取3~4个、缓控释制剂选取3~5 个时间点。 (3) 时间点的选择以溶出量尽可能等分为原则。
f2因子计算时间点的选择
如何运用溶出曲线剖析原研品的实施步骤
<对原研品/参比制剂 样品批号的遴选> 原则上从市场上购买来不同时间点的不同批号,分别测 定,观测溶出曲线波动情况。
<对仿制制剂样品的要求>
生产规模10万单位或今后最大生产规模的1/10 含量与参比制剂的差值应在5%以内。
<对测定样品数的要求>
理论上个测定12个单位,现实情况测定6个单位即可,甚 至可以更少(预试验时)!主要有统计学参数确定。
如何运用溶出曲线剖析原研品的实施步骤
至少四种溶出介质:
