不同介质溶出曲线比较-2012-09-27.
不同pH介质下呋喃妥因肠溶片溶出曲线对比
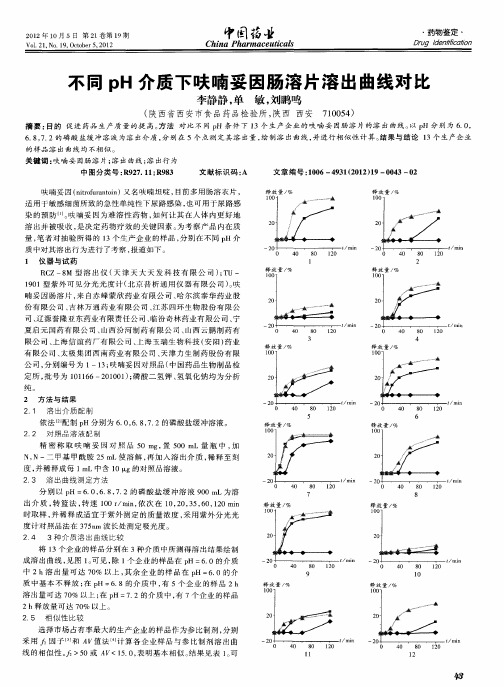
不同 p H介 质 下 呋 喃 妥 因肠 溶 片 溶 出 曲ห้องสมุดไป่ตู้对 比
李静静 , 单 敏, 刘鹏鸣
( 陕西省 西安 市食 品药品检 验所 , 西 西 安 7 0 5 ) 陕 10 4
摘要 : 目的 促 进 药 品 生产 质 量 的提 高 。 法 对 比 不 同 p 条 件 下 l 方 H 3个 生 产 企 业 的 呋 喃 妥 因肠 溶 片 的溶 出 曲线 。 p 分 别 为 6 0 以 H .,
中 2h溶 出 量 可 达 7 % 以上 , 余 企 业 的 样 品 在 p =60的 介 0 其 H .
质 中基本不 释放 ; p 在 H=6 8的介 质 中 , 5个 企 业 的样 品 2h . 有 溶 出量 可 达 7 % 以上 ; p 7 2的介 质 中 , 7个 企 业 的 样 品 0 在 H= . 有
6 8 7 2的 磷 酸 盐 缓 冲溶 液 为 溶 出介 质 , 别在 5个 点 测 定 其 溶 出量 , 制 溶 出 曲线 , . ,. 分 绘 并进 行 相 似 性 计 算 。 果 与 结 论 1 生 产 企 业 结 3个
的样 品 溶 出 曲线 均 不 相 似 。
关 键 词 : 喃妥 因肠 溶 片 ; 出曲 线 ; 出行 为 呋 溶 溶 中 图分 类 号 : 9 7 1 ; 9 3 R 2.1R 8 文 献 标 识 码 : A 文 章 编 号 :0 6 9 12 1 )9— 0 3— 2 10 —4 3 (02 1 0 4 0
10 9 1型 紫 外 可 见 分 光 光 度 计 ( 京 普 析 通 用 仪 器 有 限 公 司 ) 呋 北 。
喃妥 因肠溶片 , 自赤峰蒙欣 药业 有限公 司、 来 哈尔滨 泰华药业股
No.5 —— 溶出曲线的测定与比较

上海市药品检验所谢沐风撰写【No.5 —— 溶出曲线的测定】—— 上海市药品检验所 谢沐风 撰写1. 关于测定时间点和结束时间点的设定 对于测定时间点,普通制剂与肠溶制剂可为 5、10、15、20、30、45、60、90、120 分钟,此后每隔 1 小时直至 6 小时止;缓控释制剂可为 15、30、45、60、90、120 分钟,3、 4、5、6、8、10、12、24 小时。
当连续两点溶出率均达 90%(调释制剂为 85%)以上、且 差值在 5%以内时,试验则可提前结束。
对于结束时间点,在酸性介质中(如 pH 值 1.0)最长测定时间为 2 小时,在其他各 pH 值介质中普通制剂为 6 小时,缓控释制剂为 24 小时。
2. 其他事项 (1) 试验样品 用于比较的两种制剂含量差值应在 5%以内;每个品种各取 12 个单位。
取三个批号样品,在最终溶出率均可达 90%以上的溶出介质(2) 参比制剂标准批号的选择中,取溶出率在约 70%处、位于中间批号的样品进行试验。
在进行仿制药研发时,考虑到原研品批间差异与耐受性,建议从市场流通渠道获得有效 期内不同时间段的 3~5 批样品,分别测定后,取结果均值用于比较;并同时确定参比制剂在 各 pH 值溶出曲线的波动范围,以更为有效地评估原研制剂内在质量和自身仿制制剂的研发 深入程度。
如果主成分是在溶解状态下进行溶出度试验的(如一些散剂、颗粒剂) ,则适当选择某一 批号,即可。
(3) 试验样品的生产规模 由于固体制剂生物利用度与生产规模密切相关, 故一般情况下应不少于今后工业化最大生产规模的 1/10 或不少于 10 万个单位。
3. 累积释放度校正计算公式 在多次取样时、可采取及时补充相同体积同温度溶出介质亦可采取不补液两种方式,但 必须保证每次抽取体积的固定性。
累积校正计算公式如下: (1)补液时:(C n−1 + ⋅ ⋅ ⋅ ⋅ ⋅ ⋅ +C 2 + C1 ) × V1 Cn L / V2 各时间点校正后的累积溶出量(%) = [ + ] × 100% L / V2 V2其中 Cn为各时间点取出后的样品浓度(即稀释前的) ;上海市药品检验所 谢沐风L为制剂标示量(单位需与Cn一致)撰写1上海市药品检验所谢沐风撰写V1为各时间点固定取样体积;V2为溶出介质体积;该公式如采用各时间点测得释放量表示,则可演变为:各时间点校正后的累积溶出量(%) = An +其中 An为各时间点测得释放量 【注:本子版给出了该种方式的累积计算模板,请参阅! 】( An−1 + ⋅ ⋅ ⋅ ⋅ ⋅ ⋅ + A2 + A1 ) × V1 V2(2)不补液时:各时间点校正后的累积溶出量(%) = C n × [V2 − (n − 1)V1 ] + (C n −1 + ⋅ ⋅ ⋅ ⋅ ⋅ ⋅ +C 2 + C1 ) × V1 × 100% LL为制剂标示量(单位需与Cn一致) V2为溶出介质体积;其中 Cn为各时间点取出后的样品浓度(即稀释前的) ; V1为各时间点固定取样体积;4. 曲线比较法 由于多 pH 值溶出曲线的绘制已成为剖析和表达固体制剂内在品质的重要手段,故对溶 出曲线比较的科学评价愈发重要。
多介质溶出曲线的比较 溶出仪机械校验结果

多介质溶出曲线的比较溶出仪机械校验结果
多介质溶出曲线的比较可以用于判断同一批药品在不同溶出条件下的溶出特性是否一致。
一般来说,多介质溶出曲线分析是通过使用不同介质对药品进行溶解试验,然后记录溶解药物的浓度变化情况,最终比较不同溶出条件下的药物释放速率和时间等参数的差异。
而溶出仪机械校验结果则主要是为了保证溶出仪的稳定性和准确性,以确保药物溶解实验的可靠性。
机械校验通常包括检查样品架、转子、马达、电子装置等方面的功能是否正常,并且根据实验室所使用的标准进行检查并记录结果。
常见的机械校验标准包括美国药典(USP)以及欧洲药典(EP)等。
因此,多介质溶出曲线比较和溶出仪机械校验结果都是评估药物溶解实验可靠性和质量的重要指标,可以协同使用来确保实验结果的准确性和可靠性。
溶出度对比研究四种溶出介质的比较样本

001【求助】溶出度对比研究-四种溶出介质的比较作者: wangjianglin332(站内联系TA)发布: -10-21 Sample Text溶出度作为工艺筛选和质量研究的重要评价指标, 按当前的审评要求必须做详尽的研究, 现今一上市品种的仿制, 溶出度研究碰到比较棘手的问题, 望园中的前辈不吝赐教。
1.主药易溶于水, 溶解度为0.1g/ml, 一剂量( 240mg) 的主药在250ml四种溶出介质( 酸(0.1mol/L盐酸溶液)、 pH=4.5(醋酸-醋酸钠缓冲液)、 pH=6.8(磷酸盐缓冲液)、水) 能完全溶解。
胶囊剂崩解时限为3分钟, 胶囊崩解药物即可溶出, 实验结果也表明在水中, 10分钟药物的溶出量即可达到90%以上, 此种情况还是否需要经过溶出曲线的相似性来判定自制样品和市售品溶出行为的一致性? 园中有帖子谈到用ICH指导原则的三步法进行考察, 那么最后一步证明崩解和溶出具有相关性如何考察?2.溶出度的比较研究一般需考察自制品和市售品在四种溶出介质( 酸(0.1mol/L 盐酸溶液)、 pH=4.5(醋酸-醋酸钠缓冲液)、 pH=6.8(磷酸盐缓冲液)、水) 中的溶出行为, 溶出量的测定方法也一般采用UV法进行测定。
本品取样后, 需进行衍生化反应后才有紫外吸收(一般情况紫外最大吸收波长为195nm, 衍生化后为525nm), 但在实验研究过程中我们发现, 介质酸中样品1小时后吸光值在0. 1至0.2的范围, 不符合紫外吸收值的误差范围; 介质pH=4.5(醋酸-醋酸钠缓冲液)中1小时后样品吸光值为0, 推断无衍生化反应发生; 介质pH=6.8(磷酸盐缓冲液)中1小时后样品吸光值也在0.1至0.2的范围内, 不符合紫外吸收值的误差范围。
综合推断, 除水以外, 另外三种介质对衍生化反应均有不同程度影响, 溶出量无法准确测定, 此种情况下能否以水一种介质进行溶出度的对比研究?举报删除此信息caoyuan521(站内联系TA)问题一: 在国内一般有溶出检测项目的制剂都不再检测崩解项目了。
溶出曲线的测定与比较

上海市药品检验所 谢沐风撰写 xiemufeng@ 本文版权归作者所有,任何个人或团体使用本文内容,请与作者联系。
【No.5 —— 溶出曲线的测定】1. 关于测定时间点和结束时间点的设定 对于测定时间点,普通制剂与肠溶制剂可为 5、10、15、20、30、45、60、90、120 分钟,此后每隔 1 小时直至 6 小时止;缓控释制剂可为 15、30、45、60、90、120 分钟,3、 4、5、6、8、10、12、24 小时。
当连续两点溶出率均达 90%(调释制剂为 85%)以上、且 差值在 5%以内时,试验则可提前结束。
对于结束时间点,在酸性介质中(如 pH 值 1.0)最长测定时间为 2 小时,在其他各 pH 值介质中普通制剂为 6 小时,缓控释制剂为 24 小时。
2. 其他事项 (1) 试验样品 用于比较的两种制剂含量差值应在 5%以内;每个品种各取 12 个单位。
取三个批号样品,在最终溶出率均可达 90%以上的溶出介质(2) 参比制剂标准批号的选择中,取溶出率在约 70%处、位于中间批号的样品进行试验。
在进行仿制药研发时,考虑到原研品批间差异与耐受性,建议从市场流通渠道获得有效 期内不同时间段的 3~5 批样品,分别测定后,取结果均值用于比较;并同时确定参比制剂在 各 pH 值溶出曲线的波动范围,以更为有效地评估原研制剂内在质量和自身仿制制剂的研发 深入程度。
如果主成分是在溶解状态下进行溶出度试验的(如一些散剂、颗粒剂) ,则适当选择某一 批号,即可。
(3) 试验样品的生产规模 由于固体制剂生物利用度与生产规模密切相关, 故一般情况下应不少于今后工业化最大生产规模的 1/10 或不少于 10 万个单位。
1上海市药品检验所 谢沐风撰写 xiemufeng@ 本文版权归作者所有,任何个人或团体使用本文内容,请与作者联系。
3. 累积释放度校正计算公式 在多次取样时、可采取及时补充相同体积同温度溶出介质亦可采取不补液两种方式,但 必须保证每次抽取体积的固定性。
不同溶出介质中头孢地尼胶囊溶出曲线的相似性比较

不同溶出介质中头孢地尼胶囊溶出曲线的相似性比较刘小燕;金涌;臧洪梅【摘要】目的采用不同溶出介质进行头孢地尼胶囊溶出度实验,考察不同溶出条件对头孢地尼胶囊溶出度的影响,同时为难溶性药物制剂质量判断提供参考.方法以盐酸溶液(稀盐酸24→1000)、水、PBS4.0缓冲溶液、PBS7.0缓冲溶液为溶出介质,绘制参比制剂和自制制剂的溶出曲线,以相似因子f2作为指标,对比自制制剂与参比制剂溶出特性.结论在这4种介质中,参比制剂与自制制剂相似高于60.结论自制制剂与参比制剂在4种不同介质中溶出行为基本一致.%Objective To compare the dissolution curves of cefdinir capsules in various dissolution media and to provide the reference for insoluble drug quality evaluation. Methods The dissolution curves of the cefdinir capsules were determined in various dissolution media, and the resemblances of dissolution curve were compared by similarity factors ( f2 ). Results The similarity factors ( f2 ) in various conditions were over 60. Conclusion The dissolution curve of two products in various dissolution media was in good comparability .【期刊名称】《安徽医药》【年(卷),期】2013(017)005【总页数】4页(P749-752)【关键词】头孢地尼;胶囊;溶出;相似因子【作者】刘小燕;金涌;臧洪梅【作者单位】安徽医科大学药学院,安徽,合肥,230032【正文语种】中文难溶性药物的溶出度是影响其生物利用度的重要因素,因此,体外溶出度是考察制剂质量的重要指标,溶出度项目也是难溶性药物制剂质量标准定制的重点内容[1-2]。
优选不同介质溶出曲线比较

F1 因 子 计 算 公 式
n
Rt Tt
f1 t 1 n
Rt
100
t 1
Rt和Tt分别表示两制剂在第n个取样点的平均累积溶出率。
F2 因 子 计 算 公 式
f2 50log
100
n
1
( Rt Tt )2
i1
n
Rt和Tt分别表示两制剂在第n个取样点的平均累积溶出率。
体外溶出曲线比较的具体操作
<f1因子和f2因子的判定标准>
n对于计算结果的贡献尤甚!
f2因子计算时间点的选择
(1)溶出量在85%(缓控释制剂80%)以上的时间 点仅能选取一个。
(2)普通速释制剂选取3~4个、缓控释制剂选取3~5 个时间点。
(3)时间点的选择以溶出量尽可能等分为原则。
f2因子计算时间点的选择
时间点的选择以溶出量尽可能等分为原则。 加入最终溶出量为89% 1、四等分,在原研制剂的溶出曲线上寻找22.25%、
<对原研品/参比制剂 样品批号的遴选> ❖ 原则上从市场上购买来不同时间点的不同批号,分别测定, 观测溶出曲线波动情况。 <对仿制制剂样品的要求> ❖ 生产规模10万单位或今后最大生产规模的1/10 ❖ 含量与参比制剂的差值应在5%以内。 <对测定样品数的要求>
理论上个测定12个单位,现实情况测定6个单位即可,甚 至可以更少(预试验时)!主要有统计学参数确定。
如何运用溶出曲线剖析原研品的实施步骤
❖ 对原研制剂的剖析: <对于测定时间点>
普通制剂与肠溶制剂可为5、10、15、20、30、45、60、 90、120分钟,此后每隔1小时直至6小时止;缓控释制剂可 为15、30、45、60、90、120分钟,3、4、5、6、8、10、 12、24小时。当连续两点溶出率均达90%(缓控释制剂为 85%)以上、且差值在5%以内时,试验则可提前结束。 <对于结束时间点>
多潘立酮片在不同溶出介质中的溶出曲线比较

706西北药学杂志2020年9月第35卷第5期乳、脂质体等液体制剂固体化有一定的参考意义。
该 分散片较好地保持了液体自乳化给药系统的特性,有 望提高如卡维地洛等生物药剂学n类药物的生物利 用度,扩展自乳化给药系统的应用范围。
参考文献:[1] B r il A,S liv ja k M,D im a r tin o M J,e t a l.C a rd io p ro te c tiv ee ffe cts of c a r v e d ilo l,a n o ve l beta a d re n o c e p to r a n tag o n is tw ith v a s o d ila tin g p r o p e r tis s,in an ae sth e tise d m in ip ig s:c o m p a ris o n w it!p r o p ra n o lo l[J].C a rd io v a s c R s s,1992,26(5):518-525.[2] D u n n C J,L e a A P,W a g s ta ff A J.C a rve d ilo l.A reappraisalo f its pharm acological properties and therapeutic use in cardiovascular disorders[J].D ru g s,1997,54(1) :161-185.[3] M c t a v is h D,C a m p o ii-R ic h a rd s D,S o rk in E M.C a rv ed ilo l.A re v ie w of its p h a rm a c o d y n a m ic and p h a rm a c o k in e tic p r o p e r tie s,and th e ra p e u tic e ffic a c y[J].D r u g s,1993,45(2):232-258.[4] A y o u b M,H a s a n A,N a h a s H,t a l.E n h a n c in g o ra l b ioa v a ilab ility o fc a rv ed ilo l u s in g s o lid d is pe rs io n te ch n iq u e[J].I n t J P h a rm P h a rm S c i,2016,8(7) :193-199.[5] Z o g h b i A,W a n g B.C a rv e d ilo l s o lu b ility en hance m en t b yin c lu s io n c o m p le x a tio n and s o lid d is p e rs io n:re v ie w[J].JD r u g D e liv T e c,2015,5(2) :1-8.[6] J a n a k ira m a n A K,S u m a th i B,Saleem T M,et a l.D e sig nand e v a lu a tio n o f C a rv e d ilo l N a n o c ry s ta ls S u sta in e d R elease T a b le ts[J].J A p p l P h a rm Sci?2017,7(4):61-68. [7] A b o u d H M,E l K o m y M H?A l i A A?et a l.D e v e lo pm e n t,o p tim iz a tio n,and e v a lu a tio n o f C a rv e d ilo l-L o a d e dS o lid L ip id N a n o p a rtic le s fo r in tra n a s a l d ru g d e liv e ry[J].A A P S P h a r m S ii T e c h,2016,17(6):1353-1365.[]冯丽杰,王柏.2-羟丙基环糊精对卡维地洛增溶作用 的研究[J].药学进展,2013,37(9)460-463.[9] H u Y C,Z h i Z Z,Z h a o Q F,et a l.3D c u b ic m e s o p o r o u ss ilic a m icrosphere as a ca rrier fo r p o o rly soluble d ru g carve-d ilo l[J].M ic ro p o r M esopor M a t,2012,1 47(1) :94-101.[10] A lk ila n i A Z,H a m e d R,A l-M a r a b e h S,et a l.N a n o e m u lsion-base d f ilm fo r m u la tio n fo r tra n s d e rm a l d e liv e ry o fc a rv ed ilo l[J].J D ru g De liv S ii T e c h,2018,46 :122-128.[11] C h a va n R B,M o d i S R,B a n s a l A K.R o le of s o lid c a r ri-ess in p h a rm a c e u tic a l p e rfo rm a n c e o f s o lid s u p e rs a tu rab le S E D D S o fc e le c o x ib[J].I n t J P h a r m,2015,495(1):374-384.[2]刘晓庆,郑春丽,丁亚飞,等.达比加群酯自微乳分散片的制备及质量评价[J].中国新药杂志,2017,26 (16):1942-1947.[13] C h a i F J,S u n L L,D i n g Y F,e t a l.A s o l i d s e l f-nanoe-m u ls ify in g s y ste m o f th e BC S class n b d ru g d a b ig a tra ne te x ila te to im p ro v e o ra l b io a v a ila b ility[J].N a n o m e d icine (L o n d),2016,11(14):1801-1816.[14] Y e o m D W,Chae B R,K im J H,et a l.S o lid fo r m u la tio no f a s u p e rs a tu ra b le s e lf-m ic ro e m u ls ify in g d ru g d e liv e rys y ste m fo r v a ls a rta n w ith im p ro v e d d is s o lu tio n and b ioa v a ilab ility[J].O nc o ta rg e t,2017,8(55) :94297-94316.[15] Q i X L,Q in J Y,M a N,et a l.S o lid s e lf-m ic ro e m u ls ify in gd is pe rs ib le ta b le ts of c e la s tro l:fo rm u la tio n d e v e lo p m e n t,c h a ra te riz a tio n and b io a v a ila b ilitye v a lu a tio n[J].In t JP h a rm 2014 472:40-47.[16] K a rw a l R,G a rg T,R a th G,et a l.C u rre n t tre n d s in se l-e m u ls ify in g d ru g-d e liv e ry syste m s (S E D D s)to enhanceth e b io a v a ila b ility o f p o o rly w a te r-s o lu b le d ru g s[J].C r itR e v T h e r D ru g C a rrie r S y s t,2016,33(1) :1-39.[17] B a la t a G F,E a s s a E A,S h a m a r d lH A,e t a l.S e lf-e m u lri-fy in g d ru g d e liv e ry syste m s as a to o l to im p ro v e s o lu b ility and b io a v a ila b ility o f r e s v e ra tro l[J].D ru g Des D e v ilT h e r,2016,10:117-128.[8]张雅捷,刘晓庆,陈敏,等.达比加群酯纳米乳的制备及体外评价[J].中国药科大学学报,2016,47(6)688-693.[9]刘晓庆,郑春丽,张雅捷,等.达比加群酯磷脂复合物纳米乳的制备及体外评价[J].西北药学杂志,2018, 33(4)512-516.[20] K a sse m A M,Ib r a h im H M,S am y A M.D e v e lo p m e n tand o p tim iz a tio n o f a to rv a s ta tin c a lc iu m load ed se l-n a n o e m u ls ify in g d ru g d e liv e ry s yste m (S N E D D S)fo ren h a n cin g o ra l b io a v a ila b ility:in w T ro and in vivo e v a lu-a tio n[J].J M ic ro e n c a p s u l,2017,34(3): 319-333.(收稿日期:2020-01-02)多潘立酮片在不同溶出介质中的溶出曲线比较刘雪峰1,王荣2,妙苗1,王荪璇1,王嫦鹤陕西省食品药品监督检验研究院,西安710065 &.西安医学院,西安710021)摘要:目的测定多潘立酮片在5种溶出介质中的溶出曲线,并与参比制#的溶出曲线进行比较,为全面评价药品体外溶出行为提供参3#方法采用桨法,转速为50 r'm in 1,以p H值为1 2的盐酸与p H值为4.5,6.0和6.8的磷酸盐(P B S)缓冲液以及水为溶出介质,采用H P L C法测定累积溶出量并绘制溶出曲线,采用八因子法计算相似度#结果被测样品在5种介质中与参比制#的溶出曲线相似#结论被测样品具有与参比制#相似的体外溶出行为#关键词:多潘立酮片;溶出曲线;H P L C法;八因子D O I:10.3969). is s n.1004-2407. 2020. 05.016中图分类号:R94 文献标志码:A文章编号:1004-2407(2020)05-0706-04基金项目:重大新药创制专项-药物一致性评价关键技术与标准研究项目(编号:017Z X09101001)http://X B Y Z. cbpt. cnki. net西北药学杂志2020年9月第35卷第5期707 Comparison of dissolution curves of Domperidone Tablets in different mediaL I U X u e fe n g1,W A N G R o n g2,M I A O M ia o1,W A N G S u n x u a n1,W A N G C h a n g h e1(1.S h a a n xi In s titu te fo r F o o d t r o l,X i^an710065 ,C h in a;2.X i^a n M e d ic a l U n iv e r s ity an710021,C h in a)A b s tra c t:T o d e te rm in e th e d is s o lu tio n p ro fils s o f D o m p e rid o n e T a b le ts in5d is s o lu tio n m e d ia,to com p a re w ith th e re fe rence p re p a ra tio n s and to p ro v id e th e basis fo r a c o m p re h e n sive e v a lu a tio n o f d ru g d is s o lu tio nT h e pa d d le m e th o d w as a d opte d a t 50r •m in 1,and h y d ro c h lo ric acid s o lu tio n w it h p H 1.2,p h o sp h a te b u ffe r saline (P B S)w ith p H4.5,6. 0,6. 8and w a te r as th e d is s o lu tio n m e d ia,p ro file s w e re d e te rm in e d w ith H P L C,a n d c o m p a ra tiv e ly analyzed b y(2fa c to r m e th o d.T h e d is s o lu tio n cu rve s o f th e te ste d sam ples are s im ila r to th e re fe re n ce p re p a ra tio n in th e5d is s o lutio n m e d ia.T h e d is s o lu tio n b e h a v io r o f th e te ste d sam ple w as s im ila r to th e re fe re n ce p re p a ra tio n in vitro.K e y w o rd s:D o m p e rid o n e T a b le ts;d is s o lu tio n c u r v e;H P L C;/2fa c to r多潘立酮是具有抗呕吐作用的多巴胺受体拮抗剂[12],临床主治功能性、器质性、感染性等恶心、呕吐 和非溃瘍性消化不良[36]+通过测定其在多种p H条 件下的药物溶出曲线(10],用于评价多潘立酮口服固 体制剂的质量(1];通过比对溶出曲线和参比制剂进行相似度评价,从而推测其在生物利用度方面的差异[12]。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
F1 因 子 计 算 公 式
f 1
R T
t 1 t
n
t
R
t 1
n
100
t
Rt和Tt分别表示两制剂在第n个取样点的平均累积溶出率。
F2 因 子 计 算 公 式
f 50l og 2 1 100 n 2 ( R T ) t t i 1 n
这是比石头还坚硬的药物!)
体外溶出曲线比较的具体操作
原研制剂曲线类型
<参比制剂15分钟溶出量达85%以上时(前提50转)> ★ 无需采用f1和f2因子比较。 ★ 仿制制剂在15分钟内平均溶出率也达85%以上。
★ 强调:无需关注5、10分钟、20/30分钟溶出量,但需测定。
体外溶出曲线比较的具体操作
精密度的优劣说明均值是否具有代表性: (注意非测定时间点、而是计算时间点)
<对于原研制剂> 以上所选用的第一时间点溶出结果变异系数(RSD)应不得过 20%,自第二时间点至最后时间点溶出结果变异系数(RSD)均应 不得过10%。
若不符合,应从仪器适用性予以考虑解决,如增加转速。
原研制剂曲线类型
<参比制剂在15~30分钟内溶出量达85%以上时>
☺ 采用f2因子比较时,比较5或10、15、30分钟三个时 间点。(根据溶出量等分原则选择5或10min) ☺ 对应于参比制剂平均溶出率分别为60%和85%两个时 间点,两者平均溶出量差均在〒15%范围内;
< 参比制剂在30分钟后达85%以上时>
用超声法(盐的溶解方式亦如此)。
(3) 试验前应首先进行原料药在各pH值溶出介质中的稳定性 考察,以确保试验数据的准确测定。
如何运用溶出曲线剖析原研品的实施步骤
对原研制剂的剖析:
<对于测定时间点> 普通制剂与肠溶制剂可为5、10、15、20、30、45、60、 90、120分钟,此后每隔1小时直至6小时止;缓控释制剂可 为15、30、45、60、90、120分钟,3、4、5、6、8、10、 12、24小时。当连续两点溶出率均达90%(缓控释制剂为 85%)以上、且差值在5%以内时,试验则可提前结束。 <对于结束时间点> 在酸性介质中最长测定时间为2小时,在其他各pH值介质 中普通制剂为6小时,缓控释制剂为24小时。
有机溶剂:对比剖析时可加入,但最终拟定质量标准时 决不允许添加。 <表面活性剂种类> 阐述最常用的十二烷基硫酸钠和吐温-80的优缺点
放宽溶出试验参数的“最极端条件”
装臵:桨板法 转速:100转 加入表面活性剂:3.0%浓度
引申至创新药:在以上条件下,如仍难以有任何一个介质
达85%以上溶出量,则建议慎重考虑,放弃研发!(说明
如何运用溶出曲线剖析原研品的实施步骤
对原研制剂的剖析:
<装臵与转速> 片剂:桨板法/50转起始。
胶囊剂:转篮法/50转或桨板法/50转(加沉降蓝)起始。
<溶出介质> 不建议采用小杯法,一律采用900ml或1000ml。 如样品浓度过低,可采用加大进样量至50~500μl。
如何运用溶出曲线剖析原研品的实施步骤
如何运用溶出曲线剖析原研品的实施步骤
至少四种溶出介质:
【普通制剂】 (1)酸性药物 pH值分别为1.2、5.5~6.5、6.8~7.5和水; (2)中/碱性药物和包衣制剂 pH值分别为1.2、3.0~5.0、6.8和水; (3)难溶性药物制剂 pH值分别为1.2、4.0~4.5、6.8和水; (4)肠溶制剂 pH值分别为1.2、6.0、6.8和水;
如何运用溶出曲线剖析原研品的实施步骤
<对原研品/参比制剂 样品批号的遴选> 原则上从市场上购买来不同时间点的不同批号,分别测 定,观测溶出曲线波动情况。
<对仿制制剂样品的要求>
生产规模10万单位或今后最大生产规模的1/10 含量与参比制剂的差值应在5%以内。
<对测定样品数的要求>
理论上个测定12个单位,现实情况测定6个单位即可,甚 至可以更少(预试验时)!主要有统计学参数确定。
Rt和Tt分别表示两制剂在第n个取样点的平均累积溶出率。
n对于计算结果的贡献尤甚!
f2因子计算时间点的选择
(1) 溶出量在85%(缓控释制剂80%)以上的时间
点仅能选取一个。 (2) 普通速释制剂选取3~4个、缓控释制剂选取3~5 个时间点。 (3) 时间点的选择以溶出量尽可能等分为原则。
f2因子计算时间点的选择
【缓/控释制剂】
pH值分别为1.2、3.0~5.0、6.8~7.5和水。 #与美国作法有所不同:美国统一采用1.0、4.5、6.8和水。
如何运用溶出曲线剖析原研品的实施步骤
溶出介质配制方法:
(1)各国不尽相同、建议根据原研制剂生产厂商的国别而定。 各国药典对缓冲盐溶液的浓度有特殊的要求。 (2) 表面活性剂加入时,一定采用煮沸法配制,绝对不要采
时间点的选择以溶出量尽可能等分为原则。
加入最终溶出量为89%
1、四等分,在原研制剂的溶出曲线上寻找 22.25%、
44.5%、66.75%的最相近的溶出时间点。 2、三等分,在原研制剂的溶出曲线上寻找29.66%、 59.33%的最相近的溶出时间点。 采用以上时间点以及89%溶出的时间点比较因子。
对于f2因子计算时间点数据精密度的规定
对原研制剂的剖析: <试验参数的放宽>
在某溶出介质中最终溶出量未达要求、无法进行比较时, 首选加表面活性剂方式:浓度以0.01%(w/v)为起点、按照1、 2、5级别逐步增加,不建议采用3.0%以上浓度。
但当精密度差、必须提高精密度才能使溶出均值更具代 表性时,采用提高转速至75~100转方式。
仿制药研发的必由之路 → “殊途同归”
生物利用度 相同
90%
生物利用度
体外多条溶出曲线
相同
体外多条溶出曲线
不同 处方/辅料/制剂工艺 相同 原研药 处方/辅料/制剂工艺
仿制药
仿制药研发是否成功的评价
● 首先测定原研品的多条溶出曲线 ● 仿制药研发进程:小试 → 中试 → 放大 以上每一步骤样品的多条曲线均应与原研 品一致,直至放大生产到一定规模、连续三 批(每批10万片或今后最大生产规模的 1/10),即宣告“仿制成功”!
