OMEGA小提试剂盒提取质粒步骤(中文翻译版)
质粒中提中文版(Omega)

中提质粒步骤材料准备:灭菌250或500mL三角瓶,托盘天平,5mL移液枪及枪头,卫生纸,废液缸,记号笔,50mL 圆底离心管,15mL尖底离心管步骤:1.集菌将100mL菌液分批倒入50mL圆底离心管中,室温12000rpm离心1min,弃流出液体,打开盖倒置吸水纸上控干。
2.加入2.5mL solution I(提前加入RNase,4℃保存),重悬细菌沉淀(可使用5mL移液枪吹打)。
3.加入2.5mL solution II,轻柔混匀(颠倒离心管7-10次),以获得清亮的裂解物,室温静置3-5min。
(此步主要是碱裂解细菌,使其中的蛋白质和DNA变性,反应时间不能太长,否则容易使大肠杆菌的基因组DNA断裂成小片段,污染质粒DNA)4.加入1.25mL Buffer N3,轻柔混匀(颠倒离心管7-10次),直至形成白色沉淀,室温静置2-3min。
5.4℃12000rpm离心10min,使白色沉淀沉于底部。
6.取出一个Lysate Clearance Filter Syringe,抽出活塞,小心将5中液体全部转移至注射器中(注射器可不放活塞直接直立于4中的离心管中,液体不会出来),室温静置2min。
7.将6中注射器放置于一新的15mL离心管,轻推注射器活塞,使液体流入离心管中。
8.加入0.1倍体积的ETR(约600uL)至过滤后的液体中,混匀(颠倒离心管7-10次),冰浴20min,期间颠倒离心管几次。
(此期间准备一个Hind-Bind DNA midi Column加入2mL GPS Buffer,室温静置10min,4000rpm离心5min)9.42℃温浴5min,溶菌液变浑浊,室温4000rpm离心5min,则ETR沉入底部。
10.小心将上层液体转移至一新的15或10mL离心管中,加入0.5倍体积的EtOH(约2.5mL),轻柔混颠倒5-6次,室温静置2min。
11.将10中液体加入柱子中,室温4000rpm离心5min,弃液体,重新装好柱子,直至液体全部滤过。
omga质粒提取试剂盒_说明书_翻译

omgaE.Z.N.A.质粒试剂盒操作规程说明书(译版)1. 自新鲜划痕选择培养板中分离单菌落,接种含适当选择性抗生素的2-5ml的LB或YT培养基进行培养。
37℃强力摇动(~300rpm)孵育20-24h。
使用10-20ml培养管或容量至少4倍于培养容积的培养瓶。
强烈推荐使用endA阴性大肠杆菌菌株进行常规质粒分离。
此类菌株包括DH5α和JM109。
2. 将1.5-5.0ml细菌菌液室温13,000 g离心3min。
轻轻倒出或吸走培养基并丢弃。
3. 加入200μl 的溶液Buffer T 1/Rnase A重悬沉淀,涡旋或用移液器反复吹打。
充分重悬沉淀对于获得高质量的DNA非常重要。
4. 加入200μl溶液Buffer T 2,倒置、转动试管5-10次使之轻轻混匀,得到透明的裂解产物。
室温孵育5min。
不要用力混合,以免使染色体DNA断裂,减低质粒的纯度。
该步反应不要超过5min。
溶液II不用时要拧紧瓶盖,以免试剂被空气中的CO2酸化。
5. 加入200μl溶液Buffer T 3,立即倒置试管15-20次混匀,直至白色絮状沉淀物形成。
冰上孵育5min。
为避免形成局部沉淀,加入溶液III后应立即、充分混匀溶液。
6. 4℃13,000 g离心10分钟。
白色沉淀物形成,立即进行下一步操作。
7. 小心翼翼的吸取上清液,加入到新的1.5ml离心管(不是试剂盒提供的)中。
加入200ul 用异丙醇稀释的BAC 结合液(缓冲液),颠倒3-5次充分混匀。
BAC 结合液使用前必须用96%-100%的异丙醇稀释,详细的说明见瓶壁或第三页说明书8.加入样本DNA(HiBind DNA MicroElute)到提供的2ml收集管中。
9. 室温8000g离心30s,丢弃收集管,将离心柱放入新的收集管中。
10. 将收集柱放回收集管并加入750ul SPM buffer(用乙醇稀释),室温8000g离心30s,丢弃收集管,将离心柱放入新的收集管中。
OMEGArna提取试剂盒中文说明

E.Z.N.A. Total RNA Kit I (R6834-01 50 preps)步骤A . 真核细胞和组织自己需要的材料:β-巯基乙醇、70%乙醇(DEPC 水配置)、除RNase 的枪头和EP 管。
材料的最佳量想得到最佳的产量和好的Hibind RNA 柱的纯化效果,选用正确的细胞和组织量是最重要的。
Hibind RNA 柱的最大处理量是可变的,根据细胞和组织的类型。
最大的结合能力是100ug 的RNA 。
TRK 裂解缓冲液的最大裂解能力是1*107个细胞或30mg 的组织。
细胞的步骤1. 用500ul 的TRK 裂解缓冲液裂解细胞(≤1*107),使细胞团松散,轻轻弹EP 管或者用枪头吹旋,再用漩涡振荡混匀。
a) 使用前每1ml TRK 裂解缓冲液加入20ul 的β-巯基乙醇。
b) 如果是单层的组织培养细胞(成纤维细胞,内皮细胞等),可以直接在细胞培养器里裂解细胞。
完全吸去培养基后直接加TRK 裂解缓冲液至细胞中。
加700ul 的TRK 到T35细颈瓶或10cm 的培养皿中,更小的培养器加500ul 的TRK 。
将液体布满整个器皿表面,确保细胞裂解完全。
将裂解产物转移至1.5mlEP 管中。
c) 如果细胞是悬液培养,收集细胞(≤1,500rpm or 400*g )*5min ,弃上清,加入TRK裂解液,漩涡振荡混匀。
2. 匀浆化裂解产物“裂解和匀浆化样品”-第四页有详细的说明,如果细胞≤1*105,漩涡振荡1min 。
不完全使样品匀浆化会显著的减少RNA 的产量还容易造成柱子堵塞。
a) 用匀浆器30 s ,使样品匀浆化。
b) 用钝的针头的注射器(0.9mm 直径),至少吹打5次是样品匀浆化。
注射器要除RNase 。
3. 将匀浆后的裂解产物转移至Homogenization Spin Column 中,离心,≥1,4000*g, 3min,室温。
将离心收集的流出液转移到新的EP 管中。
OMEGA小提试剂盒提取质粒步骤(无内毒)

OMEGA小提试剂盒提取质粒步骤(中文翻译版)1、将携带目的质粒的大肠杆菌接种于含10~15ul基础培养基/氨苄西林培养介质的50ml培养瓶中。
2、室温下500×g离心10min。
3、弃去上清,剩余沉淀物中加入500ul的SolutionⅠ/RNase A,彻底混匀。
4、将混悬液移至新的2ml离心管中,加入500ul SolutionⅡ,轻柔彻底混匀,可得清亮的细菌裂解物,室温下孵育2min(混匀时用力过大,可破碎出染色体DNA,使目的质粒纯度下降)。
5、向4中液体加入250ul预冷的Buffer N3,轻柔、彻底混匀,直到出现白色絮状沉淀,4℃≥12000×g离心10min(可室温,最好4℃)(Buffer应彻底混匀,若混合物粘稠呈棕色或呈球状,应多混匀几次以中和溶液,溶液的彻底中和对于获得好的产出是必要的)。
6、小心吸取并将上清液转移进新的1.5ml离心管1:0.1的比例向上清液中加入ETR Solution 混匀溶液并于冰上孵育10min,孵育过程中颠倒几次以混匀(加入ETR Solution后,细菌裂解物将出现浑浊,但冰上孵育后将变澄清)(勿用2ml离心管收集上清,因为2ml离心管中有太多液体时,ETR Solution将悬浮于溶液中)。
7、将6中液体于42℃孵育5min,溶液将再次变浑。
室温下12000×g离心3min,ETR Solution 将于离心管底部形成蓝色层。
8、将上层水相转移入新的2ml离心管中,按1:0.5的比例加入无水乙醇(室温,96~100%),轻柔混匀,室温下孵育1~2min。
9、将8中的溶液取700ul到柱子中,组装收集管,室温下1000×g离心1min,弃去收集管中通过柱子的液体,柱子和收集管重复利用。
10、重复9中步骤,直到收集的细菌裂解物全部用完。
11、将500ul Buffer HB加入柱子中,室温下1000×g离心1min,弃去收集管中废液(目的:将残存的蛋白污染物除去,是获得高质量DNA所必需的)。
OMEGA小提试剂盒提取质粒步骤

OMEGA小提试剂盒提取质粒步骤以下是使用OMEGA小提试剂盒提取质粒的步骤:1. 打开Omega小提试剂盒,并将试剂瓶放置在室温下15-30分钟,以使其达到室温。
同时,将所需试剂加热至37°C,并准备其他必要的材料和试剂。
2.使用无菌技术,取出含有目标质粒的菌落并转移到15mL离心管中。
注射100-500µL的STET缓冲液(一种细胞裂解缓冲液)至离心管中。
3. 使用无菌技术,将质粒菌落悬浮液均匀涂布到2% Made by Omicron小鼠胚胎或其他适当的琼脂糖琼脂糖板(SD盘)上。
将板培养在37°C的培养箱中,24-48小时。
4.在培养后,用移液器或吸管轻轻吹气将质粒菌落悬浮液从SD盘转移到1.5mL(或2mL)离心管中。
5.离心细胞,以将固体与培养上清分离。
将离心条件设置为13,000×g,4°C,5分钟。
6.丢弃上清液并用1mLSTET缓冲液洗涤菌落。
在洗涤步骤中,轻轻上下振荡离心管,以确保洗涤液均匀地覆盖菌落。
7.离心细胞,以将液体与固体分离。
将离心条件设置为13,000×g,4°C,5分钟。
丢弃上清液。
8.重新悬浮菌落,使用约200-500µLSTET缓冲液,并轻轻振荡离心管,直到完全悬浮。
9. 取1.5 mL离心管中的样品,加入等体积的Lysis Buffer G2,并快速倒置混合,以完全裂解细胞,并将细胞内容物释放到溶解液中。
10. 加入等体积的N3 Buffer,并轻轻倒置混合,以中和裂解反应。
11. 加入等体积的G3 Buffer,并轻轻倒置混合。
此时,样品已经准备好进行DNA纯化。
请注意,上述步骤仅提供了OMEGA小提试剂盒提取质粒的基本步骤。
根据具体实验要求和试剂盒的使用说明,步骤可能会有所不同。
在开始实验之前,请仔细阅读并遵守试剂盒的使用说明。
omega质粒提取试剂盒原理

omega质粒提取试剂盒原理
omega质粒提取试剂盒是一种快速提取质粒的试剂盒,原理基于离心法和碱裂解法。
质粒提取步骤如下:
1.细菌菌落挑选:选择莱茵氏或理光法制备的菌落,接种到含有复性2倍YT培养基中的管中,温育至15-18小时,使生长到中期即可。
2.洗涤菌体:离心收集菌体细胞,使用TE液洗涤菌体,通过离心去除菌体细胞内部的杂质。
3.裂解细胞:用离心的菌体用Alkali Lysis Buffer裂解细胞。
使得细胞壁和细胞膜破裂,游离出细菌的质粒和基因组DNA。
此时保持碱性能稳定质粒。
4.中和试剂添加:使用HCl溶液中和裂解碱的催化活性,维持实验体系pH值在7.0左右。
5.离心收集DNA:用NaCl把DNA从碱性溶液中析出,并通过离心将DNA沉淀下来。
6.洗涤DNA:用乙醇洗涤钠盐,去除残留的离子,甘油可保持溶液中的DNA
稳定性。
7.重悬质粒:将去除干扰物后的纯质粒在TE缓冲液中重悬,即可用于下一步实验。
质粒小提试剂盒提取质粒

质粒小提试剂盒提取质粒
(1)柱平衡步骤:向吸附柱CP3中(吸附柱放入收集管中)加入500μL的平衡液BL,12,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中;
(2)取1-5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm离心1分钟,尽量吸除上清;
(3)向留有菌体沉淀的离心管中加入250μL溶液P1(先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌沉淀;
(4)向离心管中加入250μL溶液P2,温和地上下翻转6-8次使菌体充分裂解;
(5)向离心管中加入350μL溶液P3,立即温和地上下翻转6-8次,充分混匀,此时将出现白色絮状沉淀。
12,000rpm离心10分钟,此时在离心管中底部形成沉淀;
(6)将上一步收集的上清液用移液器转移到吸附柱CP3中,注意尽量不要吸出沉淀。
12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3放入收集管中;
(7)向吸附柱CP3中加入600μL漂洗液PW(先检查是否已加入无水乙醇),12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3放入收集管中;
(8)重复操作步骤(8);
(9)将吸附柱CP3放入收集管中,12,000rpm离心2分钟,目的是将吸附柱中残余的漂洗液除去;
(10)将吸附柱CP3置于一个干净的离心管中,向吸附膜的中间部位滴加50-100μL洗脱缓冲液EB,室温放置2分钟,12,000rpm离心2分钟将质粒溶液收集到离心管中。
小提质粒实验方案及详细步骤
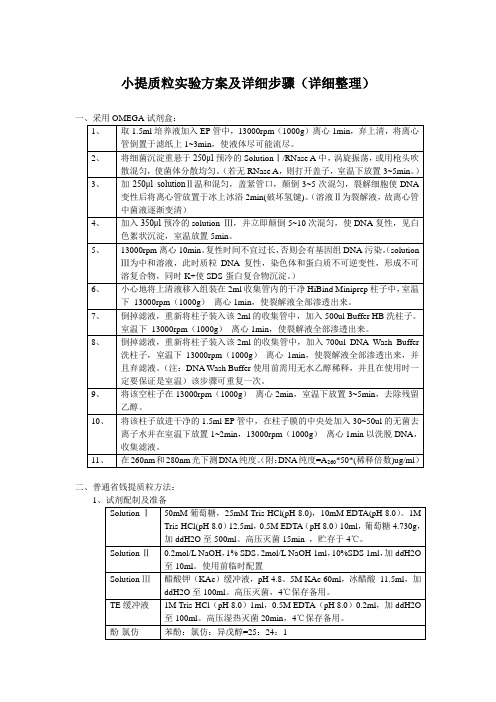
2、
3、Leabharlann 4、 5、 6、 7、Solution Ⅱ Solution Ⅲ TE 缓冲液 酚-氯仿
无水乙醇 70%乙醇 其他准备 2、具体操作步骤 1、 取 1.5ml 培养液加入 EP 管中,12000rpm 离心 2min,弃上清,将离心管倒 置于滤纸上 1~3min,使液体尽可能流尽。将细菌沉淀重悬于 100μl 预冷的 SolutionⅠ中,吹打混匀,剧烈振荡,使菌体分散均匀。打开盖子,室温 下放置 3~5min。 加 200μl 新鲜配制的 solutionⅡ,盖紧管口,颠倒 3~5 次混匀,动作温和, 裂解细胞使 DNA 变性后将离心管放置于冰上冰浴 5min(破坏氢键), (溶液 Ⅱ为裂解液,故离心管中菌液逐渐变清) 加入 150μl 预冷的 solution Ⅲ,将管温和颠倒 5~10 次混匀,使 DNA 复性, 见白色絮状沉淀,在冰上放置 5min。12000rpm 离心 10min。复性时间不 宜过长,否则会有基因组 DNA 污染。 (solution Ⅲ为中和溶液,此时质粒 DNA 复性,染色体和蛋白质不可逆变性,形成不可溶复合物,同时 K+使 SDS- 蛋 白 复 合 物 沉 淀 。 )根据菌体的量调节三种溶液的比例,保证 solution1:solution2:solution3=1:2:1.5 将上清液移入干净 EP 管中,加入 450μl 的苯酚/氯仿/异戊醇,振荡混匀, 4℃,12000rpm 离心 5min 将上清液移入另一干净 EP 管中, 加入 2.5 倍体积预冷的无水乙醇混匀 (轻 柔) ,置于-20℃冰箱放置 20min,4℃下 12000rpm 离心 10min。 弃上清,用 1ml 预冷的 70%乙醇洗涤沉淀 1-2 次,4℃离心 8000rpm,5min, 弃上清,将 EP 管倒扣与滤纸上流尽水分。静置一会儿使乙醇挥发干净。 向沉淀中加入 50μl TE 缓冲液,使 DNA 完全溶解,-20℃保存备用。 高压灭菌锅,冷冻离心机,移液枪,EP 管,滤纸,枪头,提前制冰。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
质粒提取(小提,mini kit)
1、将携带目的质粒的大肠杆菌接种于含10~15ul基础培养基/氨苄西林培养介质的50ml培养瓶中。
2、室温下5000×g离心10min。
3、弃去上清,剩余沉淀物中加入500ul的SolutionⅠ/RNase A,彻底混匀。
4、将混悬液移至新的2ml离心管中,加入500ul SolutionⅡ,轻柔彻底混匀,可得清亮的细菌裂解物,室温下孵育2min(混匀时用力过大,可破碎出染色体DNA,使目的质粒纯度下降)。
5、向4中液体加入250ul预冷的Buffer N3,轻柔、彻底混匀,直到出现白色絮状沉淀,4℃≥12000×g离心10min(可室温,最好4℃)(Buffer应彻底混匀,若混合物粘稠呈棕色或呈球状,应多混匀几次以中和溶液,溶液的彻底中和对于获得好的产出是必要的)。
6、小心吸取并将上清液转移进新的1.5ml离心管1:0.1的比例向上清液中加入ETR Solution 混匀溶液并于冰上孵育10min,孵育过程中颠倒几次以混匀(加入ETR Solution后,细菌裂解物将出现浑浊,但冰上孵育后将变澄清)(勿用2ml离心管收集上清,因为2ml离心管中有太多液体时,ETR Solution将悬浮于溶液中)。
7、将6中液体于42℃孵育5min,溶液将再次变浑。
室温下12000×g离心3min,ETR Solution将于离心管底部形成蓝色层。
8、将上层水相转移入新的2ml离心管中,按1:0.5的比例加入无水
乙醇(室温,96~100%),轻柔混匀,室温下孵育1~2min。
9、将8中的溶液取700ul到柱子中,组装收集管,室温下1000×g 离心1min,弃去收集管中通过柱子的液体,柱子和收集管重复利用。
10、重复9中步骤,直到收集的细菌裂解物全部用完。
11、将500ul Buffer HB加入柱子中,室温下10000×g离心1min,弃去收集管中废液(目的:将残存的蛋白污染物除去,是获得高质量DNA所必需的)。
12、向柱子中加入混有乙醇的700ulDNA Wash Buffer,室温下10000×g离心1min,弃去收集管中液体。
13、重复12中的步骤。
14、弃去收集管中液体,空管在最大转速(≥13000×g)离心3min 以干燥柱子(对于移除柱子中残留的乙醇是必须的)。
15、将柱子放入新的1.5ml离心管中,直接向柱子中的白色网状物上加入Endotoxin-Free Elution Buffer 80~100ul(依终产物浓度而定,可每次30ul×2次),室温下放置2min,≥13000×g离心1min,以洗提DNA(将提取约70~85%柱子中收集的DNA,可再重复一次以提取完全,但因再次加入洗提液,会使终产物浓度下降)。
声明:文档为自己翻译后逐字打出来的,有不妥之处望各位同行不吝赐教,以方便大家实验参考,谢谢。
