OMEGA小提试剂盒提取质粒步骤(无内毒)
OMEGA试剂盒操作步骤

1.称取500 mg玻璃珠于2 mL离心管中,加入0.2~0.5 g的土壤样品(最好不要超过0.3 g)。
加入1 mL SLX Mlus Buffer。
快速研磨仪65 Hz研磨2 min(时间还需要摸索调整)。
2.加入100 μL DS Buffer涡旋混匀。
3.70 ℃水浴10 min,在水浴过程中快速涡旋一下。
对于一些难以溶解的菌体,提高温度到90 ℃。
(一般将水浴温度设定为80 ℃。
)4.常温下3000 rpm 离心 3 min。
将800 μL上清液移取到2 mL 离心管中,加入270 μL SP2 Buffer,涡旋彻底混匀。
5.冰浴5 min,4 ℃ 13000 x g 离心5 min。
6.小心吸取上清液移至2 mL 离心管中,加入0.7倍体积的异丙醇。
反复颠倒20~30次混匀,将样品置于-20 ℃下 1 h。
7. 4 ℃ 13000 x g 离心10 min,沉淀DNA。
8.小心弃去上清液,确保没有丢失DNA颗粒。
将离心管倒置在吸水纸上1 min,除干液体。
9.加入200 μL Elution Buffer,涡旋10 s。
65 ℃水浴10~20 min 溶解DNA。
(具体时间根据离心管底部沉淀决定。
)10.加入50~100 μL HTR Reagent(由溶液颜色深度决定),涡旋10 s彻底混匀。
注意:HTR Reagent使用前需要摇晃瓶子使其混匀。
11.室温下静置2 min。
13000 x g 离心2 min。
12.将清澈的上清液移至2 mL 管中。
注意:如果上清液一直是土壤的暗色的话,重复步骤10~12 HTR的处理。
13.加入等体积的 XP2 缓冲液,涡旋混匀。
例如:如果第12步处理完溶液体积为250 μL,则加入250 μL XP2 缓冲液。
14.将第13步所得的液体涂到已装上收集管HiBind DNA Column 上。
10000 x g 室温离心1 min。
弃去流下的液体,收集管可以重新使用。
OMEGA小提试剂盒提取质粒步骤

OMEGA小提试剂盒提取质粒步骤以下是使用OMEGA小提试剂盒提取质粒的步骤:1. 打开Omega小提试剂盒,并将试剂瓶放置在室温下15-30分钟,以使其达到室温。
同时,将所需试剂加热至37°C,并准备其他必要的材料和试剂。
2.使用无菌技术,取出含有目标质粒的菌落并转移到15mL离心管中。
注射100-500µL的STET缓冲液(一种细胞裂解缓冲液)至离心管中。
3. 使用无菌技术,将质粒菌落悬浮液均匀涂布到2% Made by Omicron小鼠胚胎或其他适当的琼脂糖琼脂糖板(SD盘)上。
将板培养在37°C的培养箱中,24-48小时。
4.在培养后,用移液器或吸管轻轻吹气将质粒菌落悬浮液从SD盘转移到1.5mL(或2mL)离心管中。
5.离心细胞,以将固体与培养上清分离。
将离心条件设置为13,000×g,4°C,5分钟。
6.丢弃上清液并用1mLSTET缓冲液洗涤菌落。
在洗涤步骤中,轻轻上下振荡离心管,以确保洗涤液均匀地覆盖菌落。
7.离心细胞,以将液体与固体分离。
将离心条件设置为13,000×g,4°C,5分钟。
丢弃上清液。
8.重新悬浮菌落,使用约200-500µLSTET缓冲液,并轻轻振荡离心管,直到完全悬浮。
9. 取1.5 mL离心管中的样品,加入等体积的Lysis Buffer G2,并快速倒置混合,以完全裂解细胞,并将细胞内容物释放到溶解液中。
10. 加入等体积的N3 Buffer,并轻轻倒置混合,以中和裂解反应。
11. 加入等体积的G3 Buffer,并轻轻倒置混合。
此时,样品已经准备好进行DNA纯化。
请注意,上述步骤仅提供了OMEGA小提试剂盒提取质粒的基本步骤。
根据具体实验要求和试剂盒的使用说明,步骤可能会有所不同。
在开始实验之前,请仔细阅读并遵守试剂盒的使用说明。
omega质粒提取试剂盒原理

omega质粒提取试剂盒原理
omega质粒提取试剂盒是一种快速提取质粒的试剂盒,原理基于离心法和碱裂解法。
质粒提取步骤如下:
1.细菌菌落挑选:选择莱茵氏或理光法制备的菌落,接种到含有复性2倍YT培养基中的管中,温育至15-18小时,使生长到中期即可。
2.洗涤菌体:离心收集菌体细胞,使用TE液洗涤菌体,通过离心去除菌体细胞内部的杂质。
3.裂解细胞:用离心的菌体用Alkali Lysis Buffer裂解细胞。
使得细胞壁和细胞膜破裂,游离出细菌的质粒和基因组DNA。
此时保持碱性能稳定质粒。
4.中和试剂添加:使用HCl溶液中和裂解碱的催化活性,维持实验体系pH值在7.0左右。
5.离心收集DNA:用NaCl把DNA从碱性溶液中析出,并通过离心将DNA沉淀下来。
6.洗涤DNA:用乙醇洗涤钠盐,去除残留的离子,甘油可保持溶液中的DNA
稳定性。
7.重悬质粒:将去除干扰物后的纯质粒在TE缓冲液中重悬,即可用于下一步实验。
质粒小提步骤[推荐]
![质粒小提步骤[推荐]](https://img.taocdn.com/s3/m/c8d5f3c6250c844769eae009581b6bd97f19bc97.png)
BIOMIGA质粒小提试剂盒II简明步骤(PD1213)(详细内容请参考英文说明书)I. 实验前准备 II. 注意事项RNase A: 使用前将提供的所有RNase A瞬时离心后加入Buffer A1, 使用后将Buffer A1/RNase A置于4oC保存。
质粒拷贝数:纯化中低拷贝的质粒时,使用2倍的菌液体积,2倍的Buffer A1,B1,N1, 相同体积的Wash Buffer 和Elution Buffer. DNA Wash Buffer*: 使用前请将8 mL (PD1213-00)或48 mL (PD1213-01)或216 mL (PD1213-02) or 90 mL (PD1213-转化菌:若为-70oC 甘油冻存的菌,请先涂布平板培养03)96-100% 乙醇加入DNA Wash Buffer。
后,再重新挑选新的单个菌落进行培养。
Buffer B1: 在低于室温时会沉淀,请于50oC左右水浴加热至沉切勿直接取冻存的菌种进行培养。
淀完全溶解,溶液澄清,使用后保证Buffer B1瓶盖旋紧。
在室温下(22-25oC)进行所有离心操作。
III. 操作步骤若用于提取1-5 mL的菌落,请将Buffer A1, B1, N1的量降低至250 μL, 250 μL 及350 μL,DNA wash Buffer及Elution Buffer的量不变。
1. 接种新鲜的单个菌落到5-12 mL的LB培养基(含适量抗生素),37oC震荡培养14-16小时(勿超过16小时)。
2. 室温下10,000 x g离心1分钟,收集菌体,并尽可能的吸去上清。
注:残留的液体培养基容易导致菌体裂解不充分,第5步离心后沉淀较松,不易吸取上清。
注:本说明书中的操作程序适用于标准LB (Luria Bertani)培养基培养12-16 小时后,OD600(细菌密度)在之间的菌液。
若采用的是富集培养基,如TB或2×YT,注意保证OD600不超过。
质粒小提试剂盒提取质粒

质粒小提试剂盒提取质粒
(1)柱平衡步骤:向吸附柱CP3中(吸附柱放入收集管中)加入500μL的平衡液BL,12,000rpm离心1分钟,倒掉收集管中的废液,将吸附柱重新放回收集管中;
(2)取1-5ml过夜培养的菌液,加入离心管中,使用常规台式离心机,12,000rpm离心1分钟,尽量吸除上清;
(3)向留有菌体沉淀的离心管中加入250μL溶液P1(先检查是否已加入RNaseA),使用移液器或涡旋振荡器彻底悬浮细菌沉淀;
(4)向离心管中加入250μL溶液P2,温和地上下翻转6-8次使菌体充分裂解;
(5)向离心管中加入350μL溶液P3,立即温和地上下翻转6-8次,充分混匀,此时将出现白色絮状沉淀。
12,000rpm离心10分钟,此时在离心管中底部形成沉淀;
(6)将上一步收集的上清液用移液器转移到吸附柱CP3中,注意尽量不要吸出沉淀。
12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3放入收集管中;
(7)向吸附柱CP3中加入600μL漂洗液PW(先检查是否已加入无水乙醇),12,000rpm离心30-60秒,倒掉收集管中的废液,将吸附柱CP3放入收集管中;
(8)重复操作步骤(8);
(9)将吸附柱CP3放入收集管中,12,000rpm离心2分钟,目的是将吸附柱中残余的漂洗液除去;
(10)将吸附柱CP3置于一个干净的离心管中,向吸附膜的中间部位滴加50-100μL洗脱缓冲液EB,室温放置2分钟,12,000rpm离心2分钟将质粒溶液收集到离心管中。
小提质粒实验方案及详细步骤
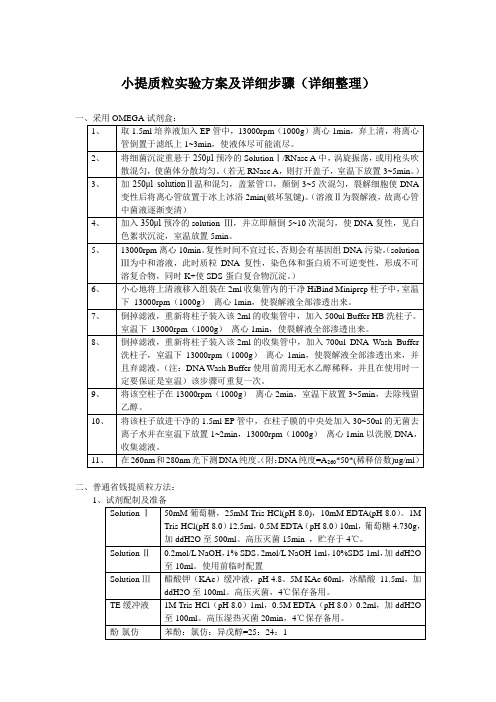
2、
3、Leabharlann 4、 5、 6、 7、Solution Ⅱ Solution Ⅲ TE 缓冲液 酚-氯仿
无水乙醇 70%乙醇 其他准备 2、具体操作步骤 1、 取 1.5ml 培养液加入 EP 管中,12000rpm 离心 2min,弃上清,将离心管倒 置于滤纸上 1~3min,使液体尽可能流尽。将细菌沉淀重悬于 100μl 预冷的 SolutionⅠ中,吹打混匀,剧烈振荡,使菌体分散均匀。打开盖子,室温 下放置 3~5min。 加 200μl 新鲜配制的 solutionⅡ,盖紧管口,颠倒 3~5 次混匀,动作温和, 裂解细胞使 DNA 变性后将离心管放置于冰上冰浴 5min(破坏氢键), (溶液 Ⅱ为裂解液,故离心管中菌液逐渐变清) 加入 150μl 预冷的 solution Ⅲ,将管温和颠倒 5~10 次混匀,使 DNA 复性, 见白色絮状沉淀,在冰上放置 5min。12000rpm 离心 10min。复性时间不 宜过长,否则会有基因组 DNA 污染。 (solution Ⅲ为中和溶液,此时质粒 DNA 复性,染色体和蛋白质不可逆变性,形成不可溶复合物,同时 K+使 SDS- 蛋 白 复 合 物 沉 淀 。 )根据菌体的量调节三种溶液的比例,保证 solution1:solution2:solution3=1:2:1.5 将上清液移入干净 EP 管中,加入 450μl 的苯酚/氯仿/异戊醇,振荡混匀, 4℃,12000rpm 离心 5min 将上清液移入另一干净 EP 管中, 加入 2.5 倍体积预冷的无水乙醇混匀 (轻 柔) ,置于-20℃冰箱放置 20min,4℃下 12000rpm 离心 10min。 弃上清,用 1ml 预冷的 70%乙醇洗涤沉淀 1-2 次,4℃离心 8000rpm,5min, 弃上清,将 EP 管倒扣与滤纸上流尽水分。静置一会儿使乙醇挥发干净。 向沉淀中加入 50μl TE 缓冲液,使 DNA 完全溶解,-20℃保存备用。 高压灭菌锅,冷冻离心机,移液枪,EP 管,滤纸,枪头,提前制冰。
质粒抽提步骤2012-6-13 OMEGA

质粒的提取
1、原理:破菌后,由于细菌基因组DNA和质粒的分子量及结构不一样,在不同pH状况下,可以将两者分离,然后进行纯化,就可以得到较纯的质粒。
2、质粒抽提步骤
(1)将带有质粒的E.coli接种于5ml LB、抗生素培养液中,37度摇床培养12-16h。
(2)取1.0-5.0ml的菌液,室温下10000×g离心1min收集菌液。
(3)倒弃培养基。
加入250μL Solution I/RNaseA混合液,漩涡振荡使细胞完全悬浮。
(4)往重悬混合液中加入250μL Solution II,轻轻颠倒混匀4-6次。
此操作避免剧烈混匀裂解液且裂解反应不要超过5min。
(5)加入350μL Solution III,温和颠倒数次至形成白色絮状沉淀。
(6)室温下,大于或等于10000×g离心10min。
(7)转移上清液至套有2ml收集管的Hi Bind DNA结合柱中,室温下,10000×g离心1min,倒去收集管中的滤液。
(8)把柱子重新装回收集管,加入500μL HB Buffer,按上述条件离心,弃去滤液。
(9)把柱子重新装回收集管,加入700μL DNA Wash Buffer,按上述条件离心,弃去滤液。
(10) (可选)弃去滤液,重复第9步骤一次。
(11)弃去滤液,把柱子重新装回收集管,10000×g离心空柱2min 以甩干柱子基质。
(12)把柱子装在干净的1.5ml离心管上,加入30-50μL Elution Buffer 到柱子基质中,静置1-2min,10000×g离心1min洗脱出DNA。
omega质粒小提protocol

Omega 质粒小提试剂盒protocol主要试剂1. 使用前,将RNase A全部加入Solution I中并于4度保存。
2. 按下表用无水乙醇稀释DNA Wash Buffer,并于室温保存。
D6942-00: 加入6 ml无水乙醇D6942-01: 加入120 ml无水乙醇3. 按下表用异丙醇稀释HBC Buffer,并于室温保存。
D6942-00: 加入1.6 ml无水乙醇D6942-01: 加入16 ml无水乙醇D6942-02: 加入32 ml无水乙醇试剂配方及作用Solution I组分浓度25 mM Tris-HCl(pH8.0),10 mM EDTA,50 mM 葡糖糖(Glucose)溶液1的主要作用是将菌体沉淀悬浮起来。
25mM Tris-HCl是缓冲溶液,保证反应体系的pH 恒定。
EDTA是金属离子螯合剂,10 mM EDTA的作用是与微生物体内的金属离子相互结合,抑制DNase的活性。
50 mM葡萄糖的作用是增加溶液的粘度,保证菌体悬浮,延缓菌体沉降的时间。
溶液1在使用前通常要加入RNA酶(RNase A),RNA酶的作用很清楚,降解掉溶液中的RNA。
由于RNA酶属于蛋白质,蛋白质稳定性很差,所以加了RNase A的溶液1需要低温4℃保存。
Solution II组份浓度250 mM NaOH,1%(W/V)SDS(十二烷基硫酸钠)溶液2的主要作用是细胞裂解。
溶液1将细胞悬浮后,就需要添加溶液2了,溶液2的作用就是对细胞进行裂解。
溶液2只包括两种成分:氢氧化钠和SDS。
真正起到到细胞裂解作用的是氢氧化钠,这也是为什么这个方法会被叫做碱裂解法。
氢氧化钠会破坏细胞膜的结构,使之发生bilayer(双层膜)结构向micelle(微囊)结构的相变化,从而导致细胞的裂解。
SDS的作用将在下一步提到。
添加溶液2后需要注意的一个是时间一定不能过长,另一个是不可以剧烈震动离心管。
时间过长以及剧烈震动都将导致氢氧化钠破坏基因组DNA,断裂的基因组DNA碎片将会与相似大小质粒一同被抽提,污染样品。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OMEGA小提试剂盒提取质粒步骤(中文翻译版)
1、将携带目的质粒的大肠杆菌接种于含10~15ul基础培养基/氨苄西林培养介质的50ml培养瓶中。
2、室温下500×g离心10min。
3、弃去上清,剩余沉淀物中加入500ul的SolutionⅠ/RNase A,彻底混匀。
4、将混悬液移至新的2ml离心管中,加入500ul SolutionⅡ,轻柔彻底混匀,可得清亮的细菌裂解物,室温下孵育2min(混匀时用力过大,可破碎出染色体DNA,使目的质粒纯度下降)。
5、向4中液体加入250ul预冷的Buffer N3,轻柔、彻底混匀,直到出现白色絮状沉淀,4℃≥12000×g离心10min(可室温,最好4℃)(Buffer应彻底混匀,若混合物粘稠呈棕色或呈球状,应多混匀几次以中和溶液,溶液的彻底中和对于获得好的产出是必要的)。
6、小心吸取并将上清液转移进新的1.5ml离心管1:0.1的比例向上清液中加入ETR Solution 混匀溶液并于冰上孵育10min,孵育过程中颠倒几次以混匀(加入ETR Solution后,细菌裂解物将出现浑浊,但冰上孵育后将变澄清)(勿用2ml离心管收集上清,因为2ml离心管中有太多液体时,ETR Solution将悬浮于溶液中)。
7、将6中液体于42℃孵育5min,溶液将再次变浑。
室温下12000×g离心3min,ETR Solution 将于离心管底部形成蓝色层。
8、将上层水相转移入新的2ml离心管中,按1:0.5的比例加入无水乙醇(室温,96~100%),轻柔混匀,室温下孵育1~2min。
9、将8中的溶液取700ul到柱子中,组装收集管,室温下1000×g离心1min,弃去收集管中通过柱子的液体,柱子和收集管重复利用。
10、重复9中步骤,直到收集的细菌裂解物全部用完。
11、将500ul Buffer HB加入柱子中,室温下1000×g离心1min,弃去收集管中废液(目的:将残存的蛋白污染物除去,是获得高质量DNA所必需的)。
12、向柱子中加入混有乙醇的700ulDNA Wash Buffer,室温下1000×g离心1min,弃去收集管中液体。
13、重复12中的步骤。
14、弃去收集管中液体,空管在最大转速(≥13000×g)离心3min以干燥柱子(对于移除柱子中残留的乙醇是必须的)。
15、将柱子放入新的 1.5ml离心管中,直接向柱子中的白色网状物上加入Endotoxin-Free Elution Buffer 80~100ul(依终产物浓度而定,可每次30ul×2次),室温下放置2min,≥13000×g离心1min,以洗提DNA(将提取约70~85%柱子中收集的DNA,可再重复一次以提取完全,但因再次加入洗提液,会使终产物浓度下降)。
声明:文档为自己翻译后逐字打出来的,有不妥之处望各位同行不吝赐教,以方便大家实验参考,谢谢。
