硫的同素异形体
硫及其氧化物教学设计

硫及其氧化物一、硫单质【基础知识】1.自然界中硫单质的存在形态游离态:火山喷口附近或地壳的岩层里化合态:主要以氧化物和硫酸盐的形式存在2.硫单质的物理性质硫俗称硫黄,是一种黄色晶体,质脆,易研成粉末,不溶于水,微溶于酒精,易溶于CS2(用于洗涤沾有硫的容器)。
3.硫的同素异形体硫元素有多种同素异形体(由同一种元素组成的不同单质),最常见的是晶状的单斜硫和斜方硫,另外还有S 8、S 6、S 4、S 2等分子存在。
4.硫的结构硫位于第三周期ⅥA 族,最外层有6个电子,在反应中易得到2个电子而呈-2价;硫的最高正价为+6价;单质硫的化合价为0,处于中间价态,故单质硫既有氧化性又有还原性,在反应中既可作氧化剂又可作还原剂。
如 S -2S 0S +4(或 S +6) 5.硫的化学性质 (1)氧化性在加热的条件下,硫能被H 2和绝大多数的金属单质还原。
由于硫的氧化性比较弱,与变价金属反应时往往生成低价态的金属硫化物。
S+H2H 2S2Na+S Na 2S (易爆炸)(Fe 元素显+2价而不是+3价) 2S (Cu 元素显+1价而不是+2价) (2)还原性在一定条件下,硫可被F 2、O 2、Cl 2等非金属单质以及一些具有氧化性的化合物氧化。
S+O 2SO 2(现象:空气中,淡蓝色火焰;纯氧中,蓝紫色火焰)S+6HNO 3(浓)2SO 4+6NO 2↑+2H 2O S+2H 2SO 4(浓)2↑+2H 2O表现氧化性表现还原性研磨点燃(3)硫在强碱溶液里加热可发生歧化反应(歧化反应:同一种物质中的同一价态的同种元素的原子,在反应中既有升高,又有降低的氧化还原反应;归中反应:同一种元素的不同价态的原子,在反应中,化合价高的降低,化合价低的升高(但是化合价变化互不交叉)的氧化还原反应)SO3+3H2O2S+K2(可用热碱溶液除去试管中残留的硫)(两种方法)(4)特性:Ag、Hg在常温下不跟O2反应,但易跟S反应。
硫单质

化学硫的知识点总结

化学硫的知识点总结1. 硫的物理性质硫是一种黄色的非金属固体,在常温下呈硫黄色晶体,具有特殊的臭味。
硫有两种常见的同素异形体:单斜硫和正交硫。
单斜硫在95.5°C以上的温度下稳定,而正交硫在低于95.5°C的温度下稳定。
硫的密度为2.07 g/cm3,熔点为115.21°C,沸点为444.6°C。
硫在常温下是不溶于水的,但能溶于有机溶剂如苯、二硫化碳等。
2. 硫的化学性质硫是一种活泼的非金属元素,它能与大部分元素发生化学反应。
硫能与氧气反应形成二氧化硫(SO2)和三氧化硫(SO3),与氢气反应生成硫化氢(H2S),与金属反应形成对应的硫化物。
此外,硫还能与氮、碳、磷等元素发生反应。
硫的化学性质使其在化工生产中有着广泛的应用,如生产硫酸、硫磺、硫酰胺等产品。
3. 硫的生产与提取硫的主要生产和提取方法包括湿法法、干法法和熔炼法。
湿法法主要是指从原矿中用水溶液提取硫化合物,再通过反应还原得到硫;干法法是指直接从硫矿石中通过热解或氧化还原得到硫;而熔炼法则是指将硫化物与铁、铜等金属矿石一起熔炼,得到金属和硫的混合物,再通过其他方法分离提取硫。
4. 硫的主要化合物及应用硫有很多重要的化合物,其中最重要的包括硫酸(H2SO4)、二氧化硫(SO2)、硫化氢(H2S)、硫化物等。
硫酸是一种重要的工业化学品,广泛应用于冶金、化工、石油、医药等领域;二氧化硫是一种重要的环境污染物,也是一种重要的化工原料;硫化氢主要用于冶金、化工和环保领域;硫化物是一类重要的金属矿石,在冶金领域有着广泛的应用。
5. 硫的环境影响硫是一种常见的环境污染物,主要由硫煤燃烧、工业生产、交通运输等活动排放而来。
二氧化硫和硫化氢是硫的两种主要气态污染物,它们能够对环境和人体健康造成严重影响。
硫污染主要表现在二次大气污染、酸雨、大气光化学污染等方面。
为了减少硫污染,各国纷纷制定了相应的法律法规和标准,采取了一系列的措施,如燃烧技术改进、烟气脱硫、清洁能源推广等。
硫和硫的化合物
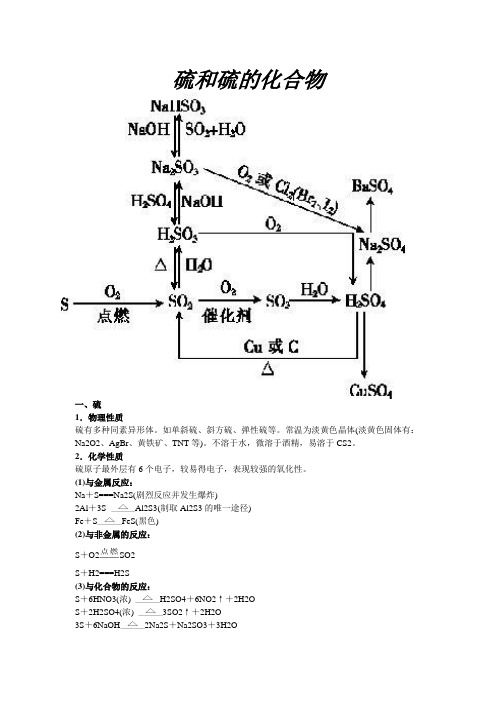
硫和硫的化合物一、硫1.物理性质硫有多种同素异形体。
如单斜硫、斜方硫、弹性硫等。
常温为淡黄色晶体(淡黄色固体有:Na2O2、AgBr、黄铁矿、TNT等)。
不溶于水,微溶于酒精,易溶于CS2。
2.化学性质硫原子最外层有6个电子,较易得电子,表现较强的氧化性。
(1)与金属反应:Na+S===Na2S(剧烈反应并发生爆炸)2Al+3S Al2S3(制取Al2S3的唯一途径)Fe+S FeS(黑色)(2)与非金属的反应:S+O2SO2S+H2===H2S(3)与化合物的反应:S+6HNO3(浓) H2SO4+6NO2↑+2H2OS+2H2SO4(浓) 3SO2↑+2H2O3S+6NaOH2Na2S+Na2SO3+3H2O例题:将m g铁粉和n g硫粉均匀混合,在密闭容器中加热到红热,冷却后加入L b mol·L-1的盐酸就不再产生气体。
若把已放出的气体收集起来,在标准状况下的体积是。
由Fe+S FeS,FeS+2HCl===FeCl2+H2S↑,得Fe~2HCl;又由Fe+2HCl===FeCl2+H2↑,得Fe~2HCl,即产生气体的总体积和消耗的盐酸的量与硫粉量无关,只由铁的量确定。
设加入b mol·L-1盐酸的体积为V,则×2=V×b mol·L-1得V=L或mL标准状况下产生气体的体积为×22.4 L·mol-1=0.4m mL二、硫的氧化物1.SO2的性质2.SO2的实验室制法3.几种物质漂白原理的比较4.SO2的危害和治理SO2是大气主要污染物,直接危害人类身体健康,酸雨为SO2产生的二次污染物。
SO2的主要来源为燃烧含硫的燃料(如煤),消除SO2污染的最有效的途径是减少SO2的排放。
5.三氧化硫SO3是硫的最高价氧化物,为白色易挥发晶体,是典型的酸性氧化物。
将SO2气体分别通入下列溶液中:①品红溶液,现象是溶液褪色。
②溴水溶液,现象是溶液褪色。
高三化学硫的知识点归纳

高三化学硫的知识点归纳硫是一种常见的元素,其具有丰富的化学性质和应用。
在高三化学学习中,硫的相关知识点是不可或缺的一部分。
本文将对高三化学中硫的知识进行归纳,以帮助同学们更好地掌握该知识点。
1. 硫的基本性质硫的化学符号为S,原子序数为16,属于周期表中的第16族元素。
硫的外层电子结构为2s²2p⁴,因此,它具有6个价电子。
硫的物态分为几种常见的形式,如黄硫、红硫、花硫等。
2. 硫的同素异形体硫存在着多种同素异形体。
其中,最常见的是黄硫(S₈)。
黄硫呈现为黄色结晶固体,由八个硫原子通过共价键形成。
此外,还有红硫(S₂₀),呈现为红色结晶固体,由二十个硫原子构成。
3. 硫的物理性质硫在常温下是固体,融点为112.8°C,沸点为444.6°C。
硫的密度为2.07 g/cm³,具有较低的电导率。
此外,硫对光有较强的吸收能力,呈现不透明。
4. 硫的化学性质硫是活泼的非金属元素,具有多种化学反应。
主要的化学性质包括:a. 与氧的反应:硫可以与氧反应生成二氧化硫(SO₂),此反应常见于燃烧过程中。
b. 与氢的反应:硫可以与氢反应生成硫化氢(H₂S),硫化氢是一种有毒气体,有臭鸡蛋味。
c. 与金属的反应:硫可以与金属反应生成金属硫化物。
例如,硫和铁的反应生成硫化铁(FeS)。
d. 与酸的反应:硫可以与酸反应生成硫化氢(H₂S)。
这种反应常见于实验室中。
5. 硫的氧化态和硫酸的制备硫的氧化态主要有-2、0、+4、+6等。
其中,最常见的是硫的-2氧化态,即硫化物。
硫酸是一种重要的化学品,其制备常用的方法有铁与硫的反应、氧气氧化和硫在空气中燃烧等。
6. 硫的应用硫在工业生产和日常生活中有着广泛的应用。
主要包括:a. 合成硫酸:硫酸是一种重要的化学原料,广泛应用于冶金、石化、制药等行业。
b. 制备药物:硫化物和硫酸盐在药物合成中起到重要的作用,例如磺胺药物。
c. 生产橡胶:硫化橡胶是一种重要的橡胶制品,硫可以用于橡胶的硫化反应。
高中化学【自然界中的硫 二氧化硫】

第2节硫的转化第1课时自然界中的硫二氧化硫学习目标:1.了解含硫元素的物质在自然界中的存在形态以及含硫物质的主要来源。
2.掌握硫单质的物理性质和化学性质。
(重点)3.掌握二氧化硫的性质。
(重难点)一、自然界中的硫微点拨:硫元素的常见价态:-2、0、+4、+6;-2价硫元素只有还原性,+6价硫元素只有氧化性。
二、硫单质1.同素异形体(1)定义:由同一种元素组成的性质不同的几种单质。
(2)几种元素的同素异形体:硫单质俗称硫黄,常见的同素异形体有正交硫、单斜硫;氧元素有O2、O3;碳元素有金刚石、石墨等。
2.物理性质硫单质是一种黄色或淡黄色的固体,很脆,不溶于水,微溶于酒精,易溶于CS2。
微点拨:(1)硫黄是中学阶段唯一呈黄色的固态非金属单质。
(2)实验室可用CS 2洗涤附着在试管壁上的硫黄。
3.化学性质(1)氧化性:如硫与金属铁反应,反应方程式:S +Fe=====△FeS 。
(2)还原性:如硫与O 2的反应,反应方程式:S +O 2=====点燃SO 2。
微点拨:硫在空气、氧气中燃烧火焰颜色不同,但产物相同。
4.用途主要用于制造硫酸、化肥、火柴、杀虫剂等,还用于制造火药、烟花爆竹等。
三、硫元素不同化合价之间的相互转化价态: S -2 S 0 S +4 S +6↓ ↓ ↓ ↓性质:只有还原性 既有氧化性又有还原性 只有氧化性低价态发生氧化反应发生还原反应高价态微点拨:元素的最高价只有氧化性,最低价只有还原性,中间价态既有氧化性也有还原性。
四、二氧化硫1.物理性质颜色气味 密度 毒性 状态 溶解性 无色刺激性 ρSO 2>ρ空气 有毒 气态 易溶于水 2.化学性质3.实验室制法:实验室常用Na2SO3固体与较浓的硫酸反应制取SO2(写出反应的化学方程式):Na2SO3+H2SO4(浓)===Na2SO4+H2O+SO2↑。
4.用途:制硫酸、漂白剂、消毒剂和防腐剂等。
5.可逆反应在相同条件下,能同时向正反两个方向进行的反应,为可逆反应,可逆反应的化学方程式用“”表示。
高一化学硫的知识点和公式

高一化学硫的知识点和公式硫是一种常见的非金属元素,具有广泛的应用。
本文将介绍关于硫的一些基本知识点和相关公式。
1. 硫的基本性质硫的原子序数为16,原子符号为S,原子量为32.06。
其外层电子构型为2s²2p⁴。
硫的物态为黄色针状晶体或黄色结晶粉末。
2. 硫的同素异形体硫存在多种同素异形体,其中最常见的是α-硫和β-硫。
α-硫为黄色针状晶体,在95.6℃以上转变为无定形的红色液体,再经过快速冷却就可以得到β-硫,为黄色结晶粉末。
3. 硫的化合价硫的化合价一般为-2,但也可以表现出其他化合价。
在一些元素中,硫可以以+4、+6的价态存在。
4. 硫的常见化合物硫可以与许多元素发生化学反应,形成不同的化合物。
常见的硫化物有硫化氢(H₂S)、二氧化硫(SO₂)、硫酸(H₂SO₄)等。
5. 硫的制取方法硫的主要制取方法是从硫铁矿中提炼。
首先,将硫铁矿加热到高温,使得硫铁矿中的硫与氧反应生成二氧化硫;接着,通过冷凝和洗涤的方式收集二氧化硫,再通过氧化反应制得硫。
6. 硫的应用领域硫在工业生产和科学研究中有广泛的应用。
硫的化合物可以作为肥料、农药、颜料和染料等。
此外,硫也用于制造一些日用品如肥皂、清洁剂等。
以下是一些与硫相关的公式:1. 二氧化硫的生成反应:硫 + 氧→ 二氧化硫S + O₂ → SO₂2. 硫酸的生成反应:二氧化硫 + 水 + 氧气→ 硫酸SO₂ + H₂O + 1/2O₂ → H₂SO₄3. 硫水化学反应:硫 + 氢气→ 硫化氢S + H₂ → H₂S4. 硫酸滴定反应:H₂SO₄ + NaOH → Na₂SO₄ + H₂O通过了解硫的基本性质、化合价、制取方法以及相关公式,我们能更深入地了解硫的化学性质和应用。
希望本文对你的学习有所帮助。
注意:本文所提及的公式和反应方程式仅为示范用途,实际应用中可能有更多相关反应和公式,请在应用时进行进一步研究和验证。
高中化学 硫和硫化物竞赛解析

高中化学硫和硫化物竞赛解析第一题(10分)硫化氢及其衍生物2003年12月重庆发生了重大井喷事件,中毒者无数,死亡160多人。
中毒原因是因为所喷发出来的天然气中含有高浓度的气体H2S。
H2S是无色有恶臭的剧毒气体,空气中H2S浓度达5mg·L-1时就会使人感到烦躁,达100mg·L-1就会使人休克而致死亡。
在这次事故中,很多受害群众用湿润的毛巾掩住嘴鼻或者将脸贴近湿润的土地,结果逃过了大劫。
1.如上所述,受害群众自我解救的方法是利用了H2S的溶解性。
101.325kPa,293K时,1体积水能溶2.6体积H2S气体,求该条件下饱和H2S水溶液的物质的量浓度和pH值(忽略-8223.硫和氧都是ⅥA族的元素,硫化氢中的一个H可以被乙基替代,得到乙硫醇。
类似地,如果丙酮中的O被S替代,得到CH3-CS-CH3,则其命名为;同样,已知CH3-CO-SH命名为乙硫羟酸,则CH3-CS-OH可命名为。
4.苯硫酚的酸性比苯酚。
1mol化合物HSCH2CH(NH2)COOH能与mol的NaOH反应。
5.HSCH2CH(NH2)COOH电离常数分别Ka1、Ka2、Ka3(Ka1>Ka2>Ka3),指出Ka1、Ka2、2第二题(11分)S2Cl2的结构、制备与性质S2Cl2是黄红色油状发烟液体,有刺激性臭味,熔点-80℃,沸点136℃。
蒸气有腐蚀性,遇水分解,易溶解硫黄;将适量氯气通入熔融的硫黄而得。
S2Cl2用作有机化工产品、杀虫剂、硫化染料、合成橡胶等生产中的氯化剂和中间体,也用于橡胶硫化、糖浆纯化、软水硬化等。
1.S2Cl2的结构简式是;空间构型为型(直线、折线)2.根据S2Cl2的结构特点,它应属于(类别),再列举两例此类常见化合物、(共价化合物或离子化合物各1例);3.制备S2Cl2的化学方程式是,实际得到的产物是,如何用简单的实验方法得到较纯的S2Cl2:。
224应,所得主要产物Y的分子含氢2.14%(质量分数),且Y的摩尔质量比X略大;Y是高度对称的分子,结构中存在四重对称轴(旋转90°重合)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.给硫加热时,要防止硫蒸气燃着。
操作熔化的硫时,要防止烫伤。
单斜硫
编辑
硫有多种同素异形体,最常见的是斜方硫(又叫菱形硫、α-硫)和单斜硫(又叫β-硫)。
单斜硫和斜方硫是单质硫在不同温度下的变体。
单斜硫是针状晶体,只稳定存在于95.6℃以上,在室温下它缓慢地转变成斜方硫。
α-硫熔点为112.8℃,β-硫熔点为119℃。
它们都易溶于CS2中。
实验表明,α-硫及β-硫都是由S8环状分子组成。
α-硫为黄色,密度为2.06克/厘米;;β-硫为浅黄色,密度为1.96克/厘米;
硫元素的单质,是硫的同素异形体,分子晶体,分子中每个S原子与另外2个S原子形成S-S单键。
分子式量为256
2种类
编辑
斜方硫(菱形硫):Dolomite Rhombic sulfur
化学式:S8
是硫由二氧化碳结晶而得之紧密的黄色晶体,融点112.8度。
单斜硫:Monoclinic sulphur
化学式:S8
融化硫於部份凝固後,倒出多馀液体,剩下无数之针形晶体即为单斜硫,融点119.2度
弹性硫:Plastic sulphur
化学式:S8
为沸腾之硫注入冷水所得之软黏体,有弹性。
