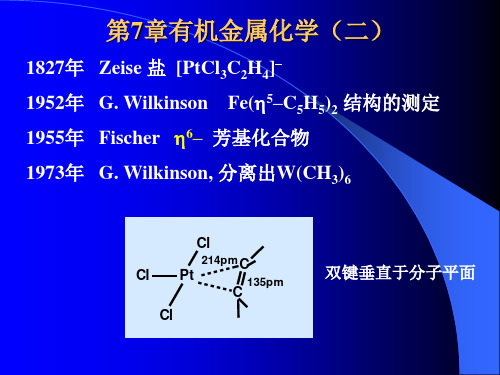
金属有机化学(2)
金属有机化学-2

_ X W C NR2
X W C NR2 _
配体RC不仅可与一个金属形成三重键,也可与三个金属原 子形成三个单键,以此在过渡金属原子簇中形成三重桥基 基团,μ3-alkylidyne。 12.5 金属羰基配合物 过渡金属羰基配合物属所知最早的有机金属化合物 中的一类。它们是合成其它低价金属配合物,特别是原子 簇的常用原料。羰基配体不仅可被许许多多其它配体所取 代,而且未被取代的羰基还能稳定化合物分子
M M
O C M
μ3
M
二重桥联 doubly bridging
三重桥联 triply bridging
CO作为双桥基配体十分常见,特别是在多核原子簇化合物 中;它们几乎总伴随着金属-金属键而出现:
O C M C O C O M O C M M
CO桥常成对出现,并能与非桥联模式处于动态平衡之中。 例如,Co2(CO)8的溶液至少含有两种异构体:
1. DMPE Ta Br Br C H 2. 2Na/Hg P P Ta C H CMe3
CMe3
3. Hexa(t−butoxy)ditungsten在温和的反应条件下,与炔烃 发生金属化反应,也可得到过渡金属炔基配合物:
(t−BuO)3W≡W(t−BuO)3 + RC≡CR
⎯→ ⎯
2 (t−BuO)W≡C−R R = 烷基
12.5.1 1.
制备,结构和性质 金属+CO Ni + 4CO Fe + 5CO
⎯1bar, 25° C→ ⎯⎯ ⎯
Ni(CO)4 ⎯100bar, 150⎯→ Fe(CO)5 ⎯⎯⎯C °
2.
金属盐+还原剂+CO
3 4
H PO VCl3 + 3Na + 6CO ⎯diglyme→[Na(diglyme)2]+[V(CO)6] − ⎯⎯→ ⎯⎯ ⎯
金属有机化学:第二章 电子计数与18电子规则

过渡金属元素的一般趋势
前过渡金属
较低的电负性 高氧化态 硬酸、亲氧
后过渡金属
较高的电负性 低氧化态 软酸、亲硫
配体与配位数
➢ 配体(ligand):
[MXaLb]c+
❖ 阴离子配体X-,如Cl-、CN-、CH3-、H- 等 ❖ 中性配体L,如CO、PR3、NR3等 ➢ 配位数:中心原子周围配位原子的个数,不等同于配体的个数
轨道重叠效率乙烯hs键的轨道重叠效率通常接近100因此是比p键更强的化学键八面体配合物分子轨道能级图s给电子配体反键轨道antibonding非键轨道nonbonding成键轨道bondingp酸配体s电子给体p电子给体配体的p轨道能量高于t2g轨道形成新的分子轨道后d电子进入新形成的能量更低的t2g成键轨道2g完全充满18电子规则s电子给体p电子受体p酸配体18电子规则相比有机化合物中的8电子稳定结构又多了5个d轨道最多可填充10个电子
几个术语
电子云密度:原子核周围价层电子出现的概率密度。
价电子较多的原子(如Pt(0))或电子云紧凑的原子有高电子云密 度。价电子较少的原子(如Na+)或电子云松散的原子有低电子 云密度。不要与电负性相混淆!
富电子:愿意给出电子/电子对到其他原子。
富电子原子通常具有较低的电离能。富电子的特征往往与较低的 电负性、有强的电子给体与之配位、带负电荷等因素相关。借用 有机化学中的术语,富电子基团会是好的亲核试剂。
离子模型电子计数步骤: 1)确定过渡金属在元素周期表中的位置(族序数) 2)确定过渡金属中心的氧化态
a) 注意整个配合物是否带有电荷 b) 确定配体所带的电荷 3)确定金属的dn电子构型 4)确定配体提供的电子数(离子模型) 5)加和3)、4)得到金属中心周围总的价电子数 共价模型电子计数步骤: 1)确定过渡金属在元素周期表中的位置(族序数) 2)确定配体提供的电子数(共价模型) 3)加和1)、2)及配合物电荷得到金属中心周围 总的价电子数
第二章 主族元素的金属有机化合物

第二章 主族元素的金属有机化合物
陕西师范大学 化学与材料科学学院
金属有机化学
概念
凡分子中 M—C 键是由主族元 素与碳直接键合 的金属有机化合物 称之为主族元素的金属有机化合物。
金属有机化学
主族元素的金属有机化合物,根据其金属— 碳键的性质,可以分为以下三类:
㈠ 离子键化合物:碱金属
2M + nRX = RnM + MXn
M + RX = RMX (4-1)型的重要反应 PhBr + 2Li
(4-1)
(4-2)
PhLi + LiBr
这一反应是由K. Ziegler用溴苯和锂反应以合成 苯基锂。
金属有机化学
(4-2)型的代表反应
☆格氏试剂的合成 Mg + RX RMgX
☆有机硅化合物的直接合成 Si(Cu) + 2RCl R2SiCl2 (R=烷基、芳基)
和活泼氢化合物的反应
RH + MY RM + HY 这一反应可看作酸、碱的反应,称金属化 (metalation),是 H.Gilmann于1934年发现的。 炔烃类的反应有下面的例子: RC CH + NaH RC CH + NaNH2 RC CH + EtMgBr
反应向 右RM 能沉淀 或HY 能除去
金属有机化学
三烷基铝
三烷基铝是缺电子化合物,容易生成二聚体,三甲 基铝即使在气相也成二聚体结构.在实验室中,三烷基 铝可用Grignard试剂 、烷基汞、烷基硼化合物等来 合成。 除三甲基铝外,其他的三烷基铝在工业上可以 用金属铝、氢和烯烃来合成:
金属有机化学
有机铝化合物的反应中最重要的是和烯烃的反应
有机化学中的金属有机化合物

有机化学中的金属有机化合物金属有机化合物是有机化学领域中的一类重要化合物,其分子结构中含有金属与有机基团的化学键。
金属有机化合物具有独特的性质和广泛的应用,对于研究金属有机化学以及发展金属有机合成方法具有重要意义。
本文将介绍金属有机化合物的定义、合成方法以及其在催化反应和材料科学中的应用。
一、金属有机化合物的定义金属有机化合物是指化合物中含有金属元素(如铁、铜、锌等)和有机基团(如烃基、醇基等)的共价键。
这些化合物通常以配合物的形式存在,其中金属中心与有机基团通过配位键相连。
金属有机化合物可以根据金属元素的性质和配位方式进行分类,如金属卡宾、金属烯烃配合物等。
二、金属有机化合物的合成方法1. 金属有机化合物的合成可以通过直接反应法实现。
直接反应法是指金属与有机底物直接发生反应生成金属有机化合物。
例如,Grignard 试剂与卤化物反应生成金属有机化合物,这是一种常用的合成金属有机化合物的方法。
2. 金属有机化合物的合成也可以通过还原法实现。
还原法是指用还原剂还原金属盐类,使金属离子与有机底物发生反应生成金属有机化合物。
这种方法常用于合成铁、镍等金属有机化合物。
3. 另一种常用的合成金属有机化合物的方法是配体交换法。
配体交换法是通过将金属配合物中的配体与有机配体交换,从而生成金属有机化合物。
这种方法广泛应用于合成含铂、钯等金属的有机化合物。
三、金属有机化合物的应用金属有机化合物在催化反应中具有重要作用。
例如,铁-铍双金属有机化合物可以催化烯烃羰基化反应,得到醛和酮化合物。
铜配合物可用作C-C键的形成催化剂,广泛应用于有机合成领域。
金属有机化合物在材料科学中也具有广泛应用。
例如,金属有机化合物可以用于合成金属有机聚合物,这些聚合物在光电、荧光材料方面具有良好性能。
金属有机化合物还可以用于制备金属有机框架材料(MOF),这种材料在气体吸附、分离等方面具有重要应用价值。
总结金属有机化合物是有机化学中的重要研究对象,对于金属有机化学的发展和应用具有重要意义。
[理学]第三章-金属有机化学-part2
![[理学]第三章-金属有机化学-part2](https://img.taocdn.com/s3/m/7ad8a60054270722192e453610661ed9ad5155a5.png)
2. 分子氮配合物中的化学键
N2与CO是等电子体,分子氮与过渡金属离子(原子) 生成配合物时的成键情况也与一氧化碳相似。
氮原子上的孤对电子进入过渡金属离子(原子)的空 轨道,形成σ配键,同时过渡金属离子(原子)的d电子进 入N2分子的反键π*空轨道,形成反馈π键,构成σ-π双键结 构。
N2比CO不易给出电子(N2的2σg比CO的5σ负),N2的 Lewis碱性较CO弱;同时N2的2πg比CO的2π正,不易接 受电子,因此,N2的π酸性较CO弱,一般认为N2是中等强 度的π-接受体和弱的σ给予体。 【 问 题 】N2 是 π- 配 体 , 在 形 成 分 子 氮 配 合 物 对 金 属 离 子 (原子)有何要求? 【问题】N2与CO配位性谁更强?哪一种更稳定?
N
NO
NO+与CO是等电子体, 键级为3。 NO的键长为115.1 pm, NO+的键长 106.2 pm。
NO 作 配 体 时 是 三 电 子 给 予 体 。 当它跟金属配位时,处于反键*轨道 上的电子先转移到金属原子上.
M+NO → NO++M-
NO+与金属M-的配位方式同CO一 样,即NO+(亚硝酰阳离子)向金属M-提 供一对电子形成配键, 而M-提供d电子 到NO+的反键* 轨道形成反馈配键, 亦即形成-反馈键。
从Raman光谱来看,端配N2配合物伸缩频率为1930 2230cm-1 ,说明NN键被削弱。
如图所示为端配和侧配的N2配合物:
N
110.1
178o N
178.4 P
Cl 218.5Co
216.7 220.2
160 P
H
(a)
Li
Li
Li
Ni
N
Li Li
有机金属化学(二)05
卡宾(Schrock)配合物(高氧化态) C亲核 卡宾(Schrock)配合物(高氧化态) C亲核 配合物
Carbyne配合物 配合物
Carbyne配合物 配合物
讨论: 讨论:
1. 烯丙基配合物 烯丙基配合物[PdC3H5Cl]2的结构和总价电子计数 的结构和总价电子计数, 金属原子间是否存在M–M键 ? 键 金属原子间是否存在 对比 [Pt(CO)Cl2]2和[Mn(CO)4Cl]2
一. 常见的有机配体和齿合度 常见的有机配体和齿合度
提供M的 提供 的 电子数 1 2 2(4) 2 齿合度 η1 η2 η2 η1 配体 烷基(H, X) 烷基 烯烃(CH2=CH2) 烯烃 炔烃(CH≡CH) ≡ 炔烃
M C
M-L的结Байду номын сангаас 的结构
M
CR3
C
M
C
C
亚烷基(carbene) 亚烷基
M
H H CH4 H H NH3 H H H H H OH2 FH H
2. 等瓣相似
R. Hoffmann, (Nobel Lecture, 1982) “Building Bridges between Inorganic and Organic Chemistry”
Angew. Chemie. Vol 21, 10(1982)711-724
Ti
(深绿色固体 深绿色固体) 深绿色固体
含茂基的弯曲夹心(bent-sandwich )化合物 含茂基的弯曲夹心 化合物
4. 环戊二烯基 羰基化合物 环戊二烯基–羰基化合物
Fe(CO)5+2 C5H6(二聚体 → Fe2(η5–C5H5)2(CO)4 + CO + H2 二聚体) 二聚体 η V(η5–C5H5)2 +CO → V(η5–C5H5)(CO)4 η η
金属有机化学:第五章 膦配体 (2)

金属中心反馈p键向P-C的 s*轨道填充电子,削弱P-C 键,使P-C键变长
注意:同时存在缩短P-C键 长的反效应,P给出孤对电 子到金属,导致P原子周围 孤对与键对电子的排斥作用 减弱,缩短P-C键
• 膦配体的电子性质可以在很大的范围内调节(从“强s电子给 体/弱p电子受体”到“弱s电子给体/强p电子受体”)
128
PBr3
131
PEt3, PPr3, PBu3
PPh2(OMe)
132
PEt2Ph, PMePh2
136
Cy2PCH2CH2PCy2
142
PPh3
145
PPh2(t-Bu)
157
PPh2(C6F5)
158
P(i-Pr)3
160
PBz3
165
PCy3
PPh(t-Bu)2
170
P(O-t-Bu)3
87
PPhH2
P(OCH2)3CR
101
PF3
104
Me2PCH2CH2PMe2
P(OMe)3
107
P(OEt)3
109
P(CH2O)3CR
114
Hale Waihona Puke Et2PCH2CH2PEt2
115
PMe3
118
Ph2PCH2PPh2
121
PMe2CF3
PCl3
124
Ph2PCH2CH2PPh2
125
PPh2H
P(OPh)3
P(C6F5)3
P(O-i-Pr)3 P(OEt)3
P(OMe)3
PPh2Cl PMe2CF3 P(O-2,4-Me-C6H3)3 P(OPh)3 P(OCH2)3CR
《金属有机化学》作业参考答案

《金属有机化学》作业参考答案一选择题1、B;2、C;3、B;4、D;5、A;6、A;7、C;8、A;9、C;10、D;11、A;12、D;13、A;14、C;15、A;16、A;17、C;18、B;19、A;20、A;21、B;22、C;23、D;24、B;25、D;26、A;27、A;28、A;29、D;30、A.31、A;32、B;33、A;34、B;35、B; 36、D;37、A;38、A;39、A;40、B;41、D;42、C 43、C 44、A 45、D 46、A 47、D二填空题1.金属;2.聚氯乙烯稳定剂;3.双键; 4.L=(12-n)/2; 5.四腿琴凳式; 6.非键电子;7.茂; 8.聚硅氧烷; 9.光照;10.环戊二烯基钠;11.配体取代法; 12.酰基;13.活性空位; 14.2电子配体; 15.金属一金属键.; 16.d—p一dπ键; 17.福州模型;18.Dewar-Chatt-Duncanson模型; 19.π给予体簇合物;20.金属羰基原子簇; 21.d—p一dπ键;22.歧化反应。
23、有机化学无机化学24、M—C 过渡金属有机化合物非过渡(主族)金属有机化合物25、离子型化合物σ键合的化合物非经典键合的化合物26、RM R2M27、过渡金属环戊二烯基28、Grignard29、离子键化合物、共价键化合物、缺电子化合物30、有机化学无机化学31、金属-碳( M-C )键32、过渡金属环戊二烯基33、σ-π配键34、Ziegler Natta35、MR2 RMX直线36、Grignard 试剂三简答题1.韦德规则的要点:(1)硼烷和碳硼烷呈三角面多面体构型;(2)由多面体顶点全占据是封闭型;空一个顶点的是巢穴型;空两个顶点是网兜型;(3)每一个骨架B有一个H(或其它单键配体)端基连结在它上面,一对电子定域在上面,剩余的b对电子是骨架成键电子;(4)每一个B提供三个原子轨道(AO)给骨架成键,多面体的对称性由这些AO产生的(M+1)个骨架成键分子轨道(MO)决定(M是多面体顶点),即:因此,算出任一硼烷的成键MO数就能知道它的对称性,而成键MO数=骨架成键电子对数b。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
具有9个低能量的成键分子轨道(6个σ轨道和3 个π轨道)可以填充18个电子。
RuⅡ
FeⅡ Cr0 CoⅢ ReⅤ
4 2
7 8
戴帽八面体 四方反椎
[Mo(CO)4Cl3]- MoⅡ
化合物中比较常见的是四配位和六配位化合物,绝大多数是六 配位化合物,正八面体的高度对称性,使得分子轨道之间的能 量降低,增加了六配位的正八面体络合物的稳定性。
四、络合物的配位数和几何构型
1. 四配位络合物
t1u σ对称 eg π对称 t2g eg t1u a1g
a1g
18电子规则可以预测络合物的结构和稳定性。 RhH(CO)(PPh3)3 NVE=9+1+2+2×3=18 稳定 Co(CO)4 NVE=9+2×4=17 不稳定
Co2(CO)8 HCo(CO)4 NVE=9+2×4+1=18 有一些化合物16电子也稳定:
atomic number)
很早以前,N.V.Sidgwick提出了一个经验规 则: 稳定的过渡金属有机络合物中,金属的电子 数与配位体提供的电子数总和与本周期中的 惰性气体的电子数相同。
例如: Ni(CO)4 Ni 原子序数 28,外围28个电子。 4 个CO 2×4=8 个电子 EAN=36,与惰性气体Kr的电子构型相同。 [Ag(NH3)4]+ Ag 原子序数 47,外围46个电子。 4 个NH3 2×4=8 个电子 EAN=54,与惰性气体Xe的电子构型相同。
η 5CP (C5H5)
η
6
η 3CH CH=CH2
η 1CH CH=CH2
η
7
(C7H7)
NO
C (carbΒιβλιοθήκη ne)注:括号中表示一个配体可以同时与两个以上的金属原子配位。 如:M-X-M
5.金属氧化态与配位数的关系
dn
10 10 8 8 10 8
CN
2 3 3 4 4 5
几何构型
线性 平面三角 T-型 平面四方 四面体 三角双椎
d10元素:Zn2+, Ni0, Pd0, Pt0
Ni(CO)4
四面体结构
d8, d9元素
d8:Pd2+, Ni2+
d9:Cu2+
Cu(NH3)42+
平面四边形
2. 五配位络合物
d8元素:Fe0, Co+
dsp d
3
s
p
Fe(CO)5
三角双锥型结构
3. 六配位络合物 d7 d6
Mo
W 6 5 4
Tc
Re 7 6 5
Ru
Os 8 7 6
Rh
Ir 9 8 7
Pd
Pt 10 9 8
Ag
Au / 10 9
Cd
Hg
dn
Ⅲ
Ⅳ
1
0
2
1
3
2
4
3
5
4
6
5
7
6
8
7
i) Sc族(s2d1)在离子状态时不具有d电子。 ii) Zn族(d10s2)不形成d电子电离的化合物。 iii) F层半添满的Ln、Ac系也属于过渡元 素,但通常所说的过渡金属是指d区的 过渡元素。
如何计算: 1.中性分子
dn 8 配体电子数 NVE
2×(Cp)=10 18
Fe
Ni(CO)4
π C3H5Fe(CO)2NO
10 8
4×(CO)=8 2×CO=4 π -C3H5=3 NO=3
18 18
2. 带电荷络合物:NVE是未络合时金属价电子层中 电子数加上或减去配位离子的电荷数之后,和配位 体所贡献的电子数之和。
化合物举例
Au(PPh3)Cl Pt(PPh3)3 [Rh(PPh3)3]+ [Ir(CO)2Cl2]Ni(PF3)4 [Co(CNAr)5]+
金属氧化态
AuⅠ Pt0 RhⅠ IrⅠ Ni0 CoⅠ
6
6
6
6
四方椎
八面体
Ru(PPh3)3Cl2
[Fe(CN)6]4Cr(CO)6 [Co(NH3)6]2+ ReH5(PPh3)3
a. 烯烃与过渡金属配位 1.烯烃的成键π轨道供给电子和金属空d轨道 相重叠,形成σ配位键,σ-coordinate bond 2.金属的满填d轨道和烯烃的反键π*轨道相 重叠,形成π-反馈键,π-back bond
C M C
Dewar-ChattDuncanson Model
σ配位键使烯烃电子云密度↓
2. 18电子规则
1972年,C.A.Tolman总结和归纳了许多实验结果, 明确提出了18电子规则:对于稳定的单核反磁过渡 金属络合物,其金属的d电子数与配体配键的电子 数总和等于18。
EAN规则的核算方法:必须记住惰性气体的电子数 和该金属的总的外围电子。 18电子规则的核算方法:是从EAN规则简化而来, 除去闭壳结构的内部电子,只计算外层的电子,问 题简单的多。
3. 配位数(coordination number CN)
配体同金属之间形式上(并非一定是真正的) 存在σ键数 络合物中与金属配位的电子给予体的数目
注:配位数不等于配位体的数目。
配位数从0到12,一般为4~8
例
CO, Ph3P, R
CH CH CH2
CN 1 CN 2
R2P(CH2CH2)nPR2, π -CH2-CH=CH2 , M
dn [Co(NH3)6]3+ Co d9 Co3+=9-3=6 配体电子数 6(NH3)=2×6=12 NVE 18
[η5-C5H5Mo(CO)3]-
Mo d6 Mo-=6+1=7
η5-C5H5=5 3(CO)=2×3=6
18
3. 双核络合物
dn
配体电子数
双核
总电子数
Mn2(CO)10 Mn 7 2Mn=2×7=14
第二章
过渡金属络合物的性质
一.过渡金属及电子构型
M 中心金属原子 central transition metal atom L 配位体(ligand)
过渡金属(M)
1、定义:过渡金属是常见氧化态时d轨道(或f轨 道)没有填满或者其能量接近于外层价电子轨 道能量,因而可以利用d轨道(或f轨道)成键 的元素。
2、范围
Ⅲ 3d Sc (d1s2) Ⅳ Ti (d2s2) Ⅴ V (d3s2) Ⅵ Cr (d5s1) Ⅶ Mn (d5s2) Fe (d6s2) Ⅷ Co (d7s2) Ni (d8s2) Ⅰ Cu (d10s1) Ⅱ Zn (d10s2)
4d
5d 0 Ⅰ Ⅱ
Y
La
Zr
Hf 4 3 2
Nb
Ta 5 4 3
Cl Rh PPh3 PPh3 Wilkinson's Rh=d9 PPh3 PPh3 Ir Cl PPh3 Vaska's Ir=d9 CO TiCl2
稳定
Ti=d4
六、金属与配体之间的相互作用
配位体解离之后,形成配位不饱和的络合 物,它能和烯烃、CO、N2、CO2、SO2等 小分子成键,从而使本来惰性的小分子活 化,易于发生反应,总称为小分子活化.
10 ×CO=20
Mn-Mn=2 (2×7+10×2 )/2=18
18电子规则成立的理由: 1. d区 18电子~p区8电子规则 (惰性气体电 子构型解释)
5个nd,1个(n+1)s,3个(n+1)p=9个 分子轨道 每个轨道2个电子,9×2=18,与惰性气体 电子构型类似稳定。
2. 分子轨道理论:
b.一氧化碳与过渡金属配位
在过渡金属与CO形成的络合物中,CO以C和金属相连,CO将 孤对电子给予中心金属原子的空轨道形成σ-配键,另一方面, 中心金属原子将其d轨道上的电子反馈到CO的反键π*轨道中 形成反配位键,这种配位键从整体上称σ-π电子授受配键。
M
C
O
实验表明这些络合物C-O键比CO中的C-O键长,红外光谱 伸缩振动频率变小,说明被配位的CO中C-O键被削弱,M- C键键长要比正常单键短。
二、金属氧化态
金属氧化态(数): 金属化合物中配位 的金属外层轨道(包括(n-1)d, ns, np)被 取走电子后,剩下的电荷。或者说:中 心金属原子的电子对属于电负性较大配 体后剩下的电核数。—— Os oxidation state oxidation numder
例:
Os FeCl2 Fe(CO)5 NiCl2(PPh3)2 Ni(PPh3)4 Fe2+ + ClFe0 + 5CO Ni2+ + 2Cl- + 2PPh3 Ni0 + 4PPh3 Fe Ⅱ Fe 0 Ni Ⅱ Ni 0 dn (外层d电子 的数目) d6 d8 d8 d10
提出的问题:
1.反磁性有机络合物(轨道中的电子双双成对)
2.金属价电子数(The Number of Vallence Electron)NVE 3.基元反应 金属价电子数(NVE)=金属本身价电子数(nd,(n+1)s, (n+1)p,统称dn)与配体所提供电子数之和。
X型配体提供1个电子
