骨髓间充质干细胞形态
山羊骨髓间充质干细胞向纤维软骨分化的形态学改变

基金 资助 :
【 h t t p : / / w ww . c r t e r o r g 】
中国分类号: R3 9 4 . 2
甘哀 雀科 技支 撵计 划 项 巨 1 0 4 F K C A1 4 4 )  ̄西 民族 大学 中青 年科研 基 金项 目 r 8 7 1 6 0 1 3 9 ) .  ̄
。
S t a t e Et h n i c Af f a i r s Co mmi s s i o n , Me d i c a l Co l l e g e o f No  ̄ h we s t Un i v e r s i t y f o r Na t i o n a l i t i e s , L a n z h o u 7 3 0 0 3 0 , Ga n s u Pr o v i n c e, Ch i n a ; S c h o o l o f S t o ma t o l o g y , L a n z h o u Un i v e si r t y , L a n z h o u 7 3 0 0 0 0 , Ga n s u
2 01 4. 0 6. 00 7
于细 魄 :骨 髓 干细魄 :骨 髓 闾充质 于细 胞 :颞 下 镀关节 盘 :碱 性 戏纤 维细 瞻生 长 因子;细 瞻培 养 :组织 I程 } 透射 电镜 ; 国家 自然科 学基 金
主题 词 :
骨髓间充质干细胞形态

骨髓间充质干细胞形态骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一类存在于骨髓中的多能干细胞,在医学领域中具有重要的研究和应用价值。
它们具有自我更新和多向分化的能力,可以分化为成骨细胞、成脂细胞和软骨细胞等,因此被广泛应用于组织工程、再生医学和免疫治疗等领域。
骨髓间充质干细胞的形态特征是它们的形态与其他细胞存在显著差异。
正常情况下,骨髓间充质干细胞呈梭形或纺锤形,细胞体较大,胞质丰富。
细胞核呈椭圆形或卵圆形,位于细胞的中央或偏离中央位置。
细胞浆内含有丰富的有机物质和细胞器,如内质网、线粒体和高尔基体等。
此外,骨髓间充质干细胞表面具有特定的标志物,如CD73、CD90和CD105等,可以通过流式细胞术等技术进行鉴定和分离。
骨髓间充质干细胞的形态特征与其功能密切相关。
首先,骨髓间充质干细胞的形态特征决定了它们具有较好的粘附能力和迁移能力。
这使得它们能够在体内迅速定位到损伤部位,并参与组织修复和再生过程。
其次,骨髓间充质干细胞的形态特征决定了它们的分化潜能和功能。
通过调控细胞外基质、生长因子和信号通路等因素,可以诱导骨髓间充质干细胞向特定方向分化,从而实现组织的再生和修复。
最后,骨髓间充质干细胞的形态特征还与其免疫调节功能密切相关。
研究表明,骨髓间充质干细胞能够通过分泌细胞因子、抑制炎症反应和调节免疫细胞的活性等方式,发挥免疫调节作用,从而对炎症性和自身免疫性疾病具有治疗潜力。
在临床应用方面,骨髓间充质干细胞具有广阔的前景。
首先,骨髓间充质干细胞可以用于组织工程领域,如骨髓间充质干细胞可以通过载体材料和生物活性因子等技术,构建人工骨骼和软骨组织,用于治疗骨和关节疾病。
其次,骨髓间充质干细胞还可以应用于再生医学领域,如骨髓间充质干细胞可以通过干细胞移植等技术,修复受损组织和器官,治疗心脑血管疾病、神经退行性疾病和器官功能衰竭等疾病。
此外,骨髓间充质干细胞还可以用于免疫治疗领域,如骨髓间充质干细胞可以通过调节免疫细胞的活性和增强免疫耐受性等机制,治疗自身免疫性疾病和移植排斥反应等疾病。
骨髓间充质干细胞形态观察
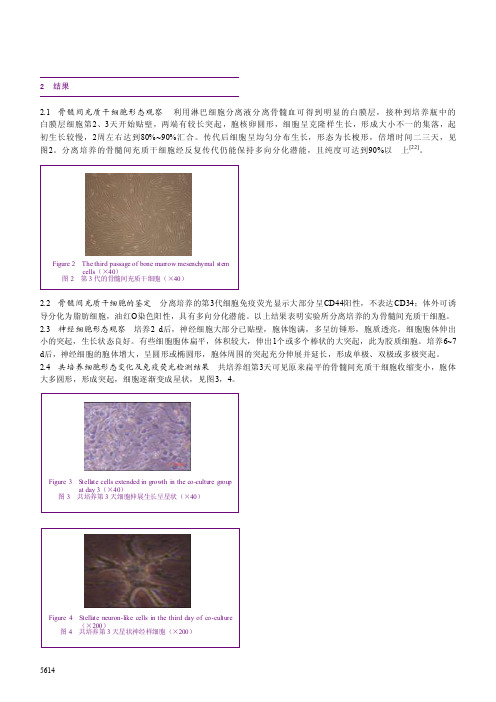
56142 结果2.1 骨髓间充质干细胞形态观察 利用淋巴细胞分离液分离骨髓血可得到明显的白膜层,接种到培养瓶中的白膜层细胞第2、3天开始贴壁,两端有较长突起,胞核卵圆形,细胞呈克隆样生长,形成大小不一的集落,起初生长较慢,2周左右达到80%~90%汇合。
传代后细胞呈均匀分布生长,形态为长梭形,倍增时间二三天,见图2。
分离培养的骨髓间充质干细胞经反复传代仍能保持多向分化潜能,且纯度可达到90%以 上[22]。
2.2 骨髓间充质干细胞的鉴定 分离培养的第3代细胞免疫荧光显示大部分呈CD44阳性,不表达CD34;体外可诱导分化为脂肪细胞,油红O 染色阳性,具有多向分化潜能。
以上结果表明实验所分离培养的为骨髓间充质干细胞。
2.3 神经细胞形态观察 培养2 d 后,神经细胞大部分已贴壁,胞体饱满,多呈纺锤形,胞质透亮,细胞胞体伸出小的突起,生长状态良好。
有些细胞胞体扁平,体积较大,伸出1个或多个棒状的大突起,此为胶质细胞。
培养6~7 d 后,神经细胞的胞体增大,呈圆形或椭圆形,胞体周围的突起充分伸展并延长,形成单极、双极或多极突起。
2.4 共培养细胞形态变化及免疫荧光检测结果共培养组第3天可见原来扁平的骨髓间充质干细胞收缩变小,胞体大多圆形,形成突起,细胞逐渐变成星状,见图3,4。
Figure 2 The third passage of bone marrow mesenchymal stem cells (×40) 图2 第3代的骨髓间充质干细胞(×40)Figure 3 Stellate cells extended in growth in the co-cultu re grou p at day 3(×40) 图3 共培养第3天细胞伸展生长呈星状(×40) Figure 4 Stellate neuron-like cells in the third day of co-culture (×200) 图4 共培养第3天星状神经样细胞(×200)共培养组第4~5天后星状细胞数目逐渐增多,并可互相形成连接,具有神经样形态结构,免疫荧光显示神经元特异性烯醇化酶呈阳性表达,见图5,阳性率为 (32.7±11.5)%,表现神经元细胞的特性。
骨髓间充质干细胞总结

2003年8月,为给大家提供一个网上交流干细胞研究经验的平台,我们干细胞版设立了骨髓间充质干细胞培养讨论区,经过近三个月的讨论学习,我们既学习丰富了自己的知识体系,也对间充质干细胞尤其是分离培养方面有了更为翔实的认识,为了大家阅读的方便,我们决定把本版中的相关内容,同时参考部分书目和文献,做一总结。
一、骨髓间充质干细胞的分离目前常用的分离MSC的方法有全骨髓法和密度梯度离心法,全骨髓法即根据干细胞贴壁特性,定期换液除去不贴壁细胞,从而达到纯化MSC的目的。
密度梯度离心法即根据骨髓中细胞成分比重的不同,提取单核细胞进行贴壁培养。
随着对MSC表面抗原认识的深入,有人利用免疫方法如流式细胞仪法、免疫磁珠法等对其进行分离纯化,但经过流式或磁珠分选后的细胞出现了增殖缓慢等一些问题,加之耗费较大和技术的难度,在某种程度上限制了这些方法的广泛应用。
1. 直接培养法(全骨髓培养法)1987年,Friedenstein等发现在塑料培养皿中培养的贴壁的骨髓单个核细胞在一定条件下可分化为成骨细胞、成软骨细胞、脂肪细胞和成肌细胞,而且这些细胞扩增2 0-30代后仍能保持其多向分化潜能,这类细胞即为骨髓间充质干细胞(BMSC),其工作对今后MSC的研究具有重要意义,不仅证实了骨髓MSC的存在,而且创建了一种体外分离和培养MSC的简便可行的方法,得到了广泛的应用。
culture-spirit采用直接贴壁法,24-36小时首次换液,换液时用PBS洗两次,7 -10天传第一代,以后2-3天传代。
培养基采用Hyclone的DMEM/F-12(1:1),血清是天津TBD的FBS(顶级),得到了较好的培养结果。
布兰卡根据自己培养大鼠MSC的经验,详细介绍了实验步骤:(1)接种后60-80分钟,换液去除悬浮细胞(2)原代培养24h,48h各换液一次(3)观察细胞情况,在原代培养7天左右时,如观察到成片的典型形态的细胞,在瓶底用Marker笔标记,0.25%胰酶消化,镜下观察控制,约5-10分钟(室温太低时应放置到孵箱中),加入全培养基终止消化,瓶体朝上,吸管轻轻吹打4-8分钟,尤其是标记部位。
骨髓间充质干细胞的主要表面标志

骨髓间充质干细胞的主要表面标志1 骨髓间充质干细胞的发现和来源骨髓组织中有多种细胞成分,除基质细胞等已经分化的细胞外,还含有两类多潜能干细胞:造血干细胞和间充质干细胞。
1987 年Friedenstein 等发现在塑料培养皿中培养的贴壁的骨髓单个细胞在一定条件下可分化为多种类型的细胞,而且经过20-30个培养周期仍能保持其多向分化潜能。
由于骨髓中的这种多能细胞能够分化为多种中胚层来源的间质细胞, 故称之为间充质干细胞(Mesenchymal stem cells,MSCs),或间质祖细胞(MPCs),是成人多能干细胞的一类。
早期分离培养时,发现其形状呈成纤维细胞样而称其为成纤维细胞集落形成单位(Colony-forming unit-fibroblast,CFU-F),或骨髓基质成纤维细胞(Marrow stromal fibroblast,MSF)。
Friedenstein AJ , Chailakhyan RK, Gerasimov UV. Bone marrow o steogenic stem cells: in vit ro cult ivat ion and t ransp lantat ion in diffusion chambers. Cell T issue Kinet, 1987, 20 (3) : 263-267]2 鉴于其强大的增殖能力及多向分化潜能,可在体外长期培养和遗传背景较稳定,而且用自体干细胞诱导构建的组织不涉及伦理问题,也不存在MHC限制,所以骨髓间充质干细胞日益受到重视。
但是与造血干细胞等其他细胞相比,骨髓中MSCs的数量非常少,约占整个骨髓有核细胞的十万分之一,并随年龄的增加,细胞数量逐渐减少。
因此,如何简便有效地从骨髓中获取高纯度的MSCs显得尤为重要,寻找高度特异性的MSCs的表面抗原也就成为MSCs研究中的一项重要任务和目标。
不仅如此,一种同样来源于骨髓、贴壁生长、被认为更原始(可以分化为MSCs)也具有更强增殖能力的干细胞也被鉴定,它就是多能成体祖细胞(multipotent adult progenitor cell (MAPC) or mesodermal progenitor cell(MPC))[Reyes, M., Lund, T., Leuvik, T., Aguiar, D., Koodie, L., Verfaillie,C.M. (2001) Purification and in vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood 98, 2615-2625],因能和MSCs一起被纯化而统称BM stromal stem cell。
骨髓间充质干细胞体外成软骨分化的形态学变化

骨髓间充质干细胞体外成软骨分化的形态学变化王志聪;刘跃洪;周庆;陈曦;周宇;孙慧君;刘谟震【摘要】背景:骨髓间充质干细胞在向软骨细胞分化过程中可形成聚合体,但是该形态学特点是否可代表骨髓间充质干细胞已经成软骨分化尚无研究报道.目的:观察骨髓间充质干细胞成软骨分化过程中聚合体的形成和成软骨分化情况.方法:体外培养大鼠骨髓间充质干细胞,传代至第6代时备用.对照组用无血清LG-DMEM培养基培养14d,诱导组用含转化生长因子β3的成软骨完全诱导培养基培养14d,倒置显微镜观察诱导过程中细胞形态变化;免疫荧光染色、甲苯胺蓝染色、qRT-PCR检测成软骨特异指标Ⅱ型胶原、蛋白多糖和成软骨转录因子SOX9的基因表达及蛋白合成情况.结果与结论:①与对照组相比,诱导组骨髓间充质干细胞在第3天失去典型的成纤维形态,第7天开始形成成簇的单层聚合体,第14天形成直径更大的多层聚合体;②聚合体的免疫荧光染色及甲苯胺蓝染色均阳性,而聚合体外的单个细胞无特异染色;③qRT-PCR亦证实诱导组有成软骨特异基因Ⅱ型胶原、蛋白多糖和SOX9表达;④上述研究结果提示骨髓间充质干细胞成软骨分化过程中聚合体的形成可作为成软骨分化的一种形态学检测指标.【期刊名称】《中国组织工程研究》【年(卷),期】2018(022)033【总页数】5页(P5281-5285)【关键词】骨髓间充质干细胞;成软骨分化;软骨细胞;聚合体;形态学;Ⅱ型胶原;蛋白多糖;SOX9转录因子;干细胞;国家自然科学基金【作者】王志聪;刘跃洪;周庆;陈曦;周宇;孙慧君;刘谟震【作者单位】德阳市人民医院骨科,四川省德阳市618000;德阳市人民医院骨科,四川省德阳市618000;德阳市人民医院骨科,四川省德阳市618000;德阳市人民医院骨科,四川省德阳市618000;德阳市人民医院骨科,四川省德阳市618000;大连医科大学药学院,辽宁省大连市116044;大连医科大学附属第一医院骨科,辽宁省大连市116011【正文语种】中文【中图分类】R394.2文章快速阅读:文题释义:转化生长因子β3:在哺乳动物胚胎发育过程中,能够促进形态发生,并对脊椎形成、肢端发芽、面骨形成及心脏瓣膜的形成起重要作用。
小鼠骨髓间充质干细胞的分离培养与鉴定

小鼠骨髓间充质干细胞的分离培养与鉴定摘要】目的分离、培养符合实验要求的小鼠骨髓间充质干细胞并进行鉴定,为进一步的研究打基础。
方法采用贴壁培养法培养小鼠骨髓间充质干细胞,观察细胞的形态及生长特性,并应用流式细胞仪对细胞表面抗原CD34、CD45、CD29、CD44进行表型鉴定。
结果原代分离的间充质干细胞在接种后培养24小时,细胞开始贴壁,胞体呈圆形或多边形,培养第3-5天,细胞开始较紧密贴附壁上并开始有细胞呈梭形,培养第7天开始观察到细胞分裂,随着细胞数的增加,细胞的生长速度变快,逐渐成漩涡状排列,培养第12天贴壁细胞长满瓶底的80%,并融合成片。
传代后细胞生长迅速,培养7天左右即可长满瓶底的80%。
传至10代仍具有良好的增殖活性。
流式细胞仪检测第4代及第8代MSCs细胞均不表达CD34、CD45,但表达CD29、CD44,纯度分别为73.8% 、91.65%。
结论采用贴壁培养法可获得生长状态良好、增殖能力强的间充质干细胞,随传代数增加,其纯度增加,且该方法简单、实用。
【关键词】骨髓间充质干细胞细胞培养流式细胞术表型鉴定【中图分类号】R392.2 【文献标识码】A 【文章编号】2095-1752(2012)01-0082-02间充质干细胞(mesenchymal stem cells,MSCs)起源于中胚层,具有高度增殖和自我更新的能力,有向骨、软骨、脂肪、血管内皮细胞、神经星型胶质细胞等分化的潜能[1],可分化成骨髓基质支持造血,并可分泌多种细胞因子促进造血干细胞增殖分化,同时它能抑制同种异体反应性T淋巴细胞,在同种异基因造血干细胞移植后的造血重建及免疫调节,预防移植物抗宿主病等方面有广阔的应用前景[2],但骨髓间充质干细胞含量极低,仅占骨髓单个核细胞的0.001%-0.010%[3],因此,培养出生长状态良好,足够数量的骨髓间充质干细胞是应用的前提。
1 材料和方法1.1 材料1.1.1 实验动物雄性,C57B L/6小鼠,清洁级,8周龄,体重18-20g,购于吴氏动物实验中心。
骨髓间充质干细胞形态

骨髓间充质干细胞形态骨髓间充质干细胞(mesenchymal stem cells,MSCs)是一类存在于骨髓、脂肪组织和其他组织中的多能干细胞。
它们具有自我更新和多向分化的能力,可以分化为骨细胞、软骨细胞、脂肪细胞等不同类型的细胞。
骨髓间充质干细胞的形态特征对于研究其生物学特性和应用具有重要意义。
骨髓间充质干细胞在体外培养条件下呈现出一种纤维状或星状的形态。
它们具有较大的细胞体积和多个突起,这些突起可以与周围细胞或基质相互作用。
骨髓间充质干细胞的细胞质富含丰富的内质网和高尔基体,这些细胞器对于蛋白质合成和分泌起着重要作用。
骨髓间充质干细胞的细胞核通常呈椭圆形或不规则形状。
细胞核包含着遗传信息,控制着细胞的生长和分化。
骨髓间充质干细胞的细胞核内含有染色质和核仁,染色质是细胞遗传物质的主要组成部分,核仁参与核糖体的合成和蛋白质合成。
骨髓间充质干细胞的形态特征对于其功能和应用具有重要影响。
研究发现,骨髓间充质干细胞的形态与其增殖和分化能力密切相关。
较大的细胞体积和多个突起可以增加细胞与周围环境的接触面积,促进细胞间的信号传导和物质交换。
丰富的内质网和高尔基体可以提供足够的蛋白质合成能力,支持细胞的增殖和分化。
骨髓间充质干细胞的形态特征还可以用于鉴定和分离。
通过观察细胞的形态特征,可以初步判断细胞的纯度和活性。
一般来说,纤维状形态和较大的细胞体积是骨髓间充质干细胞的典型特征,而脱落细胞和变形细胞则可能是其他细胞类型的污染。
近年来,骨髓间充质干细胞作为一种重要的干细胞资源,被广泛应用于组织工程、再生医学和免疫治疗等领域。
其形态特征的研究不仅有助于深入了解其生物学特性和功能,还可以为其应用提供理论基础和实践指导。
骨髓间充质干细胞具有纤维状或星状的形态特征,具有较大的细胞体积和多个突起。
细胞核呈椭圆形或不规则形状,包含着遗传信息。
这些形态特征对于骨髓间充质干细胞的生物学特性、功能和应用具有重要意义。
通过研究骨髓间充质干细胞的形态特征,可以更好地理解其生物学行为和应用潜力,推动干细胞研究和临床应用的发展。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
骨髓间充质干细胞形态
骨髓间充质干细胞(BM-MSCs)是一类来源于骨髓的多能干细胞,具有广泛的应用前景。
BM-MSCs具有多向分化潜能,可以分化为成骨
细胞、软骨细胞、脂肪细胞等多种细胞类型,因此在组织工程、再生
医学、免疫治疗等领域有着广泛的应用。
BM-MSCs的形态特征是细胞体积较大,呈梭形或星形,细胞质丰富,核浆比例低,核染色质较少,细胞质内含有丰富的细胞器,如线粒体、内质网、高尔基体等。
此外,BM-MSCs表面具有多种细胞表面标志物,如CD29、CD44、CD73、CD90等,同时不表达CD34、CD45
等造血干细胞标志物。
BM-MSCs的分离和培养需要特定的培养基和条件。
目前常用的培养
基包括DMEM/F12、α-MEM等,通常添加10%的胎牛血清或人血清,以及一定浓度的抗生素和抗真菌剂。
在培养过程中,需要控制细胞密
度和培养时间,以保证细胞的生长和分化。
BM-MSCs的应用前景非常广泛。
在组织工程领域,BM-MSCs可以
用于修复骨、软骨、肌肉等组织缺损,同时也可以用于修复心肌、神
经等组织缺损。
在再生医学领域,BM-MSCs可以用于治疗糖尿病、
肝病、肾病等疾病。
在免疫治疗领域,BM-MSCs可以用于治疗自身
免疫性疾病、移植排斥等疾病。
总之,BM-MSCs是一类非常有前途的干细胞,具有广泛的应用前景。
随着技术的不断进步和研究的深入,相信BM-MSCs将会在更多的领
域得到应用。
