铷盐概述
NPD
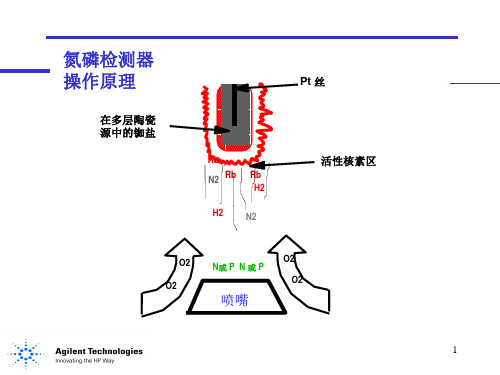
在多层陶瓷 源中的铷盐
Rb N2 Rb Rb H2 H2
Pt 丝
活性核素区
N2
O2 O2
N或 P N 或 P
O2
O2
喷嘴
1
氮磷检测器 操作原理
主要用于分析检测含有氮、磷的化合物。其核心部件是一个加 热的陶瓷源--叫做铷盐珠,处于喷嘴的上方。其样品经载气 携带经过一个氢气/空气等离子体。低的氢气/空气比不能维持 火焰,使碳氢化合物的电离减至最小,而铷珠表面的碱盐离子 促进有机氮或有机磷化合物的电离。输出的电流正比于收集到 的离子数。用一个静电计测量并将其转换为数字形式,传送到 一个输出设备。
350oC 2min 100oC/min 250oC 0min 25psi(对于EPC进样口恒定压力)
300oC(推荐325-330oC) 3mL/min 60mL/min 10mL/min(推荐氮气) 50pA(推荐30-35)
60oC 0min 20oC/min 200oC.095V),通常作微小校正。
9
10
NPD测试条件
色谱柱与样品 类型 样品 进样体积 1uL 进样口 温度 HP-5 30mx 0.32mmx 0.25um PN19091J-413 NPD测试样品 18789-60060
进样口压力 分流/不分流 模式 分流流量 60mL/min 分流时间 0.75min PTV 模式 进样口温度 初始时间 0.1min 速率1
200oC 吹扫/填充或分流/不分流 柱温跟踪 冷柱头进样 60oC PTV(见下面) 25psi(对于用氦气的EPC进样口,压力恒定) 不分流
不分流 60oC 720oC/min
11
终温1 终温时间1 速率2 终温2 终温时间2 进样口压力 分流时间 0.75min 分流流量 60mL/min 检测器 温度 H2流量 空气流量 尾吹气+柱流量 补偿 柱箱 初始温度 初始时间 速率1 终温 终温时间
铷的化学式-概述说明以及解释

铷的化学式-概述说明以及解释1.引言1.1 概述铷(Rubidium,化学符号Rb)是一种化学元素,属于第一周期的碱金属元素。
它是地壳中含量较稀少的元素之一,与钾、钠等金属具有相似的特性。
铷的化学式为Rb。
铷是一种银白色的金属,具有良好的导电性和导热性。
它的密度较小,相对分子质量约为85.47 g/mol。
与其他碱金属类似,铷在空气中容易与氧气发生反应,形成氧化铷(Rb2O)。
铷也与水反应,生成氢氧化铷(RbOH)。
铷的熔点较低,为39.3C,使得它在常温下可以轻易熔化。
铷具有一些特殊的化学性质。
它具有较高的电离能,使得铷可以形成带正电荷的离子。
在溶液中,铷离子会与其他带负电荷的离子形成化合物。
此外,铷还可以与氯、氟等非金属元素形成化合物,如RbCl、RbF等。
由于铷在自然界中含量较少,它的应用领域相对较窄。
然而,铷具有一些特殊的性质,使得它在某些领域有着独特的应用前景。
例如,铷在光学领域中被广泛应用于激光器和光电器件中。
此外,铷也被用作实验室中的基础化学物质,用于合成其他化合物或进行科学研究。
本文将详细介绍铷的基本性质和化学反应,以及总结铷的化学式。
我们还将展望铷在未来的应用前景,探讨其可能在材料科学、能源存储等领域的潜在应用价值。
通过深入了解铷的化学性质和应用前景,有助于我们更好地理解和利用这一元素。
1.2 文章结构本文将分为三个主要部分进行讨论。
首先,引言部分将提供关于本文的概述、文章结构以及研究目的的说明。
其次,正文部分将详细介绍铷的基本性质和化学反应。
最后,结论部分将总结铷的化学式,并展望铷的应用前景。
在正文部分中,2.1 铷的基本性质将详细探讨铷的物理和化学性质,包括其原子结构、元素周期表中的位置以及常见的物理特性(如密度、熔点、沸点等)。
此外,我们还将讨论铷的离子化倾向、电子亲和力以及化学键的形成等方面的特点。
接下来的2.2 铷的化学反应部分将着重探讨铷与其他元素或化合物之间的化学反应。
铷的资源和应用前景分析

铷的资源和应用前景分析铷在医药、催化剂、电子元件、磁流体发电、特种玻璃甚至火箭离子推进装置中都展现了其广泛的应用。
由于铷元素在高科技领域有无可替代的作用,需求量与日剧增,其能源储量日益趋于紧张,如何高效的使用铷以及如何改进铷的提取技术,在今后铷的应用前景里将会是很重要的一个课题。
标签:铷应用领域应用前景0前言铷是德国科学家Robert Bunsen、Gustav Robert Kirchhopp在1861年通过光谱分析法利用分光镜通过锂云母矿物时发现的。
铷是一种银白色蜡状金属,质地轻而柔软,比重仅为 1.532g/cm3,在(102.7F=39.2℃)温度环境下可熔解为液态,至686℃沸腾。
铷属于碱性金属,原子序数37,化学性质较钾活泼,在光的作用下易放出电子,是第二个最具正电性且稳定的碱金属元素。
遇水起剧烈作用,生成氢气和氢氧化铷。
易与氧作用生成氧化物。
由于遇水反应放出大量热,所以可使氢气立即燃烧。
因其在室温条件下会发生自燃,纯金属铷通常存储于密封的玻璃安瓿瓶中。
在我国,铷资源的分布较为广泛,但多存在于其他矿物之中,目前在自然界中未发现有独立的铷矿物,因此铷的采集主要通过从其他矿产中提取为主,如从光卤石、锂云母、海水中及部分地层水,盐湖卤水中提取。
其中又以光卤石中铷的总储量为最大。
铷共有45个同位素(铷-71~铷-102),其中有1个同位素是稳定的。
在自然界出现的铷-87,带有弱放射性。
由于铷元素特有的化学及物理性质,使其在诸多领域中发挥了重要的作用。
1铷的矿物特征和矿物类形及铷资源分布情况铷元素在地壳中分布广泛,丰度值为16甚至比铜还高,其含量约为0.0279%,因此可算是资源量较为丰富的一种元素。
但地球上的铷没有单独富集形成独立矿物,而是分散在其他造岩矿物中。
目前发现铷主要赋存在白榴石、艳榴石、锂云母、光卤石、海水及盐湖卤水等自然矿物中。
锂云母里含有 1.5%的铷,是提供铷工业产品的重要来源,其次是钾矿物及一些钾的氯化物。
铷铯及其化合物概况

铷/铯及其化合物概况1.1 铷/铯的基本概况1.1.1 铷的基本概况铷英文名称:Rubidium。
性质:第1族(IA)(碱金属)元素。
原子序数37。
铷在1861年由德国Bunsen R W和Kirchhoff G R共同发现。
有稳定的85Rb 和放射性的87Rb两种天然同位素;24种人工合成同位素。
铷是一种银白色稀有碱金属,CAS No.:7440-17-7。
熔点很低(38.8℃),沸点为688℃,密度为1.53克/厘米3。
铷质软,有延展性,化学性质极活泼,在空气中能自燃与水利用强烈在常温下能引起燃烧和爆炸,甚至同-100℃的冰亦能猛烈反应。
在光的作用下,铷易放出电子,由于铷的活性大,生产、使用、贮存和运输中,必须将其放在严密隔绝空气的装置中。
铷在自然界分布很广,但至今尚未发现单纯的铷矿物,而常在锂云母、黑云母、光卤石等矿物中存在。
盐湖卤水和海水中也含有较多的铷。
目前,锂云母、盐湖卤水是提取铷的主要资源。
铷的用途铷是制造光电管的主要感光材料,使用光波范围广、灵敏度高(稍逊于铯)、稳定。
铷原子钟的特点是需要的功率小、体积小、重量轻,准确度可达万亿分之一。
铷极易电离,可用作固体电池的电介质。
目前正在大力开展铷在离子发动机、磁流发电机及热电前正在大力开展铷在离子发动机、磁流发电机及热电换能器等方面的研究工作。
1.1.2 铯的基本概况铯是碱金属族的一种银白色、质软、易展性的金属元素,铯的熔点( 28.55 ℃) ;沸点(679℃) ;蒸气压最高,密度最大,正电性最强,电离势和电子逸出功最小。
金属铯的活性很强,在空气中燃烧会喷溅,产生浓密的碱性烟雾,伤害眼睛、呼吸系统和皮肤。
因此在生产、贮存及运输时必须严格防止金属铯同空气或水接触。
铯的主要化工产品是硫酸铯、硝酸铯、碳酸铯、氯化铯、碘化铯、铬酸铯等盐类及金属铯。
铯特性与铷相似,铯的用途与铷相同外。
铯的氧化物亦可作高能固体燃料,铯可制造人工铯离子云、铯离子加速器,以及反作用系统材料与烟火制造材料。
铷 工业指标

铷工业指标简介铷(Rubidium)是一种化学元素,属于碱金属。
它的原子序数为37,化学符号为Rb。
铷具有低熔点、低沸点和高反应性等特点,在工业生产中具有广泛的应用。
本文将详细介绍铷在工业中的指标及其相关内容。
1. 铷的物理性质•原子量:85.4678 g/mol•密度:1.532 g/cm³•熔点:39.31°C•沸点:688°C•摩尔体积:55.76 cm³/mol•半径:248 pm2. 铷的化学性质铷是一种高度活泼的金属元素。
它与氧、水和大多数非金属元素都能发生剧烈反应。
2.1 反应性铷能够与氧气反应生成氧化铷(Rb2O)。
在与水接触时,铷会迅速与水反应产生氢气和氢氧化铷(RbOH)。
此外,铷还能与酸类发生反应。
2.2 合金制备由于铷具有良好的合金制备性能,它常被用于制备各种合金。
例如,铷银合金具有较低的熔点和良好的电导率,可用于制作电极材料。
3. 铷在工业中的应用3.1 光电器件铷在光电器件中有着广泛的应用。
由于铷具有高度敏感的光学特性,它被广泛用于激光技术、光纤通信和光谱分析等领域。
铷原子钟是一种利用铷原子的特性来测量时间的高精度时钟。
3.2 医疗领域由于铷对生物体无毒且容易被人体吸收,它在医疗领域也有一定的应用。
例如,铷-82可以作为一种放射性示踪剂,用于检测心肌灌注。
3.3 燃料电池铷在燃料电池中被广泛应用。
燃料电池是一种将化学能直接转化为电能的装置,而铷则可以作为催化剂促进反应速率,提高燃料电池效率。
4. 铷工业指标4.1 生产量根据国际能源署的数据,全球铷的年产量约为500吨。
主要生产国家有中国、俄罗斯和加拿大等。
4.2 市场价格铷是一种稀有金属,市场价格相对较高。
根据市场供求关系和其他因素的影响,铷的价格会有所波动。
4.3 质量标准铷在工业中需要符合一定的质量标准。
例如,在光电器件领域,铷需要具备一定纯度和稳定性才能保证器件的性能。
结论铷作为一种重要的工业元素,在光电器件、医疗领域和燃料电池等领域都有着广泛应用。
2024年铷市场需求分析

2024年铷市场需求分析1. 引言本文对铷市场进行需求分析,旨在了解铷市场的潜在需求,为投资者提供决策依据。
首先,我们将简要介绍铷的基本信息,然后探讨铷市场的需求潜力,并分析驱动需求的因素。
最后,根据需求分析结果,提供建议。
2. 铷的基本信息铷(Rb)是一种化学元素,属于碱金属。
它的原子编号为37,原子量为85.468,定位于元素周期表的第五周期第一组。
铷具有较低的熔点和沸点,具有一定的金属特性,可以与其他元素形成化合物。
铷在生命科学、化学工业和电子技术等领域有广泛应用,因此具有一定的市场潜力。
3. 铷市场需求潜力3.1 市场规模根据市场调研数据,铷市场规模逐年增长。
主要原因包括新兴应用领域对铷的需求增加以及传统领域的稳定需求。
根据预测,未来几年内铷市场将保持稳定增长。
3.2 主要应用领域3.2.1 生命科学领域铷在生命科学领域有重要应用,特别是在细胞研究、免疫学和病理学等方面。
铷离子在细胞膜的稳定性和功能中起着重要作用,因此在药物研究和治疗方面有潜在需求。
3.2.2 化学工业领域铷化合物在化学工业中具有一定的应用。
例如,铷化合物可以用作催化剂、添加剂和电池材料。
随着化学工业的发展,对铷的需求将逐渐增加。
3.2.3 电子技术领域铷在电子技术领域有广泛应用,特别是在光电器件和半导体材料中。
铷化合物可以用作半导体表面的提取剂,以增加半导体器件的性能。
随着电子技术行业的快速发展,对铷的需求也将持续增长。
3.3 市场驱动因素3.3.1 科技进步科技的进步驱动铷市场的需求增长。
新兴技术的发展为铷在各领域的应用提供了更多可能性,从而刺激市场需求。
3.3.2 人口增长由于人口的增长和生活水平的提高,对生命科学、化学工业和电子技术的需求也在不断增加。
这促使相关产业对铷等元素的需求增加。
3.3.3 政策支持政府的政策支持对促进铷市场发展起着积极作用。
政府对相关领域的研究经费和创新项目提供支持,为市场需求的增长提供了保障。
国内外铷矿调研
国内外铷矿调查情况简介国内外铷矿调查情况简介1铷的基本知识铷的性质铷(英文名称Rubidium,化学符号Rb)是一种重稀碱金属,属低熔点活泼金属。
熔点38.89℃,沸点686℃,呈银白色蜡状,质软而轻,有延展性。
铷的化学性质与钾相似,但比钾活泼。
铷暴露在空气中会燃烧,在室温和空气中能自燃,因此必须在严密隔绝空气的情况下保存在液体石蜡中。
铷遇水会爆炸,铷甚至与温度低到-100℃的冰相接触时,也能发生猛烈反应,生成氢氧化铷和氢气。
铷在165K时能分解冰,加热到573K时能置换出玻璃中的硅。
80℃以下可用橡胶容器;200℃以下可用玻璃、石英、黄铜、铝或陶瓷容器;700~1000℃须用软钢、不锈钢、镍合金或镍制容器。
金属铷由于活性大,因此其生产、使用、贮存和运输必须在严密隔绝空气的装置中进行。
金属铷的提取操作必须始终在矿物油或惰性气体保护下或在真空中进行。
铷和铯具有类似的物理性质,在许多应用领域可以相互替换,但铯的化学性质比铷更活泼。
化学上, 铷是仅次于铯的第二正电性金属, 能与大多数阴离子结合形成可溶性化合物, 这些化合物大多有较强的吸湿性。
此外,铷还能与其他碱金属(如锑、铋、铬、铜、铁、铅)、金及汞等形成二元或多元系合金以及不可溶性复合卤化物,能制成熔点很低的液体合金。
铷还可以和许多非过渡金属形成化合物。
铷的用途由于铷具有很强的化学活性和优异的光电效应性能,使其在许多领域中有着重要的用途。
铷是制造自动控制、光谱测定、电子器件、分光光度计、雷达、彩色电视、电子钟、激光器以及玻璃、陶瓷等设备的重要原料。
在空间技术方面,离子推进器和热离子能转换器需要大量的铷;铷的氢化物和硼化物可作高能固体燃料;放射性铷可用来测定矿物年龄。
铷在光的作用下易放出电子,可用于制造光电池。
铷和钾、钠、铯的合金可用以除去高真空系统的残余气体。
铷盐(如碘化物)可用于制药。
碘化铷银(RbAg4I5)是良好的电子导体,可用作固体电池的电解质。
铷的性质及分析方法综述
铷的性质及分析方法综述一、铷的基本性质表1:铷的基本性质二、热分解法热分解法是制取高纯金属铷和铯的一种方法,使铷和铯氢化物或氮化物进行热分解。
在真空度为13.3Pa,温度500℃以下,可得到较好的效果。
用叠氮化物热分解,可用以制备高纯金属铷和铯。
可用硫酸铯水溶液与偶氮钡反应而制得铯的叠氮化物CsN3,它在326℃熔融,而在390℃分解而形成金属铯。
此法可获得不含气体的光谱纯金属,这些金属用作测定其热力学性能及物理常数。
三、热还原法该法是制取金属铷和铯的简便方法,在生产上广泛采用此法。
铷和铯的氧化物、氢氧化物,碳酸盐、卤化物、硫酸盐、铬酸盐、硝酸盐等,均可用强还原性金属锂、钠、钙、镁、锆、铝或硅等在高温度下还原,然后减压蒸馏将铷和铯从反应器中移出。
金属热还原法因采用的原料及还原剂不同,而有下面一些方法。
(1)镁还原法:该法以金属镁作还原剂,可采用的铷、铯化合物原料有:碳酸盐,铝酸盐、氢氧化物、氧化物等,反应可在较低温度(500~550℃)下进行;(2)锆还原法:该法以金属锆作还原剂,已成功地用于放电管材料用的金属铷和铯的生产。
此法反应速度快,在850℃左右温度下进行,可得到较高的金属回收率,但要求有良好的装置并应严格控制厦应条件。
比较好的原料是铷、铯的铬酸盐和重铬酸盐。
还可用酸式硫酸盐和硫酸盐等;(3)钙还原法:该法以铷和铯的氯化物为原料,用钙还原。
是生产金属铷和铯的重要方法。
钡和钙金属可还原CsCl而镁却不能。
将纯氯化铷(或铯)装入干燥的不锈铜反应器中,然后加入大约等比例的纯钙粉,混合均匀并稍压紧。
然后将反应器密封抽真空至1.33×10-2Pa,开始缓慢升温,在400℃时,铯开始从反应器中流出来。
然后,逐渐升温到800℃并保持约30min,使反应完全。
在真空下(真空度高,纯度高)金属蒸气流动至冷凝器冷凝,液态金属流入收集器中。
金属的回收率可达90%~95%。
还原所得金二、铷矿的选矿工艺三、铷的分离、提取方法四、铷的测定方法及干扰六、应用铷原子的最外层电子很不稳定,很容易被激发放射出来。
中国铯铷盐行业市场现状及发展趋势分析
中国铯铷盐行业市场现状及发展趋势分析一、铯铷产品应用领域铯是一种可“上天入地”的稀有矿种,在地壳中的丰度处于中等水平,主要以铯榴石、锂云母和盐湖卤水的形式存在,但锂云母和盐湖卤水中铯的品位非常低,开发成本高。
铯榴石因其品位高而具有无可比拟的先天优势。
铷无单独工业矿物,常分散在锂云母、铯榴石和盐矿层之中。
铯产品运用领域广泛,主要用于医疗医药、航空航天、5G通信、时间频率行业、油气钻探、精细化工、防火材料等领域。
其不可替代性和卓越性能已获得相关领域高度认可和规模化使用,西方发达国家是全球铯的主要消费国,我国在铯的高端应用领域与西方发达国家仍有差距。
二、全球铯铷资源储量分布情况全球氧化铯资源储量约22万吨,主要分布于加拿大、津巴布韦、纳米比亚、澳大利亚四国,资源非常稀缺。
铯榴石含有5%-32%氧化铯,其矿产是提取铯资源的主要原料。
铯资源亦分布于锂云母矿、盐湖卤水等中,但品位极低,主要作为伴生资源开采,开发成本很高。
目前全球可规模化开采的铯榴石矿仅有三个,分别为加拿大Tanco矿区、津巴布韦Bikita矿区和澳大利亚Sinclair矿区,其中Bikita矿区铯榴石资源逐步枯竭,Sinclair矿区2019年完成所有经济可采矿石的开采和运输,因此Tanco矿区是目前铯资源开采主力矿山。
三、全球铯铷盐行业龙头企业——中矿资源中矿资源是全球铯产业链最完善的制造商,具备铯榴石开采、加工、精细化工产品的生产和提供产品技术服务的能力,是铯铷盐精细化工领域的龙头企业。
2018年中矿资源向东鹏新材原股东发行股份及支付现金购买其100%股权,其中发行股份对价约14亿元,现金支付约4亿元,进入稀有轻金属产业链。
截至2021年上半年,中矿资源营业收入8.74亿元,同比增长68.51%,其中铯铷盐业务收入4.03亿元,同比增长100.2%,占比总营收比例为46%。
2018年中矿资源收购东鹏新材时,江西东鹏的股东承诺2018年、2019年、2020年的三年净利润分别不低于1.6亿、1.8亿、2亿。
碱金属元素性质总结讲解
元素周期律碱金属元素性质总结I.元素周期律1.周期表位置IA族(第1纵列),在2、3、4、5、6、7周期上均有分布。
元素分别为锂(Li)-3,钠(Na)-11,钾(K)-19,铷(Rb)-37,铯(Cs)-55,钫(Fr)-87。
2.碱金属的氢氧化物都是易溶于水, 苛性最强的碱, 所以把它们被称为为碱金属。
3.碱金属的单质活泼,在自然状态下只以盐类存在,钾、钠是海洋中的常量元素,其余的则属于轻稀有金属元素,在地壳中的含量十分稀少。
钫在地壳中极稀少,一般通过核反应制取。
4.保存方法:锂密封于石蜡油中,钠。
钾密封于煤油中,其余密封保存,隔绝空气。
II.物理性质II.1物理性质通性(相似性)1.碱金属单质皆为具金属光泽的银白色金属(铯略带金黄色),但暴露在空气中会因氧气的氧化作用生成氧化物膜使光泽度下降,呈现灰色。
常温下均为固态。
2.碱金属熔沸点均比较低。
摩氏硬度小于2,质软。
.导电、导热性、延展性都极佳。
3.碱金属单质的密度小于2g/cm3,是典型轻金属,锂、钠、钾能浮在水上。
4.碱金属单质的晶体结构均为体心立方堆积,堆积密度小。
II-2.物理性质递变性随着周期的递增,卤族元素单质的物理递变性有:1.金属光泽逐渐增强。
2.熔沸点逐渐降低。
3.密度逐渐增大。
钾的密度具有反常减小的现象。
II.3.物理性质特性1.铯略带有金色光泽,钫根据测定可能为红色,且具有放射性。
2.液态钠可以做核反应堆的传热介质。
3.锂密度比没有小,能浮在煤油中。
4.钾的密度具有反常现象。
钾的密度反常变化的原因:根据公式:ρ=A r/V原子,可知相对原子质量的增大使密度增加,而电子层的增加又使原子体积增大使得密度减小。
即单质的密度由相对原子质量和原子体积两个因素决定。
对钾来说,核对最外层引力较小,体积增大的效应大于相对原子质量增加产生的影响,结果钾的密度反而比钠小。
II.5焰色反应1.碱金属离子及其挥发性化合物在无色火焰中燃烧时会显现出独特的颜色,这可以用来鉴定碱金属离子的存在,锂、铷、铯也是这样被化学家发现的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铷盐概述一、铷的概述铷,元素符号Rb,银白色稀有碱金属,在元素周期表中属IA族,原子序数37,原子量85.4678,立方晶体,常见化合价为+1。
金属铷的熔点很低,质软,有延展性。
铷在地壳中很分散,至今还没有发现单纯的铷矿物。
铷在地壳中的含量为5.1X10-5--3.1×10-4,按元素丰度排列居16位。
铷资源主要赋存于花岗伟晶岩,卤水和钾盐矿床中。
现在人们主要从花岗伟晶岩矿床开发回收铷,主要工业矿物是锂云母,锂云母中铷含量可达3.75%,是提取铷的主要矿源。
国外花岗伟晶岩氧化铷资源储量约为17万t,其中津巴布韦10万t,占58%;纳米比亚5万t,占29%;加拿大1.2万t占7%.这三个国家氧化铷含量为16.2万t,占国外铷资源的95%。
我国有丰富的铷资源,储量名列前茅,且类型齐全,分布全国。
我国铷资源主要赋存于锂云母和盐湖卤水中,锂云母中铷含量占全国铷资源储量的55%,以江西宜春储量最为丰富,是目前我国铷矿产品的主要来源。
湖南、四川的锂云母矿中也含有铷。
青海、西藏的盐湖卤水中含有极为丰富的铷,是有待于开发的我国未来的铷资源。
目前,世界上铷盐工业生产的主要原料是锂云母。
用锂云母生产铷盐时,一般采用氯锡酸盐法、铁氯化物、BAMBP萃取法。
对于铷含量低的液体矿物,如海水、盐湖卤水、工业母液,一般采用吸附法和萃取法。
我国生产铷的主要工业原料是锂云母。
新余市东鹏化工有限责任是我国目前最大的铷盐生产基地,他们利用锂云母提锂后的混合碱母液采用T—BAMBP萃取法从中分离,提取铷,他们还利用这种萃取法提取铷化合物,以不同无机酸和或有机酸进行反萃,制得多种铷化合物。
T—BAMBP萃取工艺目前在国外都处于领先水平。
此外,对于一些有价值的潜在铷资源,我国也进行了有效的开发研究。
江西的开发研究成果,显示了我国巨大的铷开发、生产潜力。
二、铷化合物的提取方法铷广泛地分散于钾的矿物和盐卤中。
锂云母的组成为KRbLi(OH,F)Al2Si3O1,含3.5%以上Rb2O,是主要的铷资源。
铯榴石矿物(Cs2O·Al2O3·4SiO2),含有01.5%以上Rb2O。
一些铷是从矿物中提取铯时制取的。
从矿物资源中回收铷的传统方法(包括从矿石中提取铝碱矾的混合物)是,矿石用硫酸浸出到生成碱矾,过滤矾溶液,用水洗涤渣。
矿石在浸出之前锻烧可提高回收率。
其它碱矾可分步结晶分离。
用提纯后的铷矾中和至铝沉淀可转变为氢氧化铷,随后用氢氧化钡沉淀硫酸盐。
氯锡酸盐需要部分分离钾,剩余的碳酸盐转化为氯化物,溶液用足量的氯化锡沉淀出氯锡酸铯,其可溶性比相应的铷盐要小。
沉铯后的溶液用过量的氯化锡沉淀出氯锡酸铷。
提纯后的氯锡酸铷可用高温分解、电解或化学方法分离铷和氯化锡。
铷化合物亦可从其它碱金属化合物用溶剂萃取或离子交换方法分离。
纯金属铷可用活性金属还原铯榴石锂云母矿,再用真空蒸馏而获得。
其它方法是热化学还原纯的铷化合物,根据以下反应:2RbCl+Ca→CaCl2+2Rb2RbOH+Mg→Mg(OH)2+2RbRb2CO3+3Mg→3MgO+C+2Rb铷、铯工业生产的基本原料主要以铯榴石锂云母等固态矿为主,其提取过程较复杂,成本高,能耗大。
由于卤水中铷铯以离子形式存在因而其提取铷、铯工艺相对简单,成本低,耗能少,是目前铷铯工业技术发展趋势。
目前分离提取方法主要有沉淀法、离子交换法和溶剂萃取法等。
1、分步沉淀法提铷、铯用分步结晶法从各种含铷铯矿物中提取铷、铯化合物的方法。
这是一种富集、提取化合物的经典化学方法。
该法根据铷、铯化合物与杂质在某溶剂中的溶解度差异,通过重复加热溶解、冷却结晶沉淀的过程,达到富集、净化铷、铯化合物的目的。
提铷、铯包括光卤石分步沉淀,铝钒分步沉淀,锡氯酸盐分步沉淀,锑氯酸盐分步沉淀,二氯碘化物分步沉淀,氯溴碘化物分步沉淀,四草酸盐分步沉淀,过氯酸盐分步沉淀等。
(1)光卤石分步沉淀从光卤石中提取铷和铯早已不用这种方法。
(2)铝钒分步沉淀向含铷、铯硫酸盐水溶液中加入一定量的硫酸铝,加热后经冷却即生成相应的铝铷矾[RbAl(S04)2•12H20]或铝铯矾[CsAl(S04)2•12H20]沉淀。
利用铝铷矾、铝铯矾与其他金属的铝矾在水中溶解度差别,通过分步沉淀,使铷、铯得到富集、提纯。
铝钾矾[KAl(S0)4•12H20]、铝铷矾、铝铯矾在水中的溶解度如表1。
分步沉淀过程是向含铷或铯的硫酸盐溶液中,加入所需量的硫酸铝并加热,经冷却后即沉淀出铝铷矾或铝铯矾。
分离除去母液,所得矾重复用水加热溶解、冷却结晶沉淀,可获得纯铝铷矾或铝铯矾。
铝铷矾或铝铯矾经处理则得铷、铯盐。
铝铷矾、铝铯矾一次沉淀的金属回收率在94%以上。
铝铯矾分步沉淀过程的净化效果和回收率优于铝铷矾。
(3)锡氯酸盐分步沉淀铷或铯的氯化物在稀盐酸溶液中均可同SnCl4作用生成溶解度较小的锡氯酸铷(Rb2SnCl6)或锡氯酸铯(Cs2SnCl6)复盐沉淀。
钾、铷、铯的锡氯酸盐在293K温度水和盐酸溶液中的溶解度如表2。
向锂云母提锂后的混合磷酸碱母液中通入C02,将其中70%的钾以碳酸氢钾沉淀除去,然后加入盐酸将铷、铯等转化为氯化物并调整溶液酸度。
按含铯量计算,加入稍过量的SnCl4,使铯以Cs2SnCl6沉淀析出,铷仍留在溶液中。
经分离后,再向溶液中加入按含铷量计算过量的SnCl4,使溶液中的铷以Rb2SnCl6沉淀析出。
由于在Cs2SnCl6和Rb2SnCl6沉淀过程中都有一定过量的SnCl4,导致Cs2SnCl中有少量Rb2SnCl6,而Rb2SnCl6中有一定数量的K2SnCl6。
为得到纯净物,可分别将两种沉淀物于水或稀盐酸中进行重结晶。
最后分别将两种锡复盐溶于水并加热,加入氢氧化铵,使复盐水解成氯化铷或氯化铯和偏锡酸及氯化铵。
过滤分离后,溶液经蒸发浓缩得到氯化铷或氯化铯同氯化铵的混合盐。
再经加热挥发除去氯化铵即得到纯氯化铷或氯化铯。
这是从锂云母提锂后的混合碱母液提铷、铯常用的有效方法。
(4)锑氯酸盐分步沉淀锑氯酸盐(锑铯复盐,3CsCl•2SbCl3)分步沉淀是盐酸法处理铯榴石制取铯盐的重要方法之一。
向含氯化铯的水溶液中加入SnCl4,便会生成氯化铯一氯化锑复盐沉淀,复盐分子式为3CsCl•2SbCl3或Cs3Sb2Cl9。
借此可将铯从大量的杂质中分离出来。
锑铯复盐在盐酸溶液中的溶解度如表3。
不同SnCl4浓度对锑铯复盐溶解度的影响如表4。
中国和美国都曾用盐酸法处理过铯榴石(见铯榴石盐酸法分解)。
矿石经浓盐酸分解后用水浸出,经过滤得到约含Cs(:115%的溶液。
向溶液中加入一定量的SnCl4,使氯化铯以3CsCl•2SbCl3,复盐沉淀,借此从溶液中分离出来。
用沸水分解沉淀后过滤,往滤液加入氢氧化铵和碳酸铵使铁、铝、钙、锑等杂质沉淀而被除去。
经过滤分离出沉淀后,用盐酸酸化滤液,再次用SnCl4将氯化铯以3CsCl•2SbCl3复盐沉淀出来。
沉淀出来的已是较纯的复盐。
这种复盐再经热水分解、过滤、滤液蒸干,加盐酸除去少量氨,通H2S除锑,再浓缩、蒸干、脱水得纯氯化铯。
(5)二氯碘化物分步沉淀铷、铯氯化物溶液同一氯化碘(ICl)能生成在盐酸溶液中溶解度较小的二氯碘化铷(RblCl2)或二氯碘化铯(CsICl2)。
铷、铯的二氯碘化物在盐酸中的溶解度如表5。
向富含氯化铷或氯化铯的盐酸溶液中加入ICl并加热,即生成RbICl2或CslCl2沉淀。
原氯化铷或氯化铯溶液中的锂,钠也会生成相应的二氯碘化物,但由于这些二氯碘化物不稳定或溶解度较大而残留于溶液中,其他杂质大多不生成二氯碘化物亦残留于溶液中。
沉淀出的RblCl2或CsICl2反复用盐酸水溶液溶解和重结晶,过程中杂质进入母液,从而得到纯的RblCl2或CsICl2。
RblCl2或CsICl2最后经加热分解,得到纯度较高的氯化铷或氯化铯。
分解出的ICl经收集返回使用。
该法用于从氯化铷或氯化铯中分离钾的效果较好。
CsICl2的回收率比RblCl2高。
(6)氯澳碘化物分步沉淀氯溴碘化物同属多卤化物,氯化铷或氯化铯同溴化碘(IBI•)能生成溶解度较小的氯溴碘化铷(RbIBrCl)或氯溴碘化铯(CsIBrCl)。
其他碱金属同溴化碘也能生成氯溴碘化物,但由于这些化合物不稳定或溶解度较大仍残留于溶液中。
除碱金属以外的其他元素大多不生成氯溴碘化榭,可同铷、铯分离。
分离工艺是向氯化铷或氯化铯的水溶液中加入一定量事先合成好的溴化碘,立即生成桔红色RbIBrCl或CsIBrCl沉淀。
经冷却、过滤分离,沉淀反复用水加热溶解、冷却析出沉淀,以得到很纯的RbIBrCl或CsIBrCl。
最后将纯的RbIBrCl或CsIBrCl沉淀加热分解为氯化铷或氯化铯和溴化碘。
溴化碘经吸收后返回使用。
经足够次数的重结晶即可获得高纯氯化铯或高纯氯化铷。
此法从氯化铯中分离铷的效果好,可产出含铯99.99%、铷<7×10-3%的氯化铯。
(7)四草酸盐分步沉淀碱金属氯化物同过量的草酸在水溶液中加热可生成四草酸盐。
四草酸盐又称酸式草酸盐,通式为MeH3(C204)2•nH2O(Me为碱金属)。
钾、铷、铯的四草酸盐在水中的溶解度随温度变化较大。
据此,常通过铷、铯的四草酸盐分步沉淀来分离提纯铷、铯,最后获得铷、铯碳酸盐产品。
钾、铷、铯的四草酸盐在每100g 的294K温度的水中的溶解度分别为2.46g、2.03g和4.34g。
向含氯化铷或氯化铯的水溶液中加入过量草酸,煮沸一定时间后冷却即析出RbH3(C204)2•2H20或CsH2(C204)2•2H20针状结晶体。
经固液分离后,将沉淀反复用水加热溶解、冷却结晶,便得到纯的四草酸铷或四草酸铯。
纯的四草酸铷或四草酸铯经加热分解即得纯碳酸铷或碳酸铯。
四草酸盐分步沉淀易于将铷、铯氯化物转变成碳酸盐,能得到较高的金属回收率,可从铷盐中消除微量铯和钾以获得纯铷盐。
四草酸铷经10次重结晶处理后,金属回收率仍可达到71.7%,铷盐中碱金属含量可降至Li<0.001%、Na0.01%、K0.5%、Cs0.1%~0.5%。
过氯酸盐分步沉淀氯化铷或氯化铯水溶液可与过氯酸生成过氯酸铷(RbCl04)或过氯酸铯(CsCl04)沉淀。
向氯化铷或氯化铯的水溶液中加入稍过理论量的过氯酸(HCl04),经加热煮沸、冷却即生成RbCl04或CsCl04沉淀。
其他杂质的过氯酸盐因溶解度均较大仍残留于溶液中而与铷或铯分离。
沉淀经重复加水、加热溶解,冷却析出沉淀,即得到很纯的过氯酸铷或过氯酸铯。
纯的过氯酸铷或过氯酸铯再经加热分解,便得到高纯氯化铷或高纯氯化铯。
过氯酸铷或过氯酸铯沉淀过程的一次直收率高于95%。
加热分解过程中应严格控制铷、铯过氯酸盐的加热温度,以防爆炸。
铷的用途和铯大致相同,但铷光电池和光阴极的灵敏度以及使用范围稍逊于铯。
