科学九上12探索酸的性质
九年级科学上册1.2探索酸的性质

化学方程式:
2HCI + CaCO3 = CaCI2 + H2O + CO2↑
2.酸一定(yīdìng)含氢元素与氧元素,对吗?
HCl=H++Cl-
3.二氧化碳溶于水后也会产生氢离子,
二氧化碳是酸吗?
第九页,共二十九页。
用什么方法测定物质的酸碱性? pH试纸(shìzhǐ)
pH<7
pH 酸性 , 值越小,酸性 越强; (suān xìnɡ)
(suān xìnɡ)
pH>7 碱性, pH值越大,碱性越强;
第二十页,共二十九页。
b、在盛有少量(shǎoliàng)稀盐酸的试管里滴入
几滴硝酸银溶液,观察现象,再滴稀硝酸, 又观察其现象。
硝酸银
现象 有白色沉淀生成,再加入稀
: (xiànxiàng)
硝酸后,白色沉淀不消失。
化学 方程式: (huàxué)
稀盐酸
HCl+AgNO3= AgCl↓+HNO3
白色沉淀
第一页,共二十九页。
1、电离的定义:电解质溶解(róngjiě)于水或受热熔化 时,产生自由移动的离子的过程叫做电离。 说明 : (shuōmíng) ①在电解质溶液里,所有的阳离子带的正电 荷总数(zǒngshù)和所有阴离子带的负电荷总数(zǒngshù) 相等,整个溶液不显电性。
②阴、阳离子所带的电荷数一般可以根据它们的 化合物的化合价来判断。
九年级科学上册 1.2 探索酸的性质(第三课时)课件

学方程式为:
消失
AgNO3+HCl=AgCl +HNO3
实验室常用这种方法来检验盐酸或能电离 出Cl—的物质存在。
Cl—的检验方法:
滴加硝酸银溶液出现白色沉淀,再滴入稀 硝酸沉淀不溶解。
第七页,共二十四页。
三种(sān zhǒnɡ)离子(Cl- SO42- CO3 2-)的检验:
SO42—的检验方法:滴加硝化钡溶液(róngyè)出现白色 沉淀,再滴入稀硝酸沉淀不溶解。
(huàxuéxìngzhì)
AgNO3 + HCl = AgCl↓ + HNO3
产生白色沉淀
第十九页,共二十四页。
物理性质(wùlǐ 浓xìn硫gzhì酸):有黏性,吸水性(可作干燥剂)。
化学性质 : (huàxué xìngzhì)
a、腐蚀性
、脱水 性 b
(tuō shuǐ)
c、跟Ba2+反应 (检验SO42-或Ba2+的存在) H2SO4 + BaCl2 = BaSO4↓+ 2HCl
Cl—的检验方法:滴加硝酸银溶液出现白色(báisè)沉 淀,再滴入稀硝酸沉淀不溶解。
CO32—的检验方法:滴加稀盐酸溶液产生使澄清 石灰水变浑浊的气体
思考:检验SO42-或Cl-时,为什么要加稀HNO3?
第八页,共二十四页。
演示 氯化钡 (yǎnshì)
再滴几滴稀 硝酸(xiāo suān)
碳酸钠
白色(báisè)沉淀 白色沉淀溶解
检验SO42-时,要加几滴稀硝酸,目的是除去CO32—
等杂质离子的干扰。因为CO32—与BaCl2溶液接触时,
也有白色沉淀BaCO3生成,但BaCO3沉淀都溶于稀硝
科学九上1.2探索酸的性质.ppt

红棕色
黄色
CuO+2HCl=CuCl2+H2O
根据以上化学方程式归纳出盐酸的另一性质
结论4、盐酸能与金属氧化物反应生成盐和水
实验中铁锈可与盐酸反应,该实验有什么实际用途?
可用于除锈,同时除锈除了用到盐酸 之外,还可用硫酸。
Fe2O3 + 3H2SO4 = 2Fe2(SO4)3 + 3H2O
红棕色
黄色
中性
无 色
描 蓝色 述 紫色 现 红色 象
蓝
紫
红
色
色
色
碱使紫色石蕊试液变蓝 氢氧化钠和盐酸正好完全反应 盐酸过量,盐酸使紫色石蕊试液 变红
思考:反应中的紫色石蕊试液起到什么作用? 请你设计一个实验来证明它的作用?
显示物质的变化
胃酸(盐酸)过多的病人常服用 一种叫“胃舒平”的药片来治疗, 药片的主要成份是氢氧化铝,为什 么能用它来治疗胃酸过多呢?
收集实验的证据,描述实验现象: 蛋壳表面产生气泡,燃着的木条伸入后会熄灭 书写化学方程式:
CaCO3 + 2HCl=CaCl2 + H2O + CO2↑
模拟以上的方程式,写出Na2CO3与盐酸的反应式
请你根据下面两条方程式,归纳出 盐酸的另一个性质
Na2CO3 + 2HCl=2NaCl + H2O + CO2↑ CaCO3 + 2HCl=CaCl2 + H2O + CO2↑
1.什么是酸?
酸= H+ + 酸根阴离子
2.可用什么方法检验物质的酸碱性?
用PH试纸 使用酸碱指示剂
用酸碱指示剂只能指示溶液的酸碱性。 而pH试纸不仅能显示溶液的酸碱性,还能 显示溶液的酸碱性的强弱,
科学初三上浙教版1.2探索酸的性质教案
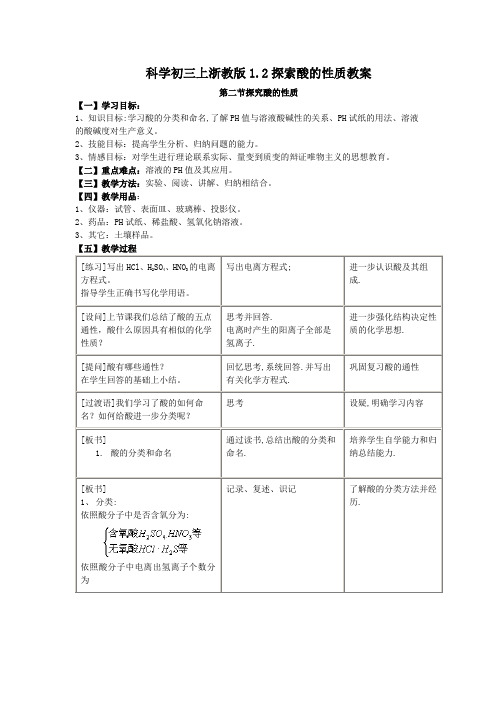
科学初三上浙教版1.2探索酸的性质教案第二节探究酸的性质【一】学习目标:1、知识目标:学习酸的分类和命名,了解PH值与溶液酸碱性的关系、PH试纸的用法、溶液的酸碱度对生产意义。
2、技能目标:提高学生分析、归纳问题的能力。
3、情感目标:对学生进行理论联系实际、量变到质变的辩证唯物主义的思想教育。
【二】重点难点:溶液的PH值及其应用。
【三】教学方法:实验、阅读、讲解、归纳相结合。
【四】教学用品:1、仪器:试管、表面皿、玻璃棒、投影仪。
2、药品:PH试纸、稀盐酸、氢氧化钠溶液。
3、其它:土壤样品。
【五】教学过程1、现有HCl、HF、H2CO3、H3PO4四种酸,分别把它们归类并命名。
无氧酸;含氧酸;一元酸。
附2:课堂练习二1、某溶液PH=3,那么该溶液〔A〕呈酸性〔B〕呈碱性〔C〕呈中性〔D〕无法判断酸碱性2、人体内一些液体的近似PH值如下:血浆7.35~7.45,胆汁7.1~7.3,胰液7.5~8.0,胃液0.9~1.5,其中一种液体呈酸性,该液体是(A)血浆(B)胆汁(C)胰液(D)胃液3、苹果汗的近似PH值为2.9~3.3,在苹果汁中滴入紫色石蕊试液,显示的颜色是(A)无色(B)红色(C)蓝色(D)紫色4、以下各PH值表示溶液酸性最强的是(A)PH=14(B)PH=7(C)PH=1(D)PH=05、有一瓶溶液PH值是9.5,取少量注入试管中,再滴入几滴酚酞试液,溶液呈色,假如要使试管里的溶液PH值降至5,能够采取的方法.附3:随堂检测1、连线题:把相关的内容之间用短线连接起来;盐酸HNO3二元无氧酸硫酸H2S一元含氧酸氢硫酸H2SO4二元含氧酸硝酸HCl氢氯酸2、填空:酸在电离时生成的离子是离子,盐酸的PH7,氢氧化钠溶液的PH7,把盐酸逐滴滴入氢氧化钠溶液中,反应后溶液的PH值逐渐(升高、降低或不变)。
恰好中和时PH7。
科学:1.2《探索酸的性质》课件3(浙教版九年级上)

九年级科学上册 1.2《探索酸的性质》教师优选教案 浙教版

9.1.2.1探索酸的性质学案(第一课时)班级:姓名:学号:学习目标:知识与技能:从电离角度认识酸的概念,学会使用酸碱指示剂测定物质的酸碱性。
过程与方法:结合日常生活实例认识酸性物质,通过亲身探究认识酸碱指示剂。
情感、态度与价值观:通过了解科学知识与生活有着密切联系,增强科学来自生活的认识。
学习重点:酸的概念,酸碱指示剂的使用。
学习难点:酸的电离方程式,指示剂的制取。
一、课前预习1.酸性溶液pH 7,碱性溶液pH 7。
酸性溶液能使色石蕊试液变色,碱性溶液能使紫色石蕊试液变色。
2.溶液的酸碱性强弱程度可以用来测定,其具体的操作方法是:用洁净的蘸取少量待测试液,滴在pH试纸上。
将试纸上显示的颜色与对照,即可确定待测试液的pH值。
当pH<7时,pH越小,酸性越;反之,当pH>7时,pH越大,碱性越强。
预习疑难摘要:二、课堂学习过程讨论:列举日常生活中我们接触过的酸性物质(名称及对应的化学式)。
调味用的,胃液中的,饮料中的,水果中的,化学工业中的。
小结:溶液呈现酸性的物质中一般都含有一类特殊物质——酸。
(一)夯实基础·学习新知——什么是酸想一想:写出盐酸、硫酸和硝酸的化学式、、要认识酸以及判定酸,我们可以从电离角度着手。
电离:一些物质或而离解成离子的过程。
电离的外部条件:或思考:电离方程式是电离过程的表达形式。
书写盐酸、硫酸和硝酸的电离方程式,并总结这些酸的共同特点。
共同点:练一练:1、下列电离方程式正确的是()A.H2SO4 =H+ + SO42-B.Al2(SO4)3 = 2Al3++ 3SO4 2 -C.Ba(OH)2= Ba 2+ +(OH)-D.NaCl=Na1+ +Cl1-2、写出下列物质的电离方式Ca(OH)2 = Na2CO3 = H2CO3 = CuSO4 = (二)寻找规律·探究新知讨论:NaHSO4是一种酸吗?请说明理由总结:酸的概念:关键字:、、同时,我们把某种酸电离产生的阴离子叫做酸的酸根离子。
探索酸的性质--浙教版

九年级科学上册 1.2 探讨酸的性质(第3课时)教案(1)

1.2 探讨酸的性质(3)课题课型新授课教学目标1、认知领域:了解盐酸、浓盐酸的个性以及用途。
了解硫酸、浓硫酸的个性以及用途。
2、技能领域:会使用试管和滴管进行物质(溶液)性质试验。
3、情感领域:通过实验探究活动,培养学生实事求是的科学态度。
教学重点三种常见酸的个性。
教学难点三种常见酸的个性。
教学策略及教具试管、锌、氧化铁粉末、氧化铜、硫酸铜和氢氧化钠(制氢氧化铜)氯化钡溶液,浓盐酸、浓硫酸、稀盐酸、稀硫酸,硝酸银、试管、玻璃棒、烧杯,纸,硝酸。
板书设计四、酸的个性1、盐酸的个性:浓盐酸具有挥发性;*Cl-的检验2、硫酸的个性:稀释浓硫酸时,应把浓硫酸慢慢注入水中;浓硫酸具有强烈的脱水性,能使木村、纸张脱水碳化。
教学过程(突出重点、难点、分层次处理、呈现具体课内练习)设计意图酸的共性通过盐酸、硫酸的化学性质归纳出酸有哪些共性(通性):1、酸能使紫色的石蕊变红,无色酚酞不变色2、酸+金属=盐+氢气3、酸+金属氧化物=盐+水了解本章的学习要点和学习思路培养学生关注自然,发散思维,快速进入课堂学习。
4、酸+碱=盐+水5、酸+盐=新盐+新酸【思考】:为什么不同的酸具有共同的化学性质呢?酸的用途观察图1-16酸的用途,试概述其中一俩种用途的实现途径。
体会性质决定用途。
过渡:盐酸和稀硫酸在化学性质上有很大的共性,是因为它们都能电离出氢离子,但不同的酸由于酸根离子不同,也显示出各自的个性。
一、不同酸的个性1.不同酸的个性:某种酸具有与别的酸所不同的性质,叫做这种酸的个性。
2.不同的酸由于组成不同,会显示不同的个性,这使得不同的酸具有不同的用途。
二、盐酸的个性1.盐酸的颜色和状态:无色液体。
2.浓盐酸(浓硝酸)具有挥发性,会挥发出具有刺激性气味的氯化氢气体。
氯化氢气体极易溶于水,它会溶于空气中的水蒸气而形成白雾(盐酸小液滴)。
演示:打开浓盐酸的瓶盖,观察瓶口发生的现象,并用手扇动,闻一下气味――瓶口出现白雾,为盐酸小液滴;并有刺激性气味。
