常见漂白剂的分类及漂白原理-试题君之每日一题君2017-2018学年高一化学人教版(上学期期末复习) 1
漂白剂的种类及使用范围

漂白剂的种类及使用范围
漂白剂是一种常用的清洁剂和消毒剂,其种类和使用范围非常广泛。
常见的漂白剂主要有以下几种:
1. 次氯酸钠:也称为漂白粉,是一种氯氧化合物,具有强烈的氧化还原性。
可以用于清洁和漂白衣物、毛巾、床单、厨房用具等家庭用品,还可以用于消毒病房、厕所、厨房等公共场所。
2. 漂白水:也称为氯水,是一种氯化合物,可以杀死细菌和病毒。
可以用于消毒水龙头、马桶、地面、墙壁等,但需要注意稀释比例,以避免对材料造成损害。
3. 双氧水:具有较强的氧化还原性,可以用于漂白牙齿、清洁创口、消毒口腔等。
4. 漂白氧:是一种过氧化合物,可以用于漂白和清洁衣物、毛巾、床单、厨房用具等家庭用品。
漂白剂的使用范围包括但不限于家庭、医院、餐厅、学校等场所。
但需要注意的是,在使用漂白剂时需要注意安全,避免接触皮肤和眼睛,避免与其他化学品混合使用,以免产生有害气体。
同时,在使用漂白剂时需要根据具体材料和物品的特性,选择合适的漂白剂和适当的浓度和使用方法。
- 1 -。
高一化学漂白剂知识点总结

高一化学漂白剂知识点总结在高一化学学习中,漂白剂是一个重要的知识点。
本文将对漂白剂的定义、种类、化学反应和应用进行总结。
漂白剂是一种用于去除物体上的颜色的化学物质,在生活和工业中被广泛应用。
1. 漂白剂的定义漂白剂是一种能够氧化物质并去除颜色的物质。
它可以将有色物质中的色素分子还原为无色的物质,从而使物体变得明亮、洁白。
2. 漂白剂的种类常见的漂白剂有氯漂白剂、氧漂白剂和二氧化氯漂白剂。
氯漂白剂主要是指含有氯离子的化合物,如氯气和次氯酸钠;氧漂白剂则是指含有氧的化合物,如过氧化氢和过硫酸钠;二氧化氯漂白剂则是指含有二氧化氯的化合物,如二氧化氯气体。
3. 漂白剂的化学反应漂白剂在与有色物质接触时发生氧化反应,从而去除颜色。
以氧漂白剂过氧化氢为例,其化学反应可以简化为:2 H2O2 + 2 e- → 2 H2O + O2↑这个反应过程中,过氧化氢将电子释放给有色物质的色素分子,使其发生还原反应,从而去除颜色。
4. 漂白剂的应用漂白剂在生活和工业中有多种应用。
其中最常见的就是用于洗衣服和消毒。
在洗衣服中,漂白剂可以去除衣物上的污渍和颜色,使其变得干净明亮。
在消毒方面,漂白剂可以杀灭细菌和病毒,保持环境的清洁和卫生。
此外,漂白剂还可以用于脱色和漂白实验。
在化学实验中,漂白剂可以用来去除颜色,以便更好地观察和分析实验结果。
总之,漂白剂是一种能够去除物体颜色的化学物质。
我们学习了漂白剂的定义、种类、化学反应和应用。
了解漂白剂的知识有助于我们更好地理解化学反应的原理,并能在实际生活中正确使用漂白剂。
希望这篇总结对你的学习有所帮助!。
漂白剂的工作原理和分类

漂白剂的工作原理和分类参考资料:中国环保网/trade/supply/index--1000100310021008--.htm吸收液用氯化汞与氯化钠作用生成四氯汞钠,当样品中的SO2与吸收液作用之后,生成一种稳定的络合物(可防止SO2的损失),这种络合物与甲醛及盐酸副玫瑰苯胺作用生成紫红色络合物,颜色的深浅与SO2浓度成正比,可在580nm下比色测定。
常用的氧化漂白剂有两种:一种是含氯漂白剂,另一种是含氧漂白剂。
一、含氯漂白剂,简称氯漂,是能释放活性氯的氧化剂,通常有氯漂水和氯漂粉。
作为漂白剂,它的漂白去污能力比氧漂强,使用氯漂可使布草白度保持及表面净化程度较好,但织物纤维在漂白过程中受到的损伤也比氧漂要大。
为此,在漂白过程中对pH 值、温度、时间和浓度要进行严格的控制,以减少织物受到的损伤。
其中温度对氯漂漂白有显著影响,提高温度,能加快漂白反应速度,缩短漂白时间。
在一定温度下,温度增加7℃左右,漂白速度可增加一倍,温度增加10℃左右漂白速度增加两倍。
专业洗涤工作量大,并希望迅速完成,因此在使用氯漂漂白织物时,通常通过适当升高温度,以提高漂白和洗涤速度。
但洗涤过程中并不是温度越高越好,要注意的是温度过高会使纤维聚合度降低。
一般建议使用氯漂的温度在60-70℃左右,时间为10-15分钟。
二、含氧漂白剂,简称氧漂,通常有氧漂剂和彩漂粉。
它对织物的漂白较温和,一般不会损伤织物,可令白色或有色织物漂白后色泽更亮丽。
常用的含氧漂白剂主要是双氧水和彩漂粉,有较好的漂白作用和杀菌作用。
氧漂是通过在水溶液中经过过羟离子游离出活性氧而产生漂白作用,在常温下,它的漂白速度比较缓慢,为了提高洗涤速率,一般在高温条件下进行漂白,既提高了漂白速度,也增加了织物的的去污力和白度。
因此通常使用双氧水洗涤漂白温度控制在80~90℃,漂白时间在10~15min。
在洗衣業上,一般使用的漂白剂,大致可分为二大类:一为氧化漂白剂,一为还原漂白剂。
各类漂白剂的漂白原理

各类漂白剂的漂白原理
各类漂白剂的漂白原理可以归纳为以下几种:
1. 氧漂剂:例如过氧化氢、漂白粉等。
氧漂剂可以通过释放氧气来漂白物质。
这种漂白剂会和污渍中的有机物质发生化学反应,将其氧化分解为无色或带有光泽的物质。
2. 氧化漂剂:例如酸性漂白液等。
氧化漂剂通过向物质中引入氧气或其他氧化剂,使其发生氧化反应而漂白。
氧化剂可以将有色物质中的电子转移给自身,从而使有色物质变为无色或色泽淡化。
3. 还原漂剂:例如亚硫酸盐、亚硝酸盐等。
还原漂剂通过向物质中引入电子,还原有色物质的色团,使其失去吸收光的能力而实现漂白。
这种漂白剂的漂白原理是将有色物质中的某些化学键还原断裂,从而破坏其吸收光的特性。
4. 酶类漂白剂:例如含有过氧化酶的洗衣粉。
酶类漂白剂通过特定的酶与污渍中的有机物质发生化学反应,使其分解为无色或较浅色的物质。
这种漂白剂的漂白原理是利用酶的催化作用,加速有机物质的降解反应。
除了以上的漂白原理,不同的漂白剂还可能涉及其他的成分和反应机制。
在使用漂白剂时,应根据具体的材料和污渍特性选择合适的漂白剂,遵循正确的使
用方法和注意事项,以确保安全和有效的漂白效果。
漂白物质及原理

漂白物质及原理
漂白物质是一类广泛应用于漂白和去除污渍的化学物质,常见的包括氯漂白剂、氧漂白剂和还原漂白剂等。
1. 氯漂白剂:
氯漂白剂广泛应用于家庭和工业清洁中。
其原理是通过释放氯离子来氧化并分解有色物质,进而去除污渍。
氯漂白剂一般包含次氯酸钠(NaClO)或过氧化氢(H2O2)等化学物质。
氯
离子与有色物质中的双键或结构中的可还原基团发生反应,使其发生裂解或氧化,从而达到漂白的效果。
2. 氧漂白剂:
氧漂白剂常用于漂白纸张、纺织品和食品加工过程中。
最常见的氧漂白剂是过氧化氢(H2O2),其分解产生氧气和水,通
过氧气的氧化作用来去除污渍。
氧漂白剂对于不同类型的污渍具有不同的漂白效果,能够有效降解染料分子的结构,实现漂白的效果。
3. 还原漂白剂:
还原漂白剂主要包括亚硫酸盐和亚硫酸氢钠等化学物质。
还原漂白剂通过具有强还原性的亚硫酸根离子(S2O3^2-)来还原
着色物质,使其失去着色性。
还原漂白剂常用于去除有机污渍,如茶渍、咖啡渍和汗渍等。
其作用原理是还原漂白剂中的亚硫酸根离子与污渍中的色素分子进行化学反应,将其还原为无色物质。
各种漂白剂的漂白原理

各种漂白剂的漂白原理漂白剂是一种可以去除物体表面颜色的化学物质。
不同种类的漂白剂具有各自的漂白原理。
下面我将介绍几种常见的漂白剂的漂白原理。
1. 氯漂白剂:氯漂白剂是一种常用的漂白剂,其主要成分是含氯化合物,如次氯酸钠。
氯漂白剂的漂白原理是通过氧化反应去除颜色。
在碱性条件下,次氯酸离解为次氯酸根离子和氧气。
次氯酸根离子具有强氧化性,能够与有机色素发生氧化反应,将其还原为无色或淡色物质,从而达到漂白的效果。
2. 过氧化氢漂白剂:过氧化氢漂白剂的主要成分是过氧化氢。
过氧化氢漂白剂的漂白原理是通过氧化反应去除颜色。
过氧化氢能够释放出活性氧,从而导致有机物发生氧化反应,使其颜色褪去。
过氧化氢漂白剂在酸性条件下更容易分解,释放出氧气,因此酸性的过氧化氢漂白剂更容易起到漂白的效果。
3. 硫代硫酸盐漂白剂:硫代硫酸盐漂白剂的主要成分是亚硫酸盐或硫代硫酸盐。
硫酸亚硫酸盐可通过氧化反应发生氧化还原反应,将有机物的色素分子还原为无色物质。
硫代硫酸盐漂白剂的漂白原理可通过亚硫酸根离子(SO3^2-)或硫酸酸根离子(S2O3^2-)对有机物色素产生还原作用,去除颜色。
4. 臭氧漂白剂:臭氧漂白剂的主要成分是臭氧。
臭氧漂白剂的漂白原理是通过氧化反应去除颜色。
臭氧是一种强氧化剂,能够与有机物发生氧化反应,将其颜色褪去。
臭氧漂白剂常常用于漂白纸浆和纺织品等领域。
需要注意的是,不同种类的漂白剂具有不同的适用范围和使用条件。
在使用漂白剂时,需要根据被处理物体的特性选择合适的漂白剂,并按照使用说明正确使用,以避免产生不良反应或危害人体健康。
此外,漂白剂的使用也应遵循环保原则,减少对环境的污染。
高考化学漂白知识点总结

高考化学漂白知识点总结一、漂白的定义漂白是指通过化学方法去除物质中的颜色、污渍或杂质的过程。
漂白可以分为氧化漂白和还原漂白两种方式。
氧化漂白是指通过氧化反应使染色质氧化而脱色,还原漂白则是指通过还原反应使染色质还原而脱色。
二、漂白剂的种类1. 氯漂白剂:大气中的氯气和水生成的次氯酸溶液,次氯酸钠和次氯酸钙。
2. 臭氧漂白剂:臭氧气体。
3. 过氧化氢漂白剂:过氧化氢溶液。
4. 硫代硫酸盐漂白剂:亚硫酸氢钠和硫代硫酸钠。
三、漂白原理1. 氯漂白剂原理:次氯酸可以氧化分子中的双键,氧化染料使其脱除色。
同时也可以分解有机物,氧化染色物使其脱除色。
2. 臭氧漂白剂原理:臭氧能将染料中的双键氧化,或通过和分子中某些固定位置的双键分子发生加成反应而发生分子的裂解,使其变得无色。
3. 过氧化氢漂白剂原理:过氧化氢本身在水溶液中是不稳定的,它可以分解为活性自由基,自由基氧化染料使其脱除色。
4. 硫代硫酸盐漂白剂原理:亚硫酸氢根离子和双氧-亚硫酸根离子能与染料中的双键发生加成反应,活化染料分子,或起到还原作用,使其脱色。
四、漂白剂的应用1. 漂白衣物:在日常生活中,漂白剂常用于漂白衣物,以去除衣物上的污渍或变黄的部分。
2. 消毒食品:漂白可以杀菌消毒,使食品更加安全可靠。
3. 清洁环境:漂白剂也可以用于清洁户外场所,去除一些难以清洁的环境污染。
五、高考化学漂白的考点和解题技巧1. 理解漂白的原理和机制,掌握漂白剂的种类及其化学反应过程,例如次氯酸的生成和分解反应,次氯酸和染料中双键的氧化反应等。
2. 掌握漂白剂的应用场景和具体操作步骤,如何使用次氯酸或过氧化氢来漂白衣物、清洁环境等。
3. 掌握漂白相关的化学方程式,如次氯酸钠和氯气的反应方程,过氧化氢水溶液分解的反应方程等。
4. 注意漂白剂的化学性质和用途之间的关系,考查漂白剂是否可以氧化某种物质或还原某种物质的反应类型。
总之,在高考化学中,漂白是一个重要的考试内容,学生需要理解漂白的原理和机制,掌握漂白剂的种类和化学反应过程,掌握漂白剂的应用场景和具体操作步骤,掌握漂白相关的化学方程式,注意漂白剂的化学性质和用途之间的关系等,才能更好地应对考试中的相关题目。
高中化学漂白性物质归纳!
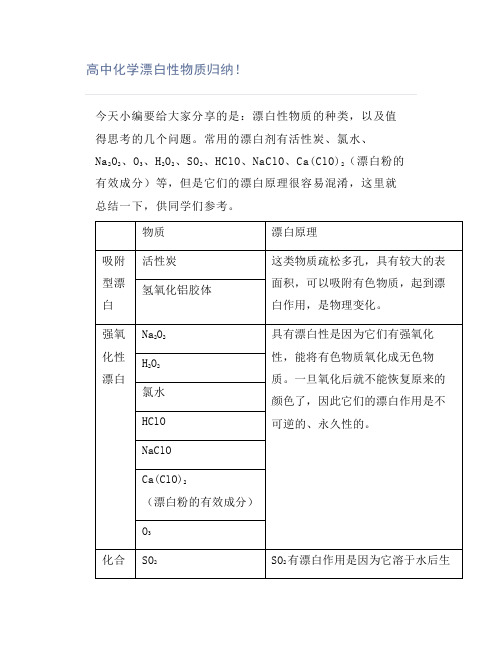
高中化学漂白性物质归纳!
今天小编要给大家分享的是:漂白性物质的种类,以及值得思考的几个问题。
常用的漂白剂有活性炭、氯水、
Na2O2、O3、H2O2、SO2、HClO、NaClO、Ca(ClO)2(漂白粉的有效成分)等,但是它们的漂白原理很容易混淆,这里就总结一下,供同学们参考。
1、下列褪色现象是SO2的漂白性吗?
(1)SO2使橙色溴水褪色
(2)SO2使紫色KMnO4酸性溶液褪色
(3)SO2使红色酚酞褪色
解析:以上褪色现象都不是SO2的漂白性所致。
(1)、(2)褪色的原因是SO2的还原性。
分别发生氧化还原反应
SO2+Br2+2H2O= H2SO4+2HBr
5SO2+2KMnO4+2H2O=K2SO4+2MnSO4+ 2H2SO4
(3)褪色的原因是SO2溶于H2O后生成了H2SO3,H2SO3是酸可以使红色酚酞变为无色。
2、氯水和SO2分别使紫色石蕊产生什么现象?
解析:氯水中的HClO先使紫色石蕊变红,而后因为它有强氧化性使红色褪去。
SO2溶于H2O后生成了H2SO3,H2SO3是酸可以使紫色石蕊变为红色。
而H2SO3不具有强氧化性,所以红色不会褪去。
3、SO2和Cl2混合后能否增强漂白效果?
解析:不能。
因为SO2和Cl2混合后会发生氧化还原反应SO2+ Cl2+2H2O= H2SO4+2HCl
生成物H2SO4和HCl都没有漂白作用,所以漂白效果会减弱。
当n(SO2): n(Cl2)=1:1时,完全失去漂白作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
1月23日
常见漂白剂的分类及漂白原理
高考频度:★★★☆☆ 难易程度:★★★☆☆
典例在线
大约4 000年前,埃及人已经用硫燃烧所形成的二氧化硫漂白布匹。
在古罗马著名诗人荷马的著作里讲到硫燃烧有消毒和漂白作用。
下列物质都具有漂白性:①潮湿的氯气、②二氧化硫、③活性炭、④过氧化钠,其漂白原理相同的是
A .①③
B .②③
C .②④
D .①④
【答案】D
【解析】这些具有漂白性的物质可以分为三类,第一类是因具有强氧化性而显漂白性,属于这类的有①潮湿的氯气(含氯气与水反应生成的次氯酸)和④过氧化钠;第二类是因具有吸附性吸附色素脱色而漂白,属于这类的有③活性炭;第三类是②二氧化硫,因可以与有机色质化合成不稳定的无色物质而漂白。
综上所述,D 正确。
解题必备
物质的漂白性比较 1.漂白性分类比较
漂白类型 漂白原理
常见代表物
漂白特点
加合型
与有机色质结合,形成不
稳定的无色化合物 SO 2
一定条件下,SO 2放出,又
恢复原色
氧化型
将有色物质氧化为无色物
质
氯水、HClO 、Ca(ClO)2、O 3、
H 2O 2、Na 2O 2
褪色后不能恢复原色
吸附型
吸附作用,物理变化
活性炭
通过一定的处理可以重复
使用
2.SO 2和Cl 2的漂白性拓展
SO 2
新制氯水(Cl 2通入水溶液中) 漂白原理
SO 2能与某些有色物结合成不稳
定无色物
Cl 2与H 2O 反应生成的HClO 具有强氧
化性,可以将有色物氧化成无色物
漂白效果不稳定,加热能复原稳定
漂白范围某些有机色质绝大多数有机色质
与有机色质作用实例
品红2
SO
−−−→
通褪色−−→
△红
色,紫色石蕊2
SO
−−−→
通红色
品红2l
−−−→
通C褪色−−→
△不显红色,
紫色石蕊2l
−−−→
通C先变红,随即褪色混合作用SO2+Cl2+2H2O===H2SO4+2HCl,漂白作用大大减弱
易错易混
若将等物质的量的Cl2和SO2气体相混合,在溶液中会发生反应:SO2+Cl2+2H2O===H2SO4+2HCl,从而失去漂白能力。
因此将Cl2和SO2混合使用,不仅不能提升漂白效果,反而会降低甚至失去漂白能力。
学霸推荐
1.下列物质都具有漂白性,其中漂白原理和其他几种不同的是
A.H2O2 B.SO2 C. O3 D. HClO
2.SO2既有氧化性又有还原性,还有漂白性。
下列对它变化中表现的性质标注正确的是
①SO2使溴水褪色(还原性)
②SO2使品红溶液褪色(漂白性)
③SO2通入氢硫酸(H2S)产生淡黄色浑浊(氧化性)
④SO2使润湿的蓝色石蕊试纸变红(水溶液酸性)
A.只有①②④ B.只有③④ C.只有①③ D.①②③④
3.下列物质都具有漂白作用,其中漂白原理没有利用物质化学性质的是
A.过氧化钠 B.二氧化硫 C.双氧水 D.活性炭
参考答案
1.【答案】B
2.【答案】D
【解析】① SO2使溴水褪色,体现了SO2的还原性,故①正确;②SO2使品红溶液褪色体现了SO2的漂白性,故②正确;③SO2通入氢硫酸(H2S)产生淡黄色浑浊,体现了SO2的氧化性,故③正确;④SO2使润湿
的蓝色石蕊试纸变红体现了SO2是酸性氧化物,其水溶液酸性,故④正确;答案为D。
3.【答案】D
学霸之路。
