腹腔、盆腔外科手术用可吸收防粘连产品
防粘连类III类医用耗材产品范围

防粘连类(III类)医用耗材产品范围
1.本次京津冀公立医院联合采购防粘连类(III类)医用耗材是指可以将患处和周边组织物理性隔离,具有适度的柔软性,在组织愈合过程中起到防止生物组织彼此粘连的作用,且依据《医疗器械注册管理办法》,于2017年3月30日前取得第三类医疗器械注册证的医用耗材。
2.本次京津冀公立医院联合采购防粘连类(III类)医用耗材涉及的学科为外科、妇产科、骨科、神经外科;适用的人体范围为体内,包括腹(盆)腔、椎管、肌腱、宫腔、颅内;产品主要成分为壳聚糖及其衍生物、聚乳酸及其共聚物、透明质酸、纤维素衍生物、胶原、聚四氟乙烯、聚乙二醇;产品形态为液、膜、凝胶。
3.本次京津冀公立医院联合采购防粘连类(III类)医用耗材不包括具有防粘连作用的手术器械、仪器设备、补片和上述范围以外的医用耗材。
粘克可吸收医用膜(聚乳酸防粘连膜)和同类产品的比较
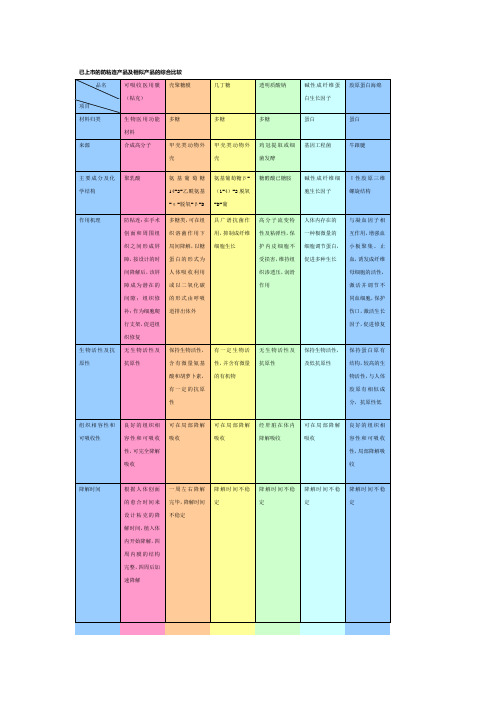
糖醛酸已糖胺
碱性成纤维细胞生长因子
Ι性胶原三维螺旋结构
作用机理
防粘连:在手术创面和周围组织之间形成屏障,按设计的时间降解后,该屏障成为潜在的间隙;组织修补:作为细胞爬行支架,促进组织修复
多糖类,可在组织溶菌作用下局间降解,以糖蛋白的形式为人体吸收利用或以二氧化碳的形式由呼吸道排出体外
一切手术止血与损伤的修复,适用外科、皮肤科、骨科、妇科及难愈性创伤的愈合
安全可靠性副作用
安全可靠无毒副作用柔韧兴好
纯化度低,强度低,无毒副作用
无毒副作用
无毒副作用
有致敏性
安全可靠无毒副作用
疗效
粘克结合国内外相关产品有缺点的基础上生产的新一代防粘连产品,防粘连作用确切、组织修补效果明显
有防粘连作用、对皮肤损伤有一定修复作用
具广谱抗菌作用,抑制成纤维细胞生长
高分子流变特性及粘弹性,保护内皮细胞不受损害,维持组织渗透压,润滑作用
人体内存在的一种极微量的细胞调节蛋白,促进多种生长
与凝血因子相互作用,增强血小板聚集、止血,诱发成纤维母细胞的活性,激活并调节不同血细胞,保护伤口,激活生长因子,促进修复
生物活性及抗原性
无生物活性及抗原性
可在局部降解吸收
良好的组织相容性和可吸收性,局部降解吸收
降解时间
根据人体创面的愈合时间来设计粘克的降解时间,植入体内开始降解,四周内膜的结构完整,四周后加速降解
一周左右降解完毕,降解时间不稳定
降解时间不稳定
降解时间不稳定
降解时间不稳定
降解时间不稳定
可吸收医用膜(粘克)
壳聚糖膜
几丁糖
透明质酸钠
碱性成纤维蛋白生长因子
防粘连产品及相似产品的综合比较
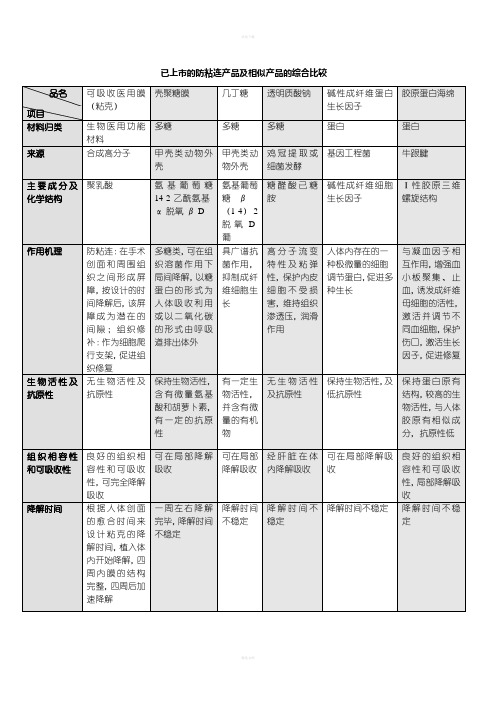
已上市的防粘连产品及相似产品的综合比较粘连平(黑龙江燎原科技有限公司)成分:聚乙二醇和盐酸小檗碱作用机制:1、.无色.略有微臭的物体.它可以与水性任意混合.也可以与某有机溶济混合,但不溶于乙醚.其性质稳定. 毒性小.对许多药物有增溶.增加稳定性和延长药效作用.并且不被肠道细菌分解.不能被机体组织吸收利用.2、聚乙二醇化蛋白质有以下特点:(1)增加溶解度和稳定性(2)改变药代动力学(与药物蛋白结合减缓代谢)(3)改变免疫原性(与有治疗价值的酶因子结合降低免疫原型)3、盐酸小檗碱:是由中药黄连提取加工出的一种物质,味苦,色黄,具有抗炎性渗出,抗感染的作用.同时它还具有除疤痕促进修复多靶点作用.术优康(贵州扬生医用器材有限公司)术尔泰(河南传承医疗器械有限公司)成分:羧甲基葡聚糖钠(属于壳聚糖的衍生物)粘液状态作用机制:具有保护组织生物活性,保护组织t-PA活性,减少渗出,缓和刺激,润滑隔离及生物屏障作用,促进上皮、组织创面完全性修复。
外用,喷涂,湿敷,冲洗。
医用几丁糖凝胶(术亿宁)成分:几丁糖--医用几丁糖凝胶是由蟹壳提纯的高分子化合物几丁质(作用机制:防止术后组织粘连的机理有:(1)医用几丁糖凝胶具有选择性促进上皮细胞、内皮细胞生长而抑制成纤维细胞生长的生物特性,从而促进组织生理性修复,抑制疤痕形成,减少组织粘连。
(2)医用几丁糖凝胶具有局部止血作用及抑制血纤维蛋白束形成,从而减少了因血肿机化而造成的组织粘连。
(3)医用几丁糖凝胶有润滑作用及生物屏障作用,能有效地阻止粘连发生。
医用几丁糖凝胶保护关节软骨的机理在于几丁糖在理化性质上与关节内氨基多糖相似,具有粘弹性,缓吸收性,而氨基多糖时软骨及软骨基质构成与代谢的基础。
益术康(医用透明质酸那凝胶)成分:医用透明质酸钠凝胶(非处方、OTC产品)---作用机制:(一)粒细胞的游走及活性,刺激巨噬细胞作用,抑制炎证反应,减少术后粘连的形成。
形成隔离空间,产生生物屏障,因此可阻碍外源性组织细胞靠近损伤处,从而抑制粘连。
外科手术用防粘连冲洗液在普外科术中应用分析

外科手术用防粘连冲洗液在普外科术中应用分析摘要:目的:探讨外科手术用防粘连冲洗液在普外科术中的临床应用效果。
方法:选取2014年11月到2015年11月于我院行腹腔普外科手术患者共118例,随机分为观察组和对照组,对照组患者在手术中没有实行防粘连的方法,对照组采取外科手术用防粘连冲洗液治疗。
结果:观察组术后的阳性体征率为13.56%,术后粘连的发生率为10.17%;对照组术后的阳性体征率为25.42%,术后粘连的发生率为23.73%。
结论:外科手术用防粘连冲洗液在普外科术中的临床应用效果显著,能够减少患者手术粘连的发生率,并且患者在术后恢复较快,在临床上有使用和推广的价值。
关键词:外科手术用防粘连冲洗液;普外科;临床效果在外科手术中术后组织粘连是临床上一种常见的现象,特别是在腹部手术中容易发生粘连,比如出现便秘、消化不良、腹部胀气、恶心等症状,这种现象对患者的生活造成了极大影响,在临床上需要加强防粘连的技术。
本次研究的主要目的是探讨外科手术用防粘连冲洗液在普外科术中的应用效果,选取2014年11月到2015年11月于我院行腹腔普外科手术患者共118例,作为本次研究的对象,其具体报告如下。
1资料与方法1.1一般资料选取2014年11月到2015年11月于我院行腹腔普外科手术患者共118例,作为本次研究的患者,利用计算机随机将患者分为两组,即观察组和对照组,每组各59例患者。
观察组59例患者中男性39例,女性20例,年龄17-70岁,平均年龄(38.2±4.5)岁,初次手术20例,再次手术39例;对照组59例患者中男性37例,女性22例,年龄18-69岁,平均年龄(37.2±4.1)岁,初次手术23例,再次手术36例;两组患者在在年龄、性别、手术次数等一般资料对比上均无显著性差异(P>0.05);具有可比性。
1.2入选标准所有患者均是自愿参加本次研究;在临床上均行腹腔普外科手术。
一些生物材料在相关产品上的应用志利

适用范围:用于手术过程中视野渗血以及小静脉出血的局部止血;封闭缺损组织;防止组织粘连。
杭州普济医药技术开发有限公司
医用生物蛋白胶
性能组成:本产品是由一定比例来自猪血的纤维蛋白原,凝血酶,ⅩⅢ因子,钙离子,以及附件组成。
适用范围:本产品主要用于组织的损伤,缺损的修复。
上海其胜生物制剂有限公司
医用胶原蛋白海绵
性能组成:人体胎盘提取型以人体胎盘为原料,经过提取其中的胶原蛋白而成。其中,总蛋白含量:胶原蛋白海绵大于总重量的25%,羟脯氨酸含量不小于总蛋白含量的9%。牛跟腱型,以牛跟腱为原料经过提取其中的胶原蛋白而成,其中,总蛋白含量:胶原蛋白海绵大于总重量45%,羟脯氨酸含量不小于总蛋白含量的9%。
适用范围:用于胸腹腔手术过程中视野渗血,小静脉出血的止血,降低创面组织液渗出。
上海利康瑞生物工程有限公司
HM医用蛋白封合胶
性能组成:组分1:纤维蛋白原和ⅩⅢ因子,组分1溶解液:PH6.5-8.0注射用水。组分2:凝血酶,组分2溶解液:PH6.5-8.0注射用水和Ca2+。配套使用器械为双联注射器。
适用范围:该产品可用于神经外科和普外科,可减少局部手术创面渗血和漏液,具有止血和封闭缺损组织作用。
瑞士Biomet Merck Gmbh
塞普棉消炎止血胶原海绵Septocoll E Hemostyptic Collagen Fleece
性能组成:本产品由胶原(从马蹄组织中提出的蛋白)和庆大霉素制成。
适用范围:临产上适用于外科手术中止血消炎。
纤维蛋白原和纤维蛋白类
广州倍绣生物技术有限公司
粘克,可吸收的防粘连膜

粘连的危害
大部分轻、中度术后腹腔粘连患者存在不同程度的慢性 腹痛、腹胀、腹泻、便秘、消化不良等症状,导致体质 明显下降,劳动能力显著减弱;
女性盆腔术后粘连患者存在慢性盆腔疼痛、下腹坠胀、 尿频尿急、性交痛等,严重影响患者的生活质量;
甲状腺术后可因粘连压迫喉返神经,导致声音嘶哑; 脊柱手术可因粘连压迫脊神经根,致术后根性疼痛; 肌腱粘连造成肢体屈曲功能不全,并牵扯刺激神经; 椎板切除术后的硬膜外粘连,导致手术失败;
羧
酸
泄系统排出体外。
循
CO2+H2O
环
粘克®的安全性
材料
粘克®的使用材料乳酸为人体固有的物质,与人体紧张性活动时 产生的乳酸相同,能被人体完全代谢,无蓄积。
乳酸在医药领域已得到长期、广泛的应用。 聚乳酸材料经FDA认可,用于医学临床、生物工程和药物载体等
多个领域。 以聚乳酸为材料制成的医用产品有芬兰Bio-fix公司、日本Grand
粘克® 可吸收医用膜
北京瑞捷诺德医药信息技术有限公司
2010年1月2日
第一部分 基础篇
粘连基础知识
粘连的概念
粘连是组织创伤后自我修复的生理过程,是组 织修复过程中不可避免的现象。
手术后不良粘连是与组织修复无关的、不应有 的组织/脏器连结或粘附,造成组织变形、阻 塞、扭曲,引发严重后果。
术后不良粘连是有手术史以来国内外尚未解决 的重要医学难题。
fix公司的可吸收骨钉及缝合线,美国Johnson 公司缝合线、美 国SurgiWrap公司可降解抗组织粘连膜等,证明是极其安全的。
粘克®的安全性
粘克的生物安全性评价
溶血
根据GB/T14233.2中方法,使用医用聚氯乙稀为对照材料,用分 光光度计测定各试管吸光度。取样面积为60cm2。
外科手术用防粘连冲洗液盆腔灌注法预防妇产科腹盆腔手术术后粘连的临床效果观察

外科手术用防粘连冲洗液盆腔灌注法预防妇产科腹盆腔手术术后粘连的临床效果观察王勤萍;聂清英;杨英;张丽萍【期刊名称】《中国医药指南》【年(卷),期】2016(014)012【摘要】目的观察和探讨外科手术用防粘连冲洗液盆腔灌注法预防妇产科腹盆腔手术术后粘连的临床效果.方法选择于2013年12月至2014年12月来我院妇产科进行腹盆腔手术的患者64例作为研究对象,随机分为观察组和对照组两组,每组32例患者.对对照组患者采用常规治疗,观察组患者在对照组常规治疗的基础上使用防粘连冲洗液盆腔灌注法预防妇产科腹盆腔手术术后粘连.然后对比观察两组患者的术后一般情况,术后排气时间,切口愈合时间,腰骶部酸痛发生率和腹部坠胀感发生率以及两组患者的粘连发生率比较.结果观察组的粘连发生率显著低于对照组,并且具有显著性差异(P<0.05).观察组的术后排气时间,切口愈合时间,腰骶部酸痛发生率和腹部坠胀感发生率显著低于对照组,并且具有显著性差异(P<0.05).结论外科手术用防粘连冲洗液盆腔灌注法预防妇产科腹盆腔手术术后粘连的临床效果显著,并且术后恢复快,不良反应少,值得临床推广应用.【总页数】2页(P35-36)【作者】王勤萍;聂清英;杨英;张丽萍【作者单位】平湖市中医院妇产科,浙江平湖314200;平湖市中医院妇产科,浙江平湖314200;平湖市中医院妇产科,浙江平湖314200;平湖市中医院妇产科,浙江平湖314200【正文语种】中文【中图分类】R713【相关文献】1.透明质酸在妇产科腹盆腔手术术后粘连预防中的临床效果观察 [J], 刘秀花2.透明质酸钠凝胶在妇产科腹盆腔手术术后粘连预防中的临床效果观察 [J], 王卫星3.外科手术用防粘连冲洗液盆腔灌注法预防妇产科腹盆腔手术术后粘连的效果观察[J], 陈敏;陈强;李铁军;全玉玲;叶义碧4.透明质酸在妇产科腹盆腔手术术后粘连预防中的临床效果观察 [J], 刘秀花;5.防粘连冲洗液盆腔灌注法预防妇产科盆腔手术术后粘连的护理研究 [J], 王艳;鄢利梅;蒋红因版权原因,仅展示原文概要,查看原文内容请购买。
聚乳酸防粘连膜作用原理及安全有效性

聚乳酸防粘连膜的功能是在手术创面形成屏障,在手术粘连形成期过后自行降解,防止术后组织粘连的发生。
【作用原理】:弘健医用膜(聚乳酸防粘连膜)屏障作用:弘健医用膜为柔性半透明薄膜,具有一定的机械强度,植入体内后,能在预期的时间内保持膜的形态,将手术创面与邻近器官组织隔离,以避免处于愈合过程中的创面与周围组织直接接触,从而可有效防止不良粘连的发生。
随着创面的愈合,纤维增生渐趋静止,弘健医用膜按照设计的时间被降解吸收,临时屏障消失而没有任何残留与蓄积。
支架作用:这是弘健医用膜的一个专利设计,该产品有一面为支架面,与创面贴附。
在手术创面部位植入弘健医用膜后,创面边缘的上皮细胞以膜为支架爬行生长,加快了创面的上皮化进程,促进创面的修复,并且使形成的瘢痕平整光滑,更有利于预防粘连的形成。
【产品说明】通用名:弘健医用膜/聚乳酸防粘连膜商品名:弘健医用膜成分:聚DL-乳酸(PDLLA)[物理性状] 本产品为无色或白色、透明或半透明、柔韧、无杂质薄膜。
批准文号:国食药监械(准)字2010第3640159号国家医疗器械分类目录:6864-01(可吸收性止血、防粘连材料)作用安全性:材料1,弘健医用膜使用的原材料乳酸为人体固有的物质,与人体无氧呼吸或紧张性活动时产生的乳酸相同,能被人体完全代谢,无蓄积。
乳酸在医药领域已得到长期、广泛的应用。
2,聚乳酸材料经FDA批准,用于医学材料、生物工程和药物载体等多个领域。
3,以聚乳酸为材料制成的医用产品有芬兰Bio-fix公司、日本Grand fix公司的可吸收骨钉及缝合线,美国Johnson 公司缝合线、美国SurgiWrap公司可降解抗组织粘连膜等,证明是极其安全的。
合成:聚乳酸及其共聚物具有良好的物理和化学性能,其强度、机械性能和降解速率等主要技术指标,通过对分子量及共聚体配比的调节,使产品得到适当的强度支持和适宜的降解速率降解:弘健医用膜的降解过程分为两个阶段:水解过程:聚乳酸材料在体液(水)的作用下,聚合物共聚链断裂,材料的机械强度减弱。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
附件2腹腔、盆腔外科手术用可吸收防粘连产品注册技术审查指导原则一、前言腹腔、盆腔外科手术用可吸收防粘连产品为植入性高风险医疗器械。
本指导原则旨在为申请人进行腹腔、盆腔外科手术用可吸收防粘连产品的研发及注册申报提供技术指导,同时也为食品药品监管部门对注册申报资料的审评提供参考。
本指导原则系对腹腔、盆腔外科手术用可吸收防粘连产品的一般要求。
申请人应根据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
若不适用,应详细阐述理由及相应的科学依据。
本指导原则系对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行。
如果有能够满足相关法规要求的其他方法,也可以采用,但是应提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制订的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围本指导原则适用于腹腔、盆腔外科手术用可吸收防粘连产品。
同时包括与该产品配套使用的器械与工具(如有)。
三、注册申报资料要求(一)综述资料1.概述(1)申报产品管理类别:Ⅲ类。
(2)分类编码:6864。
(3)产品名称:申报企业应根据医疗器械命名的有关规定进行命名,并详细说明确定依据。
2.产品描述产品描述应全面、详细,至少应包括申报产品名称、产品性状(薄膜、凝胶或溶液等)、规格尺寸(说明所有尺寸大小,如适用)、产品组成成份[主体成分、改性剂及全部辅料(包括溶剂)]及组成比例、各组分的化学名称、分子结构式、原材料(国际通用规范化学名称)、各组分在产品中的功能、产品作用原理、适用部位、预期用途、技术性能指标、规格型号划分的依据等。
与产品配套使用的器械(如有)应说明其结构组成、尺寸及原材料信息、与产品在临床应用中的配合使用情况。
3.注册单元及型号规格(1)注册单元划分原则为:①不同性状的产品(如薄膜、凝胶或溶液等),不能划为同一注册单元。
②产品配方不同不能划为同一注册单元。
(2)规格型号的划分对于存在多种型号规格的产品,应当明确各型号规格的区别。
应当采用对比表及带有说明性文字的图片、图表,对各种型号规格的结构组成、功能、产品特征、性能指标等方面进行描述。
同一注册单元检测时应考虑产品之间的差异性,如有必要应进行相关差异性检测。
4.包装说明综述资料应包括有关产品包装信息,以及与该产品一起销售的配件包装情况;应当说明与灭菌方法相适应的最初包装信息。
5.适用范围和禁忌症申请人可根据申报产品的具体预期用途及研究资料,参考本指导原则相关内容要求进一步确认申报产品具体的适用范围及禁忌症。
6.与同类产品的比较信息应当提供同类产品(国内外已上市)信息,阐述申请注册产品的研发背景和目的。
对于参考的同类产品,应当说明选择其作为研发参考的原因。
申请人应综述同类产品国内外研究及临床使用现状及发展趋势。
提交申报产品与已批准上市的同类产品等同性的对比资料,同时列表比较说明产品与同类产品在工作原理、结构组成、制造材料、性能指标以及适用范围等方面的异同。
(二)研究资料1.原材料控制应明确产品的起始物质,列明产品生产过程中由起始物质至终产品过程中所需全部材料(主体成分、改性剂及全部辅料)的化学名称、商品名/材料代号、CAS号、MSDS、化学结构式/分子式、分子量、来源和纯度、使用量或组成比例、供应商名称、符合的标准等基本信息,建议以列表的形式提供。
如果材料为某种聚合物,应提供分子式、平均分子量以及分子量分布的测定值(如果能够测定),推荐使用凝胶渗透色谱法测定。
如果材料为固体,应提供单位重量和尺寸信息。
如果材料是液体,应提供粘度、颜色和pH值等信息。
若产品的成分中含有胶原或其他动物源性材料,申请材料中应明确动物源性材料的种属和组织,以及胶原或其他材料的特定类型。
含动物来源材料产品的材料要求应符合《动物源性医疗器械产品注册申报资料指导原则》的相关要求。
应说明原材料的选择依据,起始材料及来源和纯度。
原材料应具有稳定的供货渠道以保证产品质量,需提供原材料生产厂家的资质证明及外购协议。
应明确所用原材料(主体成分、改性剂及全部辅料)的性能标准和验收标准及相关的安全性评价报告,上述材料应以列表的形式逐一列出。
2.生产工艺提交产品的生产工艺管理控制文件,详细说明产品的生产工艺和步骤,列出工艺图表。
应包括产品制备及配套使用的器械的工艺路线、关键工序、质量控制指标及相关的验证报告。
对生产工艺的可控性、稳定性应进行确认。
对生产加工过程中所使用的所有助剂(如:溶剂等)均应说明起始浓度、去除措施、残留浓度、对残留量的控制标准、毒性信息以及安全性验证报告。
应对生产、加工和包装步骤进行确认。
应给出每个过程或步骤的目的、每个过程或步骤中所使用的成分和材料、质量控制措施和所使用的设备。
应提供产品加工过程中以及终产品的质量控制要求(包括检测方法、手段)。
确证终产品的放行质量控制要求、检测方法、抽样原则及可接收标准。
3.产品性能研究(1)如果产品中含某种聚合物,应提供分子式、平均分子量以及分子量分布的测定值(如果能够测定),推荐使用凝胶渗透色谱法测定。
如果产品为固体,应提供单位重量和尺寸信息。
如果产品是液体,应提供装量、粘度、颜色和pH值等信息。
(2)应对每种材料(组分)进行检测,以评价其性质。
应控制材料(组分)的质量如:外观、粘度(如适用)、平均分子量、pH值、有机挥发性杂质含量,以及微粒物质等。
应明确所使用原材料的质量控制要求(标准)、检测方法。
应提供选材和质控标准(质量控制要求)确定的依据。
(3)提供从原材料至成品的全部制备过程(包括生产过程)。
说明产品的化学配方和生产工艺。
说明制备产品所使用的非参与化学反应成分、反应成分(包括催化剂、固化剂和反应中间体)。
应当对共聚体(如适用)进行分析,以确定(评价)产品的均一性。
(4)说明对产品的单一组分、复合组分(如适用)以及终产品的灭菌方式,应提交灭菌验证资料。
(5)无论是原材料中残留物、产品制备(生产)过程产生的化学残留物、或者是产品制备(生产)过程中引入的化学物质(不期望物质),应进行分析和控制。
应对已灭菌终产品通过极性和非极性溶液进行浸提萃取,应采用具有足够灵敏度的方法如高效液相色谱法检测潜在的毒性污染物。
此外,还应检测挥发性和非挥发性残留物质。
(6)应使用客观(定量)的测定方法详细并充分的表征产品的独有、显著特性,以便使审评人员能对这些特性有一个清楚的认识。
(7)应描述产品的关键物理性质。
根据产品性质制定检测项目。
固体、凝胶和液体防粘连产品可分别检测其撕裂强度、粘性和粘度。
确证产品的组成成分和结构信息是产品能否进行临床前和临床研究的关键。
因此需对产品进行全面研究确认,包括产品的物理尺寸、材料和性能。
(8)有效性研究应在适当的动物模型上进行产品有效性研究,通过这些研究能合理的推论出对人体的有效性。
动物研究也可以作为参考以更好地设计临床研究方案。
动物研究应尽可能的体现手术方法(开放性手术、腔镜下手术)、特定手术部位(如:在体壁和内脏之间、肠袢周围)、粘连的类型(如:新生粘连形成、原有粘连的再粘连)、粘连的评价方式(如:评分、发生率、广泛程度、严重程度),以及拟在人体临床研究中的产品使用方法。
这些研究应进行良好设计并设立对照组,以便显示产品治疗组与对照组之间具有显著的统计学差异。
植入后发生的任何感染都应报告并对结果进行统计处理。
应对预期用于人体的各不同剂量组进行比较。
还应提供对所使用动物模型的基本原理及其局限性的简要讨论。
申请人应阐明试验中选择的有效性终点观察时间与粘连形成的临床匹配性。
(9)应对产品可以防粘连的作用机理进行阐明,并提供支持性科学文献。
应考虑不同组织解剖部位粘连形成的机制可能不同。
应考虑产品降解的时间与临床粘连形成关键时间是否匹配。
(10)申请人应对产品进行体外降解试验研究,降解研究报告应说明所用材料、材料来源、研究设备、试验方案、试验步骤、支持文献等。
4.生物相容性评价及安全性研究(1)生物相容性本指导原则所涉及的产品是植入人体的,产品材料对人体应安全,不能对人体组织、血液、免疫等系统产生不良反应。
产品所使用材料的生物相容性优劣是防粘连产品研究设计中首先考虑的重要问题,申请人应提供有关研究评价技术资料,以便于审评人员全面掌握其对产品安全性进行研究及评价的情况。
生物相容性研究应遵循GB/T 16886.1《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》相关要求,与组织接触24小时—30天的产品建议进行以下试验:∙细胞毒性∙致敏性∙刺激性或皮内反应∙急性全身毒性∙溶血试验∙遗传毒性(Ames回复突变、染色体畸变、小鼠淋巴瘤突变)∙热原试验∙植入试验∙降解试验∙亚慢性毒性应根据材料的预期用途制定植入、亚慢性毒性试验方案,材料的植入部位、植入时间应模拟临床使用的实际情况。
应根据产品特性设计试验方案,试验剂量应高于在体内可检测水平。
试验材料应植入到预期使用部位或其附近,评价时间应截止到材料被动物体完全吸收为止,须监测动物的全身毒性和植入部位的局部反应以及宏观病理学和组织病理学结果。
若接触时间大于30天,建议进行慢性毒性和致癌性研究(如大鼠2年植入试验)。
对于某些材料,如某些生物相容性项目没有必要进行测试,应提供足够的理由或证据说明。
但对其他一些材料,根据材料性质,可能需要增加测试项目。
在进行临床研究之前,应完成所有的临床前安全性研究,致癌性、生殖系统和发育毒性试验可能除外。
这些除外的项目取决于遗传毒性试验的结果、是否有可能发生生殖和发育毒性以及产品的预期用途。
知情同意书应披露任何一项悬而未决的安全性研究(结果)。
如果预期用途是提高生育能力,应进行生殖毒性试验。
(2)安全剂量范围在所有生物相容性和毒性测试中,试验中的产品剂量都应反映用于人体预期使用剂量合理的安全范围。
通常,应选择一系列剂量进行动物试验,直至剂量达到人体最高用量的10倍。
如达不到上述安全剂量范围,应证明人体暴露量大于十分之一的动物试验观察中无不良反应剂量的合理性。
(3)阻碍或延迟愈合试验减少粘连形成可能延迟和阻碍期望的愈合过程,动物试验研究时应评价这种情况。
在缝线拆除后,位于缝合或吻合部位的防粘连产品不应降低组织支持强度。
本试验可以在有效性研究中设计并增加专门观察指标。
(4)感染试验应测试防粘连材料接种细菌后对败血症的发生是否有促进作用,发生这种情况的原因可能是防粘连材料刺激细菌生长、抑制抗生素扩散到感染部位、与产品相关的感染性微生物由手术部位进入血液循环途径增多或其他未知机理导致的败血症。
因此应在防粘连材料存在和不存在的情况下分别给动物接种多种消化道微生物的混合物,针对死亡率和脓肿形成进行评分,这一试验需达到一定的样本量,并采用恰当的试验方案,以确保试验结果具有统计学意义。
