含氮化合物练习题
氮的练习题

氮及其重要化合物一、选择题(本题包括10小题,每小题6分,共60分)1.下列说法中正确的是( )A.氮气化学性质不如磷活泼,故氮元素非金属性弱于磷B.磷酸比硝酸稳定,所以磷元素的非金属性比氮元素强C.“雷雨发庄稼”所包含的化学变化有:N2→NO→NO2→HNO3→硝酸盐D.因为N≡N键键能大,所以N2分子间作用力大,其熔沸点比白磷高2.汽车排放的尾气中含有NO2,NO2是城市大气污染的主要污染物之一,在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。
反应过程为①2NO22NO+2O,②2NO+O22NO2,③O+O2O3。
下列对该反应过程及产物叙述正确的是( )A.NO2起催化剂作用B.NO起催化剂作用C.NO2只起氧化剂作用D.O3与O2互为同分异构体3.(2014·郑州模拟)下列离子或分子在溶液中能大量共存,但通入NO2后不能大量共存,且不会生成沉淀的一组是( )A.K+、Na+、N、SiB.Al3+、K+、S、S2-C.Ag+、Na+、NH3·H2O、ND.Cu2+、Fe2+、Cl-、S4.无色的混合气体甲,可能含NO、CO2、NO2、NH3、N2中的几种,将100 mL甲气体经过下图各装置,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )A.NH3、NO2、N2B.NH3、NO、CO2C.NH3、NO2、CO2D.NO、CO2、N25.(2013·湘潭模拟)NH3是一种重要的化工原料,可以制备一系列物质(如图)。
下列有关表述正确的是( )A.NH4Cl和NaHCO3都是常用的化肥B.NH4Cl、HNO3和Na2CO3受热时都易分解C.NH3和NO2在一定条件下可发生氧化还原反应D.图中所涉及的盐类物质均可以水解6.(2014·南昌模拟)如图是课外活动小组的同学设计的4个喷泉实验方案。
下列有关操作不可能引发喷泉现象的是( )A.挤压装置①的胶头滴管使CCl4全部进入烧瓶,片刻后打开止水夹B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹7.为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有N、Fe2+、S和H2O,下列实验叙述中不正确的是( )A.取少量硫酸亚铁铵晶体放入试管,加热,试管口有液体生成,则可证明晶体的成分中含有结晶水B.硫酸亚铁铵晶体溶于水,得淡绿色溶液,滴入2滴KSCN溶液,溶液不显红色,再滴入几滴新制氯水,溶液变为红色,则可证明晶体的成分中含有Fe2+C.硫酸亚铁铵晶体溶于水,加少量稀盐酸,无现象,再滴入几滴BaCl2溶液,有白色沉淀生成,则可证明晶体的成分中含有SD.取少量硫酸亚铁铵晶体放入试管,加入浓氢氧化钠溶液,加热,试管口湿润的蓝色石蕊试纸变红,则可证明晶体的成分中含有N8.(2014·沈阳模拟)在100 mL混合酸中,HNO3和H2SO4的物质的量浓度分别为0.4 mol·L-1和0.1 mol·L-1,向该混合液中加1.92 g铜粉,加热,待充分反应后,所得溶液中的Cu2+的物质的量浓度是( )A.0.15 mol·L-1B.0.225 mol·L-1C.0.35 mol·L-1D.0.45 mol·L-19.(2013·汕头模拟)下列药品和装置合理且能完成相应实验的是( )10.(能力挑战题)足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体4.48 L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。
高考化学培优 易错 难题(含解析)之氮及其化合物及答案解析
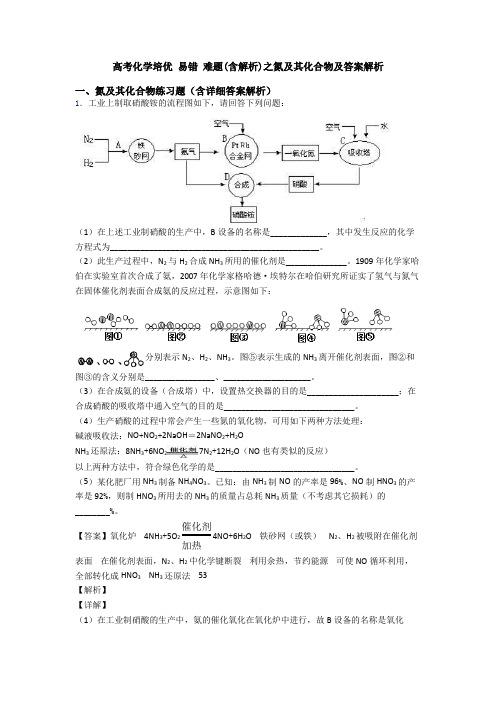
高考化学培优易错难题(含解析)之氮及其化合物及答案解析一、氮及其化合物练习题(含详细答案解析)1.工业上制取硝酸铵的流程图如下,请回答下列问题:(1)在上述工业制硝酸的生产中,B设备的名称是_____________,其中发生反应的化学方程式为________________________________________________。
(2)此生产过程中,N2与H2合成NH3所用的催化剂是______________。
1909年化学家哈伯在实验室首次合成了氨,2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体催化剂表面合成氨的反应过程,示意图如下:分别表示N2、H2、NH3。
图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是________________、____________________。
(3)在合成氨的设备(合成塔)中,设置热交换器的目的是_____________________;在合成硝酸的吸收塔中通入空气的目的是______________________________。
(4)生产硝酸的过程中常会产生一些氮的氧化物,可用如下两种方法处理:碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2ONH3还原法:8NH3+6NO27N2+12H2O(NO也有类似的反应)以上两种方法中,符合绿色化学的是________________________________。
(5)某化肥厂用NH3制备NH4NO3。
已知:由NH3制NO的产率是96%、NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗NH3质量(不考虑其它损耗)的________%。
【答案】氧化炉 4NH3+5O2催化剂加热4NO+6H2O 铁砂网(或铁) N2、H2被吸附在催化剂表面在催化剂表面,N2、H2中化学键断裂利用余热,节约能源可使NO循环利用,全部转化成HNO3 NH3还原法 53【解析】【详解】(1)在工业制硝酸的生产中,氨的催化氧化在氧化炉中进行,故B设备的名称是氧化炉,发生反应的化学方程式为4NH3+5O2催化剂加热4NO+6H2O。
高考化学氮及其化合物-经典压轴题附答案解析

高考化学氮及其化合物-经典压轴题附答案解析一、氮及其化合物练习题(含详细答案解析)1.硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。
试回答下列问题:(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:①写出铁与过量稀硝酸反应的离子方程式:__。
②写出过量铁与稀硝酸反应的离子方程式:__。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__。
上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__Al+__NO3-+__OH-+__=__[Al(OH)4]-+__N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__,反应中转移电子0.3mol,生成__mL(标准状况下)N2。
【答案】Fe+NO3-+4H+=Fe3++NO↑+2H2O 3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O 2∶3 40 10 6 4 18H2O 10 3 10∶3 672【解析】【详解】(1)①铁与过量稀硝酸反应生成硝酸铁、NO和水,离子方程式为Fe+NO3-+4H+=Fe3++NO↑+2H2O;②过量铁与稀硝酸反应生成硝酸亚铁、NO和水,离子方程式为3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O;③28g铁的物质的量为0.5mol,与含1.6mol硝酸的稀硝酸恰好完全反应,设生成的Fe3+和Fe2+的物质的量分别是xmol、ymol,即生成xmol硝酸铁和ymol硝酸亚铁,根据N原子守恒知,生成NO的物质的量为(1.6-3x-2y)mol,根据得失电子守恒有3x+2y=3(1.6-3x-2y),又有x+y=0.5,解得x=0.2,y=0.3,则生成的Fe3+和Fe2+的物质的量之比为2∶3;上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,由于生成的氢氧化亚铁在空气中易被氧化为氢氧化铁,氢氧化铁受热分解最终得到的固体是氧化铁,故其物质的量为0.5mol×12=0.25mol,质量为40g;(2)①根据得失电子守恒、原子守恒及电荷守恒,可知离子方程式为10Al+6NO3-+4OH-+18H2O=10[Al(OH)4]-+3N2↑;②上述反应中,还原剂是Al,还原产物是N2,其物质的量之比为10∶3;由方程式可知,生成3molN2时转移电子30mol,所以反应中转移电子0.3mol,生成N2的体积(标准状况下)为0.3mol10×22.4L·mol-1=0.672L=672mL。
高考化学培优(含解析)之氮及其化合物附详细答案

高考化学培优(含解析)之氮及其化合物附详细答案一、氮及其化合物练习题(含详细答案解析)1.氮及其化合物在生产生活中有广泛的应用:(1)甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH-)之比____10(填“大于”“等于”或“小于”),并说明理由_____________________________________。
(2)常温下向含0.5mol溶质的稀盐酸中缓慢通入0.5molNH3(溶液体积变化忽略不计),反应结束后溶液中离子浓度由大到小的顺序是______________________;在通入氨气的过程中溶液的导电能力___________(选填“变大”、“变小”或“几乎不变”)。
请设计实验检验铵盐中的NH4+:___________。
【答案】小于加水稀释,弱电解质的电离程度增大 c(Cl-)>c(NH4+)>c(H+)>c(OH-)几乎不变取样,加水溶解,加入氢氧化钠浓溶液,加热,若产生的气体能使湿润的红色石蕊试纸变蓝,则证明有NH4+【解析】【分析】【详解】(1)浓溶液加水稀释,越稀越电离,故0.1mol/L的氨水中电离程度更大,故甲、乙两瓶氨水中c(OH-)之比小于10;答案为:小于;加水稀释,弱电解质的电离程度增大;(2)二者恰好反应生成氯化铵,铵根水解溶液呈酸性,即c(H+)>c(OH−),依据溶液呈电中性有:c(H+)+c(NH4+)=c(OH−)+c(Cl−),因为c(H+)>c(OH−),所以c(NH4+)<c(Cl−),故离子浓度大小关系为:c(Cl−)>c(NH4+)>c(H+)>c(OH−);溶液中离子浓度几乎不变,所以导电能力几乎不变;铵盐能与强碱反应放出氨气,则检验铵根离子的实验方案:取样,加水溶解,加入氢氧化钠浓溶液,加热,若产生的气体能使湿润的红色石蕊试纸变蓝,则证明有NH4+。
【点睛】浓溶液加水稀释,越稀越电离;溶液的导电能力主要取决于溶液中离子的浓度及离子所带的电荷数:离子的浓度越大,导电能力越强;离子所带的电荷数越大,导电能力越强。
高考化学氮及其化合物-经典压轴题附答案

高考化学氮及其化合物-经典压轴题附答案一、氮及其化合物练习题(含详细答案解析)1.如图1为实验室制取氨的实验装置。
(1)写出A中所发生反应的化学方程式___。
(2)NH3在一定条件下可与O2反应生成一种无色气体,该气体遇空气迅速变红棕色,请写出相关反应的化学方程式___,___。
(3)在收集氨时试管口棉花的作用是___。
(4)一位学生用制得的氨,按图2装置进行喷泉实验,烧瓶已充满干燥的氨气,引发喷泉实验的操作____。
(5)另一学生积极思考产生喷泉的其他方法,设计了图3装置。
首先在锥形瓶中分别加入足量的下列物质,反应后产生喷泉的是(______)A.CaCO3粉末和浓盐酸B.NH4HCO3溶液与稀NaOH溶液C.HCl和AgNO3溶液D.HCl和酚酞溶液该同学又向锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。
水槽中加入的物质可以是(______)A.硝酸铵 B.食盐 C.浓硫酸 D.硫酸铜【答案】2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O NH3+5O2=4NO+6H2O 2NO+O2=2NO2减少与空气的对流,保证试管中能收集满氨气打开橡皮管的夹子,挤压胶头滴管的胶头,使少量的水进入烧瓶 A C【解析】【分析】(1)为制取氨气的装置,收集氨气的试管口需要棉花;(2)气体遇空气能迅速变红棕色,原气体是NO;(6)图3要想产生喷泉,必须生成大量气体;(7)如果放出大量热量,也能增大气体压强,产生喷泉。
【详解】(1)实验室制氨气2NH4Cl+Ca(OH)2∆CaCl2+2NH3↑+2H2O 。
(2) NH3在一定条件下可与O2反应生成一种无色气体,该气体遇空气迅速变红棕色,该气体是NO,所以NH3+5O2=4NO+6H2O。
(3) NO遇空气迅速变红棕色,所以2NO+O2=2NO2 。
(4)收集氨时试管口棉花的作用是减少与空气的对流,保证试管中能收集满氨气。
高考化学易错题专题训练-氮及其化合物练习题含详细答案

高考化学易错题专题训练-氮及其化合物练习题含详细答案一、氮及其化合物练习题(含详细答案解析)1.人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用率,而且能够更好地保护环境,请回答下列问题:(1)将N2转化为含氮化合物的过程称为固氮①人工固氮,将N2→NH3, N2发生_________反应②自然界固氮,可将少量N2转化为Ca(NO3)2等氮肥,转化途径如下(转化所需试剂及条件已略去):N2→NO→NO2→HNO3M−−→Ca(NO3)2。
写出NO→NO2→HNO3的化学方程式__________、__________。
将HNO3转化为Ca(NO3)2,列举三种不同类别......的化合物M_______(写化学式)。
(2)科学合理地保存、施用氮肥① NH4HCO3需阴凉处保存,原因是__________(写化学方程式)。
②铵态氮肥不能与碱性肥料混合使用,以NH4Cl为例写出发生反应的离子方程式________。
(3)过渡施用氮肥将导致大气中NH3含量增高,加剧雾霾的形成。
(NH4)2SO4是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去):① X可能是______、_______。
Y是___________。
②尿素CO(NH2)2是一种常用化肥,缓慢与H2O发生非氧化还原反应释放出NH3则尿素中C 元素化合价为__________。
【答案】还原 2NO + O2= 2 NO2 3NO2 + H2O = 2HNO3 + NO CaO、Ca(OH)2、CaCO3NH4HCO3ΔNH3↑+CO2↑+ H2O NH4++ OH-= NH3↑+ H2O SO3 H2SO3 H2SO4 +4【解析】【分析】本题主要考察含N物质的化学性质,运用所学知识答题即可。
【详解】(1)①N2→NH3,N的化合价由0变为了-3,则N2作氧化剂,发生还原反应;②NO→NO2的化学方程式为:2NO+O2=2NO2;NO2→HNO3的化学方程式为:3NO2+H2O=2HNO3+NO;HNO3M−−→Ca(NO3)2,M可以是CaO、Ca(OH)2、CaCO3;(2)①NH4HCO3需阴凉处保存,是因为该物质对热不稳定,受热易分解,相关的化学方程式为:NH4HCO3ΔNH3↑+CO2↑+H2O;②该离子方程式为:NH 4++OH -=NH 3↑+H 2O ;(3)①根据图可知,Y 为H 2SO 4;在自然环境中,SO 2变为H 2SO 4的途径有两种:2H O [O]2324SO SO H SO −−→−−−→、22H O O 22324SO H SO H SO −−−→−−→,故X 为SO 3或H 2SO 3;②尿素CO(NH 2)2缓慢与H 2O 发生非氧化还原反应释放出NH 3,说明尿素中N 呈-3价,由于O 呈-2价,H 呈+1价,故可算得C 呈+4价。
含氮化合物练习题

第十八章含氮化合物 (客观题 22 道,主观题 37 道) 一.客观题1. 命名下列化合物并指明分别属于伯胺、仲胺、叔胺、季铵或酰胺哪一类(1)CH 3CH 2CH 2NH 2 丙胺,伯胺 (2)CH 3CH 2CON(CH 3)2 N ,N -二甲基丙酰胺,酰胺 (3N ,N -二甲基苯胺、叔胺(4 α-呋喃甲醛 (5) 氯化三甲基乙基胺,季铵盐(6)2-丙胺,伯胺(7)(CH 3)4N +OH - 氢氧化四甲胺,季铵碱 (8)C 2H 5NHCH 3 甲乙胺,仲胺2. 写出下列化合物的构造式(9)甲基异丙基胺 (10)二苯胺(11) N-甲基丙酰胺 CH 3CH 2CONHCH 3(12)叔丁胺(CH 3)3CNH 2 (13)氯化三甲基苯基胺(14)3-溴吡啶(15)α-氨基丁酸(16)对羟基偶氮苯(17)四氢呋喃(18)甲基磺酰氯 CH 3-SO 2Cl(19)乙基亚磺酸 CH 3CH 2SO 2H(20)氯胺(21)写出分子式为C 8H 11N 的芳胺的所有同分异构体并命名H 3)2H OC H 3C H 2-N +-C H 3C l-C H 3C H 3CH 3C HCH 3NH 2C H 3N H C H C H 3C H 3CH 3CH 3N +CH 3Cl -NB rC H 3C H 2C H C O O HN H 2=H O2-al H C H 2C H 3N C H 3C H33H C H 3C H H C H 3N-乙基苯胺 N,N-二甲基苯胺 N-甲基邻甲苯胺 N-甲基间甲苯胺N-甲基对甲苯胺 邻乙苯胺 间乙苯胺 对乙苯胺2,6-二甲基苯胺 2,5-二甲基苯胺 2,4-二甲基苯胺 2,3-二甲基苯胺3,5-二甲基苯胺 3,4-二甲基苯胺(22)4.将下列化合物按碱性递增次序排列,并说明理由NH 3CH 3CH 2NH 2 CH 3CH 2CONH 2 CH 3NHCH 3解:CH 3CH 2CONH 2<C 6H 5NH 2< NH3<CH 3CH 2NH 2<CH 3NHCH 3用化学方法区别下列各组化合物 (23)二乙胺、苯胺和苄胺C 2H 5NHC 2H 5 × N 2↑C 6H 5NH 2 白色沉淀 C 6H 5CH 2NH 2 × 黄色油状液体(24)对甲基苯胺、N -甲基苯胺和N ,N -二甲基苯胺 N 2↑黄色油状液体绿色H 22C H 3H 2C H 2C H 2C H 3C H H C H 3H 3H 3H 3H 3H 3H 33H 3H 3H 3H 3H 33−−→−溴水−−−→−亚硝酸H 3H 2H -C H 3H 3H 32试以苯及其他试剂为原料,合成下列化合物 (25)对溴苯胺(26)对氨基苯甲酸(27)4-羟基-4’-硝基偶氮苯(28)间硝基乙酰苯胺混酸55~60℃2ΔN O 2N H 23N H C O C H3H O A cO C H 32H+混酸55~60℃Fe, H C l, H 2OΔ3O C H 3AlC l 3O C H 33HO C H 3H2H混酸55~60℃2Δ3O C H 3混酸55~60℃O C H 322H220~5℃l-2+弱酸, 0℃, H 2OH =O 2+H N O 32455℃95℃O 2ΔO 23O A lC l 3O 2H 3O写出对甲基盐酸重氮苯与下列试剂作用后生成的产物 (29)H 3PO 2(30)KI(31)HBr/Cu 2Br 2 (32)HBF 4,然后加热 (33)HCl/Cu 2Cl 2(34)C 6H 5OH (弱碱性溶液)(35)对甲基苯酚(36)N ,N -二甲基苯胺写出乙酐与下列胺反应生成的产物 解:(37)CH 3CH 2CH 2CH 2NH 2 (38)C 6H 5N(CH 3)2 (39)二,主观题(1) 某化合物A 分子式为C 6H 15N ,能溶于稀盐酸,在室温下与亚硝酸作用放出氮气并得到化合物B 。
高考化学氮及其化合物(大题培优 易错 难题)附详细答案

高考化学氮及其化合物(大题培优易错难题)附详细答案一、氮及其化合物练习题(含详细答案解析)1.研究金属与硝酸的反应,实验如下。
⑴Ⅰ中产生的无色气体是______。
⑵研究Ⅱ中的氧化剂①甲同学认为该浓度的硝酸中H+的氧化性大于NO3-,所以NO3-没有发生反应。
乙同学依据Ⅰ和Ⅱ证明了甲的说法不正确,其实验证据是______。
②乙同学通过分析,推测出NO3-也能被还原,依据是______,进而他通过实验证实该溶液中含有NH4+,其实验操作是______。
③补全Ⅱ中NO3-被还原为NH 的过程:NO3- + ______e- + ______= NH4+ + ______H2O4⑶研究影响产生H2的因素资料:Fe[(NO)]2+在溶液中呈棕色。
④对比Ⅱ、Ⅲ、Ⅳ,温度不同时收集到氢气的体积不同,原因是______。
⑤Ⅴ中无色气体是混合气体,则一定含有遇空气变红棕色的气体和______。
⑷根据实验,金属与硝酸反应时,影响硝酸的还原产物不同的因素有______。
【答案】NO 硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中溶液变蓝,同时没有氢气放出NO3-中氮元素的化合价为最高价,具有氧化性取Ⅱ中反应后的溶液,加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体 8 10H+ 3 相同条件下,温度升高时,化学反应速率增大,但NO3-的还原速率增大的更多 H2金属的种类、硝酸的浓度、温度【解析】【分析】⑴Ⅰ中无色气体NO遇空气生成红棕色的二氧化氮气体。
⑵①依据Ⅰ和Ⅱ硝酸浓度相同,铜的还原性弱于铁,但Ⅰ中生成NO,因此可得NO3-没有发生反应不正确。
②NO3-中氮元素的化合价为最高价,具有氧化性,证明NH4+的方法是去一定量溶液加入足量NaOH溶液并加热,产生有刺激性气味并能使湿润红色石蕊试纸变蓝的气体。
③根据化合价降低得到电子配平得到。
⑶④根据现象和温度升高时,化学反应速率增大。
⑤根据元素分析和前面的信息得到答案。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
含氮化合物练习题班级 学号 姓名一、 命名下列化合物(每小题1分,共10分)NO 2CH 3CH 3NO 21.2.CH 3NH CH 32-间硝基苯基-3-硝基丁烷 1,2-二甲氨基乙烷3.4.CH 3CH 3N +CH 3CH 3CH3Cl -N CH 3C H 3COOEt 氯化二甲基乙基-1-甲基-2-烯丁基铵 间甲乙胺基苯甲酸乙酯NCH 3C H 3N(CH 3)25.6.N NCH 3Br3,3’-二甲基-4’-二甲氨基氧化偶氮苯 3-甲基-2’-溴偶氮苯7.8.NH NHBrN +NCH 3BF 4-4-溴氢化偶氮苯 四氟硼酸间甲基苯基重氮盐9.10.CH 3CH 3CH 3N CH 3NO氧化甲乙胺 N -亚硝基甲乙胺二、 完成下列反应方程式,注明产物的立体构型和主要产物(每小题1分,共25分)1.CH 3NO 2NaOH2.HNO2CH 3NO 23.Fe + HClCH 3NO 24.H /PdCH 3NO 25.23NO26.NO 27.4NO 28.LiAlH 4NO 29.NaOHNO 2NO 2Br10.HNO NH 2Br11.NH BrCH 3HNO 212.N CH 3C H 3HNO 213.NC H 3CH 3CH 3HNO214.CH3CH2N(CH3)2H2O215.NHCOCH3Br216.NHCOCH3ClO2CH3NH217.Heat CH3CH3N+CH3CH3CH3FOH-18.NHCOCH3ClO2SCH3NH219.N 1.CH3I2.Ag2O/H2O 3.Heat20.NH2NaNO2/HCl0-5C21.N+NCH3H3PO2HSO4-22.CuCl/HCl N+NClHSO4-23.CuCN/KCN N+NBrHSO4-24.NaNO2/Cu N+N BF4-25.NH4Cl N+NBrHSO4-NH CH3+三、选择题(每小题1分,共30分)1.酸性最强的是AA.硝基甲烷B.硝基乙烷C.硝基异丙烷D.硝基苯2.与亚硝酸反应产物的碱溶液呈红色的是B A.氨基甲烷B.硝基乙烷C.硝基异丙烷D.硝基苯3.可用于鉴别硝基化合物的是DA.Fe+HClB.Sn+HClC.As2O3+NaOHD.NaNO2/HCl+NaOH4.可使硝基苯还原成苯胺的是AA.Fe+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl5.可使硝基苯还原成氧化偶氮苯的是B A.Fe+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl6.可使硝基苯还原成氢化偶氮苯的是C A.Fe+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl7.可使硝基苯还原成偶氮苯的是CA.Fe+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl8.水溶液中碱性最强的是B A.甲胺B.二甲胺C.三甲胺D.苯胺9.碱性最强的是ANH23NH2ClNH2ClNH2CH3A. B. C. D.10.与TsCl反应的产物加碱澄清,加酸又浑浊的的是A A.甲胺B.二甲胺C.三甲胺D.氢氧化四甲铵11.与亚硝酸反应生成黃色油状物的是BA.甲胺B.二甲胺C.三甲胺D.氢氧化四甲铵12.与亚硝酸反应生成绿色沉淀的是CA.苯胺B.N-甲基苯胺C.N,N-二甲基苯胺D.三甲铵13.苯胺类物质常用于保护氨基的反应是B A.磺酰化B.乙酰化C.重氮化D.酸化14.常用于鉴别苯胺的试剂是BA.氯水B.溴水C.碘/四氯化碳D.硝酸15.磺胺类药物的基本结构是AA.对氨基苯碘酰胺B.对羟基苯碘酰胺C.间氨基苯碘酰胺D.间羟基苯碘酰胺16.季铵碱的Hoffmann热消除反应的机理是DA.E1B.E2C.E1CBD.介于E1CB与E2之间17.季铵碱的热消除反应常用于AA.测定胺的结构B.测定胺分子中的氮原子数C.测定胺分子中的环数D.制备烯烃18.不能将芳香族重氮盐的重氮基用氢取代的是D A.次磷酸B.乙醇C.HCHO/NaOHD.甲醇19.能将重氮基还原成肼的是AA.Sn+HClB.葡萄糖/ NaOHC.Zn/NaOHD.Zn/NH4Cl20.重氮盐与酚的偶联介质是DA.强酸性B.强碱性C.弱酸性D.弱碱性21.重氮盐与苯胺的偶联介质是C A.强酸性B.强碱性C.弱酸性D.弱碱性22.重氮基被碘取代的催化剂是D A.CuB.CuIC.CuClD.不用催化剂23.重氮基被溴取代的催化剂是B A.CuB.CuBrC.CuClD.不用催化剂24.重氮基被硝基取代的催化剂是A A.CuB.CuBrC.CuClD.不用催化剂25.重氮基被氟取代的催化剂是DA.CuB.CuBrC.CuClD.不用催化剂四、试用化学方法鉴别下列化合物(10分)1.1-己醇、2-戊酮、3-戊酮、己烷、环已醇2.乙醇,3-戊醇,乙醛、己烷、3-戊酮五、合成(每小题5分,共10分)1.由苯合成间溴氯苯2.由苯合成对苯二胺3.由苯合成均三溴苯4.由苯合成3,5-二溴甲苯5.由苯合成间硝基甲苯同46.由苯合成4-甲基-2,6-二溴苯酚同4六、推断题(每小题2、5、3分,共10分)1.A(C6H15N)+HCl→溶解,+HNO2→N2+B,B+I2/OH-→黄↓,B+浓硫酸共热→C(C6H12),C+KMnO4/H+→乙酸+2-甲基丙酸。
求ABC结构。
2.旋光性A(C4H9O2N)+HCl→溶解,+HNO2→N2,A可水解→甲醇+旋光性B,B可溶于酸和碱,B+HNO2→乳酸。
求AB结构。
3.碱性A(C7H9N),其盐酸盐+HNO2→B(C7H7N2Cl),B加热→N2+对甲苯酚,B+苯酚/OH-→有色化合物C(C13H12ON2)。
求ABC结构。
4.A含CHON,与NaOH共热→刺激性气体,反应液酸化得B(B不含N),B+LiAlH4→C,C+浓H2SO4共热→M=56的烯D,D臭氧化得醛+酮。
求A-D结构。
5.旋光性A的分子式为C5H10O3N2,HNO2处理后水解可得到α-羟基乙酸和β-氨基丙酸,试写出A的结构式。
6.A(C5H13N)有旋光性,与亚硝酸作用得B(C5H12O),B可拆分,氧化得C(C5H10O),C与次卤酸钠反应得到异丁酸。
试推A,B,C的结构。
7.A,B,C(C7H7NO2),都含苯环。
A能溶于酸和碱;B能溶于强碱而不溶于酸;C不溶于酸和碱。
试推A、B、C结构。
8.旋光性A(C5H9NO4)既可形成内酯,也可水解;A水解→B(C2H4O3)+旋光C;B[O]→草酸,C+HNO2→N2+D,D[O]→丙酮酸。
求A-D的结构。
9.旋光性的A(C4H7NO4)可溶于酸和碱,+HNO2→N2+旋光性B,B[O]→C,C有互变异构体D;B脱水→E,E有顺反异构体F。
求A-F的结构。
10.分子式C7H7NO2的化合物A,与Sn+HCl反应生成分子式为C7H9N 的化合物B;B和NaNO2+HCl在0℃下反应生成分子式为C7H7ClN2的一种盐C;在稀酸中C与CuCN反应生成分子式为C8H7N的化合物D;D在稀酸中水解得到分子式为C8H8O2的有机酸E;E用KMnO4氧化得到另一种酸F;F受热时生成分子式为C8H4O3的酸酐G。
试写出A-G的构造式。
11.化合物(A)能溶于水,不溶于乙醚、苯等有机溶剂。
经元素分析表明(A)含有C、H、O、N。
(A)经加热后失去一分子水得到(B),(B)与溴的氢氧化钠溶液作用得到比(B)少一个C和O的化合物(C)。
(C)与亚硝酸作用得到的产物与次磷酸反应能生成苯。
试写出(A)、(B)、(C)的构造式及有关反应式。
12.A(C6H13N)经第一次霍夫曼彻底甲基化反应得B(C8H17N),经第二次霍夫曼彻底甲基化反应得C(C6H10)。
C经臭氧化还原水解生成两分子甲醛,C在苯中与顺丁烯二酸酐反应生成白色沉淀。
试推测ABC的结构13.A(C6H13N)经第一次霍夫曼彻底甲基化反应得B(C8H17N),经第二次霍夫曼彻底甲基化反应得唯一的直链化合物C(C6H10)。
C经臭氧化还原水解生成两分子甲醛。
试推测ABC的结构14.毒芹碱A(C8H17N)经两次霍夫曼彻底甲基化反应得两种互为同分异构体的直链物质B和C(C8H14)。
B经臭氧化还原水解生成一分子甲醛、D(C3H4O2)和E(C4H8O);C经臭氧化还原水解生成一分子甲醛、F(C4H6O2)和G(C3H6O)。
试推测A至G的结构15.化合物A(C7H15N)与2mol碘甲烷作用形成季铵盐,后用氢氧化银处理得季铵碱,加热得B。
B分别与1mol碘甲烷和氢氧化银作用,加热得C(C7H12)。
C用高锰酸钾氧化得D,已知D为二甲基丙二酸。
试推测A至C的结构。
