诊断试剂加速稳定性试验方案
体外诊断试剂运输稳定性研究方案

体外诊断试剂运输稳定性研究方案体外诊断试剂是一种用于检测人体样本中生化指标、疾病标志物等的试剂,其质量和稳定性对于检测结果的准确性至关重要。
而试剂在运输过程中受到温度、湿度、震动等不利环境因素的影响,可能导致试剂的降解和失效。
因此,需要进行体外诊断试剂运输稳定性的研究,以保证试剂在运输过程中的稳定性和可靠性。
本研究旨在评估体外诊断试剂在运输过程中的稳定性,具体方案如下:1.样品选择从市场上随机选取一批体外诊断试剂,包括不同制造商和不同类型的试剂。
确保选取的试剂能够涵盖常见的体外诊断试剂。
2.环境条件设置模拟实际运输环境,设置不同的温度、湿度和震动条件。
可以参考国内外相关标准和规范,确定合适的环境参数。
例如,可设置不同温度(常温、低温、高温)、湿度(相对湿度20%-80%)、震动(低频、中频、高频)条件。
3.运输箱选择选择合适的运输箱,确保能够满足运输过程中的要求。
运输箱的选取应考虑到绝缘性、隔热性、防潮性和防震性等因素。
4.试剂包装将选取的试剂进行适当的包装,以保护其在运输过程中不受到外界环境的影响。
包装材料可以使用常见的防潮、防震材料,如聚乙烯泡沫、吸湿剂等。
确保包装材料不会对试剂产生污染或化学反应。
5.试剂运输将包装好的试剂放入运输箱中,根据预设的环境条件,进行试剂的运输。
运输过程中,需保证运输箱的密封性和稳定性,避免温度、湿度和震动的剧烈变化。
6.试剂检测在运输过程结束后,对试剂进行检测,评估其稳定性。
检测指标可以包括试剂的活性、纯度、保存条件等。
对于常见的体外诊断试剂,可以通过比较运输前后的检测结果,评估试剂在运输过程中的稳定性。
7.数据分析和结果评估根据试剂检测结果,进行数据分析和结果评估。
参考相关标准和规范,对运输过程中的试剂稳定性进行评价,确定是否满足要求。
8.结论和建议根据研究结果,给出相应的结论和建议。
如果试剂在运输过程中的稳定性较好,可以提出合理的运输条件和建议;如果试剂的稳定性存在问题,可以提出相应的改进措施,如调整包装材料、改善运输环境等。
体外诊断试剂产品稳定性研究
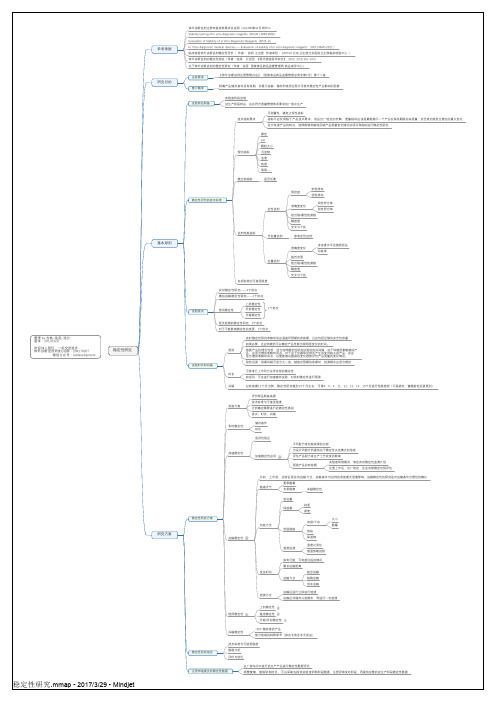
使用稳定性
上机稳定性 复溶稳定性 开瓶/开封稳定性
冻融稳定性
-20℃储存类的产品 部分地域的特殊季节(如东北地区冬天发运)
稳定性研究报告
技术标准与可接受限度 数据分析 评价与结论
注册申报提交的稳定性数据
以厂房车间中进行试生产产品进行稳定性数据评估 调整策略,缩短研制时长,可以采取先提供实验室研制阶段数据,注册评审发补阶段,再提供完整的试生产阶段稳定性数据
理化指标
颜色 pH 颗粒大小 沉淀物 浊度 纯度 等等·评价的技术标准
试剂性能指标
定性试剂 半定量试剂
质控盘
阳性样本 阴性样本
准确度变化
阴性符合率 阳性符合率
检出限/最低检测限
精密度
交叉与干扰
参考定性试剂
定量试剂 各项标准的可接受限度
准确度变化
多浓度水平定值质控品 回收率
可参考已上市同方法学试剂的稳定性 如适用,可先进行加速破坏试验,对实时稳定性进行预测
间隔
以有效期12个月为例,稳定性研究做到15个月左右,可第3、6、9、11、12、13、14、15个月进行性能检测(不是绝对,遵循前松后紧原则)
实施方案
评价样品制备来源 技术标准与可接受限度 分析确定需要进行的稳定性类别 批次、时长、间隔
线性范围
检出限/最低检测限
精密度
交叉与干扰
试验批次
实时稳定性研究——3个批次 模拟运输稳定性研究——1个批次
使用稳定性
上机稳定性 开封稳定性 开瓶稳定性
1个批次
延长效期的稳定性研究,3个批次 对于可能影响稳定性的变更,1个批次
试验时长和间隔
原则 时长
实时稳定性研究考察时间应涵盖所预期的有效期,且应包括足够的安全性余量 如果必要,还应持续到可以确定产品性能出现明显变化的时间。 根据产品的理化性质,适当选择稳定性研究试验的时间间隔,对于环境因素敏感的产 品,应适当增加考察时间点。对于由于仪器和试剂而产生的变异较大的产品,亦应 适当增加考察时间点,以便能够从数据的变化趋势评价产品质量的变化情况。 前松后紧:前期间隔可适当大一些,越接近预期的效期时,检测频次应适当增加
诊断试剂加速稳定性试验方案

Test Protocol for Accelerated Stability Test1.Test ObjectiveThe accelerated stability test is performed to determine the valid period of the Advanced Quality TM One Step Ebola Test.2.PrincipleThe test was based on the model Arrhenius Model of high temperature accelerated test. The acceleration factor is expressed as:AF=exp {(Ea/k)* [(1/Tu)-(1/Ts)]+ (RHu^n-RHs^n)},where,Ea: the start energy (eV),K: the boltzmann's constant and k=8.6*10E-5eV/K,T: the absolute temperature,RH: the relative humidity (in%) ,The subscript u: the normal state,The subscript s: was the acceleration state (e.g. Rhu ^ n referred to the n power of relative humidity under normal state),n: generally n was 2.Since the product is packed in aluminum foil bags, the humidity factor was not considered; the product is stored under 2-30℃, and the temperature of accelerated stability test is 50℃, then the acceleration factor AF = exp [(0.8 * 10 ^ 5 / 8.6) * (1 / (273 + 30) - 1 / (273 + 50))] = 6.69242, and it can be calculated that, for 24 months of valid period, the time for accelerated test at 50℃ is: 24 months/6.69242=3.586 months.3. Materials and Methods3.1 Materials3.1.1 Advanced Quality TM One Step Ebola Test, lot number:Lot #1: Lot #2: Lot #3:3.1.2 LOD quality control 1, prepared by NP antigen 1 from Wuhan Institute of Virology, CAS;LOD quality control2, prepared by NP antigen 2 (from Fitzgerald Industries):3.2 Steps3.2.1 Store the three batches of reagents at 50℃ for up to 4 months;3.2.2 When stored at 50℃ for 0 months, 1 months, 2 months, 3 months, 4 months, the three batches of reagents were tested by the quality controls, to investigate products’ performance characteristics of quality controls.3.2.3 Testing with quality controls:The test result of LOD quality control 1 was positive;The test result of LOD quality control 2 was positive;4. Test Results4.1 Test result of storage at 50℃5. Conclusions。
体外诊断试剂的稳定性试验

体外诊断试剂的稳定性试验欧洲标准(EN1364:2002)与英国标准具有同等效力(CEN——欧洲标准委员会)序言此英国标准为EN13640:2002文件官方英文版本英国制定的这个文件是在技术委员会CH/69授权下制定的。
在体外诊断这块,它负责:——帮助查询者理解文件内容——向欧洲委员会上报查询者对该文件的解释,修改建议,并保持该文件的权威。
——关注国际和欧洲的进展并在该文件中颁布。
可以技术委员会秘书处申请获得委员会列出的组织名单参考英国标准所参考的资料部分可在BSI标准的目录“国际统一标准索引”找到,或在BSI标准电子目录软件中点击“Find”就可找到。
该标准主旨不是要包揽一项合同的所有条款,使用者要正确使用该标准。
体外诊断试剂的稳定性试验此欧洲标准是欧洲委员会(CEN)2001年12月27日制定并实施的:CEN成员国必须遵守CEN内部规则,在此规则的制约下,CEN各成员国采用此欧洲标准作为本国标准,但不能对该标准作任何改动。
最新条款和参考文件可向管理中心或CEN成员国申请获得。
该标准有三种官方版本(英语、法语、德语)。
CEN成员国可以把它翻译成本国语言版本,并上报管理中心以获得认可作为本国的官方版本。
CEN成员国是执行该标准的主体,它们是:澳大利亚、比利时、捷克、丹麦、芬兰、法国、德国、希腊、冰岛、爱尔兰、意大利、卢森堡、荷兰、马尔他、葡萄牙齿、西班牙、瑞典、瑞士和英国。
前言该文件(EN13640:2002)由技术委员会(简写TC)制定。
“体外诊断医用设备”部分由DIN 主持的秘书处负责。
通过出版同一文本或签注,各国可采用欧洲标准作为本国的标准。
在2002年9月前,那些标准相违反的款项必须取消。
此文件在欧洲委员会和欧洲自由贸易组织批令下由CEN制定,该文件支持欧盟指令。
与欧盟批令的关系见附见ZA附件A和ZA只具告知性,不作要求。
此标准包括一个参考资料根据CEN内部规定,下列国家的国标准机构必须实施欧洲标准:澳大利亚、比利时等(与上页所列相同)1、适用范围该欧洲标准适用于体外诊断药品,包括试剂产品,校准仪器、标准品和试剂盒,下面简称IVD 药品。
药物稳定性加速实验

稳定性实验一、目的和要求1.了解应用化学动力学方法预测注射液稳定性的原理。
2.掌握应用恒温加速实验法测定维生素C 注射液的贮存期的方法。
二、仪器和材料仪器:恒温水浴,酸式滴定管(25ml ),锥形瓶(50~250ml )等。
材料:维生素C 注射液(2ml ∶0.25g ),0.1mol ∕L 碘液,丙酮,稀醋酸,淀粉指示液等。
三、实验内容(一)试验方法1、放样 将同一批号的V C 注射液样品(2ml ∶0.25g )分别置4个不同温度(如70、80、90和100℃)的恒温水浴中,间隔一定时间(如70℃为间隔24h ,80℃为12h,90℃为6h ,100℃为3h )取样,每个温度的间隔取样次数均为5次。
样品取出后,立即冷却或置冰箱保存,供含量测定。
2、V C 含量测定方法 精密量取样品液1ml ,置150ml 锥形瓶中,加蒸馏水15ml 与丙酮2ml ,摇匀,放置5分钟,加稀醋酸4ml 与淀粉指示液1ml,用碘液(0.1mol∕l)滴定,至溶液显蓝色并持续30秒不褪。
每1ml 碘液(0.1mol∕l)相当于8.806mg 的V C (C 6H 8O 6),分别测定各样品中的V C 的含量, 同时测定未经加热试验的原样品中V C 含量,记录消耗碘液的毫升数。
(二)实验数据处理1.数据整理 由于含量测定所用的是同一种碘液,故不必考虑碘液的精确浓度,只要比较消耗碘液的毫升数即可。
将未经加热的样品(表1-1中时间项为0)所消耗碘液的毫升数(即初始浓度)作为100%相对浓度,各加热时间内的样品所消耗碘液的毫升数与其相比,得出各自的相对浓度百分数(C 相,%)。
实验数据如表 -1。
表 -1 70℃恒温加速试验各时间内样品的测定结果2.求4种试验温度的V C 氧化降解速度常数(k 70~k 100) 用回归方法求各温度的k 值时,先将各加热时间(x )与其对应的lg(C 相,%)值(y )列表(表 -2)表16-2 加热时间及其相对浓度(%)对数值的回归计算表(70℃)用具有回归功能的计算器,将x 和y 值回归,直接得出截距,斜率和相关系。
用加速稳定性实验预测产品效期

用加速稳定性实验预测产品效期
基于阿伦尼乌斯公式(Arrhenius equation)
——EN 13640:2002 Stability testing of in vitro diagnostic reagents(体外诊断试剂的稳定性实验)
若产品在给定温度下的稳定性预测是基于阿伦尼乌斯公式,可依照以下步骤来计算效期:
1、选择在几个温度值下保存产品(如25℃、30℃、35℃、40℃、45℃等);
2、对某一温度值而言,在一系列时间段X(X1、X2、X
3、X4...),
测试出样本的对应浓度C(C1、C2、C3、C4...,浓度值也可以是相对值%,如某一温度的浓度值和4℃下检测的浓度值的比值);将浓度值转化为以10为底的对数Y(Y1、Y2、Y3、Y4...)=logC,将Y对X做直线回归,得出回归方程Y=aX+b;
3、设置定义稳定性的标准,亦设定测试出的样本浓度值的最大允许范围,将设定值转化为以10为底的对数,代入上述方程,计算出特定温度下产品的可稳定时间。
4、依次计算出各个温度值T(T1、T2、T3、T4...)下的可稳定时间S(S1、S2、S3、S4...);
5、对稳定时间取10为底的对数,得到Y(Y1、Y2、Y3、Y4...)=log(S1、S2、S3、S4...),将温度换算为绝对温度(亦摄氏度+)并取倒数X=1/T;
6、根据第五条得出的一系列X值、Y值,做直线回归,得出回归方程Y=mX+n;
7、根据上述回归方程,计算出给定的产品保存温度下(如4℃)的稳定时间,即得出产品的预测效期。
稳定性实验方案

稳定性实验方案(参考)诊断原料稳定性考核主要包括热稳定性、真实稳定性、运输稳定性及冻融稳定性四部分,工作流程如下图所示,具体方案见下文。
根据抗原和抗体进行分类,此外结合产品的用途,综合考虑上述实验内容的安排和设计,以便满足市场客户需求,合理调配公司资源。
现给出各类型开展稳定性评价分具体实验方案。
1蛋白的稳定性实验方案1.1发货蛋白的稳定性实验各项目负责人根据项目特点,确定发货的蛋白稳定性实验内容。
因为发货浓度一般都是以mg/ml作为单位,所以考核其稳定性主要是用于存放条件的确定。
考核方案以持续检测和对比实验为主,一般不开展高温热加速实验,因为高温热加速实验本身就很难保证稳定性合格,此外为了使其稳定,添加的稳定剂或类似物质后影响抗原的后期使用。
发货蛋白初始存放条件为-20℃,可以开展2-8℃稳定性对比实验。
以分别在-20℃和2-8℃条件下存放一定时间(根据项目而异),采用免疫学或适宜方法开展平行比较,以平行分析之间的差异评价蛋白是否可以存放于2-8℃条件下。
只有在2-8℃条件下评价稳定,再根据项目情况来综合考虑是否要做37℃下的热稳定性实验。
根据上述实验进一步确定发货蛋白的存放条件,以此确保在特定保存条件下的稳定性。
持续检测的实验主要目的是为了在较长时间内监测蛋白真实稳定性而开展的评价内容。
主要采用相对稳定的检测方法,对存放在特定条件下的蛋白开展的结果重现性实验。
例如:采用经过热稳定性评价合格的抗体制备的检测系统,该检测系统批间差异在理想范围内,采用该系统对考核蛋白进行持续检测,持续检测的结果在一定范围内(可以参考绘制质控图,如L-J质控图),判定为稳定性是否合格。
1.2工作条件下蛋白的稳定性实验各项目负责人根据项目特点,确定工作条件下的蛋白稳定性实验内容。
工作条件下的稳定性考核主要涉及校准品、质控品等的稳定性问题,是基于客户使用的立场开展的用途评价及相关研究。
工作重点主要是稳定性基质的筛选和评价、稳定性的持续监测等。
体外诊断试剂稳定性考察计划

产品稳定性方案1.1 稳定性研究目的稳定性作为体外诊断试剂保持产品安全有效的重要指标,对产品的生产、运输、保存和使用等环节具有重要的指导意义。
体外诊断试剂本身就是生物试剂,一些活性基团会有不同的化学不稳定性趋向,容易发生水解、酶解和氧化等反应,从而影响到试剂的质量和稳定性。
如含有多肽类的冻干粉试剂,其储存环境中的含水量和含氧量对试剂稳定性的影响非常大。
因此,稳定性研究的目的包括:①确定产品的运输、储存和开封后的保存条件;②确定产品的保存期限和开封后保存期限;③产品储存条件和保存期限等发生变更时,验证变更后的产品稳定性;④根据稳定性研究结果,评价和调整产品组方、工艺、包装材料等。
如某体外诊断试剂产品稳定性研究目的:为考察试剂盒的稳定性,对三批产品进行储存温度2~8˚C的稳定性试验、37˚C的加速稳定性试验、2~8˚C的开瓶稳定性试验、模拟运输稳定性试验等,根据试验结果确定产品的有效期、开封有效期并确定试剂盒的运输条件。
1.2 稳定性研究的材料稳定性研究的材料包括试验仪器、试验试剂(3批)、校准品、质控品等。
稳定性研究中的试验仪器应为产品的适用机型。
除试验仪器外,稳定性研究中还会用到恒温箱、冷藏柜、恒湿箱等仪器,上述仪器应定期检查,防止因为仪器的故障导致稳定性试验失败。
试验试剂应为实际生产条件下的三批试剂,并分别说明三个批次的批号,三个批次的生产工艺与质量要求均应保持一致。
试剂的包装材料应与实际储存采用的包装材料一致。
质控品、校准品等应符合产品技术要求中的相关要求。
1.3 稳定性研究的项目稳定性研究的项目应根据产品组成和方法学原理来选择评价产品质量和有效性的项目。
一般选择产品技术要求中规定的项目,如最低检测限、准确性、重复性、线性范围、特异性、阴/阳性参考品符合率等。
如果稳定性研究结果出现不符合研究方案中确定的评价指标的情况时,应进一步分析原因。
导致产品不稳定的原因可能是组分不稳定、包装材料破损或者储存、运输条件变化等因素,企业应在确定原因后采取改进措施,并在改进之后对产品重新进行稳定性研究。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Test Protocol for Accelerated Stability Test
1.Test Objective
The accelerated stability test is performed to determine the valid period of the Advanced Quality TM One Step Ebola Test.
2.Principle
The test was based on the model Arrhenius Model of high temperature accelerated test. The acceleration factor is expressed as:
AF=exp {(Ea/k)* [(1/Tu)-(1/Ts)]+ (RHu^n-RHs^n)},
where,
Ea: the start energy (eV),
K: the boltzmann's constant and k=8.6*10E-5eV/K,
T: the absolute temperature,
RH: the relative humidity (in%) ,
The subscript u: the normal state,
The subscript s: was the acceleration state (e.g. Rhu ^ n referred to the n power of relative humidity under normal state),
n: generally n was 2.
Since the product is packed in aluminum foil bags, the humidity factor was not considered; the product is stored under 2-30℃, and the temperature of accelerated stability test is 50℃, then the acceleration factor AF = exp [(0.8 * 10 ^ 5 / 8.6) * (1 / (273 + 30) - 1 / (273 + 50))] = 6.69242, and it can be calculated that, for 24 months of valid period, the time for accelerated test at 50℃ is: 24 months/6.69242=3.586 months.
3. Materials and Methods
3.1 Materials
3.1.1 Advanced Quality TM One Step Ebola Test, lot number:
Lot #1: Lot #2: Lot #3:
3.1.2 LOD quality control 1, prepared by NP antigen 1 from Wuhan Institute of Virology, CAS;
LOD quality control2, prepared by NP antigen 2 (from Fitzgerald Industries):
3.2 Steps
3.2.1 Store the three batches of reagents at 50℃ for up to 4 months;
3.2.2 When stored at 50℃ for 0 months, 1 months, 2 months, 3 months, 4 months, the three batches of reagents were tested by the quality controls, to investigate products’ performance characteristics of quality controls.
3.2.3 Testing with quality controls:
The test result of LOD quality control 1 was positive;
The test result of LOD quality control 2 was positive;
4. Test Results
4.1 Test result of storage at 50℃
Lot No.
Test result
0 month storage
1 months storage
2 months storage
3 months storage
4 months storage
5. Conclusions。
