高考化学专题13化学反应速率化学平衡考点专练3
高考化学化学反应速率与化学平衡综合练习题附答案

高考化学化学反应速率与化学平衡综合练习题附答案一、化学反应速率与化学平衡1.黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。
请回答下列问题:(1)称量样品所用的仪器为_____,将样品研细后再反应,其目的是_______。
(2)装置a的作用是________。
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气c.有利于气体混合 d.有利于观察空气流速(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)滴定时,标准碘溶液所耗体积为_________mL。
判断滴定已达终点的现象是_______。
通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____。
(填编号)(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有____________________。
【答案】电子天平使原料充分反应、加快反应速率 b、d 使反应生成的SO2全部进入d装置中,使结果精确 20.10mL 溶液恰好由无色变成浅蓝色,且半分钟内不褪色 80.4% ②空气中的CO2与Ba(OH)2反应生成BaCO3沉淀;BaSO3被氧化成BaSO4【解析】【分析】(1)根据称量黄铜矿样品1.150g,选择精确度较高的仪器;将样品研细,增大了接触面积;(2)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;(3)反应产生的二氧化硫应该尽可能的被d装置吸收;(4)根据滴定管的读数方法读出消耗碘溶液的体积,根据反应结束时的颜色变化判断滴定终点;先找出黄铜矿和二氧化硫及碘单质的关系式CuFeS2~2SO2~2I2,再根据题中数据进行计算;(5)图2中的②中通入二氧化硫,反应生成了硫酸钡沉淀,可以根据硫酸钡的质量计算二氧化硫的量;(6)Ba(OH)2溶液能吸收空气的CO2,另外BaSO3易被空气中氧气氧化,这些原因均能引起测定误差。
2020年高考化学真题-反应速率、化学平衡(习题版)

2020年高考真题反应速率、化学平衡1.(2020年浙江卷)溶液与溶液发生反应:,达到平衡。
下列说法不正确...的是( ) A .加入苯,振荡,平衡正向移动 B .经苯2次萃取分离后,在水溶液中加入,溶液呈血红色,表明该化学反应存在限度 C .加入固体,平衡逆向移动D .该反应的平衡常数2.(2020年浙江卷)一定条件下:。
在测定的相对分子质量时,下列条件中,测定结果误差最小的是( ) A .温度、压强 B .温度、压强C .温度、压强D .温度、压强3.(2020年江苏卷)CH 4与CO 2重整生成H 2和CO 的过程中主要发生下列反应1422CH (g)CO (g)2H (g)2CO(g)247.1kJ mol H -+=+∆=⋅ 1222H (g)CO (g)H O(g)CO(g)41.2kJ mol H -+=+∆=⋅在恒压、反应物起始物质的量比()()42CH :CO 1:1nn =条件下,CH 4和CO 2的平衡转化率随温度变化的曲线如图所示。
下列有关说法正确的是A .升高温度、增大压强均有利于提高CH 4的平衡转化率B .曲线B 表示CH 4的平衡转化率随温度的变化C .相同条件下,改用高效催化剂能使曲线A 和曲线B 相重叠D .恒压、800K 、n(CH 4):n(CO 2)=1:1条件下,反应至CH 4转化率达到X 点的值,改变除温度外的特定条件继续反应,CH 4转化率能达到Y 点的值4.(2020年天津卷)已知()2+26Co H O ⎡⎤⎣⎦呈粉红色,[]24CoCl -呈蓝色,[]2-4ZnCl 为无色。
现将CoCl 2溶于水,加入浓盐酸后,溶液由粉红色变为蓝色,存在以下平衡:()[]2+2--2426Co H O +4Cl CoCl +6H O ΔH ⎡⎤⎣⎦,用该溶液做实验,溶液的颜色变化如下:以下结论和解释正确的是A .等物质的量的()2+26Co H O ⎡⎤⎣⎦和[]2-4CoCl 中σ键数之比为3:2B .由实验①可推知△H <0C .实验②是由于c (H 2O)增大,导致平衡逆向移动D .由实验③可知配离子的稳定性:[][]2-2-44ZnCl >CoCl5.(2020年新课标Ⅲ)二氧化碳催化加氢合成乙烯是综合利用CO 2的热点研究领域。
高考化学专题复习——化学反应速率与化学平衡

化学反应速率化学平衡两个问题:第一、化学反应进行的快慢即化学反应速率问题;第二、化学反应进行的程度即化学平衡问题一、化学反应速率1.表示方法(1)概念:化学反应速率通常用单位时间内反应物浓度的减小或生成物浓度的增加来表示(2)公式:v=△c/△t单位:mol/(L·s)或mol/(L·min)(3)注意事项:①由于反应过程中,随着反应的进行,物质的浓度不断地发生变化(有时温度等也可能变化),因此在不同时间内的反应速率是不同的。
通常我们所指的反应速率是指平均速率而非瞬时速率。
②同一化学反应的速率可以用不同物质浓度的变化来表示,其数值不一定相同,但其意义相同。
其数值之比等于化学计量数之比。
对于反应:m A+n B p C+q DV A∶V B∶V C∶V D=m∶n∶p∶q③一般不能用固体物质表示。
④对于没有达到化学平衡状态的可逆反应:v正≠v逆[例1]某温度时,2L容器中X、Y、Z三种物质的量随时间的变化如图所示。
由图中数据分析,该反应的化学方程式为___3X + Y2Z___;反应开始至2min ,Z的平均反应速率为___0.05 mol/(L·min)__。
[例2]在2A + B = 3C + 4D的反应中, 下列表示该反应的化学反应速率最快的是(B )A. V(A) = 0.5 mol/(L·s)B. V(B) = 0.3 mol/(L·s)C. V(C) = 0.8 mol/(L·s)D. V(D) = 1 mol/(L·s)练习1反应4A(S)+3B(g)==2C(g)+D(g),经2min,B的浓度减少了0.6mol/L.。
此反应速率的表示正确的是()A.用A表示的反应速率是0.4mol/L·minB.用C表示的速率是0.2mol/L·minC.在2 min末的反应速率,用B表示是0.3mol/L·minD.在2 min内用B和C表示的反应速率的值都是逐渐减少的。
高考化学专题题库∶化学反应速率与化学平衡的综合题及详细答案

高考化学专题题库∶化学反应速率与化学平衡的综合题及详细答案一、化学反应速率与化学平衡1.某校化学课外兴趣小组为了探究影响化学反应速率的因素,做了以下实验。
(1)用三支试管各取5.0 mL、0.01 mol·L-1的酸性KMnO4溶液,再分别滴入0.1 mol·L-1 H2C2O4溶液,实验报告如下。
①实验1、3研究的是_________对反应速率的影响。
②表中V=_________mL。
(2)小组同学在进行(1)中各组实验时,均发现该反应开始时很慢,一段时间后速率会突然加快。
对此该小组的同学展开讨论:①甲同学认为KMnO4与H2C2O4的反应放热,温度升高,速率加快。
②乙同学认为随着反应的进行,因_________,故速率加快。
(3)为比较Fe3+、Cu2+对H2O2分解的催化效果,该小组的同学又分别设计了如图甲、乙所示的实验。
回答相关问题:①装置乙中仪器A的名称为_________。
②定性分析:如图甲可通过观察反应产生气泡的快慢,定性比较得出结论。
有同学提出将CuSO4溶液改为CuCl2溶液更合理,其理由是____________________________________。
③定量分析:如图乙所示,实验时以收集到40 mL气体为准,忽略其他可能影响实验的因素,实验中需要测量的数据是_______________。
【答案】温度 4.0产物Mn2+可能对该反应具有催化作用分液漏斗控制阴离子相同,排除阴离子的干扰收集40mL气体所需时间【解析】【分析】(1)①、②作对比实验分析,其他条件相同时,只有一个条件的改变对反应速率的影响;(2)探究反应过程中反应速率加快的原因,一般我们从反应放热,温度升高,另一个方面从反应产生的某种物质可能起到催化作用;(3)比较Fe3+、Cu2+对H2O2分解的催化效果,阳离子不同,尽量让阴离子相同,减少阴离子不同造成的差别,催化效果可以从相同时间内收集气体体积的多少或者从收集相同体积的气体,所需时间的长短入手。
高三化学高考备考二轮复习专题——化学反应速率与化学平衡训练

2022年高考化学二轮复习特色专题——化学反应速率与化学平衡一、单选题1.(2022·四川·南部县第二中学高二阶段练习)在恒容的密闭容器中发生反应()()()3A g +B s 2C g △H ,不同温度下反应经过相同时间,测得混合体系中A 的体积分数与温度的关系如图所示。
下列推断正确的是A .X 、Z 两点,A 的逆反应速率相等B .温度不变,平衡后充入氦气,C 的体积分数减小 C .降低温度,化学平衡常数增大D .X 、Y 、Z 三点中,Z 点A 的转化率最大2.(2022·湖北宜昌·高二阶段练习)在催化剂作用下,向体积不变的密闭容器中按物质的量比1△1充入甲醇和异丁烯(用R 表示),分别在T 1和T 2两个温度下发生反应生成有机物W :()()()3CH OH g R g W g +ΔH 。
异丁烯的转化率随时间的变化关系如图所示。
下列说法正确的是A .12T >T ,ΔH>0B .()()()正正正v M =v B >v AC .维持2T 不变,再向容器中充入1molW ,新平衡时W 的百分含量增大D .当()()3n CH OH =n R 时,说明该化学反应已经达到平衡3.(2022·河北保定·高三阶段练习)气相离子催化剂(+Fe 、+Co 、+Mn 等)具有优良的催化效果。
其中在气相+Fe 催化下,乙烷发生氧化反应的机理如图所示(图中虚线为副反应)。
下列说法错误的是A .主反应为+Fe332322CH CH +2N O CH CHO+2N +H O −−→B .副反应为+Fe 332252CH CH +N O C H OH+N −−→C .每生成31mol CH CHO ,消耗2N O 的物质的量为2molD .+FeO 、()+25C H Fe(OH)⎡⎤⎣⎦、()+24C H Fe ⎡⎤⎣⎦、 均为反应中间体4.(2022·浙江温州·二模)相同的温度和压强下,有关下列两个反应的说法不正确...的是 反应1ΔH/kJ mol -⋅Δn11ΔS/J K mol --⋅⋅32MgCO (s)MgO(s)CO (g)=+ 117.6 1a32CaCO (s)CaO(s)CO (g)=+177.91 b注:△其中Δn 表示反应方程式中气体化学计量数差;△ΔH-T ΔS<0的反应方向自发A .因为Δn 相同,所以a 与b 大小相近 B .热分解温度:33MgCO (s)CaCO (s)>C .[][]33a-b=S[MgO(s)]+S CaCO (s)-S MgCO (s)-S[CaO(s)]D .两个反应在不同温度下的ΔH 和Δn 都大于零5.(2022·江苏江苏·二模)甲烷双重整制备合成气(CO 和H 2)包括了水蒸气重整(反应I)和二氧化碳重整(反应△)两个反应。
2020-2021高考化学专题训练---化学反应速率与化学平衡的综合题分类附答案
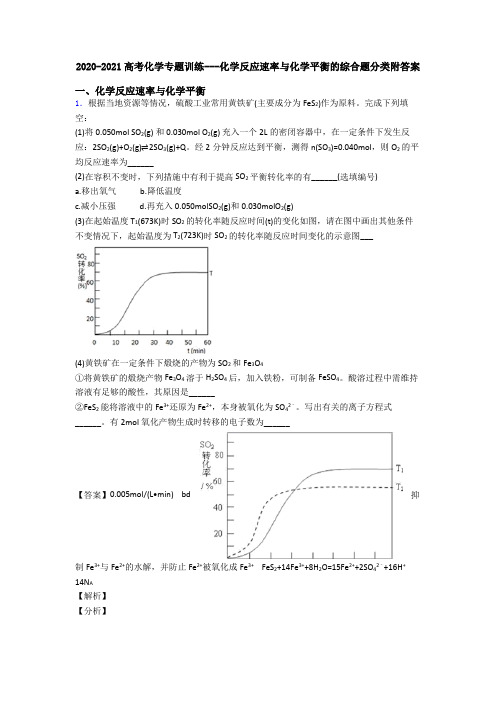
2020-2021高考化学专题训练---化学反应速率与化学平衡的综合题分类附答案一、化学反应速率与化学平衡1.根据当地资源等情况,硫酸工业常用黄铁矿(主要成分为FeS2)作为原料。
完成下列填空:(1)将0.050mol SO2(g) 和0.030mol O2(g) 充入一个2L的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)⇌2SO3(g)+Q。
经2分钟反应达到平衡,测得n(SO3)=0.040mol,则O2的平均反应速率为______(2)在容积不变时,下列措施中有利于提高SO2平衡转化率的有______(选填编号)a.移出氧气b.降低温度c.减小压强d.再充入0.050molSO2(g)和0.030molO2(g)(3)在起始温度T1(673K)时SO2的转化率随反应时间(t)的变化如图,请在图中画出其他条件不变情况下,起始温度为T2(723K)时SO2的转化率随反应时间变化的示意图___(4)黄铁矿在一定条件下煅烧的产物为SO2和Fe3O4①将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。
酸溶过程中需维持溶液有足够的酸性,其原因是______②FeS2能将溶液中的Fe3+还原为Fe2+,本身被氧化为SO42﹣。
写出有关的离子方程式______。
有2mol氧化产物生成时转移的电子数为______【答案】0.005mol/(L•min) bd 抑制Fe3+与Fe2+的水解,并防止Fe2+被氧化成Fe3+ FeS2+14Fe3++8H2O=15Fe2++2SO42﹣+16H+14N A【解析】【分析】(1)根据v=ct∆∆求出氧气的速率,然后根据速率之比等于对应物质的化学计量数之比计算;(2)反应放热,为提高SO2平衡转化率,应使平衡向正反应方向移动,可降低温度,体积不变,不能从压强的角度考虑,催化剂不影响平衡移动,移出氧气,平衡向逆反应方向移动,不利于提高SO2平衡转化率,由此分析解答;(3)反应是放热反应,温度升高,平衡逆向进行,二氧化硫的转化率减小,但达到平衡所需要的时间缩短,据此画出曲线;(4)①Fe3+与Fe2+易水解,Fe2+易被氧化成Fe3+;②根据氧化还原反应中的反应物和生成物几何电子守恒来配平化学方程式,结合方程计算转移电子数。
高考化学反应速率、化学平衡考点汇总

1化学反应速率1化学反应速率基本概念用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
常用单位为mol·(L·s)-1或mol·(L·min)-1说明:(1)固体、纯液体在反应中可视为浓度不变,故一般不用固体或纯液体表示反应速率。
(2)反应速率一般是指某段时间内的平均速率,非即时速率,不能为负数。
2化学反应速率的规律同一反应,用不同物质表示的速率之比,等于化学方程式中化学计量数之比。
【方法点击】近几年的高考题,在涉及化学反应速率的知识点时,主要是利用化学反应速率的规律,完成下述要求:1.在一个反应中,由一种物质的反应速率,换算为其他物质的反应速率。
2.比较同一反应在不同的条件下,用不同物质表示的反应速率的相对大小。
3.由速率之比写出有关方程式现举例说明如下:例:反应A+3B==2C+2D在四种不同情况下的反应速率分别为:v(A)=0.15 mol·L-1·s-1 、v(B)=0.6 mol·L-1·s-1 、v(C)=0.4 mol·L-1·s-1 、v(D)=60 mol·L-1·min-1 其中表示反应最快的是。
解析:首先统一单位v(D)=60 mol·L-1·min-1 =1 mol·L-1·s-1根据v(A)︰v(B)︰v(C)︰v(D)=1∶3∶2∶2,将四种物质的反应速率,均除以化学方程式中各自前边的化学计量数:=0.15 mol·L-1·s-1 、=0.2 mol·L-1·s-1 、=0.2 mol·L-1·s-1 、=0.5 mol·L-1·s-1 。
可见选D。
判断反应速率的大小,必须考虑各物质的反应计量数,再进行比较,同时还要注意保持单位的统一。
查补易混易错13化学反应机理2023年高考化学三轮冲刺过关(全国通用)(原卷版)

查补易混易错13 化学反应机理化学反应机理试题以图示的形式来描述某一化学变化所经由的全部反应,就是把一个复杂反应分解成若干个反应,然后按照一定规律组合起来,从而达到阐述复杂反应的内在联系的目的,这类试题符合新课标的理念,“源于教材而高于教材”,体现了化学核心素养中的宏观辨识与微观探析,从不同层次认识物质的多样性,以及由微观和宏观相结合的视角分析和解决实际问题,在备考过程中要给予高度重视与关注。
易错01反应机理(1)反应机理是用来描述某反应物到反应产物所经由的全部基元反应,就是把一个复杂反应分解成若干个基元反应,以图示的形式来描述某一化学变化所经由的全部反应,然后按照一定规律组合起来,从而阐述复杂反应的内在联系,以及总反应与基元反应内在联系。
(2)反应机理详细描述了每一步转化的过程,包括过渡态的形成,键的断裂和生成,以及各步的相对速率大小等。
典型的是基元反应碰撞理论和基元反应过渡态理论。
(3)反应机理中包含的基元反应是单分子反应或双分子反应。
完整的反应机理需要考虑到反应物、催化剂、反应的立体化学、产物以及各物质的用量。
(4)认识化学反应机理,任何化合物的每一步反应都应该是在该条件下此类化合物的通用反应。
易错02有效碰撞理论(1)化学反应发生的条件:在化学反应中,反应物分子不断发生碰撞,大多数碰撞无法发生反应,只有少数分子的碰撞才能发生化学反应,能发生有效碰撞的分子是活化分子。
普通反应物分子形成活化分子所需要的能量叫活化能。
而活化分子的碰撞也不一定都能发生有效碰撞。
发生有效碰撞不仅有能量的因素,还有空间因素,只有同时满足这两者的要求才能发生有效碰撞。
(2)反应历程:发生有效碰撞的分子叫做活化分子,活化分子具有较高的能量。
活化分子比普通分子所高出的能量称为活化能。
活化能越小,普通分子就越容易变成活化分子。
如图所示,反应的活化能是E1,反应热是E1-E2。
在一定条件下,活化分子所占的百分数是固定不变的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题13 化学反应速率化学平衡1.一定温度下,在1 L恒容密闭容器中加入1 mol的N2(g)和3 mol H2(g)发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,NH3的物质的量与时间的关系如表所示,下列说法错误的是( )时间/min 0 t1t2t3NH3物质的量/mol 0 0.2 0.3 0.3A.0~t1 min,v(NH3)=0.2/t1mol·L-1·min-1B.升高温度,可使正反应速率减小,逆反应速率增大,故平衡逆向移动C.N2(g)+3H2(g)2NH3(g)的活化能小于2NH3(g)N2(g)+3H2(g)的活化能D.t3 min时再加入1 mol的N2(g)和3 mol H2(g),反应达到新平衡时,c(N2)>0.85 mol·L-1【答案】B2.现有a、b、c三个容器,a容器恒容恒温,b容器恒压恒温,c容器恒容绝热。
在三个容器中各充入1molI2(g)和2molH 2发生反应I2(g) + H2(g)2HI(g) ΔH<0,初始时三个容器的体积和温度均相等,则反应达到平衡后,三个容器中I2(g)的转化率的大小关系是A.a=b>c B.b>a>c C.c>b>a D.a=b<c【答案】A【解析】该反应为反应前后气体的体积不变的放热反应,增大压强平衡不移动,a容器恒容恒温,b容器恒压恒温,由于压强对平衡无影响,则I2(g)的转化率的大小关系是a=b,正反应为放热反应,升高温度平衡逆向移动,c容器恒容绝热,则温度高于a、b,则a=b>c,故选A。
9.在容积一定的密闭容器中,进行可逆反应A(g)+2B(g) C(g) +D(g),有图Ⅰ、Ⅱ所示的反应曲线,下列说法中不正确...的是()A.正反应是放热反应B.P1<P2C.若P3<P4,y轴表示A的转化率D.若P3>P4,y轴表示C的体积分数【答案】C10.室温下,向圆底烧瓶中加入1 molC2H5OH和含1molHBr的氢溴酸,溶液中发生反应;C2H5OH+HBrC2H5Br+H2O,充分反应后达到平衡。
已知常压下,C2H5Br和C2H5OH的沸点分别为38.4℃和78.5℃。
下列有关叙述错误的是A.加入NaOH,可增大乙醇的物质的量B.增大HBr浓度,有利于生成C2H5BrC.若反应物增大至2 mol,则两种反应物平衡转化率之比不变D.若起始温度提高至60℃,可缩短反应达到平衡的时间【答案】D【解析】A.加入NaOH,中和HBr,平衡逆向移动,可增大乙醇的物质的量。
选项A正确。
B.增大HBr浓度,平衡正向移动,有利于生成C2H5Br。
选B正确。
C.若反应物增大至2 mol,实际上就是将反应的浓度都增大至原来的2倍,比例不变(两次实验反应物的比例都是1:1,等于方程式中的系数比),这里有一个可以直接使用的结论:只要反应物的投料比等于系数比,达平衡时反应物的转化率一定是相等的。
所以两种反应物的转化率一定是1:1。
选项C正确。
D.若起始温度提高至60℃,考虑到HBr是挥发性酸,在此温度下会挥发出去,降低HBr的浓度减慢速率,增加了反应时间,D错误。
13.(题文)一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g)2SO3(g)(正反应放热),测得反应的相关数据如下:下列说法正确的是A.v1< v2,c2< 2c1 B.K1> K3,p2> 2p3C.v1< v3,α1(SO2) >α3(SO2 ) D.c2> 2c3,α2(SO3)+α3(SO2 )<1【答案】CD14.采用N2O5为硝化剂是一种新型的绿色硝化技术,在含能材料、医药等工业中得到广泛应用。
回答下列问题(1)1840年 Devil用干燥的氯气通过干燥的硝酸银,得到N2O5。
该反应的氧化产物是一种气体,其分子式为___________。
(2)F.Daniels等曾利用测压法在刚性反应器中研究了25℃时N2O5(g)分解反应:其中NO2二聚为N2O4的反应可以迅速达到平衡。
体系的总压强p随时间t的变化如下表所示(t=∞时,N2O5(g)完全分解):t/min 040 80 160 260 1300 1700 ∞p/kPa 35.8 40.3 42.5. 45.9 49.2 61.2 62.3 63.1①已知:2N2O5(g)=2N2O4(g)+O2(g) ΔH1=−4.4 kJ·mol−12NO2(g)=N2O4(g) ΔH 2=−55.3 kJ·mol−1则反应N2O5(g)=2NO2(g)+ O2(g)的ΔH=_______ kJ·mol−1。
②研究表明,N2O5(g)分解的反应速率。
t=62 min时,测得体系中p O2=2.9 kPa,则此时的=________kPa,v=_______kPa·min−1。
③若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)____63.1 kPa(填“大于”“等于”或“小于”),原因是________。
④25℃时N2O4(g)2NO2(g)反应的平衡常数K p=_______kPa(K p为以分压表示的平衡常数,计算结果保留1位小数)。
(3)对于反应2N2O5(g)→4NO2(g)+O2(g),R.A.Ogg提出如下反应历程:第一步 N2O5NO2+NO3快速平衡第二步 NO2+NO3→NO+NO2+O2慢反应第三步 NO+NO3→2NO2快反应其中可近似认为第二步反应不影响第一步的平衡。
下列表述正确的是_______(填标号)。
A.v(第一步的逆反应)>v(第二步反应)B.反应的中间产物只有NO3C.第二步中NO2与NO3的碰撞仅部分有效D.第三步反应活化能较高【答案】O253.1 30.0 6.0×10-2大于温度提高,体积不变,总压强提高;NO2二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高 13.4 AC③由于温度升高,容器容积不变,总压强提高,且二氧化氮二聚为放热反应,温度提高,平衡左移,体系物质的量增加,总压强提高,所以若提高反应温度至35℃,则N2O5(g)完全分解后体系压强p∞(35℃)大于63.1 kPa。
④根据表中数据可知五氧化二氮完全分解时的压强是63.1kPa,根据方程式可知完全分解时最初生成的二氧化氮的压强是35.8kPa×2=71.6 kPa,氧气是35.8kPa÷2=17.9 kPa,总压强应该是71.6 kPa+17.9 kPa =89.5 kPa,平衡后压强减少了89.5 kPa-63.1kPa=26.4kPa,所以根据方程式2NO2(g)N2O4(g)可知平衡时四氧化二氮对应的压强是26.4kPa,二氧化氮对应的压强是71.6 kPa-26.4kPa×2=18.8kPa,则反应的平衡常数。
(3)A、第一步反应快,所以第一步的逆反应速率大于第二步的逆反应速率,A正确;B、根据第二步和第三步可知中间产物还有NO,B错误;17.近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。
回答下列问题:(1)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是_________(填标号)。
A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以B.氢硫酸的导电能力低于相同浓度的亚硫酸C.0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1D.氢硫酸的还原性强于亚硫酸(2)下图是通过热化学循环在较低温度下由水或硫化氢分解制备氢气的反应系统原理。
通过计算,可知系统(Ⅰ)和系统(Ⅱ)制氢的热化学方程式分别为______________、______________,制得等量H2所需能量较少的是_____________。
(3)H2S与CO2在高温下发生反应:H2S(g)+CO2(g)COS(g) +H2O(g)。
在610 K时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,反应平衡后水的物质的量分数为0.02。
①H2S的平衡转化率=_______%,反应平衡常数K=________。
②在620 K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率_____,该反应的H_____0。
(填“>”“<”或“=”)③向反应器中再分别充入下列气体,能使H2S转化率增大的是________(填标号)A.H2S B.CO2 C.COS D.N2【答案】 D H2O(l)=H2(g)+1/2O2(g) ΔH=+286 kJ/mol H2S(g)=H2(g)+S(s) ΔH=+20 kJ/mol 系统(II)2.5 2.8×10–3 > > B(2)设反应的H2S物质的量为x,由题意列三段式得:因为反应平衡后水的物质的量分数为0.02,所以=0.02,解得x=0.01;①H2S的平衡转化率α1=0.01÷0.40×100%=2.5%;反应平衡常数K=≈2.849×10-3(或2.8×10-3或2.85×10-3)。
②由已知,升温,水的物质的量分数增大,所以升温时平衡正向移动,故α2>α1,ΔH>0。
③A项,再充入H2S,平衡正向移动,使CO2转化率增大,根据化学平衡移动原理,H2S的转化率减小,故A 错误;B项,再充入CO2,平衡正向移动,在不改变H2S初始量的前提下,使H2S转化率增大,故B正确;C 项,再充入COS,平衡逆向移动,使H2S的转化率减小,故C错误;D项,再充入N2,与该反应无关,平衡不移动,H2S的转化率不变,故D错误。
综上选B。
18.丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。
回答下列问题:(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:①C4H10(g)= C4H8(g)+H2(g) ΔH1已知:②C4H10(g)+ 12O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1③H2(g)+ 12O2(g)= H2O(g) ΔH3=-242kJ·mol-1反应①的ΔH1为________ kJ·mol-1。
图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
