有机人名反应韩奇反应
人名反应及常见反应(H-J)
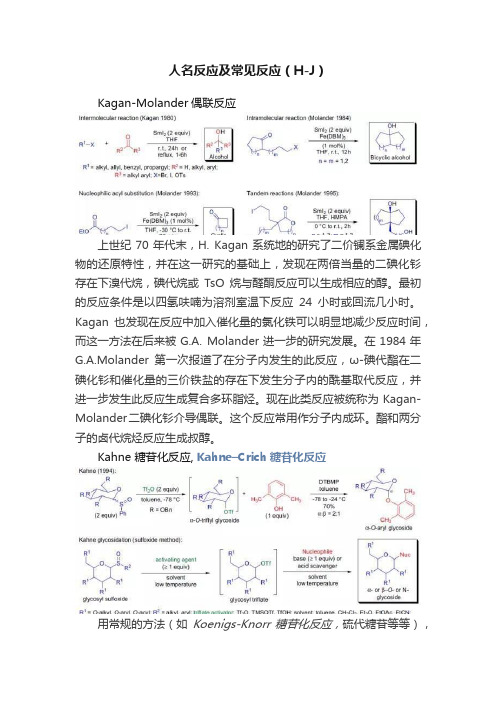
人名反应及常见反应(H-J)Kagan-Molander偶联反应上世纪70年代末,H. Kagan系统地的研究了二价镧系金属碘化物的还原特性,并在这一研究的基础上,发现在两倍当量的二碘化钐存在下溴代烷,碘代烷或TsO烷与醛酮反应可以生成相应的醇。
最初的反应条件是以四氢呋喃为溶剂室温下反应24小时或回流几小时。
Kagan也发现在反应中加入催化量的氯化铁可以明显地减少反应时间,而这一方法在后来被G.A. Molander进一步的研究发展。
在1984年G.A.Molander第一次报道了在分子内发生的此反应,ω-碘代酯在二碘化钐和催化量的三价铁盐的存在下发生分子内的酰基取代反应,并进一步发生此反应生成复合多环脂烃。
现在此类反应被统称为Kagan-Molander二碘化钐介导偶联。
这个反应常用作分子内成环。
酯和两分子的卤代烷烃反应生成叔醇。
Kahne 糖苷化反应, Kahne–Crich糖苷化反应用常规的方法(如Koenigs-Knorr糖苷化反应,硫代糖苷等等),从位阻较大的糖或活性较低的糖制备糖苷是很困难的。
直到1989年,D.Kahne及其课题组发现了一种新的制备糖苷的方法,他们将糖基亚砜和三氟甲磺酸酐溶于甲苯中,降至低温,加入一些亲核试剂(如醇,酚或胺)的甲苯溶液,反应得到相应的O-或N-糖苷。
可以在没有邻基参与的情况下可以得到α-立体选择性的产物或在没有化学助剂的情况下得到β-立体选择性的产物。
通过活化的糖基亚砜制备高立体选择性的O-, S-,或N-糖苷的反应被称为Kahne糖苷化反应(亚砜法)。
Keck自由基烯丙基化反应G.E. Keck及其团队在全合成perhydrohistrionicotoxin的过程中,遇到了将卤素置换为烯丙基的问题,他们通过卤代烃和烯丙基三丁基锡进行自由基反应很好的解决了此难题。
此反应在催化量的AIBN作为自由基引发剂在80℃的苯中进行。
此报道之后,卤代烃和烯丙基三丁基锡在自由基条件下偶联烯丙基化的反应被称为Keck自由基烯丙基化反应。
有机化学人名反应

有机化学人名反应
1. Friedel-Crafts反应:由Charles Friedel和James Crafts于1877年首次报道的一种重要的有机化学反应。
2. Grignard反应:法国化学家Victor Grignard于1900年发现的一种有机合成反应。
3. Wolff-Kishner还原反应:德国化学家Kurt Heinrich Wolff和美国化学家Morris Kishner于1913年和1919年分别发现的一种有机还原反应。
4. Birch还原反应:澳大利亚化学家Arthur John Birch于1944年发现的一种有机化学反应。
5. Cannizzaro反应:意大利化学家Stanislao Cannizzaro于1853年发现的一种有机化学反应。
6. Gabriel重氮化反应:德国化学家Siegmund Gabriel于1887年发现的一种有机化学反应。
7. Wurtz反应:法国化学家Charles Adolphe Wurtz于1855年发现的一种有机化学反应。
8. Fries重排反应:德国化学家Karl Fries于1887年发现的一种有机化学反应。
9. Hofmann消去反应:德国化学家August Wilhelm von
Hofmann于1865年发现的一种有机化学反应。
10. Robinson环加成反应:英国化学家Robert Robinson于1925年发现的一种有机化学反应。
有机人名反应——机理及合成应用

有机人名反应——机理及合成应用有机化学里,有一个有趣的领域叫做“人名反应”,听到这个名字是不是觉得有点像是某种神秘的仪式?其实,人名反应是指那些以某个人名命名的经典化学反应。
就像有人给你起个外号,化学家们也给这些反应起了名字,以纪念那些对化学有重大贡献的前辈。
今天我们就来聊聊这些反应的机理以及它们在合成中的应用,让大家对这个领域有个直观的了解。
1. 有机人名反应的机理1.1 什么是机理?简单来说,机理就是解释化学反应为什么会这样发生的故事。
就像你在看一部悬疑剧时,想知道凶手怎么作案一样,化学家们也想弄清楚反应的“幕后黑手”是什么。
机理告诉我们每一步反应过程中的分子怎么舞动,反应怎么一步步进行,就像揭开了化学反应的神秘面纱。
1.2 经典人名反应的机理我们先从最著名的几个反应说起吧,比如费林反应(FriedelCrafts反应)和迈克尔加成反应。
费林反应是由化学家费林(Friedel)和克拉夫茨(Crafts)一起开发的,它主要用来生成芳香族化合物的衍生物。
简单来说,就是把一个芳香环(比如苯)跟一个其他的基团结合起来,形成新化合物。
这就好比把你喜欢的几个菜肴混合在一起,变成一道新的美味。
迈克尔加成反应就像是个“组合拳”,它把两个分子合并,形成一个新的结构。
具体来说,它是一种加成反应,其中一个分子上的亲电中心(可以理解成化学反应中的“吸引力中心”)和另一个分子的亲核中心(“发射点”)发生反应。
这个过程有点像一个化学版的“双簧”——需要两个分子之间的默契配合,才能奏效。
2. 有机人名反应的合成应用2.1 药物合成中的应用说到应用,那可真是五花八门。
药物合成中,有机人名反应简直就是神兵利器。
比如说,某些复杂的药物分子可以通过这些反应合成出来,像阿莫西林这样的抗生素就是通过特定的反应步骤制作的。
想象一下,你要制作一款超级复杂的料理,怎么做呢?得有可靠的食谱和技巧对吧?化学家们也是如此,他们用这些反应作为合成的“食谱”,让复杂的药物分子得以顺利生成。
人名反应药物合成反应中主要的人名反应
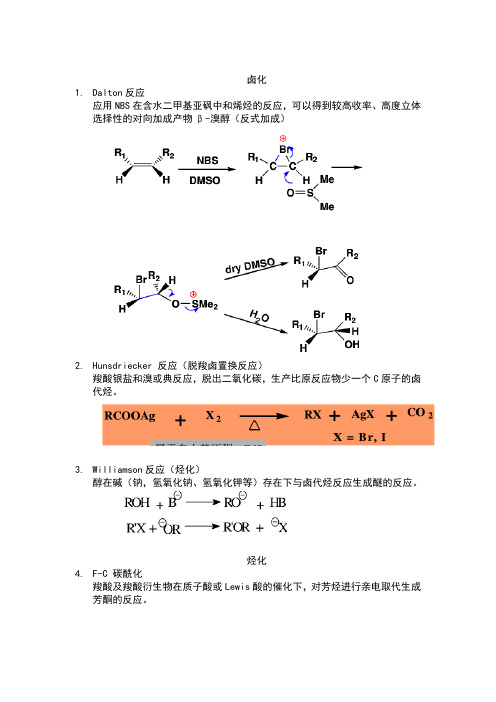
卤化1.Dalton反应应用NBS在含水二甲基亚砜中和烯烃的反应,可以得到较高收率、高度立体选择性的对向加成产物β-溴醇(反式加成)2.Hunsdriecker 反应(脱羧卤置换反应)羧酸银盐和溴或典反应,脱出二氧化碳,生产比原反应物少一个C原子的卤代烃。
3.Williamson反应(烃化)醇在碱(钠,氢氧化钠、氢氧化钾等)存在下与卤代烃反应生成醚的反应。
烃化4.F-C 碳酰化羧酸及羧酸衍生物在质子酸或Lewis酸的催化下,对芳烃进行亲电取代生成芳酮的反应。
酰化1.Gattermann反应羟基或烷氧基取代的芳烃在ZnCl2,AlCl3等Lewis酸的催化下与氰化氢和氯化氢反应,生成亚胺盐酸盐,在经水解生成相应的芳醛的反应。
2.Vilsmeier-Haack反应3.Reimer-tiemann反应4.Claisen和Dieckmann反应缩合1.Claisen-Schmidt反应2.Prins反应3.安息香缩合4.Blanc反应(氯甲基化)5.Mannich反应(氨甲基化)反应机理6.β-羟烷基化反应7. Michael反应8.Wittg反应9.羧基α活性亚甲基反应10.α,β-环氧化烷基化反应(Darens反应)11.D-A反应重排12.13.Pinacol重排14.B-B-Z重排15.Favorskii重排16.Beckmann重排17.Hofmann重排18.Stevens重排19.Sommelet-hauser重排20.Claisen重排还原21.Clemansen还原22.黄明龙反应23.氨基保护剂还有Boc。
[VIP专享]有机化学人名反应机理(比较完整)
![[VIP专享]有机化学人名反应机理(比较完整)](https://img.taocdn.com/s3/m/ff50b6f1a45177232e60a211.png)
1.Arbuzov 反应一般认为是按SN2 进行的分子内重排反应:2.Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
3.Baeyer----Villiger 反应过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为:4. Beckmann 重排在酸作用下,肟首先发生质子化,然后脱去一分子水,同时与羟基处于反位的基团迁移到缺电子的氮原子上,所形成的碳正离子与水反应得到酰胺。
迁移基团如果是手性碳原子,则在迁移前后其构型不变。
5.Bouveault---Blanc 还原脂肪族羧酸酯可用金属钠和醇还原得一级醇。
α,β-不饱和羧酸酯还原得相应的饱和醇。
6.Bucherer 反应萘酚及其衍生物在亚硫酸或亚硫酸氢盐存在下和氨进行高温反应,可得萘胺衍生物,反应是可逆的。
7.Cannizzaro 反应凡α位碳原子上无活泼氢的醛类和浓NaOH或KOH水或醇溶液作用时,不发生醇醛缩合而起歧化反应生成与醛相当的酸(成盐)及醇的混合物。
此反应的特征是醛自身同时发生氧化及还原作用,一分子被氧化成酸的盐,另一分子被还原成醇:脂肪醛中,只有甲醛和与羰基相连的是一个叔碳原子的醛类,才会发生此反应,其他醛类与强碱液,作用发生醇醛缩合或进一步变成树脂状物质。
醛首先和氢氧根负离子进行亲核加成得到负离子,然后碳上的氢带着一对电子以氢负离子的形式转移到另一分子的羰基不能碳原子上。
有机人名反应、试剂与规则

有机人名反应、试剂与规则
有机化学是研究含碳分子结构、性质和反应的科学,它以有机分子的命名、合成和应用为主要内容。
有机人名反应、试剂与规则是有机化学中的重要内容,它们为有机化学家们提供了一种通用的语言和方法,使得大家可以更好地理解、记忆和应用有机化学知识。
本文将介绍有机人名反应、试剂与规则的基本概念和应用。
一、有机人名反应
有机人名反应是以人名命名的有机反应,通常因为其发现者、发展者、研究者的名字而得名。
有机人名反应是有机化学中的重要内容之一,它们被广泛应用于有机合成和有机反应机理的研究中。
常见的有机人名反应有:Diels-Alder 反应、Wittig 反应、Aldol 反应、Grignard 反应等。
二、有机试剂
有机试剂是指在有机合成中所使用的化学试剂,通常需要具有高纯度、高活性和低毒性等特点。
有机试剂的种类繁多,包括有机金属试剂、有机酸试剂、有机碱试剂、有机卤素试剂等。
有机试剂的选择和使用应遵循安全、经济、环保和高效的原则。
三、有机命名规则
有机命名规则是指有机化合物的命名方法和规则。
有机化合物的命名一般遵循以下步骤:1、确定基团;2、确定主链;3、编号主链;
4、确定取代基和它们的位置;
5、给取代基编号;
6、组合,写出名字。
常见的有机命名规则有:IUPAC 命名法、常用名称命名法等。
总之,有机人名反应、试剂与规则是有机化学中不可或缺的内容,它们为有机化学的研究、应用和发展提供了重要的支撑和指导。
我们应该学好有机人名反应、试剂与规则,掌握有机化学的基本概念和原理,以更好地理解、应用和创造有机化学知识。
有机人名反应——机理及合成应用
有机人名反应——机理及合成应用1. 引言:有机反应的魅力大家好,今天我们聊聊有机化学中的一个特别的玩意儿——有机人名反应。
听名字就有点儿高大上对吧?其实说白了,就是那些化学反应背后,有一群化学大咖的名字在闪闪发光。
别急着打哈欠,这些反应可是有着很酷的故事和广泛的应用哦!这些反应背后的机理复杂得像迷宫,但如果你愿意跟我走一遭,我们就能一起揭开这些化学秘密的面纱,了解它们如何在实验室里翻云覆雨,甚至在我们的生活中大显神威。
2. 有机人名反应的基本概念2.1 反应的定义和背景有机人名反应,其实就是那些以化学家的名字命名的反应。
这些反应都是有着超高应用价值的,有的能帮我们合成药物,有的能让我们制造新材料。
每一个反应背后都有一个动人的故事,像是你听过的那些传奇人物一样。
比如,有个叫做“DielsAlder反应”的家伙,就是由两位化学大神的名字组合而成的。
他们发明的这个反应,可以帮助我们把两种化合物“合二为一”,就像魔法一样。
2.2 机理的揭秘接下来,我们来聊聊这些反应是怎么工作的。
简单来说,机理就是反应的“操作指南”,告诉我们每一步怎么做。
比如在DielsAlder反应中,我们有两个重要的角色:一个是“内烯”,另一个是“二烯”。
这两个角色就像是一对搭档,在化学的舞台上跳起了华尔兹,它们的结合过程就像是一场精心编排的舞蹈,每一步都需要精准把握。
3. 人名反应的实际应用3.1 合成药物的魔法我们说了这么多,这些反应到底能干啥呢?让我们看看药物的合成。
药物合成中的许多步骤都离不开这些反应,比如抗生素的制造。
如果没有这些反应,我们可能还在为感冒发愁。
DielsAlder反应不但能合成药物,还能用于制造天然产物,让我们在生活中得到更多的好东西。
比如,维生素K的合成过程就涉及到这个反应,没有它,骨头可能会变得脆弱得像干枯的树枝。
3.2 新材料的创新除了药物,这些反应在新材料的制造上也大展身手。
比如,用来制造高科技的塑料、合成纤维、甚至是液晶显示屏的材料。
经典有机人名反应及其机理
经典有机人名反应及其机理本文整理出常见的有机人名反见80多共见见个100见大部分容在见见考察范见之。
全初见内内国有机见度见然有所降低但有能力刺见的见手见于有机反见必见熟见掌握熟见反见见例机理。
冲决与熟见有机人名反见不见是化见见的要求也是考的重要容更是见化先见见的尊重见见。
学研内学与索引Arbuzov反见Arndt-Eister反见Baeyer-Villiger 化氧Beckmann 重排Birch 见原Bischler-Napieralski 合成法Bouveault-Blanc见原Bucherer 反见Cannizzaro 反见Chichibabin 反见Claisen 见见合反见Claisen-Schmidt 反见Clemmensen 见原Combes 合成法Cope 重排Cope 消除反见Curtius 反见Dakin 反见Darzens 反见Demjanov 重排Dieckmann 见合反见Elbs 反见Eschweiler-Clarke 反见Favorskii 反见Favorskii 重排见基化反见见基化反见Fries 重排Gabriel 合成法Gattermann 反见Gattermann-Koch 反见Gomberg-Bachmann 反见Hantzsch 合成法Haworth 反见Hell-Volhard-Zelinski 反见Hinsberg 反见Hofmann 见基化Hofmann 消除反见1Hofmann 重排降解Houben-Hoesch 反见Hunsdiecker 反见Kiliani 见化增法碳Knoevenagel 反见Knorr 反见Koble 反见Koble-Schmitt 反见Leuckart 反见Lossen反见Mannich 反见Meerwein-Ponndorf 反见Meerwein-Ponndorf 反见Michael 加成反见Norrish I和II 型裂解反见Oppenauer 化氧Paal-Knorr 反见Pictet-Spengler 合成法Pschorr 反见Reformatsky 反见Reimer-Tiemann 反见Reppe 合成法Robinson 见见反见Rosenmund 见原Ruff 见降反见Sandmeyer 反见Schiemann 反见Schmidt反见Skraup 合成法Sommelet-Hauser 反见Stephen 见原Stevens 重排Strecker 基酸合成法氨Tiffeneau-Demjanov 重排Ullmann反见Vilsmeier 反见Wagner-Meerwein 重排Wacker 反见Williamson 合成法Wittig 反见Wittig-Horner 反见Wohl 见降反见Wolff-Kishner-见见反见黄Yurév 反见2Zeisel 甲基见定法氧3Arbuzov反见见酸三见基见作见见核见见见代见作用生成见基见酸二见基见和一新的见代见磷与个见代见反见见其活性次序见RI RBr RCl。
有机合成人名反应专题讲解
有机合成人名反应专题讲解Arbuzov 反应亚磷酸三烷基酯作为亲核试剂与卤代烷作用,生成烷基膦酸二烷基酯和一个新的卤代烷:卤代烷反应时,其活性次序为:R'I >R'Br >R'Cl。
除了卤代烷外,烯丙型或炔丙型卤化物、a-卤代醚、a- 或 b-卤代酸酯、对甲苯磺酸酯等也可以进行反应。
当亚酸三烷基酯中三个烷基各不相同时,总是先脱除含碳原子数最少的基团。
本反应是由醇制备卤代烷的很好方法,因为亚磷酸三烷基酯可以由醇与三氯化磷反应制得: 如果反应所用的卤代烷 R'X 的烷基和亚磷酸三烷基酯 (RO)P 的烷基相同(即 R' = R),3则 Arbuzov 反应如下: 这是制备烷基膦酸酯的常用方法。
除了亚磷酸三烷基酯外,亚膦酸酯 RP(OR') 和次亚膦酸酯 RPOR' 也能发生该类反应,例22如:反应机理一般认为是按 S2 进行的分子内重排反应: N反应实例Arndt-Eister 反应酰氯与重氮甲烷反应,然后在氧化银催化下与水共热得到酸。
反应机理重氮甲烷与酰氯反应首先形成重氮酮(1),(1)在氧化银催化下与水共热,得到酰基卡宾(2),(2)发生重排得烯酮(3),(3)与水反应生成酸,若与醇或氨(胺)反应,则得酯或酰胺。
反应实例Baeyer----Villiger 反应反应机理过酸先与羰基进行亲核加成,然后酮羰基上的一个烃基带着一对电子迁移到-O-O-基团中与羰基碳原子直接相连的氧原子上,同时发生O-O键异裂。
因此,这是一个重排反应具有光学活性的3---苯基丁酮和过酸反应,重排产物手性碳原子的枸型保持不变,说明反应属于分子内重排:不对称的酮氧化时,在重排步骤中,两个基团均可迁移,但是还是有一定的选择性,按迁移能力其顺序为: 醛氧化的机理与此相似,但迁移的是氢负离子,得到羧酸。
反应实例酮类化合物用过酸如过氧乙酸、过氧苯甲酸、间氯过氧苯甲酸或三氟过氧乙酸等氧化,可在羰基旁边插入一个氧原子生成相应的酯,其中三氟过氧乙酸是最好的氧化剂。
有机化学人名反应
引言概述:有机化学人名反应是有机化学领域中的重要反应,以发现或命名人物命名,旨在纪念对有机化学做出重大贡献的科学家。
本文将介绍五个涉及有机化学人名反应的重要反应,包括Sn2反应、Friedel-Crafts反应、Hofmann降解反应、Diels-Alder反应和Hofmann重排反应。
正文内容:1. Sn2反应1.1 概述:Sn2反应是一种亲核取代反应,其中一个亲核试剂攻击官能团上的消极部分,然后将其替换为新的官能团。
1.2 人名来源:Sn2反应是以科学家在有机化学领域做出开创性贡献的Edwin S. Gould命名。
1.3 反应特点:Sn2反应的反应速率与亲核试剂浓度成正比,但与底物浓度无关。
1.4 影响因素:影响Sn2反应速率的因素包括底物结构、溶剂选择和温度等。
1.5 应用领域:Sn2反应在合成有机化学中广泛应用于底物的碳-氮键或碳-氧键的形成。
2. Friedel-Crafts反应2.1 概述:Friedel-Crafts反应是一种芳香族碳-碳键形成的反应,在芳香族化合物上引入新的取代基团。
2.2 人名来源:Friedel和Crafts是两位法国化学家,他们共同发现并开发了这一重要反应。
2.3 反应类型:Friedel-Crafts反应可以分为两种类型,即芳香烃的烷基化和芳香烃的酰基化。
2.4 反应机理:Friedel-Crafts反应的机理通常涉及亲电取代和负离子取代两种机制。
2.5 应用领域:Friedel-Crafts反应在药物合成和农药合成等领域具有重要的应用价值。
3. Hofmann降解反应3.1 概述:Hofmann降解反应是一种将主要氨基酸转化为次级氨基酸的反应。
3.2 人名来源:Hofmann是德国化学家Hermann Emil Fischer 的学生,他发现并研究了这个反应。
3.3 反应过程:Hofmann降解反应涉及以次氨基酸为中间体进行进一步反应,最终生成次级氨基酸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(韩奇反应)
• Hantzsch(韩奇)反应是由一分子醛、两分子β-酮 酸酯和及一分子氨发生缩合反应,得到二氢吡啶衍 生物。在经氧化或脱氢得到取代的吡啶-3,5-二甲酸 酯,后者可经水解、脱羧得到的相应的砒啶衍生物。
O R'O R O O OR' O R R''
R''
NH3
O2CR' R N H
NH4 NH3
O R'O R HO N H
O OR' R
O
-H2O
R''
O OR'
R'O R N H R
• Hantzsch反应的特点是可由β-酮酸酯和醛 在氨存在下一步形成二氢吡啶环系,进而 氧化得到2,4,6-三取代的吡啶衍生物。韩奇 反应应用非常广泛,是合成各种二氢吡啶 衍生物和砒啶衍生物最简单的一种方法。
• Hantzsch反应的反应原理具有典型性,用 不同的羰基化合物为原料,可有合成吡啶 环系的方法,这些合成方法都与Hantzsch 反应具有相类似的反应机制。例如由乙酰 乙酸乙酯、邻硝基苯甲醛和氨合成治疗心 脏病药物心痛定,是Hantzsch反应在药物 合成工业应用的一个很好例子。
CO2R' R
CHO
• Hantzsch反应的过程首先是一分子β-酮酸 酯与醛发生Knoevenagel反应得到缩合产物 关键中间体I,另一分子β-酮酸酯和氨发生 缩合反应得到相应的烯胺中间体II,然后中 间体I和II再通过分子内的加成—消除反应发 生环化形成二氢吡啶化合物,最后在氧化 剂作用下芳环化形成吡啶环:
O O R'O O R O
O O OR' H3N O R O R OR' H2N HO R O OR'
R''
R''
O R'O H R
R'' OH O
-H2O
ቤተ መጻሕፍቲ ባይዱ
R'O R
中 间体 I
C
O
NH3
O
-H2O
H2N R
OR'
中 间 体 II
O R'O R
R''
O OR'
R''
O
Micheal加 成
O OR'
NH3 NH4
R''
O OR' R
O
H2N
R
中 间 体 II
R'O R O- H2N R
R''
O R'O R O- HN
O OR' R
R''
O R'O R O HN R O OR'
OR'O R
O HN
R''
O R'O R O HN
O OR' R
关环
R''
O R'O R -O N H
R''
O OR' R
