实验四 沸石吸附实验(间歇式吸附实验)
吸附能力的实验报告

一、实验目的1. 探究不同吸附剂对目标物质的吸附效果。
2. 分析影响吸附效果的主要因素,如吸附剂种类、吸附时间、吸附温度等。
3. 通过实验数据,确定最佳吸附条件。
二、实验原理吸附是指一种物质(吸附剂)在另一物质(吸附质)表面或孔隙中富集的现象。
根据吸附过程的机理,吸附可分为物理吸附和化学吸附。
物理吸附主要发生在固体表面,是由于分子间作用力(如范德华力)引起的。
物理吸附具有可逆性,吸附过程不涉及化学键的形成。
化学吸附则发生在固体表面与吸附质之间,是由于化学键的形成引起的。
化学吸附具有不可逆性,吸附过程涉及化学键的形成。
本实验主要研究物理吸附,通过测定吸附剂对目标物质的吸附量,评估吸附效果。
三、实验材料与仪器1. 实验材料:- 吸附剂:活性炭、蒙脱石、沸石等。
- 吸附质:有机染料、重金属离子等。
- 溶剂:蒸馏水、乙醇等。
2. 实验仪器:- 吸附柱:柱长50cm,内径1cm。
- 恒温水浴锅。
- 分析天平。
- 分光光度计。
- 秒表。
四、实验方法1. 配制吸附剂溶液:称取一定量的吸附剂,用溶剂溶解,配制成一定浓度的吸附剂溶液。
2. 配制吸附质溶液:称取一定量的吸附质,用溶剂溶解,配制成一定浓度的吸附质溶液。
3. 吸附实验:将吸附剂溶液倒入吸附柱,控制流速,使吸附剂与吸附质充分接触。
记录吸附时间。
4. 解吸实验:将吸附后的溶液通过吸附剂,记录解吸时间。
5. 吸附量测定:用分光光度计测定吸附剂对吸附质的吸附量。
五、实验结果与分析1. 吸附效果比较:表1 吸附效果比较| 吸附剂 | 吸附量(mg/g) | 吸附率(%) || ------ | -------------- | ---------- || 活性炭 | 50.0 | 90.0 || 蒙脱石 | 40.0 | 72.0 || 沸石 | 30.0 | 54.0 |从表1可以看出,活性炭对吸附质的吸附效果最好,其次是蒙脱石,沸石吸附效果最差。
2. 影响吸附效果的因素:(1)吸附剂种类:不同吸附剂的比表面积、孔径结构等特性不同,导致吸附效果存在差异。
实验四 沸石吸附实验(间歇式吸附实验)

实验四沸石吸附实验(间歇式吸附实验)一、实验目的:1.了解沸石吸附的特点,掌握和了解间歇式吸附工艺及性能。
2..掌握用间歇吸附法处理污水的设计参数的确定方法,学会绘制废水的吸附等温线。
二、实验原理:吸附就是利用多孔性的固体(称吸附剂,具有较大的比表面),使物质在固体表面或交界面上累积或浓缩的过程。
活性炭吸附就是利用活性炭的固体表面对水中一种或多种物质的吸附作用,以达到净化水质的目的。
在温度一定的条件下,活性炭的吸附量随补吸附物质平衡浓度的提高而提高,两者之间的变化曲线称为吸附等温线,通常用费兰德利希(Fruendlic)经验式来表示。
费兰德利希等温吸附线的方程为:1nq K C=,式中:q——活性炭吸附量,g·g-1;C——被吸附物质平衡浓度,g·L-1;K,n——与溶液的温度、pH值以及吸附剂(如比表面积)和被吸附物质的性质有关的常数。
n>1,将式改为对数式得:1lg lg lg q K Cn=+当q、C相应值点绘在双对数坐标纸上,所得直线的斜率为1/n,截距为K。
三、实验设备及材料1.设备:FA2004N电子天平,上海精密科学仪器有限公司;HY-2调速多用振荡器,金坛市顺华仪器有限公司(常州国华电器有限公司);723分光光度计,上海精密科学仪器有限公司分析仪器总厂;TDL-40B离心机,上海安亭科学仪器厂;DHG-9070A电热恒温干燥箱,上海精宏实验设备有限公司。
2.器皿:1000mL容量瓶;5个50mL容量瓶/每组;2mL、5mL、10mL、25mL、50mL移液管;6个具塞三角烧杯250mL/组(干燥);6个200mL烧杯/组(干燥);6个漏斗(7cm)/组(干燥);干燥器;漏斗架;滤纸(11cm);温度计;直尺。
3.药剂:沸石;1000mgl·L-1亚甲基兰。
四、实验步骤1.绘制标准曲线:①配制水样:取10mL 1000mg·L-1亚甲基兰溶液定容至1000mL容量瓶,配制10mg·L-1亚甲基兰溶液。
沸石净化实验报告总结(3篇)

第1篇一、实验概述本报告总结了我在生化实验课程中,经过半年的学习所取得的收获与不足。
在实验过程中,我参与了多种生化实验,包括folin-酚法测蛋白、稀碱法提取酵母RNA、醋酸纤维薄膜电泳、RNA定量测定-UV吸收法、纤维素酶活力的测定、最适pH选择、菲林试剂热滴定定糖法、肌糖元的酵解作用、N-末端氨基酸残基的测定--DNS-CL 法、柱层析分离色素、凯式定氮法等实验。
二、实验收获1. 理论知识与实践操作相结合:通过实验,我深刻理解了生化实验的基本原理,掌握了各种实验操作技能。
2. 实验技能的提升:在实验过程中,我学会了如何正确操作实验仪器,处理实验数据,提高了实验技能。
3. 团队协作能力的培养:在实验过程中,我与同组成员密切合作,共同解决问题,提高了团队协作能力。
4. 理论联系实际:通过实验,我认识到理论知识与实践操作相结合的重要性,使我对生化实验有了更深入的了解。
三、实验不足1. 实验操作不够熟练:在实验过程中,我发现自己在某些实验操作上不够熟练,需要进一步加强练习。
2. 实验态度不够严谨:在实验过程中,我曾犯过一些低级错误,如忘记加入新的沸石,导致溶液差点暴沸。
这说明我在实验态度上还需更加严谨。
3. 对实验仪器的熟悉程度不够:在实验过程中,我们损坏了改良式凯式蒸馏仪,并赔偿了相应的费用。
这反映出我在实验过程中对仪器的熟悉程度不够,操作不够认真。
四、改进措施1. 加强实验技能训练:为了提高实验操作熟练度,我将在课后继续进行实验技能训练,熟练掌握各种实验操作。
2. 严谨实验态度:在实验过程中,我将始终保持严谨的态度,避免犯类似低级错误。
3. 提高对实验仪器的熟悉程度:在实验前,我将认真学习实验仪器的使用方法,确保实验过程中能够正确操作。
总之,通过本次生化实验课程的学习,我收获颇丰。
在今后的学习和工作中,我将取长补短,不断提高自己的实验技能和综合素质。
第2篇一、实验背景沸石是一种具有多孔结构的天然矿物质,因其优异的吸附性能而被广泛应用于空气净化、水处理、催化剂载体等领域。
沸石实验报告
沸石实验初步报告一、实验的目的和意义:随着矿渣微粉应用的普及,矿渣供应越来越紧,而且价格越来越高,寻找一种新的材料完全或部分取代矿渣很有必要。
沸石是一种含水的碱金属或碱土金属的铝硅酸矿物,常见于喷出岩,特别是玄武岩的孔隙中,也见于沉积岩、变质岩及热液矿床和某些近代温泉沉积中,其阳离子交换性、吸附性、分子筛这三种特性构成了沸石应用领域广泛的物性基础,广泛应用于建筑工业、农业、轻工业、环保以及国防等领域。
沸石在建材工业领域的应用主要有:1、作为水泥活性混合材料,水泥工业用量最大。
该矿石粉碎后不再做其它加工,可以直接掺入水泥熟料中,从而降低水泥的生产成本。
2、使用沸石作发泡剂,应用于制造泡沫轻质建筑砌块,配制多孔混凝土,生产硅钙板,建筑灰膏等。
3、应用沸石烧制人工轻骨料“陶粒”,具有轻质,高强,吸水率等特点。
陶粒被广泛应用于新型建筑材料工业以及建筑业,代替粘土砖,还可以应用于农业搞无土栽培。
再就是环保方面做洁净美化,污水过滤,烟尘过滤,隔音材料等。
4、用沸石作因化剂,可将有害的废料固定在混凝土当中。
5、可以加工制造成小颗粒,直接掺入水泥中作轻骨料,生产建筑砌砖,空心砖,轻质高强板材等。
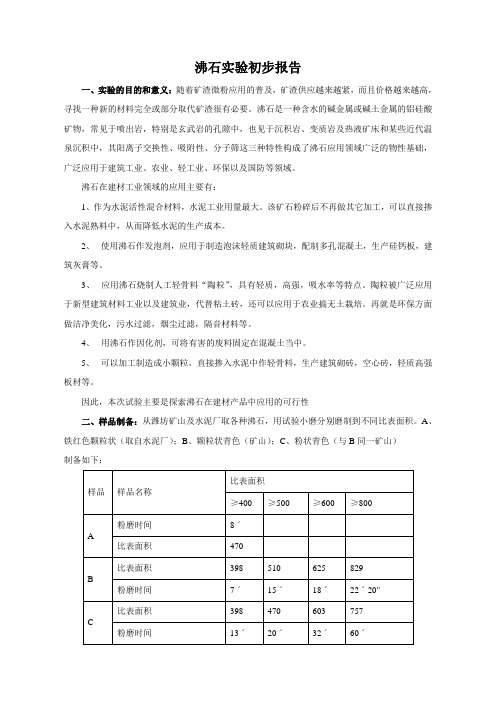
因此,本次试验主要是探索沸石在建材产品中应用的可行性二、样品制备:从潍坊矿山及水泥厂取各种沸石,用试验小磨分别磨制到不同比表面积。
A、铁红色颗粒状(取自水泥厂);B、颗粒状青色(矿山);C、粉状青色(与B同一矿山)制备如下:比表面积样品样品名称≥400 ≥500 ≥600 ≥800粉磨时间8ˊ---A比表面积470 ---比表面积398 510 625 829B粉磨时间7ˊ15ˊ18ˊ22ˊ20"比表面积398 470 603 757C粉磨时间13ˊ20ˊ32ˊ60ˊ三、全分析数据:青色沸石取自统一矿山,只是破碎粒径不同,因此只做了大颗粒青色。
样品nnn SiO2Al2O3Fe2O3CaO MgO∑A 4.08 70.40 14.07 3.36 3.61 0.40 95.92B 2.95 60.47 16.15 5.14 4.45 1.30 90.46四、方案设计:1、活性实验:按照矿粉活性试验方法对以上7份沸石进行活性检验,考察不同比表沸石活性的变化。
关于沸石吸附性的报告

关于沸石吸附性的报告一沸石的物理性质沸石,别名硅酸铝钾盐,英文名称Zeolite或Aluminosilicate。
其晶体多呈纤维状、毛发状、柱状,少数呈板状或短柱状。
密度为1.9~2.3g/cm3,基本组成如下表:二沸石的吸附原理天然沸石是一种含水架状结构硅铝酸盐矿物质,其结构特点除了有离子交换性(极易与周围水溶液的阳离子发生交换作用,交换后的沸石晶体结构不被破坏),催化性(其大孔穴可容纳一定数量的物质,从而促使化学反应在其表面加速进行)外,还有吸附性。
其吸附原理如下:2.1 沸石的“分子筛”作用沸石晶格内部有很多大小均一的孔穴和通道,孔穴和通道的体积有的可占沸石晶体体积50%以上,这些空穴和通道在一定物理化学条件下具有精确而固定的直径(3—10A)。
各种不同的沸石其直径也不同,小于这个直径的物质能够被其吸附,而大于这个直径的物质则被排除在外,这种现象被称为“分子筛”作用。
2.2 沸石的静电作用沸石具有较大的静电吸引力,在它的铝硅酸盐格架上的电荷即阳离子晶格上的负电与平衡阳离子正电的电荷中心在空间上是不重叠的,所以在其孔穴中有很大的静电吸引力,因而使沸石对极性物质具有优先选择吸附作用。
2.3 沸石的色散力作用沸石具有很大的比表面积(达500-800平米/克)因而能产生较大色散力,可用做出色的吸附剂,对于主要由扩散力起作用的吸附过程,在大多数情况下,特别是在低分压范围内,沸石的吸附容量很大,高于其它许多吸附剂,但在高分压范围内,沸石的吸附容量往往很小。
三沸石的应用3.1 沸石在水处理方面的应用人们利用天然沸石NH4+离子具有很强的选择性吸附能力,用它来从废水中除去氨氮,其中斜发沸石的氨氮去除能力较强。
袁俊生等[13]研究过斜发沸石去除水中氨氮的工艺条件和处理效果。
结果表明:在废水的pH值为7时,沸石对NH4+的平均交换容量达到12.96 mg/L,处理后水中氨氮低于50 mg/L。
天然沸石经过多种特殊工艺活化后,可以使沸石吸附性能更强,离子交换性能更好,更有利于去除水中各种污染物,成为多功能深度水处理的能替代活性炭的新型材料。
吸附实验报告

一、实验目的1. 了解吸附原理和吸附剂的选择原则;2. 掌握吸附实验的操作方法;3. 研究不同吸附剂对特定物质的吸附效果;4. 分析影响吸附效果的因素。
二、实验原理吸附是指物质在固体表面或液体界面上的富集现象。
根据吸附机理,吸附可分为物理吸附和化学吸附。
物理吸附主要指分子间的范德华力,而化学吸附则涉及化学键的形成。
吸附实验中,常用吸附剂有活性炭、沸石、离子交换树脂等。
本实验采用活性炭作为吸附剂,研究其对特定物质的吸附效果。
实验原理如下:1. 活性炭具有较大的比表面积和丰富的孔隙结构,能有效吸附水中的有机污染物;2. 吸附过程受多种因素影响,如吸附剂种类、吸附剂用量、吸附时间、溶液pH值、温度等;3. 通过测定吸附前后溶液中特定物质的浓度,计算吸附率,分析吸附效果。
三、实验仪器与试剂1. 仪器:锥形瓶、振荡器、分光光度计、移液管、容量瓶、烧杯等;2. 试剂:活性炭、特定物质溶液、标准溶液、pH缓冲溶液、去离子水等。
四、实验步骤1. 准备实验溶液:将特定物质溶液配制成一定浓度,备用;2. 准备吸附剂:将活性炭用去离子水洗净、干燥,备用;3. 吸附实验:取一定量的特定物质溶液于锥形瓶中,加入一定量的活性炭,置于振荡器上振荡;4. 吸附时间:记录不同吸附时间下吸附剂对特定物质的吸附效果;5. 测定吸附率:取一定量的吸附后溶液,用分光光度计测定特定物质的浓度,计算吸附率;6. 分析实验数据,得出结论。
五、实验数据与结果1. 吸附剂用量:取0.5g、1.0g、1.5g活性炭分别进行吸附实验,结果如下:吸附时间(min) | 0.5g活性炭吸附率(%) | 1.0g活性炭吸附率(%) | 1.5g 活性炭吸附率(%)------------------|-------------------------|-------------------------|-------------------------10 | 60.2 | 70.5 | 80.120 | 72.3 | 81.8 | 89.630 | 78.9 | 86.4 | 92.12. 吸附时间:取1.0g活性炭进行吸附实验,结果如下:吸附时间(min) | 吸附率(%)------------------|-------------------------10 | 70.520 | 81.830 | 86.440 | 88.250 | 89.63. 温度:在20℃、30℃、40℃条件下进行吸附实验,结果如下:温度(℃) | 吸附率(%)------------------|-------------------------20 | 89.630 | 90.240 | 91.54. pH值:在pH值为4、7、10条件下进行吸附实验,结果如下:pH值 | 吸附率(%)--------|-------------------------4 | 91.27 | 90.510 | 89.8六、实验结论1. 活性炭对特定物质的吸附效果受吸附剂用量、吸附时间、温度、pH值等因素影响;2. 在实验条件下,活性炭对特定物质的吸附效果较好,可应用于水处理等领域。
天然沸石吸附氨氮实验注意事项

天然沸石吸附氨氮实验注意事项
天然沸石是一种常用的吸附剂,用于处理水中的氨氮,可以有效地去除水中的氨氮,但在实验过程中需要注意以下几点:
一、实验前的准备
1.选择合适的天然沸石:天然沸石的性质和吸附能力与来源、矿物组成、晶体结构等有关,因此需要选择合适的天然沸石。
2.样品的处理:样品应该经过过滤、调节pH值等处理,以保证实验结果的准确性。
二、实验过程中的注意事项
1.天然沸石的使用量:天然沸石的使用量应该根据实际情况进行调整,一般来说,使用量应该控制在一定范围内。
2.实验条件的控制:实验条件包括温度、pH值、接触时间等,这些条件的控制对实验结果有很大的影响,需要进行严格的控制。
3.实验设备的清洁:实验设备应该保持干净,避免对实验结果产生影响。
4.实验数据的记录:实验数据应该准确记录,以便后续的分析和处理。
三、实验后的处理
1.天然沸石的回收:实验后,天然沸石应该进行回收处理,以便后续的使用。
2.实验数据的分析:实验数据应该进行分析和处理,以便得出准确的结论。
以上是天然沸石吸附氨氮实验的注意事项,希望能够对实验的进行有所帮助。
氨氮在天然沸石上的吸附及解吸

氨氮在天然沸石上的吸附及解吸l )张曦吴为中温东辉李文奇唐孝炎(北京大学环境科学中心,北京,l0087l )摘要研究了氨氮浓度、温度、时间、共存阳离子等对氨氮在天然沸石上吸附的影响,比较了HCI 及NaCI 溶液对氨氮解吸的效果,初步探讨了沸石吸附氨氮后自然硝化的规律.结果显示,随着氨氮浓度的增大或温度的升高,沸石吸附量上升,最大可达ll.5mg ・g -l ;沸石吸附的初始阶段(0—81),沸石吸附量随时间显著上升,此后趋于平缓;在不同阳离子共存的情况下,K +可使沸石吸附量降低50%以上;HCI 溶液对氨氮解吸的效果好于NaCI溶液,解吸率最高可达到60%;沸石吸附的氨氮在硝化细菌作用下可转化为硝氮,溶液中硝氮浓度l201后可达9mg ・I -l ,在总氮中比率达到27%.关键词氨氮,沸石,吸附,解吸,硝化.天然沸石是含水多孔铝硅酸盐的总称,其结晶构造主要由(SiO )四面体组成,其中部分Si 4+为AI 3+取代,导致负电荷过剩,因此,结构中有碱金属(或碱土金属)等平衡电荷的离子.同时沸石构架中有一定孔径的空腔和孔道,决定了其具有吸附、离子交换等性质[l ,2],其离子交换选择性顺序为:CS +>Rb +>K +>NH +4>Ba 2+>Sr 2+>Na +>Ca 2+>Fe 3+>AI 3+>Mg 2+>Li +可见其对氨氮具有很强的选择性吸附能力,因而可被应用于氨氮废水的处理[3,4].本实验探讨了氨氮浓度、温度、时间、共存阳离子对天然沸石吸附氨氮的影响,研究了不同化学洗脱液对氨氮解吸的效果,考察了沸石所吸附的氨氮在溶液中的自然硝化作用,旨在探索氨氮在沸石上吸附及解吸的规律,为沸石用于氨氮废水处理奠定基础.l实验部分l.l 沸石的静态吸附实验选取浙江缙云产斜发沸石(典型晶胞组成为:Na 6[(AIO 2)6(SiO 2)30]・24H 2O )为试验材料.其主要物理特性为:Si /AI 为4.2—5.3,粒径为2—3cm ,孔隙率为30—40%,动力学直径为3.9 .称取30g 沸石放入500mI 锥形瓶中,加入不同浓度(!0)的NH 4CI 溶液200mI ,置恒温水浴振荡器中振荡,使氨氮在液相和沸石固相间的分配达到平衡,721后取出样品,静置l5min ,取上清液测定NH 3-N 的平衡浓度(!e ),计算沸石对NH 3-N 的吸附2002年5月l7日收稿.l )基金项目:科技部重大专项“滇池流域农业面源污染控制技术”(K99053502).第22卷第2期2003年3月环境化学ENVIRONMENTAL CHEMISTRY VoI.22,No.2!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!Marc12003量.实验中改变NH 4CI 溶液浓度、温度、振荡时间、共存阳离子等实验条件,进行不同条件下的吸附实验对比.吸附量(!,mg ・g -1)计算公式如下:!=(C 0-C e )V /m 式中,C 0:NH 4CI 溶液起始浓度,mg ・I -1;C e :吸附后NH 4CI 溶液平衡浓度,mg ・I -1;V :溶液体积,I ;m :沸石重量,g.1.2化学解吸实验将不同NH 3-N 浓度下吸附达到平衡的沸石置于恒温箱中,75C 下干燥121,然后在干燥器中静置至室温.按上述步骤放入锥形瓶,加入NaCI 或HCI 溶液恒温振荡721,取出后测定沸石的吸附量,以新鲜沸石吸附量为对比计算解吸率(",)."=(1-!/!0)X 100%式中,!0:新鲜沸石氨氮吸附量,mg ・g -1;!:解吸后沸石残留的氨氮吸附量,mg ・g -1.1.3自然硝化实验在与阳光及大气接触的开放条件下,将30g 沸石浸没于5g ・I -1NH 4CI 溶液中,使之静置吸附,3d 后沸石表面生长出绿色藻类,此时取出沸石,缓慢清洗沸石表面残留的NH 4CI 溶液,于75C 下干燥121,在干燥器中静置至室温,然后置于500mI 50mg・I -1的NH 4CI 溶液中,20C 恒温并光照条件下培养,定期检测溶液pH 值、溶解氧(DO )以及溶液中NH 3-N 及NO -3-N 的浓度,考察沸石吸附氨氮的自然硝化作用.2结果与讨论2.1吸附等温线图1显示了不同温度下沸石在NH 3-N 起始浓度为5mg ・I -1—10g ・I -1的NH 4CI 溶液中的吸附量.从图1可见,随着氨氮浓度的增大,吸附平衡后沸石上氨氮的吸附量上升.NH 3-N 起始浓度小于1000mg ・I -1时,随着浓度的增大,沸石吸附量上升趋势明显,曲线较陡;NH 3-N 起始浓度大于1000mg ・I -1后,吸附量随浓度的上升趋势减缓;NH 3-N 起始浓度大于5000mg ・I -1后,曲线形成一平台,表明沸石吸附达到最大值,约为11.5mg ・g -1.同时,随着温度的升高,沸石吸附量亦增大,但在10C 的变化范围内,吸附量增加不多.沸石这种吸附特性符合FreundIic1吸附规律[5],即吸附量与溶液浓度的对数关系为线性.根据FreundIic1吸附等温式(!=KC 1/I ),可拟合出以上三条等温线的吸附方程式,结果见表1.表1不同温度下的吸附等温式Table 1Adsorption eguations in t1e different temperatures T /C吸附等温式相关系数K I 25In !=0.8005In C -4.43890.98830.0118 1.249235In !=0.7916In C -4.33170.98830.0131 1.263345In !=0.7915In C -4.24790.98500.0143 1.26347612期张曦等:氨氮在天然沸石上的吸附及解吸氨氮在沸石上的吸附机理以化学吸附作用与离子交换作用为主.溶液中氨氮浓度愈大,可供交换的氨氮较多,而且溶液本体与沸石表面形成的浓度差愈大,造成氨氮向沸石内部迁移并进行交换反应的动力也愈大,因此,沸石的吸附量增加;当温度升高时,不仅使得氨氮克服沸石表面界膜阻力的能力增加,而且促使沸石表面吸附的氨氮沿沸石微孔向沸石内部迁移,因而沸石吸附量也增大.图2显示吸附前后溶液pH值的变化,随着温度的上升pH值升高的趋势变得明显.根据氨氮在沸石上吸附的离子交换机理,加上对沸石结构组成的综合分析,可认为是沸石晶体中Na+等平衡电荷离子被NH+4取代而进入溶液,造成溶液pH值升高.图1不同温度下氨氮在沸石上的吸附等温线Fig.1Adsorption isotherms of ammonia-nitrogen onto the zeoIite in the differenttemperatures图2吸附前后溶液pH值的变化Fig.2pH vaIues in NH4CI soIution beforeand after adsorption2.2吸附速率图3是25C,氨氮浓度为5mg・I-1时溶液中沸石吸附量随时间变化的曲线.在沸石吸附的初始阶段(0—8h),沸石吸附量随时间显著上升,此后趋于平缓,8—48h内吸附量增加不大,显示了沸石“快速吸附,缓慢平衡”的特点.根据时间等温线,可计算此条件下沸石吸附速率,发现其符合班厄姆公式:d!/d!=!"("!).其中!表示吸附量,!表示时间,"为吸附速率常数.本实验中吸附量和时间取对数后具有较好的线性关系:In!=0.132In!-3.8412(#=0.9715).2.3共存阳离子的影响多种阳离子都存在对氨氮的吸附竞争,尤其是K+,沸石对其吸附能力在氨氮之上.实验选择K+,Na+,Ca2+,Mg2+四种金属离子(浓度均为0.1moI・I-1)与氨氮共存,分别在5mg・I-1和50mg・I-1两种氨氮浓度下,测定沸石吸附量的变化.结果见图4.由图4可见,在阳离子共存的情况下,沸石对氨氮的吸附量降低,而以K+的影响最大,使得沸石对氨氮的吸附量降低50%以上,Na+,Ca2+,Mg2+三种离子的影响相仿,差别不大.2.4化学洗脱作用下沸石的解吸氨氮在沸石上的吸附主要基于离子交换和化学吸附作用,同样地,如果采用较高浓度的洗脱液使沸石上的氨氮被交换下来,则能够达到解吸的目的.图5显示了在250 mg・I-1的NaCI和HCI溶液洗脱作用下沸石上氨氮的解吸情况.HCI溶液对沸石解吸的效果较好,在不同的氨氮浓度下其解吸率均高于NaCI溶液,最高达到60%,这是由于861环境化学22卷H+比Na+更容易取代NH+4的缘故;而在两种洗脱液中都呈现出沸石解吸率随着沸石吸附量的增大而增大的现象,其原因在于初始吸附的氨氮不仅在沸石表面结合较牢固,而且向沸石内部迁移,因此,不易被其它离子取代,而沸石表面被氨氮完全占据后,吸附作用愈来愈弱,结合不甚牢固,因此,后吸附的氨氮容易被洗脱.图3沸石吸附量随时间的变化曲线Fig.3Curve of adsorption capacityvariation with time 图4共存阳离子对吸附量的影响Fig.4Effects of coexisting cations on the adsorptioncapacity图5不同溶液对氨氮解吸的效果Fig.5Effects of different soiution on the desorption efficiency2.5氨氮的自然硝化实验中沸石吸附氨氮后暴露于大气和阳光之中,以满足自然硝化细菌生长的条件.在这种自然硝化过程中,沸石表面氨氮在硝化细菌作用下转化为硝氮,致使溶液中硝氮浓度升高,同时,沸石孔径中的氨氮向外部迁移,逐步转化为硝氮,这实际上是一种微生物作用下的解吸作用.而新鲜沸石上由于没有细菌生长,因而只有吸附作用发生.由图6可见,自然硝化过程中溶液pH值先升后降,其原因在于表面生长有大量硝化细菌的沸石浸没在NH4Ci溶液中,沸石由于未达到其吸附容量,因此,继续吸附氨氮,造成溶液pH值升高.此后由于硝化作用的进行,溶液中硝氮浓度增大,因此,pH 值降低;与此同时,与新鲜沸石形成对比,生长有硝化菌的沸石在溶液中出现DO显著降低的现象,这是硝化过程中氨氮被氧化成硝氮而耗氧的结果.图7显示了自然硝化过程中硝氮浓度明显上升的趋势,开始为零,120h后接近9mg・i-1,在所有氮形态中比率达到27%(见表2),此后硝氮的增长趋于平缓.9612期张曦等:氨氮在天然沸石上的吸附及解吸图6自然硝化过程中溶液pH值和DO的变化Fig.6pH and DO of soIutions within thenitrificationprocess 图7自然硝化过程中溶液中NH3-N和NO-3-N浓度的变化Fig.7NH3-N and NO-3-N concentrations variation within the nitrification process表2自然硝化过程中各形态氮占总氮的比率随时间的变化Table2Ratio of NH3-N,NO-2-N and NO-3-N in totaI nitrogen within the nitrification processt/h02472120216360!NH3-N/%10089.7882.2772.7871.8371.67!NO-2-N/%00.080.130.140.170.22!NO-3-N/%010.1412.6027.0828.0028.123结论(1)随着溶液氨氮浓度的增大或温度的升高,沸石吸附量上升,沸石的吸附特性符合FreundIich吸附规律.吸附前后溶液pH值升高,这是由于沸石晶体中Na+等平衡电荷离子被NH+4取代而进入溶液的结果.(2)沸石具有“快速吸附,缓慢平衡”的特点,即沸石吸附的初始阶段(0—8h),沸石吸附量随时间显著上升,此后趋于平缓.在阳离子共存的情况下,沸石对氨氮的吸附量降低,而以K+的影响最大,其使沸石的吸附量降低50%以上.(3)HCI溶液对沸石的解吸效果较好,在不同的氨氮浓度下其解吸率均高于NaCI 溶液,最高达到60%;而在两种洗脱液中都呈现出沸石解吸率随着沸石吸附量的增加而增加的现象.(4)沸石吸附的氨氮在硝化细菌作用下转化为硝氮,其浓度呈明显上升的趋势,20C恒温光照培养120h后硝氮浓度接近9mg・I-1,在所有氮形态中比率达到27%;同时出现溶液pH值先升后降及DO显著降低的现象.参考文献[1]Zorpas A,Constantinides T,VIyssides A G et aI.,Heavy MetaI Uptake by NaturaI ZeoIite and MetaIs Partitioning in Sewage SIudge Compost[J].Bioresource Technology,2000,72I113—119071环境化学22卷[2]Ortega E ,Cheeseman C ,Knight J et ai.,Properties of Aikaii-Activated Ciinoptiioiite [J ].Cement and Concrete Re-search ,2000,3011641—1646[3]祝万鹏,杨津湘,杨志华等,氨氮在饱水粉砂土和亚砂土层中吸附过程及其模拟[J ].环境科学,1996,17(2)19—11[4]Lahav O ,Green M ,Ammonium Removai Using Ion Exchange and Bioiogicai Regeneration [J ].Water Research ,1998,32(7)12019—2028[5]北川浩,铃木谦一郎,吸附的基础与设计[M ].北京:化学工业出版社,1983,32,48ADSORPTION AND DESORPTION OF AMMONIA-NITROGENONTO NATURAL ZEOLITEZHANC Xi WU Wei-zhong WEN Dong-hui LI Wen-gi TANC Xiao-yan(Center of Environmentai Sciences ,Peking University ,Beijing ,100871)ABSTRACTThe effects of ammonia-nitrogen concentration ,temperature ,time ,coexisting cations on the adsorption of ammonia-nitrogen onto the naturai zeoiite were studied ,whiie the effects of HCi and NaCi soiution on the desorption of ammonia-nitrogen from the naturai zeoiite were discussed respec-tiveiy.Nitrification of ammonia-nitrogen on the zeoiite in NH 4Ci soiution was aiso researched.With ammonia-nitrogen concentration or temperature increasing in NH 4Ci soiution ,adsorption capacity ofzeoiite wouid rise to the maximum vaiue of 11.5mg・g -1.In the beginning of the adsorption process (0—8hour ),adsorption capacity of zeoiite wouid rise obviousiy ,and after this period ,it wouid rise siowiy.Due to the coexisting of K +,adsorption capacity of zeoiite couid decrease 50%.Compared to the NaCi soiution ,HCi soiution had a better effect on the desorption of ammonia-nitro-gen with the maximum desorption efficiency of 60%.Ammonia-nitrogen on the naturai zeoiite couid be transformed to nitrate-nitrogen under the effect of nitrification bacteria ,and the concentration ofnitrate-nitrogen in NH 4Ci soiution couid reach 9mg ・i -1in 120hours with the ratio of 27%in totainitrogen.Keywords :ammonia-nitrogen ,zeoiite ,adsorption ,desorption ,nitrification.1712期张曦等:氨氮在天然沸石上的吸附及解吸。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验四沸石吸附实验(间歇式吸附实验)
一、实验目的:
1.了解沸石吸附的特点,掌握和了解间歇式吸附工艺及性能。
2..掌握用间歇吸附法处理污水的设计参数的确定方法,学会绘制废水的吸附等温线。
二、实验原理:
吸附就是利用多孔性的固体(称吸附剂,具有较大的比表面),使物质在固体表面或交界面上累积或浓缩的过程。
活性炭吸附就是利用活性炭的固体表面对水中一种或多种物质的吸附作用,以达到净化水质的目的。
在温度一定的条件下,活性炭的吸附量随补吸附物质平衡浓度的提高而提高,两者之间的变化曲线称为吸附等温线,通常用费兰德利希(Fruendlic)经验式来表示。
费兰德利希等温吸附线的方程为:,式中:q——活性炭吸附量,g·g-1;C——被吸附物质平衡浓度,g·L-1;K,n——与溶液的温度、pH值以及吸附剂(如比表面积)和被吸附物质的性质有关的常数。
n>1,将式改为对数式得:
当q、C相应值点绘在双对数坐标纸上,所得直线的斜率为1/n,截距为K。
三、实验设备及材料
1.设备:FA2004N电子天平,上海精密科学仪器有限公司;HY-2调速多用振荡器,金坛市顺华仪器有限公司(常州国华电器有限公司);723分光光度计,上海精密科学仪器有限公司分析仪器总厂;TDL-40B离心机,上海安亭科学仪器厂;DHG-9070A电热恒温干燥箱,上海精宏实验设备有限公司。
2.器皿:1000mL容量瓶;5个50mL容量瓶/每组;2mL、5mL、10mL、25mL、50mL移液管; 6个具塞三角烧杯250mL/组(干燥);6个200mL 烧杯/组(干燥);6个漏斗(7cm)/组(干燥);干燥器;漏斗架;滤纸(11cm);温度计;直尺。
3.药剂:沸石;1000mgl·L-1亚甲基兰。
四、实验步骤
1.绘制标准曲线:
①配制水样:取10mL 1000mg·L-1亚甲基兰溶液定容至1000mL容量瓶,配制10mg·L-1亚甲基兰溶液。
②将①中准备的亚甲基兰溶液稀释,按原浓度的1/2、1/4、1/8、1/12、1/16、1/20、1/24稀释。
③用分光光度计测得水样吸光度与波长关系曲线,确定最吸收波长。
分别按得出的最大吸收波长测其吸光值。
稀释时用50mL容量瓶定容,可选择与五个稀释倍数相近的,用移液管易移取的溶液体积,最后再算出实际稀释倍数。
④画出吸光值和亚甲基兰浓度(可将浓度单位mol·L-1转化为mg·L-1,便于根据标准曲线查出滤液浓度)的关系曲线,即标准曲线。
注意:标准曲线最少要求五个点;相关系数3个9,;同时要保证最后测定的吸光值落在标准曲线的五点范围内。
2.测定吸附等温线:
①用电子天平称取50、100、150、200mg沸石,置于干燥器中备用。
②在6个250mL具塞三角瓶中,各用移液管移入相同体积(100mL)实验水样(10mg·L-1亚甲基兰溶液),测定水温,分别加入0、50、100、150、80、150mg沸石,在振荡器上振荡30min以上,使达到吸附平衡。
③用滤纸滤出吸附剂,收集滤液,测出滤液吸光值。
④从标准曲线上查出相应吸光值下的滤液浓度(mg·L-1)。
⑤计算每个三角瓶中转移到沸石表面上的亚甲基兰的量,以mg(亚甲基兰)/g(活性炭)表示。
⑥根据各点q-C值,在双对数坐标纸上绘制吸附等温线。
五、实验数据处理和分析
绘制标准曲线和吸附等温线,测量曲线的截距、斜率,确定的费兰德利希吸附系数K、1/n。
六、思考题
1.吸附等温线有什么实际意义?
2.作吸附等温线时为什么要用粉状炭?
3.连续流的升流式和降流式运动方式各有什么缺点?。
